本发明属于医药
技术领域:
,具体涉及一种glp-1r激动剂及其应用。
背景技术:
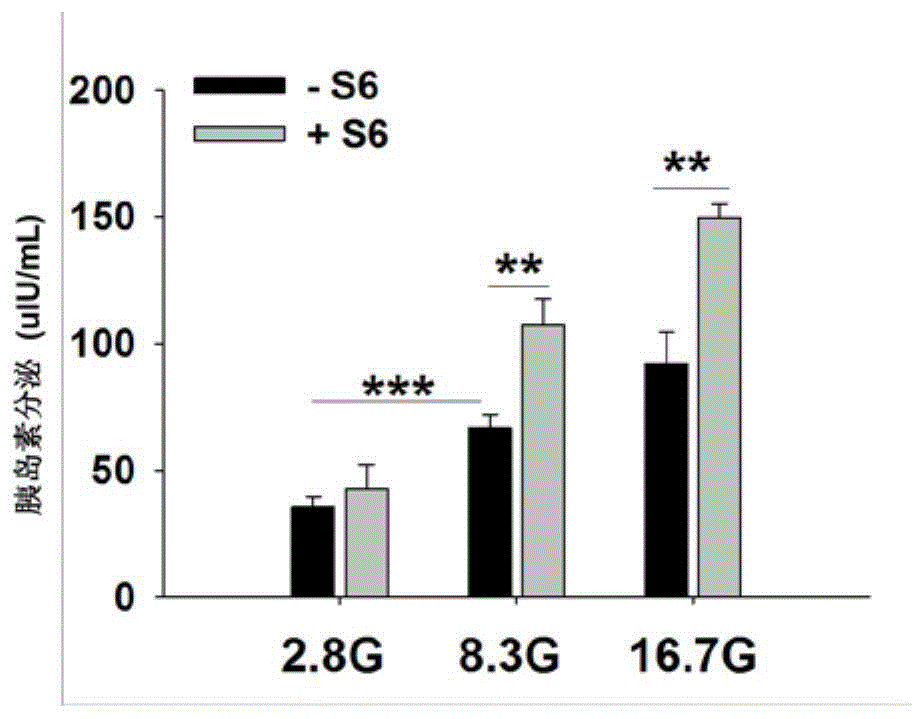
:glp-1(7-36)酰胺作为glp-1的主要活性形式,glp-1(7-36)酰胺进入血液循环后,血液和细胞膜上的二肽基肽酶iv(dpp-iv)迅速将其裂解为无活性的glp-1(9-36),其半衰期仅1-2min,因此不适用于t2dm的长期治疗。进一步的,科学研究已经对glp-1的结构进行相应的改造和修饰,以增加其半衰期进而延长体内生物学效应。然而,目前临床上投入使用的长效glp-1类似物如利拉鲁肽、艾塞那肽等均为多肽,频繁多次注射给药导致患者的依从性较差,因此小分子glp-1r激动剂的开发将从提高患者的依从性、用药方便性以及降低药物副作用的目的出发,具有广阔的临床市场前景。糖尿病是由于人体胰岛素分泌(相对或绝对)不足或者胰岛素作用障碍导致的以高血糖为特征的慢性疾病。根据国际糖尿病-联盟(internationaldiabetesfederation,idf)最新颁布的第九版世界糖尿病地图显示,2019年全球约有4.63亿成人(20-79岁)患糖尿病,预计到2030年糖尿病患病人数将达到5.78亿。若按照此趋势持续下去,2045年全球将有7亿糖尿病患者。因此,糖尿病已成为21世纪全球范围内面临的最为严峻的社会健康问题之一。2型糖尿病(t2dm)是最常见的糖尿病类型,约占全球糖尿病患者总数的90%。迄今为止,临床上用于治疗t2dm的传统药物,如胰岛素、磺酰脲类药物,虽然能够有效降低高血糖,但将血糖控制在正常范围后,仍能继续发挥降糖作用,这会导致t2dm患者出现低血糖的风险。因此,迫切需要开发一种新的治疗药物,所述药物不仅能有效降低糖尿病患者的高血糖,同时还能降低出现低血糖的风险。胰高血糖素样肽-1(glucagon-likepeptide-1,glp-1)是激素原转化酶pc1/3对胰高血糖素原基因表达产物翻译后切割而成,通过胃肠内分泌l细胞分泌,在葡萄糖和其他营养物质的摄取后发挥降糖作用。研究报道glp-1通过glp-1受体(glp-1r)以葡萄糖浓度依赖性的刺激胰岛素分泌,这是glp-1相对于其他降糖药物的最大优点。除此之外,glp-1还可增加体内胰岛素合成,促进β细胞增值分化,抑制β细胞凋亡,这些特性可能有助于逆转甚至预防糖尿病。技术实现要素:本发明的一个目的是提供一种通式为ⅰ的化合物,所述化合物为一种小分子glp-1r激动剂;本发明的另一个目的是提供一种通式为ⅰ的化合物在制备治疗糖尿病药物中的用途。第一方面,本发明提供一种通式为ⅰ的化合物,或其药学上可接受的盐、立体异构体、酯、前药、溶剂化物和氘代化合物,其中,a和b独立的选自c、n或o,b与相邻碳原子之间的表示单键或双键。r1、r2独立的选自:-h、-oh、-cf3、卤素、c1-10直链烷基、c3-10支链烷基、c3-8环烷基,或r1、r2与r1和r2之间的碳原子形成c3-8环烷基、芳香五元环基团或芳香六元环基团。r3选自-h、c1-5直链烷基、c3-8环烷基。r4、r5独立的选自-h、-oh、卤素、-cn、c1-5直链/支链烷基、-n(c0-10烷基)(c0-10烷基)、-oc0-10烷基、c3-6环烷基。优选的,所述a为n,b为c、n或o,且当b为o时,b与相邻的碳原子之间是碳氧单键;所述r1、r2独立的选自:-oh、-ch3、-cl、-c2h5,或r1、r2与r1和r2之间的碳原子形成芳香六元环基团;r3选自-ch3、-c2h5;r4、r5独立的选自-h、-oh、卤素、-ch3。优选地,所述式(ⅰ)化合物具有如下立体构型:第二方面,本发明提供一种药物组合物,所述药物组合物包含通式ⅰ的化合物或其药学上可接受的盐、立体异构体、酯、前药、溶剂化物和氘代化合物,还包括药剂学上可接受的辅料,所述辅料选自:载体、稀释剂、粘合剂、润滑剂、润湿剂。优选的,所述药物组合物包含治疗有效量的通式ⅰ的化合物。所述药物组合物适于胃肠给药或非胃肠给药,但本发明提供的glp-1r激动剂为小分子化合物,可以通过口服给药的方式,体现出相对于大分子多肽类的药物仅通过静脉内和皮下注射给药体现出优势。所述药物组合物可以制备成以下形式的药物制剂:针剂、糖浆剂、酏剂、悬浮剂、粉剂、颗粒剂、片剂、胶囊、锭剂、霜剂、膏剂、凝胶剂、乳剂等。第三方面,本发明提供一种通式ⅰ的化合物或其药学上可接受的盐、立体异构体、酯、前药、溶剂化物和氘代化合物在制备小分子glp-1r激动剂用途。本发明提供的小分子glp-1r激动剂能促进胰岛素分泌,降低高血糖,同时由于促进胰岛素分泌具有葡萄糖浓度依赖特性,还能减少低血糖现象的发生。第四方面,本发明提供一种通式ⅰ的化合物或其药学上可接受的盐、立体异构体、酯、前药、溶剂化物和氘代化合物在制备预防和/或治疗糖尿病药物中的用途。优选的,所述糖尿病为二型糖尿病。目前临床上已投入使用的glp-1r激动剂大多数是多肽类药物,如利拉鲁肽、艾塞那肽等。由于多肽类大分子药物只能通过注射途径给药,但是频繁多次注射给药导致患者用药依从性较差,而且由于肽类药物在体内外均表现出不稳定性,以注射给药的形式制约着其临床应用。本发明提供的glp-1r激动剂属于小分子药物,可通过胃肠给药,能显著提高患者用药依从性、用药方便性。第五方面,本发明提供一种通式ⅰ的化合物及其药学上可接受的盐、立体异构体、酯、前药、溶剂化物和氘代化合物在制备kv通道抑制剂中的用途。第六方面,本发明提供一种通式ⅰ的化合物或其药学上可接受的盐、立体异构体、酯、前药、溶剂化物和氘代化合物在制备治疗与kv通道相关疾病的药物中的用途。除了本发明前述的糖尿病,与kv通道相关的疾病还包括:癫痫、脑缺血性疾病、神经退行性疾病。本发明中所述的术语c0-10烷基,c0烷基是指h,因此,c0-10烷基包括h、碳原子为1-10的直链烷基或支链烷基,具体碳原子数可以为1,2,3,4,5,6,7,8,9,10。可以举出的支链烷基的例子包括但不限于异丙基、异丁基、叔丁基、异戊基。本发明中所述的术语c3-8环烷基,包括c3环烷基、c4环烷基、c5环烷基、c6环烷基、c7环烷基、c8环烷基。本发明所述的术语卤素,包括氟、氯、溴、碘。附图说明图1s6对不同葡萄糖条件下大鼠胰岛胰岛素分泌的影响。图2a表示在β细胞中存在8.3mm葡萄糖的情况下,s6对[ca2+]i的影响;b表示响应于s6的f-f0的平均值。图3a表示在有或没有s6的情况下记录电流曲线;b表示存在或不存在s6时,电压门控的ca2+通道的电流-电压关系曲线;c表示在0mv处记录的平均电流密度。图4a表示使用或不使用s6记录的细胞电流;b表示kv通道的电流-电压曲线;c表示以80mv记录的kv通道的平均电流密度:d和e表示不存在s6或存在s6时的代表性动作电位波形;f表示平均动作电位时程(apd)。图5a表示在8.3mm葡萄糖的情况下,20mm氯化四乙铵(tea)对s6诱导的[ca2+]i影响;b表示在存在或不存在8.3mm的tea时,响应s6的f-f0平均值;c表示在不存在或存在8.3mm葡萄糖的tea下,s6对胰岛素分泌的作用。图6a表示在8.3mm葡萄糖存在下,l型ca2+通道拮抗剂azelnidipine对s6诱导的[ca2+]i的影响;b表示在存在或不存在azelnidipine时,响应s6的f-f0平均值;c表示在没有细胞外钙的情况下,s6诱导[ca2+]i的变化;d表示在不存在细胞外钙的情况下,响应s6的f-f0平均值。图7a表示无细胞蛋白表达sds-page结果;b表示westernblottob透析式无细胞蛋白表达glp-1r蛋白的验证结果。图8a表示使用cetsa检测在dmso和s6(10μm)处理细胞裂解物后,glp-1r的表达随温度升高的变化,定量数据如b中显示。图9在存在或不存在exendin(9-39)的情况下,s6对胰岛素分泌的影响。图10a表示exendin(9-39)对s6诱导[ca2+]i的影响,在8.3mm葡萄糖存在下,不同处理后[ca2+]i的变化以f340/f380的比例绘制,b表示在存在或不存在exendin(9-39)时对响应s6的f-f0平均值。图11a表示s6在有或无exendin(9-39)的情况下记录的电流曲线;b表示kv通道的电流-电压曲线;c表示80mv下kv通道的平均电流密度。具体实施方式下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明的部分实施例,而不是全部。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。实施例1含有化合物s6的片剂s1:将化合物s650g按递增法添加乳糖220g的方法混合研磨80min,然后混入微晶纤维素35g和山梨醇10g再次研磨30min,研磨温度低于30℃,得到药物-乳糖混合物;s2:将混合物投入到湿法制粒机混合5min,按制剂重量每千克4ml的比例取吐温-80(溶于95%乙醇中),然后与0.5%聚维酮k30水溶液按1:20的混合作为黏合剂加到湿法颗粒机混合物中进行制粒;s4:向s2制得的颗粒中混合加入硬脂酸镁,压片机硬度控制在4-5kgf法以内,压片得到含有化合物s6的片剂1000片。实施例2含有化合物s6的颗粒剂s1:将化合物s650g按递增法添加乳糖220g的方法混合研磨80min,然后混入微晶纤维素35g和山梨醇10g再次研磨30min,研磨温度低于30℃,得到药物-乳糖混合物;s2:向步骤s1制备的药物-乳糖混合物中加入蔗糖:糊精3:1的混合物(过80目筛150g,混匀,制软材,挤压制粒,干燥,整粒,过12目筛,分装后即得含有化合物s6的颗粒剂。实施例3含有化合物s6的胶囊剂s1:将3.5g的氢氧化钠用少量质量浓度为50%的乙醇水溶液溶解,加入化合物s650g,混合并研磨,得到混合物;s2:向混合物中加入220g乳糖,混合后进行在55℃条件下干燥80min,粉碎、过40目筛网,得到混合细粉;s3:将30ml质量浓度为5%的聚维酮k30的乙醇溶液加入步骤s2所得混合细粉中制软材,过20目筛网制湿颗粒;s4:将步骤s3制得湿颗粒在50℃条件下干燥6h后,过18目筛网进行整粒;s5:测定颗粒中化合物s6的含量,计算装量,装囊,检查合格后包装,即得含有化合物s6的硬胶囊1000粒。实施例4含有化合物s6的注射剂s1:配液,取20mg化合物s6溶于1000ml磷酸盐缓冲溶液中,配成药物浓度为0.02mg/ml的药液;s2:活性炭处理,向药液中加入溶液总量0.2%的针用活性炭吸附处理0.5小时;s3:初滤,用滤纸将药液进行过滤;s4:过滤除菌,用孔径为0.22μm的微孔滤膜对药液进行除菌,除热源;s5:以2ml为单位对药液进行分装,灌封,得到注射液。接下来,本发明将按照以下效果例对本发明优选化合物s6进行测试,验证化合物s6呈葡萄糖浓度依赖性促进大鼠胰岛素分泌及其电生理机制,及验证化合物s6通过激活glp-1r促进大鼠胰岛素分泌。本发明使用的实验动物为雄性wistar大鼠,体重为180~250g,购自于山西省人民医院实验动物中心,饲养于温度为20~22℃,并配有标准啮齿动物食物及饮用水。所有操作流程均符合山西医科大学实验动物的管理和使用指南。大鼠胰岛组织的分离与培养、大鼠胰岛β细胞的分离与培养均是本领域技术人员常规的实验操作。本发明涉及的数据处理用sigmaplot12.5和igor6.1处理实验数据,并以mean±sem表示。使用student’st-test,one-wayanova或pairedt-test进行统计分析,当p<0.05时被认为具有统计学意义,使用imagelabtm软件对蛋白条带进行定量。g表示葡萄糖浓度mmol/l,比如2.8g表示浓度为2.8mmol/l的葡萄糖溶液。一、验证s6呈葡萄糖浓度依赖性促进大鼠胰岛素分泌及其电生理机制主要药品与试剂主要实验仪器效果例1s6促进胰岛素分泌呈葡萄糖浓度依赖性实验前准备:1)实验分为3组,ep(eppendorf)管编号(每组7个ep管);2)配制krbh溶液,置培养箱中孵育30min,用naoh调制ph至7.4;3)配制不同浓度的待测样品:2.8mmol/l葡萄糖溶液(2.8g)、8.3mmol/l葡萄糖溶液(8.3g)16.7mmol/l葡萄糖溶液(16.7g)、2.8g+10μms6、8.3g+10μms6、16.7g+10μms6。实验步骤:1)向每个ep管中加入500μl2.8g,在体式显微镜下挑取5个胰岛(大小均一,边缘光滑)至ep管中,放至培养箱内孵育30min;2)用移液枪将上清液吸出弃掉,然后每组依次各加入500μl2.8g、8.3g、16.7g,置培养箱中孵育30min;3)取出ep管,用移液枪将上清液吸出至提前标记好的ep管中,混匀,封口,4℃保存,并按照上一轮的加药顺序依次加入500μl2.8g+10μms6、8.3g+10μms6、16.7g+10μms6,置培养箱中孵育30min;4)取出ep管,将上清液吸出至已编号的ep管中,封口,4℃保存。检测各组胰岛素的含量。实验结果如图1所示,图1表示s6对不同葡萄糖条件下大鼠胰岛胰岛素分泌的影响,从图中可以看出,在2.8mm葡萄糖(2.8g),8.3mm葡萄糖(8.3g)和16.7mm葡萄糖(16.7g)的条件下用10μms6处理胰岛,n=7,**p<0.01;***p<0.001,从图中可以看出,在基础葡萄糖浓度(2.8g)下,s6未发挥促胰岛素分泌的作用,而在中等葡萄糖浓度(8.3g)及高葡萄糖浓度(16.7g)下的促胰岛素分泌作用显著,且后者作用明显强于前者,上述结果表明s6以葡萄糖浓度依赖性的方式促进胰岛素分泌。上述结果表明s6在高葡萄糖浓度(8.3g,16.7g)下发挥促胰岛素分泌的作用,而且此作用具有葡萄糖浓度依赖性,表明s6可以在glp-1r表达的胰岛组织中发挥促进胰岛素分泌的作用,并且极大的减少了诱发低血糖的风险。基于以上结果,我们可以初步断定s6在治疗t2dm中的可能性。接下来,我们进一步探究s6诱导胰岛素分泌的电生理机制,在大鼠原代胰岛β细胞上观察s6对细胞内钙离子浓度变化的影响。效果例2s6升高β细胞内的钙离子浓度实验前准备:1)分离胰岛β细胞,在细胞培养箱内培养3~4h;2)配制实验所需的krbh溶液(调ph至7.35~7.45)以及待测药物溶液:2.8g、8.3g、8.3g+10μms6。实验步骤:1)取细胞玻片至35mm的培养皿内,用含2.8mm葡萄糖的krbh溶液清洗细胞2次,加入fura2-am工作液,用锡箔纸包裹后于培养箱内孵育30min。用含2.8mm葡萄糖的krbh溶液清洗细胞2次,以充分去除残留的fura2-am工作液;2)在检测系统的荧光显微镜浴槽内加入适量的含2.8mm葡萄糖的krbh溶液,放置细胞于浴槽内。分别进行不同待测药物的干预,在激发波长380nm和340nm,发射波长510nm下,观察细胞的荧光强度变化。实验结果如图2-a和图2-b所示,图a表示在β细胞中存在8.3mm葡萄糖的情况下,s6对[ca2+]i的影响,[ca2+]i的变化以f340/f380的比例绘制;b表示响应于s6的f-f0的平均值,f表示不同处理在峰前和峰后15s的平均值,f0表示对于2.8mm葡萄糖浓度最小值前后15s的平均值,n=13,***p<0.001。从图中可以看出,在8.3g葡萄糖浓度下,细胞内ca2+水平明显升高;在此基础上继续添加s6,细胞内ca2+浓度仍能进一步增加。因此,可以推断s6的促胰岛素分泌作用是通过升高细胞内ca2+浓度来实现,并且在8.3g的葡萄糖浓度显著促进细胞内钙离子浓度升高。效果例3s6未影响β细胞电压依赖性钙(vdcc)通道实验步骤:1)在显微镜浴槽内加入适量检测vdcc的电极外液,然后将细胞玻片放入浴槽边缘处,并在显微镜视野内找到细胞;2)充灌电极内液;3)电极入液,高阻封接。将细胞钳制在-70mv,进行快电容补偿;全细胞模式下破膜后,给予慢电容补偿。给予-50mv~+30mv的电压刺激且以10mv为一个步阶,记录50ms内电流的变化。在记录电压依赖性钙通道时,细胞外液用ba2+代替ca2+,其主要目的是延缓钙通道的衰减,而且ba2+电流可将信号适当放大以便于分析。实验结果如图3所示,a表示在有或没有s6的情况下记录电流曲线;b表示存在或不存在s6时,电压门控的ca2+通道的电流-电压关系曲线;c表示在0mv处记录的平均电流密度,n=7。从图3可以看出,在测试电压为0mv下,与对照组相比(电流密度为-5.5022±1.4896pa/pf),s6处理组电流密度为(-6.9781±1.0858pa/pf),两组间没有显著性差异。因此,s6未影响β细胞电压依赖性钙通道,说明s6对vdcc通道没有促进作用。效果例4s6抑制了β细胞电压依赖性钾(kv)通道,延长β细胞动作电位时程实验步骤:1)在显微镜浴槽内加入适量检测电极外液,将含有β细胞的玻片放入浴槽内,并在镜下找到细胞;2)充灌适量电极内液,轻敲电极管壁除去起泡;3)电极入液,入液过程中可给予正压,既能吹走电极尖端周围的脏物,又利于高阻封接,入液后将电极放至细胞的正上方,慢慢下移电极;当电极接触到细胞膜表面时,继续下压电极,待电阻增加0.5mω左右时给予负压直至高阻封接。电压钳模式下将细胞钳制在-70mv,进行快电容补偿;全细胞模式破膜后,进行慢电容补偿,将细胞膜电容调至≥7mω。给予-70mv~+80mv的电压刺激并以10mv为一个步阶,记录400ms内电流的变化。破膜后,在电流钳模式下给予150pa、4ms的电流刺激。计算细胞去极化开始到复极化至距离静息电位以上10mv所需的时间。实验结果:通过全细胞膜片钳实验对kv电流和动作电位进行检测,结果如图4所示,a表示使用或不使用s6记录的当前迹线,b表示kv通道的电流-电压曲线,c表示以80mv记录的kv通道的平均电流密度,n=7,**p<0.01。如图4的a、b、c数据显示,在测试电压为80mv下,与对照组相比,s6处理组显著性抑制了kv电流。本实验动作电位持续时间(apd)由4ms,150pa电流注入引起,图d和e表示代表性动作电位波形,f表示平均apd,n=7;***p<0.001。如图4的d、e、f所示,与对照组相比,s6明显延长了动作电位时程。因此,s6诱导的胰岛素分泌作用是通过抑制kv通道,延长动作电位时程来完成的。效果例5kv通道部分参与s6介导的胰岛素分泌作用实验1实验前准备:1)分离胰岛β细胞,在细胞培养箱内培养3~4h;2)配制实验所需的krbh溶液(调ph至7.35~7.45)以及待测药物溶液:2.8g、8.3g、8.3g+10μms6、8.3g+20mmtea、8.3g+20mmtea+s6;3)配置fura-2am工作液:取1.5ml的ep管,加入2μl1mm的fura2-am工作液和1ml含2.8mm葡萄糖的krbh溶液,配制成终浓度为2μm的荧光染料,充分混匀后避光保存,备用。实验步骤:1)取细胞玻片至35mm的培养皿内,用含2.8mm葡萄糖的krbh溶液清洗细胞2次,加入fura2-am工作液,用锡箔纸包裹后于培养箱内孵育30min。用含2.8mm葡萄糖的krbh溶液清洗细胞2次,以充分去除残留的fura2-am工作液;2)在检测系统的荧光显微镜浴槽内加入适量的含2.8mm葡萄糖的krbh溶液,放置细胞于浴槽内。分别进行不同待测药物的干预,在激发波长380nm和340nm,发射波长510nm下,观察细胞的荧光强度变化。实验结果:为了探究s6诱导的胰岛素分泌作用是否仅与kv通道有关,我们使用kv通道阻断剂tea进行观察,结果如图5的a和b所示,a表示在存在8.3mm葡萄糖的情况下,20mm氯化四乙铵(tea)对s6诱导的[ca2+]i升高的影响,[ca2+]i的变化以在不同条件下的f340/f380的比例绘制;b表示在存在或不存在8.3mm的tea时,响应s6的f-f0平均值,n=18,***p<0.001。如图5的a和b所示,钙离子成像实验显示,tea在8.3mm葡萄糖条件下显着增加了细胞内ca2+水平,紧接着我们同时给予kv通道阻断剂tea和s6,发现[ca2+]i仍能够进一步增加。实验2实验前准备:1)实验分为3组,ep管编号;2)配制待测药物,2.8g、8.3g、8.3g+20mmtea、8.3g+10μms6、8.3g+20mmtea+10μms6。实验步骤:1)预孵育;2)取出ep管,弃上清,每组依次各加入500μl2.8g、8.3g、8.3g+20mmtea,置培养箱中孵育30min;3)取出ep管,将上清液吸出至提前标记好的ep管中,混匀,封口,4℃保存,按照上一轮的加药顺序依次加入500μl8.3g+10μms6、8.3g+20mmtea+s6,置培养箱中孵育30min;4)取出ep管,用移液枪将上清液吸出至已编号的ep管中,封口,4℃保存,检测各组胰岛素的含量。实验结果如图5的c所示,c表示在不存在或存在8.3mm葡萄糖的tea下,s6对胰岛素分泌的作用,n=6,*p<0.05,**p<0.01,***p<0.001。我们发现s6和tea分别在8.3mm葡萄糖条件下显着增强了胰岛素的分泌,同时给予tea和s6时,胰岛素分泌的能力进一步增强,这些结果共同表明,s6的促胰岛素分泌作用除了kv通道抑制作用,还涉及其他因素。效果例6证明s6介导的细胞内ca2+浓度升高的另一个原因是细胞内钙库释放实验1实验前准备:1)分离胰岛β细胞,在细胞培养箱内培养3~4h;2)配制实验所需的krbh溶液(调ph至7.35~7.45)以及待测药物溶液:2.8g、8.3g、8.3g+10μms6、8.3g+0.1μmazelnidipine、8.3g+0.1μmazelnidipine+s6;3)配置fura-2am工作液:取1.5ml的ep管,加入2μl1mm的fura2-am工作液和1ml含2.8mm葡萄糖的krbh溶液,配制成终浓度为2μm的荧光染料,充分混匀后避光保存,备用。实验步骤:1)取细胞玻片至35mm的培养皿内,用含2.8mm葡萄糖的krbh溶液清洗细胞2次,加入fura2-am工作液,用锡箔纸包裹后于培养箱内孵育30min。用含2.8mm葡萄糖的krbh溶液清洗细胞2次,以充分去除残留的fura2-am工作液;2)在检测系统的荧光显微镜浴槽内加入适量的含2.8mm葡萄糖的krbh溶液,放置细胞于浴槽内。分别进行不同待测药物的干预,在激发波长380nm和340nm,发射波长510nm下,观察细胞的荧光强度变化。实验结果:为了探究[ca2+]i的增加与细胞内钙库释放的关系,我们使用l型ca2+通道拮抗剂azelnidipine分析s6在促进细胞内ca2+浓度升高的作用,结果如图6的a和b图所示,a表示在8.3mm葡萄糖存在下,l型ca2+通道拮抗剂azelnidipine对s6诱导的[ca2+]i升高的影响,[ca2+]i的变化以在不同条件下f340/f380的比例绘制;b表示在存在或不存在azelnidipine时,响应s6的f-f0平均值为8.3mm,n=14,***p<0.001。如图6的a和b图钙离子成像实验显示,在8.3g葡萄糖条件下,细胞内钙水平显著增加;随后我们发现同时给予s6和azelnidipine时,[ca2+]i仍明显增加,这些现象提示细胞内ca2+的增加可能源自细胞内钙动员。实验2实验前准备:配制实验所需的无ca2+-krbh溶液(调节ph至7.35~7.45)以及待测药物溶液:2.8g、8.3g、8.3g+10μms6。实验步骤:1)取出细胞,用含2.8mm葡萄糖的krbh溶液清洗2次,加入fura2-am工作液孵育30min,孵育完成后用含2.8mm葡萄糖的krbh溶液清洗细胞2次;2)分别进行不同待测药物的干预,在激发波长380nm和340nm,发射波长510nm下,观察细胞的荧光强度变化。实验结果:我们在去除细胞外ca2+情况下,测量细胞内钙浓度的变化,结果如图6的c图和d图所示,c表示在没有细胞外钙的情况下,s6诱导[ca2+]i升高,[ca2+]i的变化以在不同条件下的f340/f380的比例绘制;d表示在不存在细胞外钙的情况下,响应s6的f-f0平均值为8.3mm,n=9,***p<0.001。如图6的c和d图数据显示,在没有细胞外ca2+的存在下,s6仍明显增加了细胞内钙的浓度,以上结果共同表明s6通过细胞内ca2+库释放增强了[ca2+]i。二、验证s6通过激活glp-1r促进大鼠胰岛素分泌为了证明s6是否是有效的glp-1r激动剂,我们首先引入了一种新兴的名为细胞热转变分析(cellularthermalshiftassay,cetsa)的实验来监测和量化药物到达并结合蛋白靶标的程度。其原理是每种蛋白质都有自身的热熔解曲线,当用药物处理细胞时,未与药物结合的蛋白质将在加热过程中变性失活并产生沉淀,而能与药物结合的蛋白质能稳定存在。然后通过westernblot检测不同温度下药物处理组和对照组胞浆内残留的可溶性蛋白来估算热稳定性的变化。另外该方法适用范围广泛,可以在活细胞、细胞裂解液和组织内检测药物和靶标蛋白的相互作用。主要药品与试剂主要实验仪器低温高速离心机德国eppendorf公司多功能酶标仪美国biotek公司westernblot垂直电泳系统美国biotek公司westernblot半干转膜系统美国biotek公司凝胶成像系统美国biotek公司钙成像lambda10-b系统北京mde公司pcr仪美国bio-rad公司恒温振荡培养箱太仓华美生化仪器有限公司恒温磁力搅拌器上海司乐仪器有限公司电热恒温培养箱上海福玛实验设备有限公司微型漩涡混合仪上海沪西分析仪器厂有限公司数显恒温水浴锅国华电器有限公司效果例7cetsa验证glp-1r与s6的靶向作用无细胞glp-1r蛋白的表达:1)构建大鼠glp-1r载体:用pcr扩增技术获得大鼠glp-1r的序列片段,琼脂糖凝胶中回收glp-1rrat基因片段,将目的基因glp-1r克隆到载体pex-3中,用ecori和bamhi双酶切pex-3,电泳,回收载体pex-3;利用entryonestepcloningkit,把扩增片段重组克隆到pex-3载体中;将重组连接产物转化为感受态细胞,挑取克隆菌落,少量抽提得到质粒,用ecori和bamhi双酶切鉴定,电泳,挑取阳性克隆;最后对重组质粒测序验证后进行大量抽提,取适量阳性克隆对应的菌液测序,剩余的菌液用甘油保存;将测序结果与目的基因序列进行比对,核对无误后,用甘油菌液接菌lb培养基,大量质粒抽提,得到足够量的重组质粒。2)无细胞glp-1r蛋白的表达:采用杭州谨澳生物科技z1高保真dna聚合酶g-pol-001或z2超保真dna聚合酶g-pol-002对目的基因进行扩增,为了提高蛋白表达的成功率,我们分别采用e.coli透析式无细胞蛋白表达体系,tob透析式无细胞蛋白表达体系,yeast透析式无细胞蛋白表达体系进行表达,最后用sds-page观测表达结果。实验步骤:1)从-80℃冰箱取出用tob表达系统表达的含有glp-1r的总蛋白溶液,置于冰上,取出实验所需总蛋白的体积,实验分为2组,实验干预组加入终浓度为10μms6,对照组加入同体积的dmso,置于37℃培养箱内孵育45min。孵育结束后,将实验干预组和对照组分别等分为5组,然后用rt-pcr仪在不同温度下(47~67℃)加热3min,室温冷却3min,4℃,20000g20min离心,将上清吸出至200μl的ep管中,加入5×loadingbuffer,95℃加热5min后,于-80℃冰箱内保存。2)蛋白印迹(western-blot)分析:a配制10%的分离胶和5%的浓缩胶,蛋白上样体积为5μl;b电泳:先以80v恒压分离30min,待蛋白样品进入分离胶后换成120v继续分离1h,停止电泳:c转膜:恒压半干湿法转膜,20v,25min;d封闭:将nc膜放入5%脱脂奶粉中,37℃孵育1h;e孵育一抗,用tbst将一抗稀释至1:3000,室温孵育2h,最后用tbst洗涤三次,每次10min;f孵育二抗,用tbst将二抗稀释至1:10000,室温下孵育1h后用tbst洗涤三次,每次10min,g显影:配制ecl发光液,并使用chemidictmxrs+成像系统对蛋白条带进行鉴定。实验结果:1,pex3-glp-1r表达载体的鉴定对质粒进行如下检测:1)采用序列比对的方法进行基因序列检测:测序结果与目的序列一致;2)采用序列比对的方法进行向量序列检测:侧翼20bp序列与载体一致;3)采用琼脂糖电泳的方法对片段大小进行检测:质粒无污染带,片段大小正确;4)采用紫外分光光度法对浓度进行检测:od260/280为1.8-2.0。2,tob透析式蛋白表达体系的glp-1r蛋白的鉴定分别取5μlglp-lre.coli、glp-lrtob、glp-lryeast的上清和总蛋白进行sds-page检测,如图7的a图所示,glp-lr目的蛋白在e.coli表达体系和yeast表达体系未观测到目的蛋白过量表达;目的蛋白(*)在tob表达体系疑似表达,为可溶蛋白。随后我们对glp-lrtob样品进行了westernblot检测,结果如图7的b图所示,证实glp-lr目的蛋白在tob表达体系表达。3,glp-1r是s6的特异性靶标在前一部分中,已经验证s6能够发挥促进大鼠胰岛素分泌的作用,本发明还验证了s6为有效的小分子glp-1r激动剂。首先使用cetsa技术来观察glp-1r和s6的关系,通过western-blot检测蛋白质样品,观察glp-1r表达的变化。如图8所示,图a表示使用dmso和s6(10μm)处理的细胞裂解物的cetsa使用western印迹检测s6和glp-1r之间的相互作用,定量数据如b中显示,n=3,独立实验,*p<0.05。随着温度的升高,对照组(dmso)glp-1r的表达越来越不稳定;而s6处理组的glp-1r表达虽然也随着温度升高而减弱,但相对于dmso处理组而言是稳定的,尤其是在62℃时两组间的差距最大,这说明与glp-1r结合后增强了glp-1r的热稳定性,进而说明glp-1r是s6的靶蛋白。效果例8s6通过glp-1r促进胰岛素分泌实验前准备:1)实验分3组,ep管编号;2)配制待测药物:2.8g、8.3g、8.3g+100nmexendin(9-39)、8.3g+s6+exendin(9-39)、8.3g+s6。实验步骤:1)预孵育;2)取出ep管弃上清,每组各自加入500μl2.8g、8.3g、8.3g+exendin(9-39),孵育30min;3)将上清液吸出至提前标记好的ep管中,混匀,封口,4℃保存;4)按照前一次的给药顺序,依次各自给予500μl8.3g+s6+exendin(9-39)、8.3g+s6,孵育30min后,上清液吸出至已准备好的ep管中,混匀,封口。检测各组上清液中胰岛素的含量。实验结果:通过使用glp-1r拮抗剂exendin(9-39),检查s6增强胰岛素分泌是否依赖于大鼠胰岛中的glp-1r活化,如图9所示,表示s6中存在或不存在exendin(9-39)的情况下,s6通过glp-1r诱导葡萄糖依赖性胰岛素分泌,n=6;*p<0.05,**p<0.01。结果显示exendin(9-39)阻断了s6促进的胰岛素分泌作用,表明s6对胰岛素分泌的作用与glp-1r激活有关,这与先前实验结果相同。效果例9s6通过glp-1r增加细胞内ca2+浓度实验前准备:1)分离胰岛β细胞,在细胞培养箱内培养3~4h;2)配制实验所需的krbh溶液(调ph至7.35~7.45)并配制待测溶液:2.8g、8.3g、8.3g+exendin(9-39)、8.3g+s6+exendin(9-39)、8.3g+s6;3)配置fura-2am工作液。实验步骤:在2.8g、8.3g、8.3g+exendin(9-39)、8.3g+s6+exendin(9-39)、和8.3g+s6干预下,观察细胞的荧光强度变化。实验结果:为进一步验证s6升高细胞内ca2+浓度与glp-1r的关系,我们使用exendin(9-39)对细胞内ca2+浓度变化进行检测。如图10所示,图a表示exendin(9-39)对s6诱导的影响[ca2+]i在8.3mm葡萄糖存在下,[ca2+]i的变化以f340/f380的比例绘制,图b表示在存在或不存在exendin(9-39)时对s6响应的f-f0平均值,n=9,***p<0.001。实验结果显示exendin(9-39)减弱了s6诱导的细胞内ca2+增强的作用,而单独使用时没有影响细胞内ca2+浓度变化。这些发现表明,s6通过glp-1r引起[ca2+]i增加,从而导致胰岛素囊泡的胞吐作用增强。效果例10s6通过glp-1r抑制kv通道电流实验前准备:1)分离好胰岛β细胞,在细胞培养箱内培养24h,待用;2)电极的制备;3)配制实验所需的药物浓度:11.1g、11.1g+s6、11.1g+exendin(9-39)、11.1g+s6+exendin(9-39)。实验步骤:记录不同药物干预下β细胞上kv通道电流。实验结果如图11所示,图a表示存在或不存在exendin(9-39)的情况下记录的细胞电流曲线;图b表示kv通道的电流-电压曲线;图c表示80mv下kv通道的平均电流密度,n=7;*p<0.05。实验结果证明s6明显减弱了kv通道电流,而用exendin(9-39)后,s6抑制kv通道电流的作用被逆转了。glp-1r属于g蛋白偶联受体b族亚类,当glp-1及其类似物与glp-1r结合后,可以触发一系列的信号反应,最终调节胰岛素的分泌活动。在胰岛素分泌实验中,我们观察在glp-1r阻断剂exendin(9-39)存在下,s6减弱了对大鼠胰岛素分泌的作用,表明s6通过glp-1r发挥促胰岛素分泌的作用,再次印证了s6作用于glp-1r。紧接着在钙离子成像技术实验中,我们观察s6诱导细胞内ca2+浓度升高的作用是否也与glp-1r有关,结果发现在exendin(9-39)存在下,s6升高细胞内钙离子浓度的能力被消除,这表明s6升高细胞内钙离子浓度是通过激活glp-1r完成的。而且在膜片钳实验中我们发现s6通过激活glp-1r抑制kv通道,进而延长动作电位时程,导致电压依赖性钙通道开放时间延长,最终导致细胞内ca2+浓度增加。效果例11化合物s6的急性毒性试验将雄性小鼠随机分为5组,每组10只,将化合物s6溶于生理盐水中进行灌喂给药,第1-6组的给药剂量分别为1.5g/kg、3.0g/kg、5.0g/kg、7.5g/kg、15.0g/kg。给药后将老鼠按常规标准进行饲养,10天后记录各组死亡情况,用spss13.0软件计算药物半数致死量(ld50)。药物急性毒性试验结果如下表所示,结果显示本发明提供的化合物ld50值为6.2g/kg,95%可信限为4.3-7.9g/kg,毒性较低。表1药物急性毒性试验结果组别给药剂量g/kg10天小鼠死亡数成活率11.50100%23.0190%35.0280%47.5640%515.0100最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。当前第1页12
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:章毅;张敏;杨晓华;刘云峰;刘涛;崔丽娟;薛欢
- 技术所有人:山西医科大学
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、薛老师:1.CRISPR-Cas系统 2.基因编辑 3.基因修复 4.天然产物合成 5.单分子技术开发与应用
- 2、张老师:1.探索新型氧化还原酶结构-功能关系,电催化反应机制 2.酶电催化导向的酶分子改造 3.纳米材料、生物功能多肽对酶-电极体系的影响4. 生物电化学传感和生物电合成体系的设计与应用。
- 3、豆老师:1.环境纳米材料及挥发性有机化合物(VOCs) 2.CO污染物的催化氧化 3.低温等离子体 4.吸脱附等控制技术
- 4、赵老师:1.高分子材料改性及加工技术 2.微孔及过滤材料 3.环境友好高分子材料
- 5、邬老师:1.高分子材料的共混与复合 2.涉及材料功能化及结构与性能的研究; 高分子热稳定剂的研发
- 如您是高校老师,可以点此联系我们加入专家库。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
精彩留言,会给你点赞!
专利分类正在加载中....