一种稻曲菌素A纯品的制备方法与流程
本申请涉及农产品安全检测技术领域,具体涉及一种稻曲菌素a纯品的制备方法。
背景技术:
稻曲病是一种常发于水稻穗部的真菌病害,其致病真菌为稻绿核菌。稻曲病菌侵染水稻穗部形成黄色或黑色稻曲球,该病害可使孕穗期谷粒营养运输受阻,不能正常发育,造成空秕率升高,千粒重下降,影响水稻产量。稻绿核菌在侵染水稻后会产生稻曲菌素,导致稻米作物受毒素污染;全球每年约有25%的水稻作物会受到稻曲菌素污染,造成很大的经济损失与安全风险。目前已发现共计7种稻曲菌素,分别为稻曲菌素a,b,c,d,e,f与稻曲菌素g,其共同的特征母核为一个经由醚键连接而成的十三元环缩肽,其中稻曲菌素a(ustiloxina,化学结构式见式1)是最主要的一类污染物,其含量占所有稻曲菌素污染物含量80%以上。
稻曲菌素a可以抑制真核细胞中有丝分裂过程,稻曲菌素a对有丝分裂过程的半数抑制浓度(ic50)为0.7μmol/l,与秋水仙碱相当,因此稻曲菌素a具有很强的细胞毒性与植物毒性。实验表明稻曲菌素a对人的胃、肺、乳腺、结肠和肾细胞系的生长分离均有抑制作用。当家猪被饲喂受稻曲菌素a污染的稻米时将出现中毒反应,表现为:肉猪生长减慢,增重速率降低;多种内脏器官病变,病变较为明显的有肝、肾和脾;影响母猪的生殖性能,除卵巢出现充血、出血外,产仔数、初生窝重、断奶窝重及仔猪成活率均下降,同时还出现产死胎、干尸胎及畸形胎等情况。除此之外,稻曲菌素a还将导致作物种子出芽率显著下降,影响后茬作物的产量。
鉴于稻曲菌素a污染的普遍性和危害性,针对它的污染风险评估、毒理研究以及控制方法开发等受到业界的广泛关注,对于纯化的稻曲菌素a毒素纯品的需求很大。然而目前全球尚无商品化稻曲菌素a标准品在售,且常用的分离纯化方法需要用到反相硅胶填料与sephadex葡聚糖凝胶,成本高昂,严重限制了其广泛应用。因此亟需开发一种能够大规模、安全高效、廉价的稻曲菌素a制备纯化技术。
技术实现要素:
本申请实施例通过提供一种稻曲菌素a纯品的制备方法,解决了现有稻曲菌素a纯品分离纯化成本高的问题,提高了稻曲菌素a纯品的单次制备量,并降低了分离纯化成本。
为达到上述目的,本申请主要提供如下技术方案:
本申请提供了一种稻曲菌素a纯品的制备方法,包括以下步骤:
(1)取稻曲球粉末或稻绿核菌培养物粉末,加入提取液进行超声提取,过滤,收集滤液得到稻曲菌素a粗提取液;
(2)调节稻曲菌素a粗提取液的ph,再采用大孔吸附树脂柱对稻曲菌素a粗提取液进行柱层析,收集洗脱液;
(3)将含有稻曲菌素a的洗脱液旋转蒸发,再用高速逆流色谱分离纯化,收集洗脱液;
(4)将含有稻曲菌素a的洗脱液旋转蒸干,再溶于水中,冷冻干燥,即制得稻曲菌素a纯品。
作为优选,所述提取液为含有体积分数为1.0%的甲酸和体积分数为0.1%的吐温-20的水溶液。
作为优选,所述超声提取采用的料液比为1/5-1/20。
作为优选,所述步骤(1)中采用低速或中速滤纸过滤。
作为优选,所述步骤(2)中调节稻曲菌素a粗提取液的ph至中性。
作为优选,所述大孔吸附树脂柱为弱极性大孔吸附树脂柱hz-801。
作为优选,所述步骤(2)进行柱层析时,以2-3bv/h的流速上样至大孔吸附树脂柱。
作为优选,所述柱层析采用的洗脱液为20%~30%体积分数的甲醇水溶液。
作为优选,所述步骤(3)中将含有稻曲菌素a的洗脱液旋转蒸发至无甲醇残留。
作为优选,所述步骤(2)和(3)中,在收集洗脱液时采用tlc检测洗脱液中稻曲菌素a的含量,所采用的展开剂为体积比为1:1的正丁醇-冰醋酸混合液,显色剂为含有体积分数为1.5%的茚三酮的正丁醇溶液。
作为优选,所述步骤(4)中选择只含有稻曲菌素a的洗脱液进行合并后旋转蒸干。
作为优选,所述高速逆流色谱采用体积比为正丁醇:水:三氟乙酸=1:1:0.02的溶剂体系,以上层溶剂为固定相,下层溶剂为流动相,流动相流速为1.0~1.5ml/min,仪器转速为900~1200rpm,运行温度为25℃~40℃。
本申请实施例中提供的一个或多个技术方案,至少具有如下技术效果或优点:
(1)本申请实施例通过采用大孔吸附树脂柱层析与高速逆流色谱联用的技术,一次性能上样1000mg干物质,能单次制备500mg以上且纯度大于95%的稻曲菌素a纯品,载样量大且分离纯化步骤简单,不需要使用较昂贵精密仪器,在降低生产成本的同时提高了纯品的产量,具有制备量大、回收率高、成本低廉、实用性强的优点;
(2)本申请实施例采用大孔吸附树脂柱层析和高速逆流色谱的二步法纯化稻曲菌素a,减少了多步骤制备纯化造成的原料损失;
(3)本申请实施例采用高速逆流色谱技术,以价廉易得的有机溶剂作为固定相,提高回收率的同时极大地降低了稻曲菌素a制备纯化成本。
附图说明
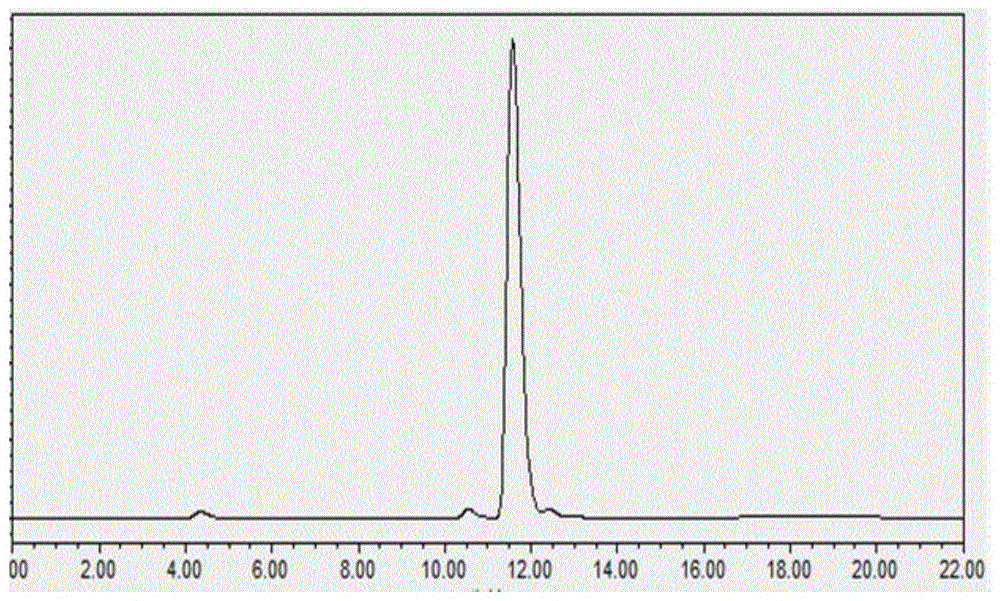
图1为本申请实施例制备得到的稻曲菌素a纯品的液相色谱检测图谱;
图2为本申请实施例制备得到的稻曲菌素a纯品的高分辨质谱图;
图3为本申请实施例制备得到的稻曲菌素a纯品的1h-nmr谱图;
图4为本申请实施例制备得到的稻曲菌素a纯品的13c-nmr谱图。
具体实施方式
本申请实施例通过提供一种稻曲菌素a纯品的制备方法,解决了现有稻曲菌素a纯品分离纯化成本高的问题,提高了稻曲菌素a纯品的单次制备量,并降低了分离纯化成本。
本申请针对上述问题,设计并建立一种在线联用大孔吸附树脂与高速逆流色谱(hsccc)技术对稻曲菌素a进行提取纯化的方法,具有重要的应用价值。其中大孔吸附树脂成本低廉,并且可反复再生使用,具有超越硅胶基质填料的成本优势;高速逆流色谱是一种采用液-液分配机制的新型色谱装置,可以实现大量样品的自动化分离,其分辨率高,载样量大,可以与其他分离手段联合使用,非常适合天然产物的分离纯化。
本申请实施例中的技术方案为解决上述问题,具体思路如下:
一种稻曲菌素a纯品的制备方法,包括以下步骤:
(1)取稻曲球粉末或稻绿核菌培养物粉末,加入提取液进行超声提取,过滤,收集滤液得到稻曲菌素a粗提取液;
(2)调节稻曲菌素a粗提取液的ph,再采用大孔吸附树脂柱对稻曲菌素a粗提取液进行柱层析,收集洗脱液;
(3)将含有稻曲菌素a的洗脱液旋转蒸发,再用高速逆流色谱分离纯化,收集洗脱液;
(4)将含有稻曲菌素a的洗脱液旋转蒸干,再溶于水中,冷冻干燥,即制得稻曲菌素a纯品。
本申请实施例通过采用大孔吸附树脂柱层析与高速逆流色谱联用的技术,一次性能上样1000mg干物质,能单次制备500mg以上且纯度大于95%的稻曲菌素a纯品,载样量大且分离纯化步骤简单,不需要使用较昂贵精密仪器,在降低生产成本的同时提高了纯品的产量,具有制备量大、回收率高、成本低廉、实用性强的优点。本申请实施例采用大孔吸附树脂柱层析和高速逆流色谱的二步法纯化稻曲菌素a,减少了多步骤制备纯化造成的原料损失。
本申请实施例制备稻曲菌素a纯品的方法稳定,能够适用于稻曲球以及大米等谷物基质中稻曲菌素a的提取纯化。其中稻曲球粉末可通过采集水稻上的稻曲球,再经烘干、粉碎制成;稻绿核菌培养物粉末可通过将稻绿核菌接种至大米等谷物培养基中培养,再将发酵谷物烘干、粉碎制成。
本申请实施例优选以含有体积分数为1.0%的甲酸和体积分数为0.1%的吐温-20的水溶液作为超声提取液,甲酸含量少,显著降低了提纯成本;本申请实施例优选上述超声提取采用的料液比为1/5-1/20,提取时间为30min;本申请实施例优选使用低速或中速滤纸过滤超声提取液,以除去固体杂质,该方法无需使用离心机,相较于常规的离心法,操作更便捷。
本申请实施例优选上述步骤(2)中调节稻曲菌素a粗提取液的ph至中性,可使提取液中稻曲菌素a以分子形式存在,提高树脂吸附量。在对稻曲菌素a粗提取液进行柱层析时,本申请实施例优选采用弱极性大孔吸附树脂柱hz-801,优选以2-3bv/h的流速上样至大孔吸附树脂柱上;优选采用20%~30%体积分数的甲醇水溶液为洗脱液,在洗脱时,优选进行梯度洗脱,如先以20%甲醇水溶液冲洗1bv,再以30%甲醇水溶液冲洗2bv,并以分部收集器收集洗脱组分,再对每管洗脱液中稻曲菌素a的含量进行检测。本申请实施例优选采用tlc检测每管洗脱液中稻曲菌素a的含量,所采用的展开剂为体积比为1:1的正丁醇-冰醋酸混合液,显色剂为含有体积分数为1.5%的茚三酮的正丁醇溶液。
在采用高速逆流色谱对柱层析后的含有稻曲菌素a的洗脱液进行分离纯化前,本申请实施例优选先将含有稻曲菌素a的洗脱液旋转蒸发至无甲醇残留,目的是防止残留甲醇影响后续高速逆流色谱分离。本申请实施例优选高速逆流色谱采用体积比为正丁醇:水:三氟乙酸=1:1:0.02的溶剂体系,以上层溶剂为固定相,下层溶剂为流动相,流动相流速为1.0~1.5ml/min,仪器转速为900~1200rpm,运行温度为25℃~40℃,并定量收集不同时间段的洗脱液。本申请实施例优选采用tlc检测洗脱液中稻曲菌素a的含量,所采用的展开剂为体积比为1:1的正丁醇-冰醋酸混合液,显色剂为含有体积分数为1.5%的茚三酮的正丁醇溶液。
本申请实施例优选步骤(4)中选择只含有稻曲菌素a的洗脱液进行合并后旋转蒸干。
为了更好的理解上述技术方案,下面将结合说明书附图以及具体的实施方式对上述技术方案进行详细的说明,但不作为对本申请的限定。
实施例1
稻曲球的获取方法:在水稻生长后期于水稻田中采集稻曲球,其特征为寄生于水稻穗部的墨绿色或棕黄色表面毛糙的球状物。将稻曲球置于65℃烘箱中晾干,以电动磨粉碎并过30目筛,获得稻曲球粉末,避光保存。
向1l去离子水中加入体积比为1.0%的甲酸与体积比为0.1%的吐温-20,混合均匀后,静置2hr,即制成提取液。取100g稻曲球粉末于玻璃容器中,加入10倍(v/w)提取液,将玻璃容器至于超声清洗仪中,80%功率超声提取30min,之后采用whatman中速滤纸过滤,收集滤液,得到稻曲菌素a粗提取液。
以浓度为1n的naoh水溶液调节稻曲菌素a粗提取液的ph至中性;向一根内径为5cm、高度为50cm的玻璃层析柱中装填hz-801大孔吸附树脂至柱床高度为40cm,用蠕动泵以2bv/h的流速将稻曲菌素a粗提取液泵入hz-801大孔吸附树脂柱,以tlc检测流出液中稻曲菌素a的含量,待流出液中出现稻曲菌素a后停止泵入,并用甲醇水溶液进行梯度洗脱,先以20%体积分数的甲醇水溶液冲洗1bv,再以30%体积分数的甲醇水溶液冲洗2bv,以分部收集器收集洗脱液,馏分体积为10ml/管,用tlc方法检测每管洗脱液中稻曲菌素a的浓度,合并含有稻曲菌素a的馏分。
配制1l体积比为正丁醇:水:三氟乙酸=1:1:0.02的溶剂体系,混匀后静置分层,将上下相分别收集,即为高速逆流色谱所用双相溶剂体系。将含有稻曲菌素a的洗脱液旋转蒸发至无甲醇残留(约为原体积一半),用高速逆流色谱体系进行分离纯化。高速逆流色谱体系参数如下:上相为保留相,下相为流动相,流速为1.0ml/min,仪器转速为900rpm,运行温度为30℃,紫外检测器在线监测洗脱成分,检测波长为254nm,选择稻曲菌素a出峰时间段的洗脱液进行合并,再进行旋转蒸干,然后溶于少量的去离子水中,冷冻干燥,即制备得到680mg稻曲菌素a纯品。所获稻曲菌素a纯品粉末置于-20℃低温保藏。
本实施例制备得到稻曲菌素a产品分别经高效液相色谱(图1)、高分辨质谱(图2)以及核磁共振波谱(图3和图4)分析,测定得到稻曲菌素a纯品的纯度为96.8%。
实施例2
稻绿核菌的大米培养物的制备过程:取长粒粳米200g至于玻璃三角瓶,加入60ml去离子水,静置2hr,121℃高压灭菌30min,接种水稻稻绿核菌菌株,25℃避光培养30天,获得水稻稻绿核菌大米培养物。将大米培养物置于65℃烘箱中晾干,以电动磨粉碎并过30目筛,获得大米培养物粉末,避光保存。
本实施例按照与实施例1相同的提取纯化过程对上述稻绿核菌的大米培养物粉末进行提取纯化,制备得到760mg稻曲菌素a纯品,经hplc鉴定稻曲菌素a纯品的纯度为95.8%。
由本申请实施例1和2可以看出,稻曲菌素a纯品的单次制备量均在500mg以上,且纯度均大于95%,远高于目前方法的制备量和纯度。由于上述实施例均为实验室制备规模,经工业放大生产制备量可进行提升,且在放大生产过程中无技术难度,具有很强的实用性。
最后说明的是,以上实施例仅用以说明本申请的技术方案而非限制,尽管参照较佳实施例对本申请进行了详细说明,本领域的普通技术人员应当理解,可以对本申请的技术方案进行修改或者等同替换,而不脱离本申请技术方案的宗旨和范围,其均应涵盖在本申请的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!