一种核酸适体功能化NK细胞及其制备与应用的制作方法
(一)技术领域
本发明涉及一种核酸适体功能化nk细胞,及其制备方法以及在制备肝癌过继性免疫治疗药物中的应用。
(二)
背景技术:
根据国家癌症中心发布的《2019中国最新癌症报告》显示:我国新增癌症病例中,肝癌发病人数位列第四,死亡率排名第二,严重威胁着我国人民的生命健康及生活质量。尽管目前肝癌治疗以手术切除为主,辅以放疗、介入治疗等综合治疗手段,获得了一定的治疗效果,但预后仍较差,肝癌患者的远期生存率仍较低。
基于nk细胞的过继性免疫治疗是一种不依赖于抗原预先致敏而直接识别与攻击肿瘤细胞的免疫细胞治疗策略。nk细胞具有良好的杀伤肿瘤细胞特性,通过分泌tnf-α、ifn-γ、颗粒酶及穿孔素等细胞因子诱导肿瘤细胞凋亡或坏死。nk细胞不需要抗原预先致敏就能直接识别和攻击肿瘤细胞,并且nk细胞具有良好的组织浸润能力能够快速浸入肿瘤组织内部,因此受到业界普遍关注。但是nk细胞缺乏肿瘤特异性靶向能力及其体外扩增效率较低,限制其更深入的临床运用。基因工程/嵌合抗原受体改造的自然杀伤性细胞(car-nk细胞)能够通过其表面表达的scfv片段特异性识别肿瘤细胞,促进nk细胞向肿瘤部位富集,是提高nk细胞靶向能力的有效手段之一。但是,由于实体肿瘤组织间质致密以及免疫抑制微环境导致免疫治疗效果有限,以及car-nk细胞存在制备工艺复杂、成本昂贵等问题,极大的限制了其临床推广应用。
多手段联合治疗是提高肝癌治疗疗效的重要策略。免疫细胞治疗与光热治疗具有天然的联合和协同治疗基础,将其联合能够有效提高实体肿瘤的治疗效果。光热治疗(photothermaltherapy,ptt)是利用近红外光照射,促使光热转换物质(如icg、pda等物质)将光能转化为热能,导致肿瘤细胞受热坏死的治疗手段。它具有无创、选择性高、无肿瘤耐药性等优点,能够在肿瘤免疫抑制微环境下发挥肿瘤治疗效果,并打破实体肿瘤致密的组织结构,进而吸引免疫效应细胞进一步浸润肿瘤组织,实现对残存肿瘤细胞的免疫杀伤。
当前免疫治疗联合光热治疗的策略主要是通过将光热转换物质包裹在各种肿瘤靶向/响应的纳米材料中使其靶向富集于肿瘤部位进行光热治疗,再辅助回输免疫效应细胞,从而形成简单的联合治疗方式。该联合治疗方式依赖于复杂的具有肿瘤靶向富集、成像、光热转换性能的纳米材料,两者之间难以真正有效协同,且存在纳米材料的长期安全性、免疫细胞肿瘤部位富集动力学不清楚等诸多问题,距离临床应用遥远。
兼具荧光成像功能的免疫/光热联合治疗更具临床转化与应用优势,首先,荧光成像具有较高的时间和空间分辨率,能够实时动态、可视化监测免疫细胞在肿瘤部位富集,进而精准为光热治疗提供肿瘤的位置信息;其次,免疫细胞在肿瘤部位富集与光热转换物质体内代谢都具有一定的时效性,准确判定最佳光照时机能够进一步提高免疫/光热联合治疗效果。
(三)
技术实现要素:
为了解决上述技术难题,本发明提供了一种用于近红外引导下免疫/光热时序协同治疗肝癌的核酸适体功能化nk细胞,及其在在制备肝癌过继性免疫治疗药物中的应用。
本发明采用的技术方案是:
一种核酸适体功能化nk细胞,由如下方法制备获得:
(1)制备pbmc细胞,与滋养细胞il21-k562共培养,获得体外激活扩增nk细胞;
(2)步骤(1)获得的nk细胞经叠氮修饰甘露糖(ac4mannaz)代谢后,在nk细胞膜表面表达叠氮基团,获得糖代谢工程化的nk细胞;
(3)将dbco修饰的gpc3核酸适体与糖代谢工程化的nk细胞混合共孵育,获得所述核酸适体功能化nk细胞;所述dbco修饰的gpc3核酸适体的核苷酸序列如下:5’-dbco-taacgctgaccttagctgcatggctttacatgttcca-3’
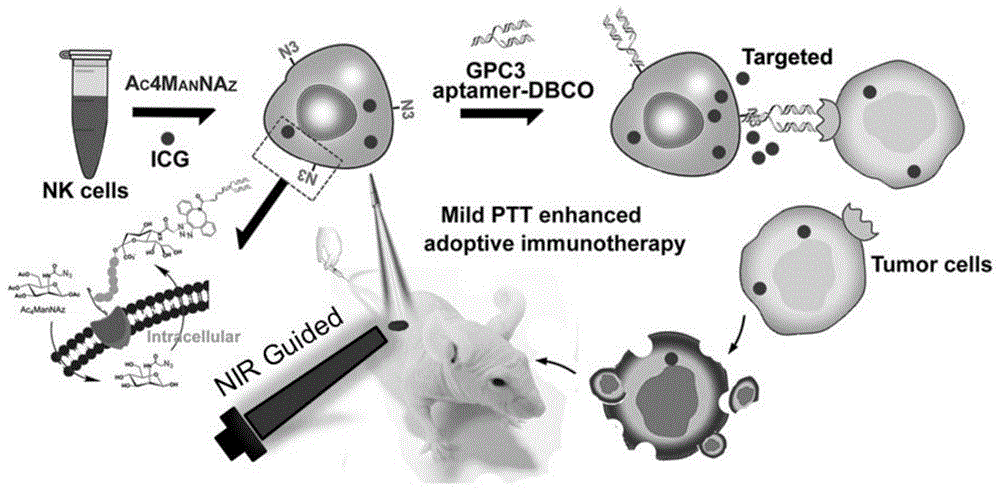
本发明是利用体外激活的nk细胞,经叠氮修饰的甘露糖(ac4mannaz)糖代谢途径处理,作为荧光/光热转换物质icg的载药体系(icg@nk),再经dbco末端修饰的gpc3核酸适体经点击化学手段共价偶联在nk细胞表面获得icg@g-nk细胞。
本发明还涉及制备所述核酸适体功能化nk细胞的方法,所述方法包括:
(1)制备健康pbmc细胞(采集外周血液30ml,采用ficoll分离提取pbmc细胞),调节pbmc细胞密度为0.5~4.0×106个/ml,将其以1:5~10的比例与il21-k562滋养细胞混合,于nk细胞培养基中培养至第7~8天,调整nk细胞密度0.3~1.5×106个/ml,按照nk细胞:il21-k562比例1:1~5,补充滋养细胞il21-k562,每天补充nk细胞培养基至第12~14天,制备获得体外激活扩增的nk细胞;所述nk细胞培养基组分为:il-2100~300iu/ml,庆大霉素50~100u/mlk,溶剂为bm581培养基;
(2)步骤(1)获得的nk细胞加入叠氮修饰甘露糖培养18~24小时后,加入荧光/光热转换物质吲哚菁绿,继续培养18~24小时,获得icg@nk细胞;
(3)将获得的icg@nk细胞加入dbco修饰的gpc3核酸适体在35~37℃共孵育0.5~1小时,获得具有荧光及光热转换效应的icg@g-nk细胞,即所述核酸适体功能化nk细胞;所述dbco修饰的gpc3核酸适体的核苷酸序列如下:5’-dbco-taacgctgaccttagctgcatggctttacatgttcca-3’。
优选的,步骤(2)中叠氮修饰的甘露糖添加浓度为0.5~8μg/ml。
优选的,步骤(3)dbco修饰的gpc3核酸适体添加浓度为0.01~1μmol/ml。
步骤(2)中所述荧光/光热转换物质吲哚菁绿添加浓度为0.1~200μg/ml。
优选的,步骤(1)中所述nk细胞培养基组成为:il-2200iu/ml,庆大霉素80u/ml,溶剂为bm581培养基。
本发明通过体外激活培养nk细胞,将nk细胞与叠氮修饰的甘露糖(ac4mannaz)共培养,通过点击化学反应将特异性识别肝癌的gpc3核酸适体共价偶联到nk细胞表面,成功构建特异性靶向识别肝癌组织的活化g-nk细胞,g-nk细胞在特异性核酸适体的靶向作用,特异性识别肿瘤细胞,释放细胞因子ifn-γ、tnf-α、穿孔素(perforin)及颗粒酶(gzmb)等,发挥特异性杀伤肿瘤细胞的作用,实现肝癌免疫治疗效果。
本发明通过上述步骤制备的icg@g-nk细胞,可通过nk细胞膜表面的gpc3核酸适体特异性识别并结合肿瘤细胞,同时可作为荧光/光热转换物质(icg)的载体体系,实现近红外荧光检测icg@g-nk细胞靶向富集于肿瘤部位,进而精准获取肿瘤的位置信息;在实现nk细胞介导的免疫治疗后,对肿瘤组织进行精准的ptt治疗。ptt能够打破实体肿瘤致密的组织结构,同时促进血管扩张加快外周血中免疫效应细胞更好的浸润肿瘤组织,实现对残存肿瘤细胞的免疫杀伤,增强肿瘤免疫反应,提升实体肿瘤治疗的疗效,进一步提高肝癌靶向的过继性免疫治疗,具有较好的协同治疗效果。
本发明的有益效果主要体现在:
1)本发明利用特异性靶向识别肝癌的gpc3核酸适体共价偶联至nk细胞膜表面,赋予nk细胞良好的肝癌靶向性,提高了nk细胞对肝癌的主动靶向杀伤能力。
2)本发明利用gpc3核酸适体功能化的nk细胞,能够作为荧光/光热转换物质(icg)的载药体系,实现近红外荧光检测nk细胞的靶向富集作用,同时精准获取肿瘤组织的位置信息,实现对肿瘤组织进行精准的ptt治疗。
3)本发明利用gpc3核酸适体功能化的nk细胞(icg@g-nk)细胞完成免疫治疗后精准ptt治疗之后,ptt治疗能够打破肿瘤致密组织结构,吸引更多免疫细胞富集,反过来继续增强过继性免疫细胞治疗效果。
(四)附图说明
图1为本发明近红外荧光引导下的免疫/光热时序协同治疗肝癌核酸适体功能化nk细胞的制备及其应用原理图。
图2为核酸适体功能化nk细胞携带荧光/光热转换物质(icg)共聚焦图。
图3为icg@g-nk细胞近红外荧光成像(a)及光热转换效率图(b)。
图4为icg@g-nk杀伤肝癌细胞流式分析图。
图5为近红外荧光监测icg@g-nk细胞肿瘤部位富集效果图
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1:
采集外周血液30ml,采用ficoll分离提取pbmc细胞,调节pbmc细胞密度为2.0×106个/ml,与il21-k562滋养细胞共培养(培养基组成为:il-2200iu/ml,庆大霉素80u/ml,溶剂为kbm581培养基);在第3天离心,调整细胞密度1.0×106个/ml,补充新鲜的kbm581培养基及il-2100iu/ml,硫酸庆大霉素80iu/ml。此后每天补充培养液及相应的细胞因子至第7天,再重新调整细胞密度为1.0×106个/ml,再次添加il21-k562滋养细胞与nk细胞共培养,培养第12天收获激活的nk细胞。
取1.0×106个/ml活化的nk细胞1ml,加入2μg的叠氮修饰的甘露糖(ac4mannaz,陕西新研博美生物科技有限公司)培养24小时,再加入50μg的吲哚菁绿(icg)培养24小时,获得icg@nk细胞;采用pbs清洗icg@nk细胞3次,500g离心5分钟,弃上清;采用0.2ml的d-pbs重悬细胞,加入0.02μm的dbco修饰的gpc3核酸适体,37℃反应0.5小时;pbs清洗3次,500g离心5分钟,弃上清,获得icg@g-nk细胞。
实施例2:
取1.0×106个icg@g-nk细胞,采用近红外光i区和ii区激光观察icg@g-nk细胞成像效果。采用808nm激光,激光功率调整为0.5w/cm2照射icg@g-nk细胞,观察光热转换效率。
取2×105个/孔的hepg2细胞,铺于24孔板;按照e/t=10:1的条件,加入实施例1所获得的icg@g-nk细胞,共培养1小时;洗去未结合的效应细胞,继续培养24小时;收集残余的肿瘤细胞,采用annexinv/pi双染的方法检测肿瘤细胞存活的差异。
实施例3:
实施例1制备的icg@g-nk细胞可用于肝癌过继性免疫治疗。收集5×106个的hepg2细胞接种于小鼠皮下,待其成长为100mm3肿瘤大小时,收集实施例1制备的icg@g-nk细胞5×106个,通过尾静脉过继性输注至小鼠体内,24小时后脱颈处死小鼠,收集小鼠主要脏器及肿瘤组织,采用近红外荧光观察icg@g-nk细胞的富集情况。
使用荧光标记法及共聚焦显微镜观测核酸适体功能化icg@g-nk细胞状态,及其靶向杀伤肝癌细胞的细胞状态以及利用流式细胞术检测杀伤后的肝癌细胞凋亡或坏死比例。具体测试结果如下:
(1)近红外引导下免疫/光热时序协同治疗肝癌的核酸适体功能化nk细胞的制备及其应用原理图;
本发明近红外引导下免疫/光热时序协同治疗肝癌的核酸适体功能化nk细胞的制备及其应用原理图参见图1。
(2)核酸适体功能化icg@g-nk细胞制备;
将dbco末端修饰的gpc3核酸适体经点击化学反应,共价偶联于nk细胞膜表面,并作为荧光/光热转换物质(icg)的载体体系。
结果见图2,由图可见,gpc3核酸适配体共价偶联于nk细胞表面,并且nk细胞能够作为icg的载体体系,携带icg分子。
(3)核酸适体功能化icg@g-nk细胞荧光成像效果图及光热转换效率;
采用近红外荧光观察核酸适体功能化icg@g-nk细胞荧光信号,并考察核酸适体功能化icg@g-nk细胞的光热转换效果。
结果见图3,由图可见,核酸适体功能化icg@g-nk细胞在近红外i区和近红外ii区均有较好的荧光信号;同时,在808nm的激光条件下具有较好的光热转换效率。
(4)核酸适体功能化icg@g-nk细胞靶向杀伤肝癌细胞流式分析图;
将2×105个/孔的hepg2细胞接种于24孔板中,37℃过夜培养。第二天将icg@g-nk细胞以e:t=10:1的效靶比加入到hepg2中,共培养1小时,采用pbs洗去未结合的nk细胞,继续培养24小时,采用annexin-vfitc/pi凋亡双染色试剂盒,考察hepg2细胞的凋亡情况。
结果见图4,由图可见,icg@g-nk细胞能够有效提高nk细胞杀伤肿瘤细胞的效率,其凋亡及坏死比例高达37.0%。
(5)核酸适体功能化icg@g-nk细胞靶向肝癌组织效果图;
收集5×106个hepg2细胞接种于小鼠皮下,待肿瘤生长至100mm3大小时,通过尾静脉过继性输注5×106个icg@g-nk细胞,24小时后,脱颈处死小鼠,收集小鼠主要脏器及肿瘤组织,采用近红外光考察icg@g-nk细胞在肿瘤组织的富集效果。
结果见图5,由图可见,icg@g-nk细胞可以特异性在肿瘤组织富集。
以上实施例的说明只是用于帮助理解本发明方法及其核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!