Ces2基因敲除大鼠模型及其构建方法和应用与流程
本发明属于生物医药技术领域,具体涉及羧酸酯酶2(ces2)基因敲除大鼠的构建方法及应用。
背景技术:
羧酸酯酶(carboxylesterase,ces)是α/β丝氨酸折叠蛋白,包含多个基因,隶属于b类酯酶。在多种内源外源物质的生物转化和前药的激活中发挥重要作用,主要分布于肝脏、肠道,在肾脏、肺和脑等器官中也有少量分布,是人体内重要的ⅰ相药物代谢酶。ces1和ces2作为主要的亚型羧酸酯酶,具有47%的氨基酸序列相似性,但是其对底物的选择有明显的倾向。ces1底物大多具有较大的酰基和较小的醇基,而ces2更倾向于选择具有较小酰基和较大醇基结构的化合物来作为底物。ces2作为胃肠道中最主要的羧酸酯酶亚型,介导大部分口服前药的首过水解代谢,参与多种临床常用的抗血小板药物,血管紧张素受体拮抗剂,抗病毒药物及肿瘤治疗药物的代谢。
ces2参与的药物代谢包括两种方式:代谢激活和代谢消除。多种临床常用前药均经由ces2代谢激活,如肿瘤治疗药物伊立替康、ly2334737(吉滨他赛前药)、卡培他滨,血管紧张素受体拮抗剂坎地沙坦、奥美沙坦等。伊立替康经ces2代谢产生活性代谢产物sn-38,其细胞毒性是伊立替康的100-1000倍。同时,ces2也参与许多临床上常用药物的代谢清除,如抗肿瘤药物氟他胺。除此之外,许多影响神经中枢的药物如可卡因和海洛因也经由ces2代谢。由于伦理等诸多原因,许多实验需借助实验动物来进行。通过不同的研究目的和研究方法,人们会选择合适的实验动物来进行实验。啮齿类动物因其体型小,易操作、繁殖较快且基因与人类相似性较高,常作为医学研究中的首选动物模型。
人体中ces2家族只有一个亚型,位于16号染色体,全长10.9kb,啮齿类动物中ces2亚型较多,小鼠中ces2包括8个亚型(ces2a-ces2h)位于8号染色体上一个全长286kb的基因簇上。大鼠中ces2也包括8个亚型,且分别位于1号染色体和19号染色体上。大鼠中ces2c和ces2i位于1号染色体上,ces2a,ces2e,ces2g,ces2h,ces2j及ces2(ab010632)位于19号染色体上。有文献报道大鼠和小鼠肝脏和肠道中表达较高的ces2亚型依次为ces2c,ces2a及ces2e。目前并无研究明确啮齿类动物中包含人类ces2的直系同源基因,但啮齿类动物和人类ces多基因家族的基因结构类似,均形成ces2-ces3a-ces4a结构,且人和啮齿类动物中ces2的底物及功能具有很高的相似性,因此常用其作为研究ces2的重要工具。大鼠相较于小鼠,体型较大、易抓取,且血量大,可连续多次进行取血而常用于药物代谢动力学的研究中。但由于大鼠和小鼠中ces2基因的复杂性,目前并无构建ces2基因敲除动物模型来进行药物代谢和脂质代谢相关的研究。构建ces2基因敲除大鼠模型能更科学、有效的研究ces2的功能并为药物代谢研究提供强有力的工具。
技术实现要素:
本发明利用crispr/cas9系统靶向大鼠中的ces2a和ces2c,首次成功构建了ces2a/j、ces2c及ces2a/c/j基因敲除大鼠模型,为研究基于ces2的药物代谢提供了全新的动物模型,也为研究大鼠中各个ces2亚型的功能提供了强有力的工具。本发明构建的ces2a/j、ces2c及ces2a/c/j基因敲除大鼠模型可用于研究大鼠中ces2各亚型的药物代谢功能,为更科学、准确的将大鼠中临床前研究结果外推至人中提供一定参考依据。除此之外,上述模型还可用于探究大鼠中ces2在脂质代谢中的作用及其与疾病发生发展的关系,为临床治疗代谢性疾病提供一些参考。
为了研究羧酸酯酶2(carboxylesterase2,ces2)代谢功能以及为药物代谢研究提供全新的动物模型,本发明首次运用crispr/cas9系统实现了大鼠体内ces2a/j、ces2c及ces2a/c/j基因敲除,并制备得到了特定ces2基因敲除的大鼠肝微粒体。本发明利用crispr/cas9系统经过靶点选择、sgrna合成、胚胎显微注射、大鼠饲养与繁殖等步骤成功得到了特定ces2基因敲除大鼠模型,并通过肝脏提取、匀浆、差速离心等步骤得到特定ces2基因敲除大鼠肝脏微粒体溶液,可用于药物代谢相关研究。
本发明提出了一种ces2基因敲除大鼠模型的构建方法,所述方法包括:
1)确定敲除靶点
利用crispr设计工具(在线设计工具http://tools.genome-engineering.org),选择crispr/cas9系统敲除靶点,即所述敲除靶点为两个以ngg为结尾的18bpdna序列。选择敲除的靶点尽可能靠近基因组5’端。
所述敲除靶点为两个相距50bp的以ngg为结尾的18bpdna序列。
所述敲除靶点如下:
ces2a:ttggctagacttcctggt(seqidno.1)和tctcctccagcatgtgca(seqidno.2);
ces2c:cggaaacaaccacatagc(seqidno.3)和tattcttatccatgtgtg(seqidno.4);
2)sgrna双链模板的体外合成与转录。
sgrna双链模板的体外转录由t7启动子启动。首先以体外合成的带有t7启动子序列和18bp靶点序列的长度为60bp的寡聚核苷酸链(oligo)为模板,用高保真kod酶进行pcr反应,得到sgrna双链模板。
所述寡聚核苷酸序列(oligo)包括:
ces2asgrna:
oligo1:
gatcactaatacgactcactatagggcctttggctagacttccgttttagagctagaaat(seqidno.5)
oligo2:
gatcactaatacgactcactataggtctcctccagcatgtgcagttttagagctagaaat(seqidno.6)
ces2csgrna:
oligo1:
gatcactaatacgactcactataggcggaaacaaccacatagcgttttagagctagaaat(seqidno.7)
oligo2:
gatcactaatacgactcactataggtattcttatccatgtgtggttttagagctagaaat(seqidno.8)
所述sgrna双链模板包括:
ces2asgrna
模板1:
gatcactaatacgactcactataggttggctagacttcctggtgttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgctttttt(seqidno.9)
模板2:
gatcactaatacgactcactataggtctcctccagcatgtgcagttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgctttttt(seqidno.10)
ces2csgrna
模板1:
gatcactaatacgactcactataggcggaaacaaccacatagcgttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgctttttt(seqidno.11)
模板2:
gatcactaatacgactcactataggtattcttatccatgtgtggttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgctttttt(seqidno.12)
用t7转录试剂盒进行转录反应,然后用酚氯仿法提取转录得到的sgrna,然后将抽提的sgrna置于-80℃保存备用。
3)sgrna与cas9mrna显微共注射
假孕母鼠的制备、单细胞胚胎的体外显微注射与移植、大鼠的繁殖。
将sgrna和cas9mrna共注射到受精卵胞浆中,并将状态良好的受精卵移植到假孕母鼠的输卵管中。
所述sgrna注射浓度为20-40ng/μl;优选地,为25ng/μl。
所述cas9mrna注射浓度为30-60ng/μl;优选地,为50ng/μl。
具体步骤为:首先对正常成年雌鼠进行超排卵处理,然后将该雌鼠与正常雄鼠合笼,使其正常交配受孕。然后将交配成功的雌鼠处死,取出受精卵,体外培养2小时。利用显微注射技术,将sgrna、cas9mrna共注射到受精卵胞浆中,其中,sgrna注射浓度为25ng/μl,cas9mrna注射浓度为50ng/μl。后培养数小时,通过形态观察判断受精卵的存活状态,将存活的受精卵移植入假孕雌鼠的输卵管中,让其自然着床,分裂并发育。
4)ces2基因敲除大鼠模型构建
假孕母鼠繁殖所得为f0代单基因或多基因杂合子大鼠,将f0代单基因或多基因杂合子大鼠与野生型大鼠合笼繁殖所得子代为f1代单基因或多基因杂合子大鼠,相同基因型f1代大鼠合笼繁育,得到纯合子突变型大鼠,即f2代大鼠,即所述ces2基因纯合子敲除大鼠动物模型。
所述步骤4)中还包括对ces2基因敲除大鼠基因型鉴定的步骤:提取大鼠模型的基因组dna,以该基因组dna为模板,依据靶点上下游序列设计引物对进行pcr反应,将这些pcr产物进行测序分析,根据测序分析结果,选择在单一位点发生非三整数倍基因编辑的大鼠进行后续繁育。
在一个具体实施方式中,对f0代单基因或多基因杂合子大鼠基因型鉴定的步骤:待f0代幼鼠4~7天大时,剪其脚趾,提取基因组dna,以该基因组dna为模板,依据靶点上下游序列设计引物进行pcr反应,将这些pcr产物进行测序分析,根据测序分析结果,选择在单一位点发生非三整数倍基因编辑的大鼠进行后续繁育。
其中,pcr所使用引物对如下:
ces2a
上游:ctgctggctattggcttcc(seqidno.13)
下游:cctgctgctttccatccc(seqidno.14)
ces2c
上游:aactttcacccacgacat(seqidno.15)
下游:aaggttaccatcagtgcc(seqidno.16)
本发明所述ces2基因敲除包括一个或多个ces2基因的敲除。
本发明还提供了由上述构建方法得到的ces2基因敲除大鼠模型。
其中,所述ces2基因敲除大鼠模型包括ces2单基因敲除大鼠模型和ces2多基因敲除大鼠模型。
本发明还提供了所述ces2基因敲除大鼠模型在制备ces2基因缺失大鼠肝脏微粒体中的应用。
本发明提出用ces2单基因或多基因敲除大鼠模型来制备ces2单基因或多基因缺失大鼠肝脏微粒体,所述肝脏微粒体中发生单个或多个基因功能缺失。
本发明还提供了一种ces2基因缺失大鼠肝脏微粒体的制备方法,co2窒息处死上述所述的ces2纯合子基因敲除大鼠动物模型后,取所述ces2基因敲除大鼠的肝脏,经匀浆、差速离心,得到ces2基因缺失大鼠肝脏微粒体。
本发明还提出了由上述方法制备得到的ces2基因缺失大鼠肝脏微粒体。
所述ces2基因缺失大鼠肝脏微粒体包括ces2单基因缺失大鼠肝脏微粒体和ces2多基因缺失大鼠肝脏微粒体。
本发明还提出一种ces2多亚型敲除大鼠的培育方法,将两种上述所述的ces2单基因或多基因纯合敲除大鼠合笼交配,得到双杂合子或多杂合子子代大鼠,再将双杂合子或多杂合子子代同窝不同性别大鼠进行自交,得到子代纯合敲除大鼠,子代纯合敲除大鼠中包括ces2多基因敲除大鼠。
其中,所述“ces2单基因或多基因纯合敲除大鼠合笼交配”包括ces2单基因与ces2单基因纯合敲除大鼠合笼交配、ces2多基因与ces2多基因纯合敲除大鼠合笼交配、ces2单基因与ces2多基因纯合敲除大鼠合笼交配。
其中,所述“双杂合子或多杂合子子代同窝不同性别大鼠进行自交”包括双杂合子与双杂合子子代同窝不同性别大鼠进行自交、多杂合子与多杂合子子代同窝不同性别大鼠进行自交。
在一个具体实施方式中,以ces2a/c/j多亚型敲除大鼠的繁育为例,取8周以上不同性别的ces2a/j纯合敲除大鼠和ces2c纯合敲除大鼠合笼繁育,产生三基因杂合f1代大鼠,将同窝不同性别的f1代杂合大鼠合笼繁育得到含有三基因纯合敲除大鼠的f2代。
本发明通过“ces2基因敲除大鼠模型的构建方法”得到ces2单基因纯合敲除大鼠模型或位于同一染色体上的多基因敲除大鼠模型,通过“多亚型ces2基因敲除大鼠模型的培育方法”得到位于不同染色体上的ces2多亚型敲除大鼠模型。而位于不同染色体上的ces2多亚型敲除大鼠模型是由ces2单基因纯合敲除大鼠模型利用本发明所述的“多亚型ces2基因敲除大鼠模型的培育方法”培育所得。
本发明还提供了如序列seqidno.9-seqidno.12之任一项所示的sgrna双链模板。
ces2asgrna
模板1:
gatcactaatacgactcactataggttggctagacttcctggtgttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgctttttt(seqidno.9)
模板2:
gatcactaatacgactcactataggtctcctccagcatgtgcagttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgctttttt(seqidno.10)
ces2csgrna
模板1:
gatcactaatacgactcactataggcggaaacaaccacatagcgttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgctttttt(seqidno.11)
模板2:
gatcactaatacgactcactataggtattcttatccatgtgtggttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgctttttt(seqidno.12)
本发明还提供了所述sgrna在构建ces2基因敲除大鼠模型中的应用。
本发明还提供了如上所述的引物对。
本发明还提供了所述引物对在构建ces2基因敲除大鼠模型中的应用。
本发明还提供了所述ces2基因敲除大鼠模型或ces2基因敲除大鼠肝脏微粒体在体外药物代谢、药物毒性评估及化合物筛选中的应用。
本发明还提出了ces2纯合基因敲除大鼠模型在药物代谢研究中的应用。研究药物代谢,需确定参与其代谢的药物代谢酶。例如,同时在ces2敲除大鼠和野生型大鼠中检测待测药物的代谢,可以确定该药物是否通过ces2代谢,同时也可以确定该药物毒性的产生是否是由ces2介导的。
本发明还提出了ces2纯合基因敲除大鼠模型在肝脏脂质代谢研究中的应用。同时检测野生型大鼠和ces2敲除大鼠肝脏结构可以发现ces2敲除大鼠中肝脏脂质代谢紊乱。ces2基因敲除大鼠模型可用于探究脂质代谢异常的原因。
本发明需要克服的技术难点有:ces2亚型众多,且部分亚型之间基因相似性可以达到95%,验证单个亚型的表达缺失时需排除其他亚型干扰,设计引物时要保证引物特异性以确保扩增的特异性。由于大鼠中各ces2亚型不在同一染色体上,所以构建ces2多亚型敲除大鼠需要通过多种单基因敲除大鼠合笼繁育。
本发明首次创新的利用crispr/cas9系统构建了ces2基因敲除大鼠模型,同时利用该大鼠模型制备了肝脏微粒体并用于药物代谢的研究中。本发明的优点包括:
利用crispr/cas9系统构建ces2基因敲除大鼠模型周期短、易于操作、成功率高且价格相对较低。
目前大鼠和小鼠中都并没有报道ces2敲除模型。同时与小鼠相比,大鼠因体型大、易抓取且血量大适合连续多次取血在药物代谢领域具有更广阔的应用前景。
ces2基因缺失的大鼠肝微粒体与现有的体外抑制剂模型相比,特异性更强且无毒性,在体外评估化合物的代谢途径和毒性中具有广阔的应用前景。
综上所述,本发明成功的敲除了大鼠体内特定ces2亚型,对其基因型和代谢功能进行了验证。并且利用该大鼠模型制备了特定ces2亚型缺失的肝脏微粒体,可用于体外研究药物代谢、药物毒性评估及化合物筛选。
在具体实施例中,本发明阐述了对敲除大鼠血清生理指标的检测结果,证明利用crispr/cas9系统构建的ces2基因敲除大鼠模型与野生型大鼠相比,生理状况无显著差异,且敲除大鼠能够正常生长和繁殖,说明ces2的敲除不会影响大鼠的生长发育和繁殖。
通过本发明得到的ces2基因敲除大鼠模型,基因缺失,转录水平表达和代谢功能缺失。在具体实施例中,cdna的pcr产物琼脂糖凝胶电泳证明了ces2a转录水平的表达缺失,ces2a的特异性底物地尔硫卓的体内药物代谢动力学实验中,敲除大鼠的产物生成量远低于野生型大鼠证实了ces2a代谢功能的缺失。
通过特异性底物地尔硫卓的体外酶动力学分析证明了通过本发明制备的ces2a/j敲除大鼠肝脏微粒体的ces2a酶活缺失。在具体实施例中,ces2a/j敲除大鼠肝脏微粒体孵育中ces2a代谢地尔硫卓的最大反应速率vmax及固有清除率clint都远低于野生型大鼠。
附图说明
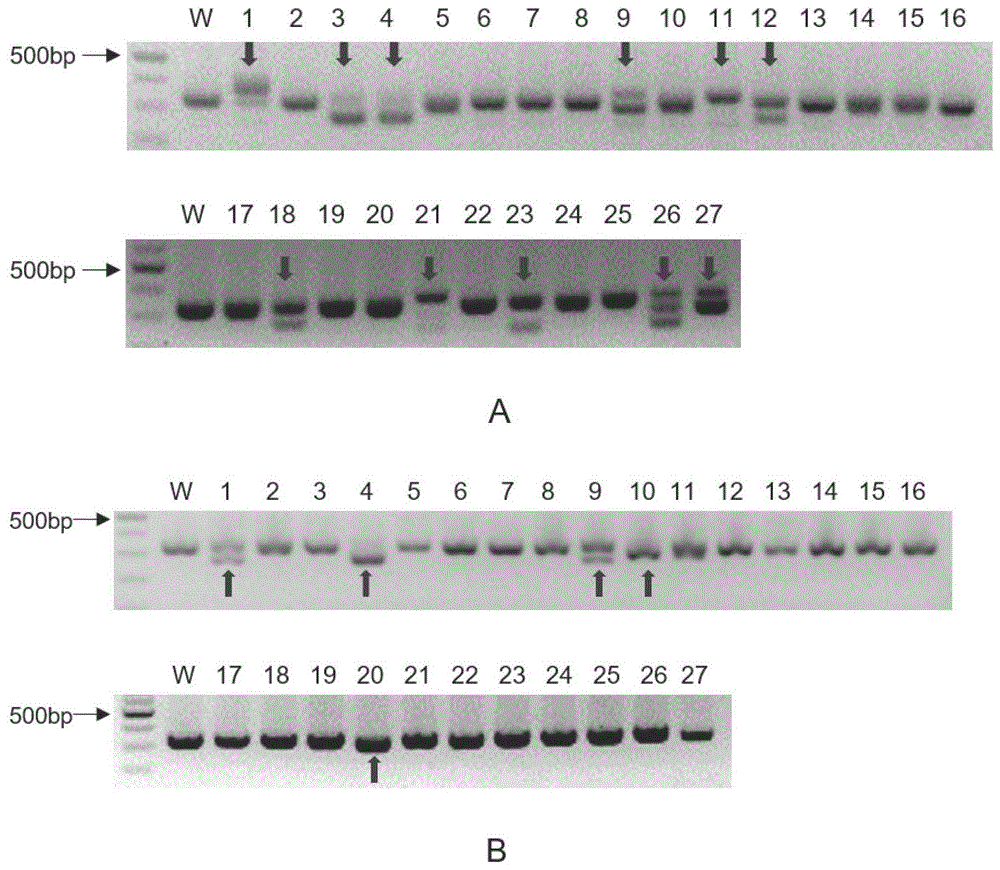
图1为ces2a和ces2c敲除大鼠模型f0代基因型鉴定结果。a图为ces2a敲除大鼠f0代基因型鉴定结果,箭头所指为发生大片段基因编辑的大鼠。b图为ces2c敲除大鼠f0代基因型鉴定结果,箭头所指为发生大片段基因编辑的大鼠。
图2为ces2a敲除大鼠模型f1代基因型鉴定测序结果。a图为野生型,b图为杂合子。
图3为ces2a和ces2c敲除大鼠f2代基因型鉴定结果。a图为ces2a敲除大鼠模型f2代基因型鉴定结果。b图为ces2c敲除大鼠模型f2代基因型鉴定结果。
图4为野生型大鼠和ces2a/j敲除大鼠及ces2a/c/j敲除大鼠肝脏(a)及小肠(b)中ces2a在转录水平的表达差异。
图5为利用ces2a/j敲除大鼠及野生型大鼠制备的肝脏微粒体对地尔硫卓代谢的体外酶动力学曲线及相关参数。
图6为地尔硫卓在ces2a/j敲除大鼠及野生型大鼠体内的药物代谢动力学(a)及药时曲线下面积(auc)(b)。
图7为甲基泼尼松龙琥珀酸酯在野生型大鼠和ces2a/c/j敲除大鼠中的代谢能力检测。
图8为野生型大鼠和ces2a/c/j敲除大鼠肝脏h&e染色结果。箭头所指为脂质空泡。图比例尺为100μm。
具体实施方式
利用以下具体实施例和附图,对本发明作进一步的详细说明,本发明的保护内容包括但不限于以下实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求书为保护范围。实施本发明的过程、条件、试剂、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,本发明没有特别限制内容。
实施例1靶点设计
crispr/cas9系统能够识别引导rna相对应的基因组中ngg结尾的dna序列,因此本发明选择基因组中ngg的5’端的长度为18bp的核苷酸序列作为敲除靶点。为最大程度的使基因发生移码突变,本发明选择敲除靶点的原则为尽可能靠近基因组5’端。crispr/cas9系统可能发生1~3个碱基的错配,所以本发明对设计出来的靶点会进行脱靶检测,脱靶检测网站为:https://benchling.com。
本发明设计的大鼠ces2基因敲除靶点如下:
ces2a的敲除靶点为ttggctagacttcctgg(seqidno.1)t和tctcctccagcatgtgca(seqidno.2),其后序列分别为tgg和cgg,该靶点位于ces2a基因的第一个外显子上,分别距离起始密码子atg38bp和88bp。
ces2c的敲除靶点为cggaaacaaccacatagc(seqidno.3)和tattcttatccatgtgtg(seqidno.4),其后序列分别为tgg和ggg,该靶点位于ces2c基因的第一个外显子上,分别距离起始密码子atg3bp和53bp。
实施例2sgrna模板的合成与转录
本发明中选择大鼠受精卵显微共注射sgrna和cas9mrna来实现对大鼠ces2基因的基因编辑。本发明首先合成一段含有t7启动子和18bp靶点序列的总长度为60bp寡聚核苷酸序列,以该序列为模板,通过重叠pcr技术得到完整地sgrna双链模板序列。将该模板用t7体外转录试剂盒进行体外转录,经酚氯仿抽提纯化后得到sgrna。
本发明合成的60bp寡聚核苷酸序列如下:
ces2a
gatcactaatacgactcactatagggcctttggctagacttccgttttagagctagaaat(seqidno.5)
gatcactaatacgactcactataggtctcctccagcatgtgcagttttagagctagaaat(seqidno.6)
ces2c
gatcactaatacgactcactataggcggaaacaaccacatagcgttttagagctagaaat(seqidno.7)
gatcactaatacgactcactataggtattcttatccatgtgtggttttagagctagaaat(seqidno.8)
其中横线标出本发明实施例1中的敲除靶点。
实施例3ces2基因敲除大鼠基因型鉴定
本发明将假孕母鼠繁育的后代称为f0代,单一位点发生非三整数倍基因编辑的f0代大鼠与野生型大鼠杂交产生的后代为f1代,同一基因型的f1代大鼠杂交得到的后代即为f2代。f1代为杂合自交,所以可能产生野生型、杂合型及纯合敲除型f2代大鼠,这些大鼠遗传背景差异较小,利于后续实验展开。
f0代大鼠基因型鉴定。在靶点上下游设计pcr所需引物,以f0代大鼠基因组为模板进行taq酶体系pcr反应,得到长度为300-400bp的pcr产物,对pcr产物进行琼脂糖凝胶电泳,选择产生显著基因编辑的大鼠(即琼脂糖凝胶电泳出现显著区别于野生型大鼠的条带)将其pcr产物进行测序。如图1所示为ces2a敲除大鼠及ces2c敲除大鼠f0代基因型鉴定结果。
pcr所使用引物对如下:
ces2a
上游:ctgctggctattggcttcc(seqidno.13)
下游:cctgctgctttccatccc(seqidno.14)
ces2c
上游:aactttcacccacgacat(seqidno.15)
下游:aaggttaccatcagtgcc(seqidno.16)
f1代大鼠基因型鉴定。f1代大鼠为f0代大鼠与野生型大鼠繁殖所得,其基因型可能为杂合子或野生型。本发明采用f0代大鼠基因型鉴定方法对f1代大鼠进行基因型鉴定。如图2所示为ces2a敲除大鼠f1代测序结果。
f2代大鼠基因型鉴定。f2代大鼠为经纯化的、同一基因型的f1代大鼠合笼繁育所得。本发明采用f0代大鼠基因型鉴定的pcr条件对f2代大鼠进行pcr,并通过琼脂糖凝胶电泳直接对其基因型进行区分,图3为ces2a基因敲除大鼠及ces2c基因敲除大鼠f2代基因型鉴定结果。
实施例4ces2基因敲除大鼠和野生型大鼠生理状况检测
对本发明实施例3中的ces2a/j、ces2c、ces2a/c/j基因敲除大鼠和野生型大鼠的生理状况进行了检测。对8周龄雄性野生型及本发明实施例3中的各ces2基因敲除大鼠禁食12h后,进行尾静脉取血,血样在4℃静置30min后,4℃,1500g离心15min所得上清即为血清,血清送艾迪康医学检测中心进行检测。检测项目包括总胆红素、直接胆红素、间接胆红素、总蛋白、白蛋白、球蛋白、白/球蛋白比例、天门冬氨酸氨基转移酶、丙氨酸氨基转移酶、碱性磷酸酶、甘油三酯、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇及总胆汁酸。检测结果显示,只有在ces2a/c/j基因敲除大鼠中直接胆红素和总胆汁酸水平降低,其他生理指标无显著变化,由此可得,ces2a/j、ces2c、ces2a/c/j基因敲除对大鼠的生理状况无重大影响。
实施例5敲除大鼠中ces2a转录水平表达检测
取本发明实施例3中的8周龄左右野生型和ces2a/j、ces2a/c/j纯合基因缺失大鼠各3只,co2窒息处死后,打开腹腔,取出肝脏最大叶和小肠,用pbs清洗表面血迹后保存于-80℃备用。分别称取各大鼠肝脏和小肠100mg加入1mltrizol进行mrna提取,取2000ngrna使用反转录试剂盒进行反转录得到cdna,以cdna为模板进行pcr反应。根据cdna序列利用ncbi数据库设计pcr所需引物,对pcr产物进行琼脂糖凝胶电泳确定野生型大鼠和敲除大鼠中ces2a转录水平表达差异。pcr引物信息如下:
上游:cctgcttattcttatccatgtg(seqidno.17)
下游:gcctacttcatccagcatat(seqidno.18)
结果如图4所示,琼脂糖凝胶电泳结果显示,以β-actin为内参,野生型大鼠肝脏和小肠中ces2a转录均正常,ces2a/j及ces2a/c/j基因敲除大鼠中均未检测到ces2amrna表达,说明ces2a/j及ces2a/c/j基因敲除大鼠中ces2a基因无法正常转录。
实施例6ces2a/j基因敲除大鼠和野生型大鼠肝脏微粒体的制备和活性检测
取本发明实施例3中的8周龄野生型和ces2a/j纯合基因敲除大鼠各3只,co2窒息处死后取整个肝脏称重后放入预冷的烧杯中,按照1:1(m/v)的比例加入预冷的0.05mtris/kcl。使用灭菌手术剪将其剪碎后,匀浆仪进行匀浆。将匀浆液以10500g,4℃条件离心30min后,转移上清液至超速离心管,继续以35000rpm,4℃离心1h,得到沉淀为肝脏微粒体,将沉淀小心刮出后使用tris/kcl重悬后,使用bca试剂盒测定蛋白浓度,分装,保存于-80℃。
对于ces2a/j基因敲除大鼠选择地尔硫卓作为底物进行体外酶动力学分析。体外实验证明大鼠中ces2a特异性介导地尔硫卓的去乙酰化代谢,产生去乙酰地尔硫卓,具有较强的特异性和选择性。本发明使用地尔硫卓作为探针底物进行敲除大鼠和野生型大鼠体外肝脏微粒体孵育,以检测两种基因型中ces2a的活性差异。孵育体系总体积为300μl,包括0.5mg/ml的肝脏微粒体,10μl的地尔硫卓储备液(0.2mm、0.5mm、1mm、2mm、5mm及10mm)及含0.33mmmgcl2的0.1m磷酸盐缓冲液。37℃预孵育5min后,加入底物地尔硫卓起始反应,继续孵育30min。加入等体积含100ng/μl的维拉帕米的预冷的乙腈终止反应,涡旋3min后,14000rpm,离心20min,取上清进行lc-ms/ms检测。所得数据经过计算分析,得到敲除大鼠和野生型大鼠肝脏微粒体中ces2a对地尔硫卓代谢的酶动力学曲线,经数据转化分析得到ces2a酶对地尔硫卓的最大反应速率(vmax),米氏常数(km)以及体外清除率(clint)。如图5所示,横轴为底物地尔硫卓浓度,纵轴为反应速率。结果显示在0.2-10mm的范围内,野生型大鼠和ces2a/j基因敲除大鼠肝脏微粒体对地尓硫卓的代谢速率随底物浓度增加而增加,但ces2a/j基因敲除大鼠对各个浓度地尔硫卓的代谢速率均小于野生型大鼠。通过对酶动力学参数分析,ces2a/j基因敲除大鼠中最大反应速率vmax和固有清除率clint显著低于野生型大鼠,证明地尔硫卓在ces2a/j基因敲除大鼠中的去乙酰化代谢减弱,代谢功能缺失。
实施例7ces2a/j基因敲除大鼠和野生型大鼠体内药物代谢动力学比较
以超纯水为溶剂配制3mg/ml盐酸地尔硫卓溶液。取本发明实施例3中的8周龄左右雄性ces2a/j纯合敲除大鼠和野生型大鼠,实验前禁食12h,正常饮水,实验开始前称量体重以确定给药体积,根据大鼠体重按照5ml/kg进行灌胃给药。分别在给药后0.083h、0.167h、0.5h、1h、2h、3h、4h、6h、8h、10h、12h、24h通过尾静脉取血的方式采集血样。将大鼠固定于尾静脉取血固定器,取300μl全血至含有10μl1mg/ml肝素钠的1.5mlep管中,轻弹混匀后迅速置于冰上。将采集的血样8000rpm,4℃,离心10min后取上清100μl加入300μl含100ng/μl维拉帕米的乙腈进行沉蛋白反应,14000rpm,4℃离心20min后取80μl上清进行lc-ms/ms检测。
通过数据处理与分析,本发明发现,灌胃给药地尔硫卓后,ces2a/j基因敲除大鼠对地尔硫卓的去乙酰化代谢显著低于野生型大鼠。图6为灌胃给药地尔硫卓后,野生型大鼠和ces2a/j基因敲除大鼠体内去乙酰地尔硫卓药时曲线,可以看出,ces2a/j基因敲除大鼠中地尔硫卓的生成量显著低于野生型大鼠,统计其药时曲线下面积,ces2a/j基因敲除大鼠显著低于野生型大鼠。
实施例8ces2a/c/j敲除大鼠和野生型大鼠肝脏微粒体的制备和活性检测
肝脏微粒体的制备方法具体同本发明实施例6,分别使用野生型和ces2a/c/j基因敲除大鼠的肝脏制备肝脏微粒体。
甲基泼尼松龙琥珀酸酯是ces2的底物。选择甲基泼尼松龙琥珀酸酯作为底物进行体外微粒体活性检测。孵育体系总体积为300μl,包括0.5mg/ml的肝微粒体,1μl的甲基泼尼松龙琥珀酸酯储备液(5mm)及含0.33mmmgcl2的0.1m磷酸盐缓冲液。37℃预孵育5min后,加入底物甲基泼尼松龙琥珀酸酯起始反应,继续孵育20min。加入等体积含100ng/μl的维拉帕米的预冷的乙腈终止反应,涡旋3min后,14000rpm,离心20min,取上清进行lc-ms/ms检测。结果如图7显示,与野生型大鼠相比,ces2a/c/j基因敲除大鼠对甲基泼尼松龙琥珀酸酯的代谢显著减弱,相对野生型大鼠降低约50%,证明ces2a/c/j基因敲除大鼠中ces2代谢能力减弱。
实施例9ces2a/c/j基因敲除大鼠和野生型大鼠肝脏h&e染色
取本发明实施例3中的8周龄野生型和ces2a/c/j纯合基因敲除大鼠各3只,禁食12h后,co2窒息处死并进行心脏取血,打开腹腔,小心取下1cm3大小肝脏在生理盐水中洗去表面血迹后,放入装有预冷的4%多聚甲醛的50ml离心管中进行组织固定。固定24h后的组织经脱水、透明、浸蜡、包埋和切片后进行苏木精和伊红染色,在显微镜下观察染色后的切片。
结果如图8所示,与野生型大鼠相比,ces2a/c/j基因敲除大鼠肝脏中脂质空泡显著增多(图中箭头所示),说明ces2a/c/j基因敲除大鼠肝脏脂质代谢异常。
本发明的保护内容不局限于以上实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求书为保护范围。
sequencelisting
<110>华东师范大学
<120>ces2基因敲除大鼠模型及其构建方法和应用
<160>18
<170>patentinversion3.3
<210>1
<211>18
<212>dna
<213>人工序列
<400>1
ttggctagacttcctggt18
<210>2
<211>18
<212>dna
<213>人工序列
<400>2
tctcctccagcatgtgca18
<210>3
<211>18
<212>dna
<213>人工序列
<400>3
cggaaacaaccacatagc18
<210>4
<211>18
<212>dna
<213>人工序列
<400>4
tattcttatccatgtgtg18
<210>5
<211>60
<212>dna
<213>人工序列
<400>5
gatcactaatacgactcactatagggcctttggctagacttccgttttagagctagaaat60
<210>6
<211>60
<212>dna
<213>人工序列
<400>6
gatcactaatacgactcactataggtctcctccagcatgtgcagttttagagctagaaat60
<210>7
<211>60
<212>dna
<213>人工序列
<400>7
gatcactaatacgactcactataggcggaaacaaccacatagcgttttagagctagaaat60
<210>8
<211>60
<212>dna
<213>人工序列
<400>8
gatcactaatacgactcactataggtattcttatccatgtgtggttttagagctagaaat60
<210>9
<211>125
<212>dna
<213>人工序列
<400>9
gatcactaatacgactcactataggttggctagacttcctggtgttttagagctagaaat60
agcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgct120
ttttt125
<210>10
<211>125
<212>dna
<213>人工序列
<400>10
gatcactaatacgactcactataggtctcctccagcatgtgcagttttagagctagaaat60
agcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgct120
ttttt125
<210>11
<211>125
<212>dna
<213>人工序列
<400>11
gatcactaatacgactcactataggcggaaacaaccacatagcgttttagagctagaaat60
agcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgct120
ttttt125
<210>12
<211>125
<212>dna
<213>人工序列
<400>12
gatcactaatacgactcactataggtattcttatccatgtgtggttttagagctagaaat60
agcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgct120
ttttt125
<210>13
<211>19
<212>dna
<213>人工序列
<400>13
ctgctggctattggcttcc19
<210>14
<211>18
<212>dna
<213>人工序列
<400>14
cctgctgctttccatccc18
<210>15
<211>18
<212>dna
<213>人工序列
<400>15
aactttcacccacgacat18
<210>16
<211>18
<212>dna
<213>人工序列
<400>16
aaggttaccatcagtgcc18
<210>17
<211>22
<212>dna
<213>人工序列
<400>17
cctgcttattcttatccatgtg22
<210>18
<211>20
<212>dna
<213>人工序列
<400>18
gcctacttcatccagcatat20
- 还没有人留言评论。精彩留言会获得点赞!