一种红光有机电致发光材料及其制备方法与流程
本发明属光电显示器件
技术领域:
,具体涉及一种红光有机电致发光材料及其制备方法。
背景技术:
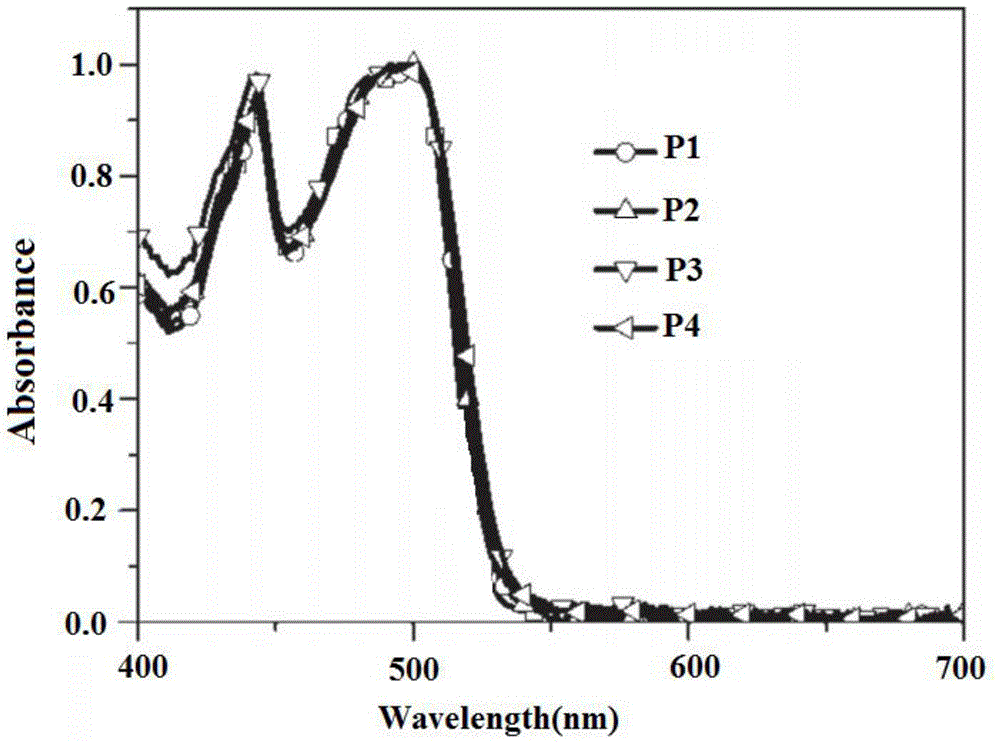
:随着时代和科技的发展,人们对美好生活质量的追求,各种电子产品的出现变得非常丰富方便。传统的显示技术——液晶显示器(lcd)似乎不能满足当前高新技术设备的要求,但有机发光二极管(oled)以其优势已进入电子产业市场,逐渐进入我们的生活。oled是在电场驱动下通过载流子注入和复合的显示器件,具有轻量、能耗低、自发发光、对比度好、可调整有机材料结构、驱动电压等优点。用于制作oled元件的发光层的有机材料源广泛,通过化学修饰容易使发光波长发生变化,但对于众多研究的蓝色高分子,一般红色分子容易消光,红色素元件的电流效率低。目前d-a型红色小分子在有机电致发光领域受到众多研究者的关注。由于d-a型分子结构在聚集状态下常常表现出强偶极子相互作用,d-a型红色材料在聚集状态或高浓度下会产生非常严重的浓度猝灭效应,因此红色材料一般具有较弱的场致发光性能。技术实现要素:本发明提供了一种红光有机电致发光材料及其制备方法,解决了现有的红光聚合物电致发光性能不佳的技术问题。本发明提供了一种红光有机电致发光材料,其结构如式(i)所示;其中,r为氢原子、碳原子数1-20的直链或者支链烷基,x的取值为0-1,聚合度n的取值为3-800。优选的,x的取值为0.1-0.7。本发明还提供了一种红光有机电致发光材料的制备方法,包括:2',7'-二溴-1,2,7,8-四辛基-9,9'-螺双[芴],2,2'-(1',2',7',8'-四辛基-9,9'-螺双[芴]-2,7-二基)双(4,4,5,5-四甲基-1,3,2-二氧杂硼烷)和3,10-二溴-14-(3-(5-苯基-1,3,4-恶二唑-2-基)苯基)-14h--双(s,s-二氧-二苯并噻吩)并吡咯通过suzuki偶联反应制得式(i)所示聚合物。优选的,所述suzuki偶联反应的温度为85℃。优选的,所述suzuki偶联反应的时间为36h。与现有技术相比,本发明具有如下优点和有益效果:本发明制备的聚合物的pl光谱在625nm左右有最大峰值,表明聚合物实现了红光发射,且光谱中没有发现明显的红移,表明聚合物的光谱稳定性较强。以本发明的聚合物制备得到的器件最大流明效率为1.96cd/a,最大亮度也达到了4264cd/m2,有效的增强了红光聚合物的电致发光效率。附图说明图1为本发明实施例15-18制备的聚合物在氯苯溶液中的紫外-可见吸收光谱;图2为本发明实施例15-18制备的聚合物在薄膜状态下的紫外-可见吸收光谱;图3为本发明实施例15-18制备的聚合物在氯苯溶液中的pl光谱;图4为本发明实施例15-18制备的聚合物在薄膜状态下的pl光谱;图5为本发明实施例15-18制备的聚合物的电压-电流密度-亮度曲线。具体实施方式下面结合具体实施例对本发明做进一步详细说明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本
技术领域:
常规试剂、方法和设备。实施例1将4,4’-二溴联苯(15.6g,50mmol)溶于150ml醋酸,冰浴下避光搅拌,取30ml发烟硝酸并用50ml醋酸稀释加入到恒压滴液漏斗中,避光条件下缓慢滴加到反应液中,滴加完毕后将反应温度缓慢升至85℃回流反应2h,观察反应液的变化,反应液由浑浊变透明时停止反应,自然冷却到室温。将反应液缓慢倒入冰水中淬灭,将混合液抽滤,滤渣分别用水、饱和亚硫酸氢钠水溶液、水、冰乙醇洗涤,之后将滤渣干燥得到4,4’-二溴-2-硝基联苯(12.7g,产率63%),其反应方程式如下所示:实施例2将4,4’-二溴-2-硝基联苯(14.28g,40mmol)和三苯基膦(26.2g,100mmol)溶于250ml的n,n-二甲基乙酰胺(dme),氩气气氛中加热搅拌过夜。停止反应并且冷却到室温,用二氯甲烷萃取并水洗3-5次,用柱层析法纯化处理,以200~300目硅胶为固定相,石油醚/二氯甲烷(2:1)为洗脱剂进行硅胶柱层析,粗产物用乙醇重结晶得到2,7-二溴咔唑(9.7g,产率74%),其反应方程式如下所示:实施例3将2,7-二溴咔唑(6.5g,20mmol)溶于50mln,n-二甲基甲酰胺(dmf)中,加入氢氧化钾(2.7g,48mmol),室温下搅拌30min,再加入2-(3-溴苯基)-5-苯基-1,3,4-恶二唑(12.94g,43mmol),滴加完毕后,85℃下继续搅拌10h。反应完毕将反应液倒入水中,有浅黄色固体析出。固体通过减压抽滤,并多次用蒸馏水淋洗,减压抽干后得2-(3-(2,7-二溴9h-咔唑-9-基)苯基)-5-苯基-1,3,4-恶二唑(9.8g,产率90%),该反应的化学方程式为:实施例4将2-(3-(2,7-二溴9h-咔唑-9-基)苯基)-5-苯基-1,3,4-恶二唑(10.9g,20mmol)溶于150ml绝干四氢呋喃,氩气气氛中室温搅拌溶解,之后将反应瓶放入-80℃低温反应器中,取正丁基锂(33ml,80mmol)缓慢滴加到反应瓶中,反应液低温下反应2h之后快速加入2-异丙基-4,4’,5,5’-四甲基-1,3,2-二氧杂硼烷(16.3ml,80mmol),之后室温下过夜反应。停止反应将反应液倒入水中淬灭,将反应液浓缩并用二氯甲烷萃取,用柱层析法纯化处理,以200~300目硅胶为固定相,洗脱剂为石油醚/二氯甲烷(2:1),得到2-(3-(2,7-双(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-9h-咔唑-9-基)苯基)-5-苯基-1,3,4-恶二唑(8.31g,产率65%),其化学反应方程式为:实施例5将2-(3-(2,7-双(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-9h-咔唑-9-基)苯基)-5-苯基-1,3,4-恶二唑(19.18g,30mmol),1-溴-2-甲亚磺酰苯(14.5g,66mmol),四丁基溴化铵(0.84g,2.6mmol)和浓度为2m的碳酸钾(34.5g,250mmol)水溶液加入到500ml的三口圆底烧瓶中,并加入250ml甲苯充分溶解,氩气气氛中加热回流搅拌,温度稳定在85℃时加入四(三苯基膦)钯(1.5g,1.3mmol),过夜反应。停止反应并且冷却到室温,用水洗反应液2~3次,将反应液浓缩过层析柱纯化,硅胶200~300目,洗脱剂为石油醚/乙酸乙酯(3:1),得到产物2-(3-(2,7-双(2-(甲基亚磺酰基)苯基)-9h-咔唑-9-基)苯基)-5-苯基-1,3,4-恶二唑(15.9g,产率80%)。其化学反应方程式为:实施例6将2-(3-(2,7-双(2-(甲基亚磺酰基)苯基)-9h-咔唑-9-基)苯基)-5-苯基-1,3,4-恶二唑(6.63g,10mmol)加入到50ml的单口圆底烧瓶中,加入五氧化二磷(151.7mg,1mmol)和9ml的三氟甲烷磺酸并在冰浴条件下反应10h。停止反应,将反应液滴加到冰水中搅拌,混合液抽滤得到黄色粉末状固体并晾干。将滤渣加入到250ml三口圆底烧瓶中并加入100ml吡啶,氩气气氛中加热回流反应6h。停止反应并且冷却到室温,将反应液倒入冰水中,缓慢加入盐酸中和过量吡啶,用二氯甲烷萃取,之后浓缩有机相过层析柱纯化,硅胶200~300目,洗脱剂为石油醚/二氯甲烷(6:1),过完柱用乙醇重结晶得到2-(3-(14h-二苯并噻吩-14-基)苯基)-5-苯基-1,3,4-恶二唑(3.47g,产率58%)。实施例7将2-(3-(14h-二苯并噻吩-14-基)苯基)-5-苯基-1,3,4-恶二唑(4.8g,8mmol)用二氯甲烷溶解在100ml的三口圆底烧瓶中,冰浴(0~5℃)条件下加入间氯过氧苯甲酸(7.2g,42mmol),避光条件下搅拌反应过夜。停止反应,将反应液倒入到冷的饱和氢氧化钠水溶液中搅拌,用二氯甲烷萃取并水洗3-4次,用柱层析法纯化,硅胶200~300目,洗脱剂为二氯甲烷/四氢呋喃(10:1),过完柱用乙醇重结晶,得到14-(3-(5-苯基-1,3,4-恶二唑-2-基)苯基-双(s,s-二氧-二苯并噻吩)并吡咯(4.4g,产率83%)其化学反应方程式为:实施例8将14-(3-(5-苯基-1,3,4-恶二唑-2-基)苯基-双(s,s-二氧-二苯并噻吩)并吡咯(0.66g,1mmol)溶解在10ml三氟乙酸和3ml三氯甲烷的混合溶液中,冰浴条件下搅拌直至反应物完全溶解,再将n-溴代丁二酰亚胺(0.89g,5mmol)用10ml三氟乙酸和3ml硫酸溶解,避光条件下缓慢滴加到反应液中,反应避光进行2h即可。将反应液倒入水中并用二氯甲烷萃取,用柱层析法进行纯化处理,以200-300目硅胶为固定相,石油醚/二氯甲烷(1:7)为洗脱剂,过完柱之后用乙醇重结晶得到3,10-二溴-14-(3-(5-苯基-1,3,4-恶二唑-2-基)苯基)-14h--双(s,s-二氧-二苯并噻吩)并吡咯(0.65g,产率81%)。实施例9将1,2-二氯苯(7.35g,50mmol)、四丁基溴化铵(1.58g,3mmol)溶于200ml二甲基亚砜,氮气气氛下室温搅拌均匀。用100ml烧杯配质量分数为50%的氢氧化钠水溶液12ml,待溶液冷却后缓慢滴加到反应液中。3h之后用注射器一次性加入溴辛烷(30.9g,154.2mmol),反应液在室温下过夜反应。停止反应之后,将反应液倒入水中淬灭,用乙酸乙酯萃取,无水硫酸镁干燥,浓缩之后用柱层析法纯化。以300-400目硅胶和洗脱剂石油醚进行硅胶柱层析,粗产物用丙酮重结晶,纯化后得到1,2-二辛基苯(13.2g,产率88%),反应方程式如下:实施例10将1,2-二辛基苯(36.24g,120mmol)、铁屑(0.34g,6mmol)溶于150ml氯仿中,冰浴下避光搅拌。取出液溴(15.5ml,301mmol),用100ml氯仿稀释并缓慢加入到避光的恒压滴液漏斗中,将恒压滴液漏斗中的液溴缓慢滴加到反应液中,加毕室温下搅拌反应12h,反应产生的尾气用饱和亚硫酸氢钠(nahso3)水溶液处理。停止反应,将反应液缓慢倒入冰的饱和nahso3水溶液中搅拌,之后进行抽滤。滤渣先后用饱和nahso3水溶液、蒸馏水和乙醇洗涤处理,滤渣晾干后用氯仿重结晶纯化处理,过滤得到1,2-二溴-4,5-二辛基苯(38.6g,产率70%),反应方程式如下:实施例11将1,2-二溴-4,5-二辛基苯(9.2g,20mmol)溶于200ml干燥四氢呋喃,氩气气氛中室温搅拌溶解,之后将反应瓶放入-78℃低温反应器中,取正丁基锂(33ml,80mmol)缓慢滴加到反应瓶中,反应液低温下反应24h。停止反应将反应液倒入水中淬灭,将反应液浓缩并用二氯甲烷萃取,以200~300目硅胶为固定相,石油醚/二氯甲烷(5:1)为洗脱剂进行硅胶柱层层析,得到2',6-二溴-2,3,4',5'-四辛基-1,1'-联苯(9.9g,产率65%),其化学反应方程式为:实施例12将干燥处理的2',6-二溴-2,3,4',5'-四辛基-1,1'-联苯(22.8g,30mmol)溶于150ml乙醚中,氮气气氛中将反应瓶放置于低温反应器中,反应温度降至-78℃,搅拌条件下将浓度为1.0mol/l的100ml氢氧化钠溶液缓慢滴加到反应液中,之后将反应温度缓慢升至室温反应8h。停止反应,将反应液倒入饱和氯化铵水溶液中淬灭,用二氯甲烷萃取,再用饱和食盐水洗涤3次,无水硫酸镁干燥。将反应液旋蒸干并冷却到室温,得到4,4',5,5'-四辛基-[1,1'-联苯]-2,2'-二醇(16.2g,产率85%),其反应方程式为:实施例13将溴酸钾(3.33g,20mmol)、溴化钠(3.6g,35mmol)、2,7-二溴9h-芴(5.2g,16mmol)和150ml去离子水加入到三口烧瓶中,放置在磁力搅拌器上搅拌,待反应物完全溶解再向反应瓶中加入4,4',5,5'-四辛基-[1,1'-联苯]-2,2'-二醇(9.5g,15mmol)和50ml二氯甲烷,待完全溶解后,保持温度维持在25℃,搅拌5min,之后缓慢滴加20ml浓度为20%的稀硫酸,完全加入后,反应约12h,停止反应,放置至室温。之后加入过量饱和亚硫酸钠溶液。用二氯甲烷萃取出有机相,以200-300目硅胶为固定相,以(石油醚:二氯甲烷=4:1)为洗脱剂进行硅胶柱层析得到2',7'-二溴-1,2,7,8-四辛基-9,9'-螺双[芴](9.7g,产率70%),其化学反应方程式为:实施例14150ml的三口瓶中加入醋酸钾(1.96g,20mmol)、[1,1'-双(二苯基膦)二茂铁]二氯化钯(0.43g,0.6mmol)、联硼酸频那醇酯(3.81g,15mmol)和2',7'-二溴-1,2,7,8-四辛基-9,9'-螺双[芴](9.23g,10mmol)。加入100ml1,4-二氧六环溶剂,用胶塞密封各口再用封口膜密封接口处。连接好装置,抽真空-充氩气-抽真空,重复三次,使反应瓶中的空气被排空,插入一个氩气球保护反应装置,调节油浴锅温度为80℃,通入冷凝水,反应12h,停止反应。另取一个干净的烧杯,加入适量的去离子水,将反应液倒入去离子水中,充分搅拌2h,将水洗液转入500ml的分液漏斗中,用二氯甲烷多次萃取,合并有机相并加入适量的无水硫酸镁搅拌干燥1h,抽滤,加入适量的硅胶旋蒸,之后放入真空干燥箱干燥2小时,以200-300目硅胶为固定相,(石油醚:二氯甲烷=4:3)为洗脱剂通过硅胶柱层析法纯化得到2,2'-(1',2',7',8'-四辛基-9,9'-螺双[芴]-2,7-二基)双(4,4,5,5-四甲基-1,3,2-二氧杂硼烷)(6.4g,产率为63%),其化学反应方程式为:实施例15将2',7'-二溴-1,2,7,8-四辛基-9,9'-螺双[芴](0.83g,0.9mmol),2,2'-(1',2',7',8'-四辛基-9,9'-螺双[芴]-2,7-二基)双(4,4,5,5-四甲基-1,3,2-二氧杂硼烷)(1.01g,1mmol)和3,10-二溴-14-(3-(5-苯基-1,3,4-恶二唑-2-基)苯基)-14h--双(s,s-二氧-二苯并噻吩)并吡咯(0.82g,0.1mmol)加入到10ml精制甲苯和5ml四氢呋喃的混合溶液中,氩气气氛中加热搅拌,10min后加入8mg四(三苯基膦)钯,温度稳定在85℃时加入1.5ml浓度为20%的四乙基羟氨水溶液,30min后停止通气,氩气气氛中反应36h。之后加入苯硼酸(50mg,0.4mmol)封端并反应8h,接着加入溴苯(312mg,2mmol)封端并继续反应8h。将反应停止并冷却到室温,沉析到200ml甲醇中,过滤干燥后索氏提取(先后用甲醇,丙酮和正己烷各抽提12h)。之后将聚合物干燥,用甲苯溶解,以300-400目硅胶为固定相,(石油醚:二氯甲烷=6:1)为洗脱剂进行柱层析,将溶液浓缩后再次沉析到甲醇中,固体过滤后放入真空干燥箱干燥,得到聚合物p1(4.2g,产率72%),其反应方程式为:实施例16本实施例与实施例15的区别为2',7'-二溴-1,2,7,8-四辛基-9,9'-螺双[芴]的含量为(0.64g,0.7mmol);3,10-二溴-14-(3-(5-苯基-1,3,4-恶二唑-2-基)苯基)-14h--双(s,s-二氧-二苯并噻吩)并吡咯的含量为(2.46g,0.3mmol),最终制得聚合物p2(5.8g,产率70%),其化学式为:实施例17本实施例与实施例15的区别为2',7'-二溴-1,2,7,8-四辛基-9,9'-螺双[芴]的含量为(0.45g,0.5mmol);3,10-二溴-14-(3-(5-苯基-1,3,4-恶二唑-2-基)苯基)-14h--双(s,s-二氧-二苯并噻吩)并吡咯的含量为(4.1g,0.5mmol),最终制得聚合物p3(5.7g,产率72%),其化学式为:实施例18本实施例与实施例15的区别为2',7'-二溴-1,2,7,8-四辛基-9,9'-螺双[芴]的含量为(0.27g,0.3mmol);3,10-二溴-14-(3-(5-苯基-1,3,4-恶二唑-2-基)苯基)-14h--双(s,s-二氧-二苯并噻吩)并吡咯的含量为(5.7g,0.7mmol),最终制得聚合物p4(6.2g,产率70%),其化学式为:综上,图1和图2分别为聚合物p1-p4在电流密度为5ma/cm2的条件下测得的的氯苯溶液(10-6mg/ml)和薄膜状态下的紫外-可见吸收光谱。上述聚合物都表现出两个吸收带,它们在约460和510nm处达到峰值。其中,460nm处的吸收带归因于双噻吩并吡咯骨架,而510nm处的带归因于噁二唑侧链单元。图3和图4为分别为聚合物p1-p4在电流密度为5ma/cm2的条件下测得的的氯苯溶液(10-6mg/ml)和薄膜状态下的pl光谱,其中,由于当双噻吩并吡咯的含量较小时,聚合物内部的d-a效应不强,导致光谱易收到极性溶剂的影响,出现双峰。而随着双噻吩并吡咯含量的增加,聚合物内部的d-a效应增强,分子内部电荷转移完全,使得发射峰呈现单一形态,且光谱均没有较明显红移,表明本发明制得的红光聚合物具有较好的光谱稳定性,且本发明通过在主链结构连接多个苯环,有效的增加了聚合物内部的共轭长度,从而使该聚合物在625nm处发射红光。图5为聚合物p1-p4的电压-电流密度-亮度曲线,其中,器件结构为ito/pedot:pss(40nm)/polymer(80nm)/csf(1.5nm)/al(120nm),由图5可知,聚合物的启亮电压较低,约为3.2-4.2v,这是由于咔唑和噁二唑单元分别促进了空穴注入和电子注入所致,且随着双噻吩并吡咯的增加,器件的启亮电压逐渐减小,且在同等电压下亮度有递进趋势,表明本发明制得的聚合物器件效率有所提高,具体数据见表1。表1聚合物p1-p4器件电致发光性能聚合物von(v)lemax(cd/a)lmax(cd/m2)cie(x,y)p14.20.831487(0.63,0.38)p23.71.22980(0.63,0.37)p33.51.352387(0.63,0.37)p43.51.964264(0.63,0.37)由表1可知,本发明制备的红光材料获得了最好的器件效果,最大流明效率为1.96cd/a,最大亮度也达到了4264cd/m2。从色坐标上看,当双噻吩并吡咯含量较高时,电荷从富电子的咔唑单元转移到主链中的缺电子的so单元和噁二唑中,增强了聚合物分子内部的电荷转移,使聚合物p1-p4表现出红色荧光。上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1