一种用于检测慢病毒载体拷贝数的方法及其应用与流程
1.本发明涉及生物技术领域,具体而言,涉及一种用于检测慢病毒载体拷贝数的方法及其应用。
背景技术:
2.随着生物技术的发展,基因治疗已成为治疗感染性疾病、遗传疾病、神经系统疾病以及肿瘤的焦点。用于基因治疗的载体系统可分为病毒性载体和非病毒性载体。目前,常用的病毒载体包括腺病毒、腺相关病毒、逆转录病毒和慢病毒载体四大系统,其中腺病毒与腺相关病毒不能将外源基因整合到基因组中,且外源基因表达时间比较短;而逆转录病毒和慢病毒能够随机将外源基因整合到细胞的基因组中,实现外源基因的长久持续性表达。
3.与逆转录病毒比较而言,慢病毒载体因为载体容量高、病毒滴度高、不受细胞分裂时期限制且无被基因沉默的风险,在临床上常常作为疾病的治疗工具。
4.慢病毒包装系统是以慢病毒基因组为基础,人为去除病毒复制所需要的基因,同时,插入用于基因表达、敲除或沉默的元件构建而成。目前,常用的为二代和三代慢病毒包装系统,主要由包装质粒、包膜质粒和穿梭质粒构成,将这些质粒共转染到293t细胞中,最后能够获得具有复制缺陷的慢病毒,以用于转染其他细胞。
5.car-t疗法为嵌合抗原受体t细胞免疫疗法,英文全称chimeric antigen receptor t-cell immunotherapy,其是通过将分离病人的t淋巴细胞在体外进行基因改造,将肿瘤相关抗原(taa)的结合区与t细胞胞内信号激活区4-1bb或cd28及其cd3-ζ链形成的嵌合基因表达在t细胞的表面,使病人的t细胞获得识别癌细胞抗原的能力,经过体外扩大培养之后,回输到病人体内从而达到清除癌细胞的一种免疫疗法。
6.近几年通过优化改良在临床肿瘤治疗上取得了很好的效果。而cart的制备与质控是影响cart治疗临床疗效和安全性的关键因素,2018年6月5日中国食品药品鉴定所研究院颁发《car-t细胞治疗产品质量控制检测研究及非临床研究考虑要点》第六章第3节明确将car-t细胞基因组中慢病毒载体拷贝数及整合的检测作为质控的标准。
7.目前,慢病毒载体拷贝数检测设计的引物和探针主要是针对car结构的scfv区、cd28-cd3区和cd137-cd3区,然而针对scfv区的引物和探针会因不同car产品类型而缺乏通用性;针对cd28-cd3区和cd137-cd3区的引物和探针会因为car产品的代次更新缺乏通用性;同时,针对cd28-cd3区和cd137-cd3区的引物和探针含有较多人源性基因的序列,扩增片段的特异性也会受到很大影响。
8.有鉴于此,特提出本发明。
技术实现要素:
9.本发明的目的在于提供一种用于检测慢病毒载体拷贝数的方法及其应用。
10.为了实现本发明的上述目的,特采用以下技术方案:
11.第一方面,实施例提供了一种用于检测慢病毒载体拷贝数的方法,其包括:检测来
自慢病毒载体上的基因元件;所述基因元件选自wpre、hiv-1ψ和rre中的至少一种。
12.第二方面,实施例还提供了一种用于检测慢病毒载体拷贝数的试剂,其包括用于检测来自慢病毒载体上的基因元件的试剂;所述基因元件选自wpre、hiv-1ψ和rre中的至少一种。
13.第三方面,实施例还提供了一种用于检测慢病毒载体拷贝数的试剂盒,其包括如前述实施例所述的用于检测慢病毒载体拷贝数的试剂。
14.第四方面,实施例还提供了前述实施例所述的用于检测慢病毒载体拷贝数的试剂在检测慢病毒载体拷贝数中的应用。
15.第五方面,实施例还提供了前述实施例所述用于检测慢病毒载体拷贝数的试剂在检测待测样本中car拷贝数中的应用。
16.与现有技术相比,本发明的有益效果为:
17.本发明实施例提供了一种用于检测慢病毒载体拷贝数的方法,其包括:检测来自慢病毒载体上的基因元件;所述基因元件选自wpre、hiv-1ψ和rre中的至少一种。经研究发现,通过对慢病毒载体上的上述元件进行检测,能够稳定且有效地检测出整合入car-t细胞基因组中整合的病毒载体拷贝数,且不受cart靶点和技术更新换代的限制,具有检测通用性。
附图说明
18.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
19.图1为验证例1中引物对wpre-1的扩增曲线;
20.图2为验证例1中引物对wpre-2的扩增曲线;
21.图3为验证例1中引物对hiv-1ψ-1的扩增曲线;
22.图4为验证例1中引物对rre-1的扩增曲线;
23.图5为验证例1中引物对rre-2的扩增曲线;
24.图6为验证例1中引物对wpre-3的扩增曲线;
25.图7为验证例1中引物对wpre-4的扩增曲线;
26.图8为验证例2中引物对和探针wpre-1的扩增曲线;
27.图9为验证例2中引物对和探针wpre-2的扩增曲线;
28.图10为验证例2中引物对和探针hiv-1ψ-1的扩增曲线;
29.图11为验证例2中引物对和探针rre-1的扩增曲线;
30.图12为验证例2中引物对和探针rre-2的扩增曲线;
31.图13为验证例2中引物对和探针wpre-3的扩增曲线;
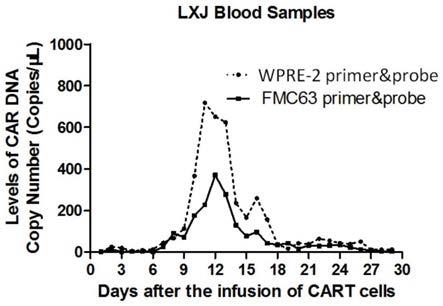
32.图14为验证例3中血液样本中基因组car拷贝数的检测结果;
33.图15为验证例3中骨髓样本中基因组car拷贝数的检测结果;
34.图16为验证例4中小鼠血液基因组中car的拷贝数的检测结果。
具体实施方式
35.下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
36.目前,慢病毒载体拷贝数的检测主要是通过针对car结构的scfv区、cd28-cd3区和/或cd137-cd3区的设计检测的引物和探针,而该设计思路获得的引物和探针不具备检测通用性,采用不同技术时,无法采用同样的产品进行car-t的制备和质控。然而,以慢病毒载体基因组上的元件为模板设计引物并非易事,因为有的区段存在大量重复的序列,加大了引物设计的难度。
37.发明人经大量研究后,一种用于检测慢病毒载体拷贝数的方法,其包括:检测来自慢病毒载体上的基因元件;所述基因元件选自wpre、hiv-1ψ和rre中的至少一种。
38.经发明人研究发现,通过对慢病毒载体上的上述基因元件中的任意一种进行检测,均能够稳定且有效地检测出car-t细胞基因组中整合的病毒载体拷贝数,能够检测不受car-t细胞更新换代的限制,具有检测通用性。
39.在一些实施方式中,所述检测慢病毒载体拷贝数的方法为用于检测car-t细胞基因组中整合的慢病毒载体拷贝数的方法。
40.在一些实施方式中,所述基因元件的检测方式为:将能够扩增所述基因元件的引物组与提取自目标car-t细胞的待测核酸样本混合以进行pcr扩增。
41.在一些实施方式中,所述待测核酸样本为dna样本。
42.在一些实施方式中,当所述基因元件为wpre元件时,所述引物组包括序列如seq id no.1~2所示的引物对和/或序列如seq id no.3所示的探针,或者所述引物组包括序列如seq id no.4~5所示的引物对和/或序列如seq id no.6所示的探针;
43.当所述基因元件为hiv-1ψ元件时,所述引物组包括序列如seq id no.7~8所示的引物对和/或seq id no.9所示的探针;
44.当所述基因元件为rre元件时,所述引物组包括序列如seq id no.10~11所示的引物对和/或序列如seq id no.12所示的探针,或者所述引物组包括序列如seq id no.13~14所示的引物对和/或序列如seq id no.15所示的探针。
45.在一些实施方式中,所述引物组中的探针5’端标记有荧光基团,3’端标记有淬灭基团。
46.优选地,所述荧光基团选自:vic、fam、tet、hex、cy3、cy5、texas red、lc red640和lc red705中的任意一种;
47.优选地,所述淬灭基团选自:bhq1、bhq2和bhq3中的任意一种。
48.在一些实施方式中,pcr扩增的反应体系:10
×
taq(无mg
2+
)2.4~2.6μl,24~26mm dntp 0.1~0.3μl,9~11μm上游引物0.4~0.6μl,9~11μm下游引物0.4~0.6μl,19~21μm探针0.1~0.3μl,4~6u/μl taq7 dna聚合酶0.15~0.35μl,90~110mm mg
2+
4~6μl,待扩增dna模板18~22ng,补足ddh2o至25μl;
49.pcr扩增的反应条件:95℃,10min;(94℃,15s;55℃,40s;)
×
45,探针。
50.本发明实施例还提供了一种用于检测慢病毒载体拷贝数的试剂,其包括用于检测
来自慢病毒载体上的基因元件的试剂;所述基因元件选自wpre、hiv-1ψ和rre中的至少一种。
51.在一些实施方式中,当所述基因元件为wpre元件时,所述试剂包括序列如seq id no.1~2所示的引物对和/或序列如seq id no.3所示的探针,或者所述试剂包括序列如seq id no.4~5所示的引物对和/或序列如seq id no.6所示的探针;
52.当所述基因元件为hiv-1ψ元件时,所述试剂包括序列如seq id no.7~8所示的引物对和/或seq id no.9所示的探针;
53.当所述基因元件为rre元件时,所述试剂包括序列如seq id no.10~11所示的引物对和/或序列如seq id no.12所示的探针,或者所述试剂包括序列如seq id no.13~14所示的引物对和/或序列如seq id no.15所示的探针。
54.本发明实施例还提供了一种用于检测慢病毒载体拷贝数的试剂盒,其包括前述任一实施方式所述的用于检测慢病毒载体拷贝数的试剂。
55.优选地,所述试剂盒还包括pcr反应液和标准品。
56.此外,本发明实施例还提供了如前述任一实施方式所述用于检测慢病毒载体拷贝数的试剂在检测慢病毒载体拷贝数中的应用。
57.优选地,所述慢病毒载体拷贝数为整合入car-t细胞基因组中的慢病毒载体拷贝数。
58.此外,本发明实施例还提供如前述任一实施方式所述用于检测慢病毒载体拷贝数的试剂在检测待测样本中car拷贝数中的应用。待测样本为dna样本,可来源于动物或人体,待测样本可以为血液样本或骨髓样本。
59.实施例1
60.一种用于检测慢病毒载体拷贝数的试剂盒,其包括用于检测慢病毒载体穿梭质粒上的wpre元件的引物对和探针wpre-1,序列信息如表1所示。
61.表1序列信息
[0062][0063]
实施例2
[0064]
一种用于检测慢病毒载体拷贝数的试剂盒,其包括用于检测慢病毒载体穿梭质粒上的wpre元件的引物对和探针wpre-2,序列信息如表2所示。
[0065]
表2序列信息
[0066][0067]
实施例3
[0068]
一种用于检测慢病毒载体拷贝数的试剂盒,其包括:用于检测慢病毒载体穿梭质粒上的hiv-1ψ元件的引物对和探针hiv-1ψ-1,序列信息如表3所示。
[0069]
表3序列信息
[0070][0071]
实施例4
[0072]
一种用于检测慢病毒载体拷贝数的试剂盒,其包括:用于检测慢病毒载体穿梭质粒上的rre元件的引物对和探针rre-1,序列信息如表4所示。
[0073]
表4序列信息
[0074][0075]
实施例5
[0076]
一种用于检测慢病毒载体拷贝数的试剂盒,其包括:用于检测慢病毒载体穿梭质粒上的rre元件的引物对和探针rre-2,序列信息如表5所示。
[0077]
表5序列信息
[0078][0079]
需要说明的是,表1~5中,探针的5’端均连接有fam荧光基团,3’端均连接有bhq1淬灭基团。需要说明的是,在其他实施例中,也可以根据需要选择其他荧光基团和淬灭基团。
[0080]
实施例6
[0081]
一种用于检测慢病毒载体拷贝数的方法,采用检测试剂对待测样本进行荧光定量pcr,具体包括以下步骤。
[0082]
pcr扩增的反应体系:10
×
taq(无mg
2+
)2.5μl,25mm dntp 0.2μl,10μm上游引物0.5μl,10μm下游引物0.5μl,12.5
×
sybgreen 0.0625μl,5u/μl taq7 dna聚合酶0.25μl,100mm mg
2+
5μl,各梯度标准品5μl,补充ddh2o至25μl。
[0083]
将配置好的反应液加入各反应管中,进行pcr扩增。
[0084]
pcr反应条件:95℃,10min;(94℃,15s;55℃,40s;)
×
45。
[0085]
验证例1
[0086]
验证实施例1~5中引物对的检测灵敏度。
[0087]
利用慢病毒载体,建立标准品(107~101copies/μl),以标准品为模板,加入sybrgreen染料,采用引物对wpre-1、wpre-2、hiv-1ψ-1、rre-1和rre-2,根据实施例6提供的realtime pcr法对标准品进行检测,同时设置2组对比例,对比例1和2的引物信息如表6所示。
[0088]
表6引物信息
[0089][0090][0091]
表6中,探针的5’端连接有fam荧光基团,3’端连接有bhq1淬灭基团。
[0092]
引物对wpre-1、wpre-2、hiv-1ψ-1、rre-1、rre-2、wpre-3和wpre-4的扩增曲线依次如附图1~7所示。由结果可知,引物对wpre-1、wpre-2、hiv-1ψ-1、rre-1和rre-2的扩增梯度均较好,灵敏度均<10e1;引物对wpre-3的扩增梯度好,灵敏度为10e1;引物对wpre-4的扩增梯度差,灵敏度均<10e1。
[0093]
验证例2
[0094]
验证实施例1~5探针的检测性能。
[0095]
利用慢病毒载体,建立标准品(107~101copies/μl),采用引物对和探针wpre-1、wpre-2、hiv-1ψ-1、rre-1和rre-2,根据实施例6提供的荧光定量pcr方法对标准品进行检测,将引物对和探针wpre-3作为对照同时进行检测,获取扩增曲线。wpre-1、wpre-2、hiv-1ψ-1、rre-1、rre-2和wpre-3的扩增曲线依次如附图8~13所示。
[0096]
由结果可知,引物对和探针wpre-1、wpre-2、hiv-1ψ-1、rre-1和rre-2对应的扩增曲线δrn值均较好,引物对和探针wpre-3对应的扩增曲线δrn值较差。
[0097]
验证例3
[0098]
验证引物对和探针wpre-2的检测灵敏度。
[0099]
采用引物对和探针wpre-2,根据实施例6所述的检测方法,检测临床回输cart19后病人dna样本基因组中car拷贝数(等同于car-t细胞基因组中整合的病毒载体拷贝数),同时,使用car19特异性检测引物与探针fmc63作为对照组(fmc63-f:ccatcaaggttcagtggcagtg,fmc63-r:taccctgttggcaaaagtaagtg;fmc63-探针:tcttgctccaggttgctaatggtgag)对样本进行检测。dna样本包括血液样本和骨髓样本,血液样本的检测结果如图14,骨髓样本的检测结果如图15所示。
[0100]
由图14和15可知,相对于car19特异性检测引物与探针fmc63而言,引物对和探针wpre-2更能有效地检测出病人血液样本和骨髓样本中的car拷贝数,灵敏度高于fmc63。
[0101]
验证例4
[0102]
以rpmi8226多发性骨髓瘤动物进行实验,将bcma-cart给药后d86天小鼠尾血样本dna作为模板,使用引物对和探针wpre-2进行realtime pcr,同时以d71体外流式检测结果为参照,检测小鼠血液基因组中car的拷贝数。检测结果如表7和图16所示。
[0103]
表7检测结果
[0104]
[0105][0106]
由表7和图16可知,小鼠血液中的bcma-car拷贝数与血液中的cart所占比例基本上相对应,d71流式检测cart比例高的小鼠(719#与545#),其d86对应的car拷贝数也高;d71流式检测不到cart的小鼠(706#与995#),其d86对应的car拷贝数也基本上接近于0。
[0107]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1