同种异体T细胞及其制备和应用的制作方法
同种异体t细胞及其制备和应用
技术领域
1.本发明属于细胞免疫治疗领域,具体涉及工程改造的同种异体t细胞、其制备及应用。
背景技术:
2.随着肿瘤治疗的发展,嵌合抗原受体t细胞(chimeric antigen receptor-t,car-t)免疫疗法逐渐成为备受关注的治疗手段。car-t细胞所表达的嵌合抗原受体(car)一般包含胞外抗原结合域、跨膜域和胞内信号传导域。通常car-t细胞是由患者自体t细胞经car基因转导并扩增而来,最后再回输到该患者体内。car-t细胞可以有效的识别肿瘤抗原,引起特异性的抗肿瘤免疫应答,而不受主要组织相容性复合体(major histocompatibility complex,mhc)的限制。目前,美国fda已经批准了两款自体car-t细胞产品上市,分别是诺华的kymriah和凯特的yescar-ta,用于难治性复发性非霍奇金淋巴瘤和急性淋巴细胞白血病的治疗。相关临床试验证明,car-t作为完全个性化的活细胞药物极具抗肿瘤潜力(maude et al.2018;park et al.2018;schuster et al.2017)。
3.上述两款car-t药物的制备及回输策略均是采集患者自体的外周血,分离得到t细胞,通过病毒载体将car的编码基因整合到t细胞的基因组上,然后进行扩大培养,最后回输到患者体内。这种完全个体化的car-t细胞生产不仅生产周期长,成本高,而且也给回输治疗带来许多不确定因素。例如,分离得到的t细胞数量不足或功能失常导致的car-t细胞制备失败、细胞制备中患者疾病快速进展而失去治疗窗口等。因此,car-t领域的一个共同期待是健康供者来源的即用型(off-the-shelf)同种异体(即通用型)car-t细胞,以有效避免或解决上述生产和治疗相关问题,并极大地降低生产成本。
4.为了有效制备同种异体car-t,需要解决2个问题:
①
因为异体t细胞表面的tcr(t cell receptor,tcr)会识别患者的异体抗原,从而导致同种异体t细胞输入带来的移植物抗宿主反应(graft-versus-host disease,gvhd);
②
宿主的免疫系统会识别异体细胞表面的hla(human leukocyte antigen),从而导致输入的异体t细胞被快速清除,影响通用型car-t疗效。
5.目前制备通用型car-t的方式是通过基因编辑的方式敲除同种异体car-t细胞表面的tcr以及hla-i类分子的表达,以减少gvhd和宿主排斥。已报道多种基因敲除编辑技术(zinc-finger nucleases,zfn;transcription activator-like effector nucleases,talens;clustered regularly interspaced short palindromic repeats,crispr)在通用型car-t方面的应用(provasi et al.2012;berdien et al.2014;ren et al.2017)。然而至今,仍只有非常有限数目的同种异体car-t的临床案例报道(qasim et al.2017)。基于基因编辑的同种异体car-t临床研究进展缓慢的主要原因可能来源于基因编辑存在的安全隐患(例如脱靶导致错误的基因编辑),基因编辑可能降低t细胞的体内持久性降低,以及生产制备中遇到的障碍(如工艺步骤繁多,对t细胞的损伤较大等)。而且,虽然通过基因编辑方式敲除异体t细胞表面的hla-i能解决患者一部分的排斥反应,但完全敲除hla-i的异体
l2-a-l1-b,c-l2-b-l1-a,或b-l1-c-l2-a。
16.在一个或多个实施方案中,第一多肽编码序列a包含内质网滞留肽的编码序列并且第二多肽编码序列b不包含内质网滞留肽的编码序列,并且各序列在所述核酸分子中的5’至3’顺序为:a-l1-b-l2-c,a-l1-c-l2-b,b-l2-a-l1-c,b-l2-c-l1-a,b-l1-c-l2-a,b-l2-c-l2-a,c-l2-a-l1-b,c-l2-b-l1-a,c-l1-b-l2-a,或c-l2-b-l2-a,或
17.在一个或多个实施方案中,第一多肽编码序列a不包含内质网滞留肽的编码序列并且第二多肽编码序列b包含内质网滞留肽的编码序列,并且各序列在所述核酸分子中的5’至3’顺序为:b-l1-a-l2-c,b-l1-c-l2-a,a-l2-b-l1-c,a-l2-c-l1-b,a-l1-c-l2-b,a-l2-c-l2-b,c-l2-b-l1-a,c-l2-a-l1-b,c-l1-a-l2-b,或c-l2-a-l2-b。
18.在一个或多个实施方案中,l2与其5’和/或3’的多肽编码序列处于同一表达框内。
19.在一个或多个实施方案中,l1与其5’和/或3’的多肽编码序列不处于同一表达框内。
20.本发明第一方面还提供一种核酸分子,选自(1)包含第一多肽编码序列a、第二多肽编码序列b、第三多肽编码序列c、第一接头l1和第二接头l2的多核苷酸序列,所述三种多肽的编码序列通过所述两种接头连接形成具有如下5’至3’顺序的结构:多肽编码序列-接头-多肽编码序列-接头-多肽编码序列,和(2)(1)的互补序列或片段。
21.在一个或多个实施方案中,第一多肽、第二多肽和第三多肽分别选自下调细胞表面tcr/cd3复合物的多肽、下调细胞表面hla-i类分子表达的功能蛋白和治疗用多肽。
22.在一个或多个实施方案中,第一多肽是下调细胞表面tcr/cd3复合物的多肽。
23.在一个或多个实施方案中,第二多肽是下调细胞表面hla-i类分子表达的功能蛋白。
24.在一个或多个实施方案中,第三多肽是治疗用多肽;优选地,治疗用多肽是嵌合抗原受体。
25.在一个或多个实施方案中,第一接头是ires或2a肽编码序列。
26.在一个或多个实施方案中,第二接头是ires或2a肽编码序列。
27.在一个或多个实施方案中,第一接头l1与其5’和/或3’的多肽编码序列不处于同一表达框内。在一个或多个实施方案中,第二接头l2与其5’和/或3’的多肽编码序列处于同一表达框内。在一个或多个实施方案中,第一接头l1和第二接头l2至少一个是2a肽编码序列。在一个或多个实施方案中,第一接头l1是ires并且第二接头l2是2a肽编码序列。
28.在一个或多个实施方案中,2a肽是f2a、p2a、t2a或e2a肽。
29.在一个或多个实施方案中,ires选自:脑心肌炎病毒ires、小核糖核酸病毒ires、口蹄病病毒ires、甲肝病毒ires、丙肝病毒ires、人类鼻病毒ires、脊髓灰质炎病毒ires、猪水疱病病毒ires、芜菁花叶马铃薯y病毒属病毒ires、人类成纤维细胞生长因子2mrna ires、瘟病毒属ires、利什曼原虫rna病毒ires、莫洛尼氏鼠白血病病毒ires、人类鼻病毒14ires、口蹄疫病毒ires、人类免疫球蛋白重链结合蛋白mrna ires、果蝇触角足基因mrna ires、人类成纤维细胞生长因子2mrna ires、庚型肝炎病毒ires、烟草花叶病毒属ires、血管内皮生长因子mrna ires、柯萨奇b组病毒ires、c-myc原癌基因mrna ires、人类myt2 mrna ires、人类双埃可病毒属1型病毒ires、人类双埃可病毒属2型病毒ires、真核启动因子4gi mrna ires、plautia stali肠道病毒ires、泰勒氏鼠脑脊髓炎病毒ires、牛肠道病毒
ires、连接蛋白43mrna ires、同源域蛋白gtx mrna ires、aml1转录因子mrna ires、nf-κb阻抑因子mrna ires、x-连锁凋亡抑制剂mrna ires、蟋蟀麻痹病毒rna ires、p58(pitslre)蛋白激酶mrna ires、鸟氨酸脱羧酶mrna ires、连接蛋白-32mrna ires、牛病毒性腹泻病毒ires、胰岛素样生长因子i受体mrna ires、人类免疫缺陷病毒1型gag基因ires、猪瘟病毒ires、卡波西肉瘤相关疱疹病毒ires、选自随机寡核苷酸文库的短ires、jembrana病病毒ires、凋亡蛋白酶激活因子1mrna ires、禾谷缢管蚜病毒ires、阳离子型氨基酸转运子mrna ires、人类胰岛素样生长因子ii引导蛋白2mrna ires、贾第鞭毛虫病毒属ires、smad5 mrna ires、猪捷申病毒-1talfan ires、果蝇无毛基因mrna ires、hsnm1 mrna ires、cbfa1/runx2 mrna ires、epstein-barr病毒ires、木槿褪绿环斑病毒ires、大鼠垂体加压素v1b受体mrna ires和人类hsp70 mrna ires。在一个或多个实施方案中,ires的核酸序列如seq id no:90所示。
30.在一个或多个实施方案中,f2a、p2a、t2a肽和e2a肽的氨基酸序列分别如seq id no:91、92、93和94所示。
31.在一个或多个实施方案中,第一多肽、第二多肽和第三多肽编码序列中至少一个包含内质网滞留肽的编码序列。
32.在一个或多个实施方案中,第一多肽和第二多肽编码序列中的一个或两个包含内质网滞留肽的编码序列。
33.在一个或多个实施方案中,第一多肽编码序列和第二多肽编码序列分别包含内质网滞留肽的编码序列。
34.在一个或多个实施方案中,包含内质网滞留肽编码序列的多肽编码序列的3’端的接头不是2a肽编码序列或包含内质网滞留肽编码序列的多肽编码序列位于核酸分子的3’末端。优选地,所述内质网滞留肽的氨基酸序列包括seq id no:35-40中任一或由其组成,其中x是任意氨基酸。优选地,所述内质网滞留肽的编码序列的多肽编码序列的3’端的接头是ires。
35.在一个或多个实施方案中,第一多肽、第二多肽和第三多肽编码序列还包含任选的信号肽。
36.在一个或多个实施方案中,第一多肽编码序列a和第二多肽编码序列b分别包含内质网滞留肽编码序列,核酸分子中各部分从5’至3’的顺序为:a-l1-c-l2-b,c-l2-a-l1-b,c-l2-b-l1-a,或b-l1-c-l2-a,其中,第一接头l1是ires,第二接头l2是2a肽编码序列。
37.在一个或多个实施方案中,第一多肽编码序列a包含内质网滞留肽的编码序列并且第二多肽编码序列b不包含内质网滞留肽的编码序列,核酸分子中各部分从5’至3’的顺序为:a-l1-b-l2-c,a-l1-c-l2-b,b-l2-a-l1-c,b-l2-c-l1-a,b-l1-c-l2-a,b-l2-c-l2-a,c-l2-a-l1-b,c-l2-b-l1-a,c-l1-b-l2-a,或c-l2-b-l2-a,其中,第一接头l1是ires,第二接头l2是2a肽编码序列。
38.在一个或多个实施方案中,第一多肽编码序列a和第二多肽编码序列b均不包含内质网滞留肽的编码序列,核酸分子中各部分从5’至3’的顺序为:a-l1/l2-b-l1/l2-c,a-l1/l2-c-l1/l2-b,b-l1/l2-a-l1/l2-c,b-l1/l2-c-l1/l2-a,c-l1/l2-a-l1/l2-b,或c-l1/l2-b-l1/l2-a,其中,第一接头l1是ires,第二接头l2是2a肽编码序列,并且核酸分子中的两个接头至少一个是l2。
39.第一多肽编码序列a不包含内质网滞留肽的编码序列并且第二多肽编码序列b包含内质网滞留肽的编码序列,并且核酸分子中各部分从5’至3’的顺序为:b-l1-a-l2-c,b-l1-c-l2-a,a-l2-b-l1-c,a-l2-c-l1-b,a-l1-c-l2-b,a-l2-c-l2-b,c-l2-b-l1-a,c-l2-a-l1-b,c-l1-a-l2-b,或c-l2-a-l2-b,其中,第一接头l1是ires,第二接头l2是2a肽编码序列。
40.在第一方面的一个或多个实施方案中,第一多肽的下调细胞表面tcr/cd3复合物的多肽包含:抗体或其抗原结合片段,或与所述抗体或其抗原结合片段具有至少90%序列相同性并保留所述抗体或抗原结合片段的抗原结合活性的突变体;其中,所述抗体包含重链可变区和轻链可变区,所述重链可变区具有下述hcdr:如seq id no:3所示的hcdr1:gykftsyv,如seq id no:9所示的hcdr2:inx1x2x3dvt,其中x1,x2,x3为任意氨基酸,如seq id no:15所示的hcdr3:ax4gx5x6ydydgfvy,其中x4,x5,x6为任意氨基酸,所述轻链可变区具有下述lcdr:如seq id no:6所示的lcdr1:ssvsy,如seq id no:7所示的lcdr2:dts,如seq id no:22所示的lcdr3:qqwx7x8x9x
10
x
11
t,其中x7,x8,x9,x
10
,x
11
为任意氨基酸。
41.在一个或多个实施方案中,x1为脯氨酸、苏氨酸、甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、甲硫氨酸或色氨酸。
42.在一个或多个实施方案中,x2为酪氨酸、甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、半胱氨酸、苯丙氨酸、色氨酸、组氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸或甲硫氨酸。
43.在一个或多个实施方案中,x3为天冬酰胺、甘氨酸、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、赖氨酸、精氨酸或组氨酸。
44.在一个或多个实施方案中,x4为精氨酸、赖氨酸或组氨酸。
45.在一个或多个实施方案中,x5为丝氨酸、甘氨酸、天冬酰胺、谷氨酰胺、苏氨酸、酪氨酸、半胱氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸或色氨酸。
46.在一个或多个实施方案中,x6为酪氨酸、甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、半胱氨酸、苯丙氨酸、色氨酸、组氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、甲硫氨酸、赖氨酸、精氨酸、天冬氨酸或谷氨酸。
47.在一个或多个实施方案中,x7为丝氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸、甘氨酸、天冬酰胺、谷氨酰胺、苏氨酸、酪氨酸、半胱氨酸、组氨酸、赖氨酸或精氨酸。
48.在一个或多个实施方案中,x8为丝氨酸、甘氨酸、天冬酰胺、谷氨酰胺、苏氨酸、酪氨酸、半胱氨酸、赖氨酸、精氨酸、组氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸或色氨酸。
49.在一个或多个实施方案中,x9为天冬酰胺、甘氨酸、谷氨酰胺、苏氨酸、酪氨酸、半胱氨酸或丝氨酸。
50.在一个或多个实施方案中,x
10
为脯氨酸、丙氨酸、亮氨酸、异亮氨酸、苯丙氨酸、甲硫氨酸或色氨酸。
51.在一个或多个实施方案中,x
11
为亮氨酸、甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、酪氨酸、半胱氨酸、丙氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸或色氨酸。
52.在一个或多个实施方案中,lcdr3选自seq id no:23、seq id no:24、seq id no:25、seq id no:26、seq id no:27、seq id no:28、seq id no:29、seq id no:30、seq id no:31、seq id no:32、seq id no:33,seq id no:34。在一个或多个实施方案中,hcdr2选自seq id no:10、seq id no:11、seq id no:12、seq id no:13、sseq id no:14。在一个或多个实施方案中,hcdr3选自seq id no:16、seq id no:17、seq id no:18、seq id no:19、seq id no:20、seq id no:21。
53.在一个或多个实施方案中,重链可变区的氨基酸序列选自:(1)seq id no:42,(2)含所述hcdr2和/或hcdr3的seq id no:42变体,(3)与(1)或(2)具有95%以上相同性的序列,和/或轻链可变区的氨基酸序列选自:(1)seq id no:43,(2)含所述lcdr3的seq id no:43变体;(3)与(1)或(2)具有95%以上相同性的序列。
54.在一个或多个实施方案中,所述抗体是单链抗体。
55.在一个或多个实施方案中,所述信号肽如seq id no:44第1-22位所示。
56.在一个或多个实施方案中,第一多肽的氨基酸序列如seq id no:44第797-1080位所示或如seq id no:97所示。
57.在第一方面的另一实施方案中,第一多肽的下调细胞表面tcr/cd3复合物的多肽包含:抗体或其抗原结合片段,或与所述抗体或其抗原结合片段具有至少90%序列相同性并保留所述抗体或抗原结合片段的抗原结合活性的突变体;其中,所述抗体包含重链可变区和轻链可变区,所述重链可变区具有下述hcdr:如seq id no:54所示的hcdr1:gytfisyt,如seq id no:60所示的hcdr2:x
12
x
13
x
14
x
15
sgyt,其中x
12
,x
13
,x
14
,x
15
为任意氨基酸,如seq id no:64所示的hcdr3:arsx
16
x
17
x
18
dydgfay,其中x
16
,x
17
,x
18
为任意氨基酸,所述轻链可变区具有下述lcdr:如seq id no:57所示的lcdr1:ssvsy,如seq id no:58所示的lcdr2:dts,如seq id no:66所示的lcdr3:qqwx
19
x
20
x
21
x
22
x
23
t,其中x
19
,x
20
,x
21
,x
22
,x
23
为任意氨基酸。
58.在一个或多个实施方案中,x
12
为丝氨酸、异亮氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸、苏氨酸、甘氨酸、天冬酰胺、谷氨酰胺、酪氨酸或半胱氨酸。
59.在一个或多个实施方案中,x
13
为苏氨酸、天冬酰胺、甘氨酸、谷氨酰胺、丝氨酸、酪氨酸、半胱氨酸、缬氨酸或异亮氨酸。
60.在一个或多个实施方案中,x
14
为脯氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、甲硫氨酸、色氨酸、甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸或半胱氨酸。
61.在一个或多个实施方案中,x
15
为精氨酸、赖氨酸、组氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸或色氨酸。
62.在一个或多个实施方案中,x
16
为丙氨酸、甘氨酸、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、赖氨酸、精氨酸或组氨酸。
63.在一个或多个实施方案中,x
17
为酪氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、甲硫氨酸、色氨酸、天冬氨酸或谷氨酸。
64.在一个或多个实施方案中,x
18
为酪氨酸、赖氨酸、组氨酸、甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸或半胱氨酸。
65.在一个或多个实施方案中,x
19
为丝氨酸、丙氨酸、甘氨酸、天冬酰胺、谷氨酰胺、苏氨酸、酪氨酸、半胱氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、
色氨酸、赖氨酸、精氨酸或组氨酸。
66.在一个或多个实施方案中,x
20
为苏氨酸、丝氨酸、甘氨酸、天冬酰胺、谷氨酰胺、酪氨酸、半胱氨酸、赖氨酸、精氨酸、组氨酸、苯丙氨酸、色氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、甲硫氨酸、天冬氨酸或谷氨酸。
67.在一个或多个实施方案中,x
21
为谷氨酰胺、天冬酰胺、甘氨酸、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、缬氨酸、异亮氨酸、丙氨酸、亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸、赖氨酸、精氨酸或组氨酸。
68.在一个或多个实施方案中,x
22
为脯氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、甲硫氨酸、色氨酸、苏氨酸、异亮氨酸、赖氨酸、精氨酸、组氨酸、酪氨酸、色氨酸、甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸或半胱氨酸。
69.在一个或多个实施方案中,x
23
为甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸。
70.在一个或多个实施方案中,lcdr3选自seq id no:67、seq id no:68、seq id no:69、seq id no:70、seq id no:71、seq id no:72、seq id no:73、seq id no:74、seq id no:75、seq id no:76、seq id no:77、seq id no:78、seq id no:79、seq id no:80、seq id no:81、seq id no:82、seq id no:83、seq id no:84,seq id no:85。在一个或多个实施方案中,hcdr2选自seq id no:61、seq id no:62、seq id no:63。在一个或多个实施方案中,hcdr3是seq id no:65。
71.在一个或多个实施方案中,重链可变区的氨基酸序列选自:(1)seq id no:86,(2)含所述hcdr2和/或hcdr3的seq id no:86变体,(3)与(1)或(2)具有95%以上相同性的序列,和/或轻链可变区的氨基酸序列选自:(1)seq id no:87,(2)含所述lcdr3的seq id no:87变体;(3)与(1)或(2)具有95%以上相同性的序列。
72.在一个或多个实施方案中,所述抗体是单链抗体。
73.在一个或多个实施方案中,所述信号肽如seq id no:44第1-22位所示。
74.在一个或多个实施方案中,第一多肽的氨基酸序列如seq id no:44第797-1080位所示或如seq id no:97所示。
75.在一个或多个实施方案中,第二多肽的下调细胞表面hla-i类分子表达的功能蛋白选自:hsv、bhv-1、ehv-1/4、prv、hsv-1/2、vzv、ebv、hcmv、mcmv、rhcmv、hhv-6/7、kshv、mhv-68、牛痘病毒和腺病毒中能直接靶向降解hla-i的功能蛋白、能经由tap蛋白来下调hla-i类分子表达的功能蛋白和能经由溶酶体来下调hla-i类分子表达的功能蛋白。
76.在一个或多个实施方案中,所述功能蛋白选自:来自ehv-1的蛋白ul49.5和来自kshv的蛋白k5。
77.在一个或多个实施方案中,功能蛋白的氨基酸序列如seq id no:44第516-771位所示或seq id no:97所示。
78.本发明另一方面提供一种核酸构建物,所述核酸构建物包含本文所述的核酸分子。
79.在一个或多个实施方案中,所述核酸构建物为一表达框,其中所述第一多肽的编码序列、第二多肽的编码序列和任选的第三多肽的编码序列处于该表达框内。
80.在一个或多个实施方案中,所述核酸构建物是克隆载体或表达载体。
81.本发明另一方面提供一种慢病毒,所述慢病毒含有本文所述的核酸分子、核酸构建物。
82.本发明另一方面提供一种宿主细胞,所述宿主细胞包含本文所述的核酸分子、核酸构建物和/或慢病毒。
83.本发明另一方面提供一种工程改造的t细胞,所述t细胞表达第一多肽、第二多肽和任选的第三多肽,其中,
84.第一多肽是下调细胞表面tcr/cd3复合物的多肽,所述多肽包含:抗体或其抗原结合片段,或与所述抗体或其抗原结合片段具有至少90%序列相同性并保留所述抗体或抗原结合片段的抗原结合活性的突变体;其中,所述抗体包含重链可变区和轻链可变区,
85.第二多肽是下调细胞表面hla-i类分子表达的功能蛋白。
86.第三多肽是治疗用多肽;优选地,治疗用多肽是嵌合抗原受体。
87.在一个或多个实施方案中,第一多肽、第二多肽、第三多肽如本发明第一方面中所述。
88.在一个或多个实施方案中,所述t细胞包含本文第一方面所述的核酸分子。
89.在一个或多个实施方案中,所述t细胞含有处于一个表达框内的所述第一多肽的编码序列、所述第二多肽的编码序列和任选的第三多肽的编码序列。
90.在一个或多个实施方案中,本发明的t细胞细胞表面hla-i类分子的表达水平为未表达所述功能蛋白的对照car-t细胞的50%以下。
91.本发明还提供一种融合蛋白,包含第一多肽、第二多肽和任选的第三多肽,其中
92.第一多肽是下调细胞表面tcr/cd3复合物的多肽,所述多肽包含:抗体或其抗原结合片段,或与所述抗体或其抗原结合片段具有至少90%序列相同性并保留所述抗体或抗原结合片段的抗原结合活性的突变体;其中,所述抗体包含重链可变区和轻链可变区,
93.第二多肽是下调细胞表面hla-i类分子表达的功能蛋白。
94.第三多肽是治疗用多肽;优选地,治疗用多肽是嵌合抗原受体,
95.在一个或多个实施方案中,第一多肽、第二多肽、第三多肽如本发明第一中所述。
96.本发明另一方面提供一种药物组合物,含有本文所述的核酸分子、核酸构建物、慢病毒或细胞,以及药学上可接受的辅料。
97.本发明另一方面提供第一多肽或其编码序列、第二多肽或其编码序列和接头在制备细胞表面tcr和hla-i下调的t细胞中的应用,或在制备治疗癌症的t细胞中的应用,其中
98.第一多肽是下调细胞表面tcr/cd3复合物的多肽,
99.第二多肽是下调细胞表面hla-i类分子表达的功能蛋白,
100.接头是ires或2a肽编码序列。
101.在一个或多个实施方案中,第一多肽和第二多肽编码序列中一个或两个包含内质网滞留肽的编码序列。
102.在一个或多个实施方案中,包含内质网滞留肽的编码序列的多肽编码序列的3’端的接头不是2a肽编码序列或包含内质网滞留肽的编码序列的多肽编码序列位于核酸分子的3’末端。优选地,所述内质网滞留肽的氨基酸序列包括seq id no:35-40中任一或由其组成,其中x是任意氨基酸。
103.在一个或多个实施方案中,本方面的应用具有本发明第一方面所述的特征。
104.本发明另一方面提供第一多肽或其编码序列、第二多肽或其编码序列和第三多肽或其编码序列、第一接头和第二接头在制备细胞表面tcr和hla-i下调的t细胞中的应用,或在制备治疗癌症的t细胞中的应用,其中
105.第一多肽是下调细胞表面tcr/cd3复合物的多肽,
106.第二多肽是下调细胞表面hla-i类分子表达的功能蛋白,
107.第三多肽是治疗用多肽;优选地,治疗用多肽是嵌合抗原受体,
108.第一接头是ires或2a肽编码序列,
109.第二接头是ires或2a肽编码序列。
110.在一个或多个实施方案中,第一多肽、第二多肽和第三多肽编码序列中至少一个包含内质网滞留肽的编码序列。
111.在一个或多个实施方案中,第一多肽和第二多肽编码序列中一个或两个包含内质网滞留肽的编码序列。
112.在一个或多个实施方案中,包含内质网滞留肽的编码序列的多肽编码序列的3’端的接头不是2a肽编码序列或包含内质网滞留肽的编码序列的多肽编码序列位于核酸分子的3’末端。优选地,所述内质网滞留肽的氨基酸序列包括seq id no:35-40中任一或由其组成,其中x是任意氨基酸。
113.在一个或多个实施方案中,本方面的应用具有本发明第一方面所述的特征。
114.本发明另一方面提供本文所述的核酸分子、核酸构建物、慢病毒在制备细胞表面tcr和hla-i下调的t细胞中的应用,或在制备癌症治疗用的t细胞中的应用。
115.一种核酸分子的构建方法,所述核酸分子包含顺序连接的第一多肽编码序列、第一接头和第二多肽编码序列、和任选的第二接头和任选的第三多肽编码序列,其中第一多肽在c端包含内质网滞留肽,其特征在于,所述接头不是2a肽的编码序列。
116.在一个或多个实施方案中,所述第一接头是ires。
117.在一个或多个实施方案中,所述第二接头是2a肽编码序列。
118.在一个或多个实施方案中,所述内质网滞留肽的氨基酸序列包括seq id no:1-6中任一或由其组成,其中x是任意氨基酸。
119.在一个或多个实施方案中,第一多肽、第二多肽或第三多肽如本文第一方面中所述。
附图说明
120.图1是本发明核酸分子的结构图。
121.图2是表1和图1a所示结构的核酸分子的car-t细胞tcr或cd3或hla的平均荧光强度。
122.图3是表2和图1b所示结构的核酸分子的car-t细胞tcr或cd3或hla的平均荧光强度。
123.图4是表3和图1c所示结构的核酸分子的car-t细胞tcr或cd3或hla的平均荧光强度。
124.图5是表4-6和图1d-图1f所示结构的核酸分子的car-t细胞tcr或cd3或hla的平均荧光强度。
125.图6显示工程改造的t细胞分泌ifn-γ的能力。
126.图7显示工程改造的t细胞的体外扩增分析。
127.图8显示工程改造的t细胞对肿瘤靶细胞的杀伤。
128.图9是实施例6的体内实验的实验过程。
129.图10是实施例6的体内实验的小鼠体重。
130.图11是实施例6的体内实验的小鼠存活率。
131.图12,一个实施方案的下调细胞表面tcr/cd3复合物的多肽突变体下调car-t细胞表面tcr和cd3的活性。
132.图13,一个实施方案的下调细胞表面tcr/cd3复合物的多肽突变体的表达增强car-t细胞的体外扩增。
133.图14,一个实施方案的下调细胞表面tcr/cd3复合物的多肽突变体的表达不影响car-t细胞的细胞毒活性。
134.图15,另一实施方案的下调细胞表面tcr/cd3复合物的多肽突变体的下调car-t细胞表面tcr和cd3的活性。
135.图16a-16c,另一实施方案的下调细胞表面tcr/cd3复合物的多肽突变体不影响car-t细胞的免疫亚群分布。
136.图17,另一实施方案的下调细胞表面tcr/cd3复合物的多肽突变体的表达不影响car-t细胞的体外扩增。
137.图18,另一实施方案的下调细胞表面tcr/cd3复合物的多肽突变体的表达不影响car-t细胞的细胞毒活性。
具体实施方式
138.应理解,在本发明范围中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成优选的技术方案。
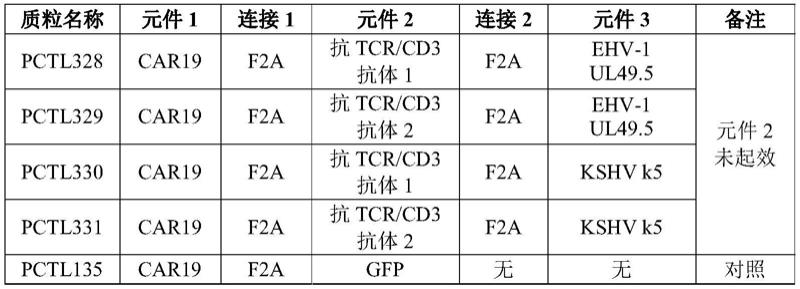
139.从单一转录子表达两个或多个独立蛋白的技术得益于多顺反子载体的建立和进步,但是,仍然有很多难题需要克服。例如,慢病毒载体的包装容量是有限的,限制了可表达的不同蛋白的数量和大小(ibrahmi 2009)。多顺反子载体一般使用内核糖体进入位点(internal ribosome entry sites;ires)核苷酸序列和2a多肽的编码序列,来达到在翻译过程中,产生两个或多个独立蛋白的目的。
140.ires作为结构元件,介导帽结构独立(cap-independent)机制来翻译下游的阅读框。但是,ires介导的帽结构独立机制的翻译,一般来说,没有5’帽结构介导的翻译效率高,其表达水平与细胞类型,顺反子的安排等等有关。
141.2a多肽,理论上讲,能够从一个多顺反子mrna上翻译产生等摩尔的分离蛋白表达。所有2a多肽结构,位置在前的蛋白在其c-端会粘上一个小2a标签;在一些应用中,这个2a标签被有利地用来区别内源和重组蛋白。但是,这个2a标签对蛋白功能的影响缺少研究;至于2a标签在何种情况下对蛋白的何种功能的影响,则没有研究。
142.在实际应用中,如何选择不同的结构元件和组合是非常具有挑战的。例如,在用2顺反子表达报告基因时,2a元件明显优于ires元件,而且,报告基因的表达与其位于2a元件的上游或下游无关(ibrahmi 2009)。但是,在应用两个或三个2a元件表达三个或4个蛋白的
时候,蛋白表达量与其在多顺反子中的位置和蛋白本身都有关系(liu 2017)。
143.在同时应用2a元件和ires元件表达三个不同蛋白的时,ires元件被放在后一个位置,最后一个蛋白是报告基因如gfp,因为尽管报告基因的表达量很低,能够显示转染成功就可以了(chinnasamy 2006)。
144.基于本发明的发明人所知,单一转录子的多顺反子仅限于表达两个功能蛋白,并且,所表达的两个功能蛋白一般是一个功能复合物的亚单位或位于细胞质的。应用单一转录子的多顺反子表达两个或三个不同功能的蛋白或多肽,还没有报道,因为在技术上存在巨大挑战。进一步地,表达三个拥有不同作用方式和/或位点的不同功能蛋白,更是难上加难。
145.本发明通过表达抗体或其片段下调细胞表面tcr/cd3复合物并表达相关功能蛋白下调细胞表面hla-i类分子,制备能抑制细胞表面tcr/cd3复合物和hla-i类分子的表达的t细胞,从而制备得到同种异体car-t细胞。
146.采用本发明方法制备得到的t细胞中,与未表达该多肽的对照相比,tcr/cd3复合物在细胞表面的表达水平被至少50%、优选至少90%、更优选至少99%或完全抑制。
147.采用本发明方法制备得到的t细胞中,hla-i类分子的表达并未完全被抑制,这些t细胞仍然在细胞表面表达一定量的hla-i类分子,因此很好地避免了受体nk细胞的攻击,同时也解决了受体的排斥反应。优选地,以流式细胞术检测,本发明car-t细胞中hla-i类分子的表达水平为未表达所述功能蛋白的对照car-t细胞的80%以下,优选60%以下,更优选50%以下,更优选30%以下,更以下25%以下。在一些实施方案中,以流式细胞术检测,本发明car-t细胞中hla-i类分子的表达水平为未表达所述功能蛋白的对照car-t细胞的10-50%,如15-50%。在一些实施方案中,即便经过相同的靶细胞刺激,本发明car-t细胞中hla-i类分子的表达水平仍为未表达所述功能蛋白的对照car-t细胞的10-50%,如15-50%。
148.因此,本发明提供一类t细胞,该类细胞含有编码下调细胞表面tcr/cd3复合物的多肽的核酸分子、编码下调细胞表面hla-i类分子表达的功能蛋白的核酸分子和任选的编码治疗性多肽的核酸分子。本文中,合适的t细胞可以是本领域周知的各种t细胞,尤其是细胞免疫疗法中常规使用的各种t细胞,包括但不限于外周血t淋巴细胞、细胞毒杀伤t细胞、辅助t细胞、抑制/调节性t细胞、γδt细胞、细胞因子诱导的杀伤细胞和肿瘤浸润淋巴细胞等,以及上述细胞的任意一种或多种的混合物。本文中,car-t细胞指至少表达嵌合抗原受体的t细胞。
149.本文中,下调细胞表面tcr/cd3复合物的多肽包含抗体或其抗原结合片段。“抗体”指这样的多肽,其包含足以令其与靶抗原特异性结合的免疫球蛋白序列元件。如本领域所知,天然的完整抗体是四聚体,包含两条相同重链多肽和两条相同轻链多肽。各重链包含至少四个结构域:氨基末端的可变结构域vh、恒定结构域ch1、恒定结构域ch2和羧基末端的恒定结构域ch3。各轻链包含两个结构域:氨基末端的可变结构域vl和羧基末端恒定结构域cl。各可变域包含三个“互补决定区”:cdr1、cdr2和cdr3,和四个“框架”区:fr1、fr2、fr3和fr4。“抗原结合片段”表示抗体中可与靶抗原特异性结合的片段。抗体或其抗原结合片段包括fab片段、fab’片段、f(ab’)2片段、fd’片段、fd片段、fv片段、二硫键结合的fv片段、单链抗体(scfv)、分离的cdr或cdr组、多肽-fc融合体、单域抗体、骆驼抗体、掩蔽抗体、小模块免
疫药物、双功能抗体、纳米抗体、humabody抗体。单链抗体是由抗体重链可变区和轻链可变区通过短肽(linker)连接而成的抗体。
150.在优选的实施方案中,本发明下调细胞表面tcr/cd3复合物的多肽是特异性结合tcr/cd3的抗tcr/cd3抗体,更优选是抗tcr/cd3的单链抗体(scfv)。在一些实施方案中,所述抗tcr抗体的包含重链可变区和轻链可变区,重链可变区具有下述hcdr:如seq id no:3所示的hcdr1:gykftsyv,如seq id no:9所示的hcdr2:inx1x2x3dvt,其中x1,x2,x3为任意氨基酸,如seq id no:15所示的hcdr3:ax4gx5x6ydydgfvy,其中x4,x5,x6为任意氨基酸;轻链可变区具有下述lcdr:如seq id no:6所示的lcdr1:ssvsy,如seq id no:7所示的lcdr2:dts,如seq id no:22所示的lcdr3:qqwx7x8x9x
10
x
11
t,其中x7,x8,x9,x
10
,x
11
为任意氨基酸。在另一些实施方案中,所述抗tcr抗体包含重链可变区和轻链可变区,重链可变区具有下述hcdr:如seq id no:54所示的hcdr1:gytfisyt,如seq id no:60所示的hcdr2:x
12
x
13
x
14
x
15
sgyt,其中x
12
,x
13
,x
14
,x
15
为任意氨基酸,如seq id no:64所示的hcdr3:arsx
16
x
17
x
18
dydgfay,其中x
16
,x
17
,x
18
为任意氨基酸,所述轻链可变区具有下述lcdr:如seq id no:57所示的lcdr1:ssvsy,如seq id no:58所示的lcdr2:dts,如seq id no:66所示的lcdr3:qqwx
19
x
20
x
21
x
22
x
23
t,其中x
19
,x
20
,x
21
,x
22
,x
23
为任意氨基酸。
151.本文下调细胞表面tcr/cd3复合物的多肽的轻链可变区和重链可变区之间可直接连接,或者可通过连接序列连接。本文中,连接序列或铰链是连接不同蛋白或多肽之间的多肽片段,其目的是使所连接的蛋白或多肽保持各自的空间构象,以维持蛋白或多肽的功能或活性。示例性的连接序列包括含有g和/或s的连接序列。通常,连接序列含有一个或多个前后重复的基序。例如,该基序可以是gggs、ggggs、ssssg、gsgsa和ggsgg。优选地,该基序在连接序列中是相邻的,在重复之间没有插入氨基酸残基。连接序列可以包含1、2、3、4或5个重复基序组成。连接序列的长度可以是3-25个氨基酸残基,例如3-15、5-15、10-20个氨基酸残基。在某些实施方案中,连接序列是多甘氨酸连接序列。连接序列中甘氨酸的数量无特别限制,通常为2-20个,例如2-15、2-10、2-8个。除甘氨酸和丝氨酸来,连接序列中还可含有其它已知的氨基酸残基,例如丙氨酸(a)、亮氨酸(l)、苏氨酸(t)、谷氨酸(e)、苯丙氨酸(f)、精氨酸(r)、谷氨酰胺(q)等。连接序列长度通常为15-20个氨基酸。在某些实施方案中,本发明不同蛋白或多肽之间由(gggs)n连接,其中n为1~5的整数。在某些实施方案中,本发明单链抗体的轻链可变区和重链可变区之间由(gggs)n连接,其中n为1~5的整数。在某些实施方案中,本文下调细胞表面tcr/cd3复合物的多肽的轻链可变区和重链可变区之间由gstsgggsgggsgggss(seq id no:41)连接。
152.本发明中,下调细胞表面tcr/cd3复合物的多肽也包括与所述抗体(尤其是本文所述的抗tcr抗体)或其抗原结合片段具有至少70%序列相同性并保留所述抗体或抗原结合片段的抗原结合活性的突变体。所述突变体包括:与参照序列具有至少70%,至少80%,优选至少85%,优选至少90%,优选至少95%,优选至少97%的序列相同性并保留参照序列的生物学活性(如活化t细胞、结合tcr)的氨基酸序列。可采用例如ncbi的blastp计算两条比对的序列之间的序列相同性。突变体还包括在所述氨基酸序列中具有一个或数个突变(插入、缺失或取代)、同时仍保留该参照序列的生物学活性的氨基酸序列。所述数个突变通常指1-50个以内,例如1-20、1-10、1-8、1-5或1-3个。取代优选是保守性取代。对于scfv,突变可以发生在cdr区内(包括前文所述的cdr区内的突变),也可以发生在fr区内,只要突变后
17、ny-br-1、upk2、havcr1、adrb3、panx3、ny-eso-1、gpr20、ly6k、or51e2、tarp、gfrα4和呈递在mhc上的这些抗原中任一者的多肽片段。合适的b细胞抗原包括但不限于cd5、cd10、cd19、cd20、cd21、cd22、cd23、cd24、cd25、cd27、cd30、cd34、cd37、cd38、cd40、cd53、cd69、cd72、cd73、cd74、cd75、cd77、cd79a、cd79b、cd80、cd81、cd82、cd83、cd84、cd85、cd86、cd123、cd135、cd138、cd179、cd269、flt3、ror1、bcma、fcrn5、fcrn2、cs-1、cxcr4、cxcr5、cxcr7、il-7/3r、il7/4/3r和il4r。
163.在优选的实施方案中,本发明结合肿瘤抗原的多肽是特异性结合上述任一种肿瘤抗原的单链抗体。本文中,单链抗体(scfv)指由抗体轻链可变区(vl区)氨基酸序列和重链可变区(vh区)氨基酸序列经铰链连接而成的具有结合抗原能力的抗体片段。感兴趣的单链抗体可来自感兴趣的抗体。感兴趣的抗体可以是人抗体,包括人鼠嵌合抗体和人源化抗体。抗体可以是分泌型或膜锚定型;优选地为膜锚定型。本文中,特异性结合是指抗体或其抗原结合片段与其所针对的抗原之间的反应。在某些实施方式中,特异性结合某抗原的抗体(或对某抗原具有特异性的抗体)是指,抗体以小于大约10-5
m,例如小于大约10-6
m、10-7
m、10-8
m、10-9
m或10-10
m或更小的亲和力(kd)结合该抗原。
164.适用于本发明的抗肿瘤抗原的抗体可衍生自本领域周知的各种抗肿瘤抗原的单链抗体。单链抗体可含有感兴趣抗体的重链可变区和轻链可变区,或由重链可变区和轻链可变区以及任选的铰链组成。重链可变区和轻链可变区之间可通过本领域周知的连接序列或铰链连接,例如前文所述的含g和s的连接序列。在某些实施方案中,本发明单链抗体的轻链可变区和重链可变区之间由gstsgggsgggsggggss(seq id no:41)连接。
165.在肿瘤抗原的单链抗体是抗cd19单链抗体的实施方案中,感兴趣的肿瘤抗原是cd19,感兴趣的单链抗体是特异性结合cd19的单链抗体。在一个或多个实施方案中,抗cd19单链抗体衍生自fmc63。示例性地,抗cd19单链抗体的轻链可变区序列包含seq id no:44第23-129位氨基酸或由其组成;抗cd19单链抗体的重链可变区序列包含seq id no:44第148-267位氨基酸或由其组成,其中,重链可变区和轻链可变区通过含g和s的连接序列连接。
166.car中所含的其它部分,如铰链区、跨膜区和胞内信号区可以是常规用于构建各类car的铰链区、跨膜区和胞内信号区。
167.本文中,铰链区指免疫球蛋白重链ch1和ch2功能区之间的区域,该区富含脯氨酸,不形成α螺旋,易发生伸展及一定程度扭曲,有利于抗体的抗原结合部位与抗原表位间的互补性结合。适用于本发明car的铰链区本领域周知。适用于本文的铰链区可选自cd8α铰链区、igg1 fc ch2ch3铰链区、igd铰链区、cd28胞外铰链区、igg4 fc ch2ch3铰链区和cd4胞外铰链区。在一个或多个实施方案中,铰链区是人cd8α铰链区。所述人cd8α铰链区可衍生自本领域周知的cd8α多肽链。示例性地,人cd8α铰链区的序列包含seq id no:44第268-312位氨基酸或由其组成。
168.本文中,跨膜区可选自cd28跨膜区、cd8跨膜区、cd3ζ跨膜区、cd134跨膜区、cd137跨膜区、icos跨膜区和dap10跨膜区中的一种或多种。优选地,用于本文的嵌合抗原受体的跨膜区为cd8跨膜区。示例性的跨膜区的氨基酸序列包含seq id no:44第313-336位氨基酸残基或由其组成。
169.本文中,胞内信号区可选自cd28、cd134/ox40、cd137/4-1bb、lck、icos、dap10、cd3ζ和fc310/中的任意一种或多种的胞内信号区,优选为4-1bb胞内信号区和cd3ζ胞内信号
区。本文示例性的胞内信号区的氨基酸序列可如seq id no:44第337-490位氨基酸残基所示。在一个或多个实施方案中,所述4-1bb胞内区包含seq id no:44第337-378位氨基酸或由其组成;cd3ζ胞内区包含seq id no:44第379-490位氨基酸或由其组成。
170.治疗用蛋白例如嵌合抗原受体还可包括信号肽。信号肽是引导新合成的蛋白质向分泌通路转移的短肽链(长度5-30个氨基酸),常指新合成多肽链中用于指导蛋白质的跨膜转移(定位)的n-末端的氨基酸序列。信号肽可以是膜蛋白信号肽,如cd8信号肽、cd28信号肽和cd4信号肽。示例性的信号肽氨基酸序列可包含seq id no:44第1-22位氨基酸残基或由其组成。
171.因此,在一个或多个实施方案中,所述car从n端至c端含有任选的抗肿瘤抗原的单链抗体、铰链区、跨膜区、一个或多个胞内区。示例性的嵌合抗原受体的氨基酸序列包含seq id no:44第23-490位氨基酸残基或由其组成,或者包含seq id no:44第1-490位氨基酸残基或由其组成。
172.形成本文嵌合抗原受体的上述各部分,如信号肽、单链抗体的轻链可变区和重链可变区、铰链区、跨膜区和胞内信号区等,相互之间可直接连接,或者可通过本领域周知的序列连接,例如前文所述的含g和s的连接序列。
173.本发明的治疗用蛋白、下调细胞表面tcr/cd3复合物的多肽和下调细胞表面hla-i类分子表达的功能蛋白两两之间通过接头连接,从而能够在单个表达框中表达多个多肽。所述接头例如2a肽或ires接头。本领域周知,2a肽是一种能诱导核糖体滑位(ribosome skipping)的短肽。示例性的2a肽包括但不限于猪破伤风病毒-1 2a(porcine teschovirus-1 2a,p2a)、口蹄疫病毒(foot-and-mouth disease virus 2a,fmdv2a,f2a)、马鼻炎a病毒(equine rhinitis a vims 2a,erav 2a,e2a)、撒那阿萨达病毒2a(thosea asigna virus 2a,t2a)、细胞质多角体病毒2a(cytoplasmic polyhedrosis vims 2a,bmcpv2a)、弗拉切病毒2a(flacherie virus 2a,bmifv2a)、脊髓灰质炎病毒2a肽(theilovirus 2a)和脑心肌炎病毒2a肽(encephalomyocarditis virus 2a)。在一个或多个实施方案中,2a肽的氨基酸序列包含seq id no:91或由其组成。本文所述接头和其相邻的多肽之间可直接连接或具有其他序列,只要不影响各接头和多肽的功能即可。例如,2a肽也可通过常规的含g和s的接头与两侧的多肽相连;ires与其5’和/或3’端的多肽编码序列之间可具有其他序列(例如其他基因的编码序列)。本文所述接头和其相邻的多肽的编码序列可位于同一表达框内或不位于同一表达框内。通常,2a肽的编码序列与其5’和/或3’端的多肽编码序列位于同一表达框内,所以2a肽的编码序列的5’端多肽编码序列可不含终止密码子,3’端多肽编码序列可不含起始密码子;而ires的序列与其5’和/或3’端的多肽编码序列不位于同一表达框内,所以ires的序列的5’端多肽编码序列含有终止密码子,3’端多肽编码序列含有起始密码子。
174.本文所述ires可为本领域已知的任何ires,包括但不限于:脑心肌炎病毒ires、小核糖核酸病毒ires、口蹄病病毒ires、甲肝病毒ires、丙肝病毒ires、人类鼻病毒ires、脊髓灰质炎病毒ires、猪水疱病病毒ires、芜菁花叶马铃薯y病毒属病毒ires、人类成纤维细胞生长因子2mrna ires、瘟病毒属ires、利什曼原虫rna病毒ires、莫洛尼氏鼠白血病病毒ires、人类鼻病毒14ires、口蹄疫病毒ires、人类免疫球蛋白重链结合蛋白mrna ires、果蝇触角足基因mrna ires、人类成纤维细胞生长因子2mrna ires、庚型肝炎病毒ires、烟草花
叶病毒属ires、血管内皮生长因子mrna ires、柯萨奇b组病毒ires、c-myc原癌基因mrna ires、人类myt2 mrna ires、人类双埃可病毒属1型病毒ires、人类双埃可病毒属2型病毒ires、真核启动因子4gi mrna ires、plautia stali肠道病毒ires、泰勒氏鼠脑脊髓炎病毒ires、牛肠道病毒ires、连接蛋白43mrna ires、同源域蛋白gtx mrna ires、aml1转录因子mrna ires、nf-κb阻抑因子mrna ires、x-连锁凋亡抑制剂mrna ires、蟋蟀麻痹病毒rna ires、p58(pitslre)蛋白激酶mrna ires、鸟氨酸脱羧酶mrna ires、连接蛋白-32mrna ires、牛病毒性腹泻病毒ires、胰岛素样生长因子i受体mrna ires、人类免疫缺陷病毒1型gag基因ires、猪瘟病毒ires、卡波西肉瘤相关疱疹病毒ires、选自随机寡核苷酸文库的短ires、jembrana病病毒ires、凋亡蛋白酶激活因子1mrna ires、禾谷缢管蚜病毒ires、阳离子型氨基酸转运子mrna ires、人类胰岛素样生长因子ii引导蛋白2mrna ires、贾第鞭毛虫病毒属ires、smad5 mrna ires、猪捷申病毒-1talfan ires、果蝇无毛基因mrna ires、hsnm1 mrna ires、cbfa1/runx2 mrna ires、epstein-barr病毒ires、木槿褪绿环斑病毒ires、大鼠垂体加压素v1b受体mrna ires和人类hsp70 mrna ires。在下述实施例中,本发明使用脑心肌炎病毒ires(seq id no:90)作为示例阐述本发明的效果,但本领域技术人员知晓脑心肌炎病毒ires可被上述任意ires替换并具有类似的效果。
175.发明人发现,在构建多顺反子序列中,若2a肽位于含有内质网滞留肽的多肽之后,则该多肽的表达或活性受限。因此,当需要在多肽中包含内质网滞留肽时,与其c端(核酸序列的3’端)连接的接头是非2a肽序列,例如ires。
176.本发明的多核苷酸或核酸分子可以是dna形式或rna形式。dna形式包括cdna、基因组dna或人工合成的dna。dna可以是单链的或是双链的。dna可以是编码链或非编码链。本发明也包括编码多肽或蛋白的多核苷酸的简并变异体,即编码相同的氨基酸序列但核苷酸序列有所不同的多核苷酸。
177.本文所述多核苷酸包括经密码子优化而发生变化的序列,只要多核苷酸所编码的氨基酸序列不变即可。经密码子优化的序列可对具体物种表现出更适合的表达性。本领域周知对多核苷酸序列进行密码子优化的方法。
178.本发明的多核苷酸可以是治疗用蛋白例如car的编码序列、下调细胞表面tcr/cd3复合物的多肽和下调细胞表面hla-i类分子表达的功能蛋白的编码序列,或者是治疗用蛋白的表达框和所述蛋白和多肽的表达框。本文中,编码序列指核酸序列中直接确定其蛋白产物(例如car、单链抗体、铰链区、跨膜区、胞内信号区、抗下调细胞表面tcr/cd3复合物的多肽或下调细胞表面hla-i类分子表达的功能蛋白等)的氨基酸序列的部分。编码序列的边界通常是由紧邻mrna 5’端开放读码框上游的核糖体结合位点(对于原核细胞)和紧邻mrna 3’端开放读码框下游的转录终止序列确定。编码序列可以包括,但不限于dna、cdna和重组核酸序列。本文中,表达框指表达感兴趣基因所需的完整元件,包括启动子、基因编码序列和polya加尾信号序列。本文所述的多核苷酸可以是独立的核酸分子,分别含治疗用蛋白的编码序列、下调细胞表面tcr/cd3复合物的多肽的编码序列和下调细胞表面hla-i类分子表达的功能蛋白的编码序列,如分别是治疗用蛋白的表达框、多肽的表达框和功能蛋白的表达框;或者所述治疗用蛋白的编码序列和所述下调细胞表面tcr/cd3复合物的多肽的编码序列和所述下调细胞表面hla-i类分子表达的功能蛋白的编码序列中的两者可经由接头连接为一个核酸分子,这样三种编码序列在两个表达框内;或者,所述治疗用蛋白的编码序列
和所述下调细胞表面tcr/cd3复合物的多肽的编码序列和所述下调细胞表面hla-i类分子表达的功能蛋白的编码序列可经由接头连接为一个核酸分子,如三种编码序列在同一表达框内,或者是三个表达框经由合适的接头连接为同一核酸分子。在某些实施方案中,本发明的多核苷酸为治疗用蛋白、所述多肽、所述功能蛋白的编码序列同处一个表达框的核酸分子,其含有启动子、编码所述治疗用蛋白和多肽的核酸序列以及polya加尾信号。在一个或多个实施方案中,所述多核苷酸还包含任选的内质网滞留肽的编码序列。
179.在某些实施方案中,所述编码序列或表达框整合到t细胞的基因组中。因此,在这些实施方案中,本文所述的t细胞的基因组中稳定整合了包含编码本文所述治疗用蛋白和多肽的表达框。
180.本发明也涉及核酸构建物,该核酸构建物含有本文所述的多核苷酸,以及与这些序列操作性连接的一个或多个调控序列。本发明所述的多核苷酸可以多种方式被操作以保证所述下调细胞表面tcr/cd3复合物的多肽和下调细胞表面hla-i类分子表达的功能蛋白和任选的治疗用蛋白的表达。在将核酸构建物插入载体之前可根据表达载体的不同或要求而对核酸构建物进行操作。利用重组dna方法来改变多核苷酸序列的技术是本领域已知的。
181.调控序列可以是合适的启动子序列。启动子序列通常与待表达蛋白的编码序列操作性连接。启动子可以是在所选择的宿主细胞中显示转录活性的任何核苷酸序列,包括突变的、截短的和杂合启动子,并且可以从编码与该宿主细胞同源或异源的胞外或胞内多肽的基因获得。调控序列也可以是合适的转录终止子序列,由宿主细胞识别以终止转录的序列。终止子序列与编码该多肽的核苷酸序列的3’末端操作性连接。在选择的宿主细胞中有功能的任何终止子都可用于本发明。调控序列也可以是合适的前导序列,对宿主细胞翻译重要的mrna的非翻译区。前导序列与编码该多肽的核苷酸序列的5’末端可操作连接。在选择的宿主细胞中有功能的任何终止子都可用于本发明。
182.在某些实施方案中,所述核酸构建物是载体。载体可以是克隆载体,也可以是表达载体,或者是同源重组载体。本发明的多核苷酸可被克隆入许多类型的载体,例如,质粒、噬菌粒、噬菌体衍生物、动物病毒和粘粒。克隆载体可用于提供本发明治疗用蛋白与多肽的编码序列,如含治疗用蛋白的编码序列与多肽的编码序列的一个核酸分子。表达载体可以以病毒载体形式提供给细胞。通常通过可操作地连接本发明的多核苷酸至启动子,并将构建体并入表达载体,实现本发明多核苷酸的表达。该载体对于复制和整合真核细胞可为合适的。典型的克隆载体包含可用于调节期望核酸序列表达的转录和翻译终止子、起始序列和启动子。病毒载体技术在本领域中是公知的并在例如sambrook等(2001,molecular cloning:a laboratory manual,cold spring harbor laboratory,new york)和其他病毒学和分子生物学手册中进行了描述。可用作载体的病毒包括但不限于逆转录病毒、腺病毒、腺伴随病毒、疱疹病毒和慢病毒。同源重组载体用于将本文所述的表达框整合到宿主基因组中。
183.通常,合适的载体包含在至少一种有机体中起作用的复制起点、启动子序列、方便的限制酶位点和一个或多个可选择的标记。例如,在某些实施方案中,本发明使用慢病毒载体,该慢病毒载体含有复制起始位点,3’ltr,5’ltr,本文所述的多核苷酸,以及任选的可选择的标记。
184.合适的启动子的一个例子为即时早期巨细胞病毒(cmv)启动子序列。该启动子序
列是能够驱动可操作地连接至其上的任何多核苷酸序列高水平表达的强组成型启动子序列。合适的启动子的另一个例子为延伸生长因子-1α(ef-1α)。然而,也可使用其他组成型启动子序列,包括但不限于类人猿病毒40(sv40)早期启动子、小鼠乳癌病毒(mmtv)、人免疫缺陷病毒(hiv)长末端重复(ltr)启动子、momulv启动子、鸟类白血病病毒启动子、eb病毒即时早期启动子、鲁斯氏肉瘤病毒启动子、以及人基因启动子,诸如但不限于肌动蛋白启动子、肌球蛋白启动子、血红素启动子和肌酸激酶启动子。
185.为了评估治疗用蛋白、多肽或其部分的表达,被引入细胞的表达载体也可包含可选择的标记基因或报道基因中的任一个或两者,以便于从通过病毒载体寻求被转染或感染的细胞群中鉴定和选择表达细胞。在其他方面,可选择的标记可被携带在单独一段dna上并用于共转染程序。可选择的标记和报道基因两者的侧翼都可具有适当的调节序列,以便能够在宿主细胞中表达。有用的可选择标记包括例如抗生素抗性基因,诸如neo等等。
186.报道基因用于鉴定潜在转染的细胞并用于评价调节序列的功能性。在dna已经被引入受体细胞后,报道基因的表达在合适的时间下进行测定。合适的报道基因可包括编码荧光素酶、β-半乳糖苷酶、氯霉素乙酰转移酶、分泌型碱性磷酸酶或绿色萤光蛋白基因的基因。合适的表达系统是公知的并可利用已知技术制备或从商业上获得。
187.本文所述的多核苷酸通常可以用pcr扩增法获得。具体而言,可根据本文所公开的核苷酸序列,尤其是开放阅读框序列来设计引物,并用市售的cdna库或按本领域技术人员已知的常规方法所制备的cdna库作为模板,扩增而得有关序列。当序列较长时,常常需要进行两次或多次pcr扩增,然后再将各次扩增出的片段按正确次序拼接在一起。或者,也可直接合成本文所述的核酸分子。
188.将基因引入细胞和将基因表达入细胞的方法在本领域中是已知的。载体可通过在本领域中的任何方法容易地引入宿主细胞,例如,哺乳动物、细菌、酵母或昆虫细胞。例如,表达载体可通过物理、化学或生物学手段转移入宿主细胞。
189.将多核苷酸引入宿主细胞的物理方法包括磷酸钙沉淀、脂质转染法、粒子轰击、微注射、电穿孔等等。将感兴趣的多核苷酸引入宿主细胞的生物学方法包括使用dna和rna载体。将多核苷酸引入宿主细胞的化学手段包括胶体分散系统,诸如大分子复合物、纳米胶囊、微球、珠;和基于脂质的系统,包括水包油乳剂、胶束、混合胶束和脂质体。
190.将多核苷酸引入宿主细胞的生物学方法包括使用病毒载体,特别是逆转录病毒载体,这已经成为最广泛使用的将基因插入哺乳动物例如人细胞的方法。其他病毒载体可源自慢病毒、痘病毒、单纯疱疹病毒i、腺病毒和腺伴随病毒等等。已经开发了许多基于病毒的系统,用于将基因转移入哺乳动物细胞。例如,逆转录病毒提供了用于基因传递系统的方便的平台。可利用本领域中已知的技术将选择的基因插入载体并包装入逆转录病毒颗粒。该重组病毒可随后被分离和传递至体内或离体的对象细胞。许多反转录病毒系统在本领域中是已知的。慢病毒是逆转录病毒科下的属。慢病毒载体是一种较复杂的逆转录病毒载体。用于慢病毒包装的试剂为本领域所周知,如常规的慢病毒载体系统包括prsv-rev、pmdlg-prre、pmd2g和目的干扰质粒。在一个实施方案中,使用慢病毒载体pwpxl。
191.因此,在某些实施方案中,本发明还提供用于活化t细胞的慢病毒,该病毒含有本文所述的逆转录病毒载体以及相应的包装基因,如gag、pol、vsvg和/或rev。
192.本文中,宿主细胞含有、表达和/或分泌本文所述的抗体和/或融合蛋白以及任选
的治疗用多肽。本文中,当提及细胞含有或包含、表达、分泌某种分子如多肽时,“含有”指所述所述分子含于所述细胞内或表面上;“表达”指该细胞生产所述分子;“分泌”指该细胞将所表达的分子分泌出细胞外。宿主细胞既包括最终用于疾病治疗目的的t细胞,也包括生产car-t细胞过程中使用到的各种细胞,如大肠杆菌细胞,以用于如提供本发明蛋白的编码序列或提供本文所述的载体。在某些实施方案中,本文提供一种稳定表达本文所述下调细胞表面tcr/cd3复合物的多肽的car-t细胞。
193.适用于本发明的t细胞可以是各种来源的各种类型的t细胞。例如,t细胞可来源于健康个体的pbmc。在某些实施方案中,获得t细胞后,可先用适量的(例如30~80ng/ml,如50ng/ml)的cd3抗体刺激活化,然后在含有适量的(例如30~80iu/ml,如50iu/ml)的il2培养基中进行培养备用。
194.因此,在某些实施方案中,本发明提供一种基因修饰的t细胞,该基因修饰的t细胞含有本文所述的多核苷酸,或含有本文所述的慢病毒载体,或感染了本文所述的慢病毒,或采用本文所述的方法制备得到,或稳定表达本文所述的治疗用蛋白和多肽。
195.本发明的t细胞(例如car-t细胞)可经历稳固的体内t细胞扩展并在血液和骨髓中以高水平持续延长的时间量,并形成特异性记忆t细胞。不希望被任何具体的理论所束缚,在遇到并随后消除表达替代抗原的靶细胞后,本发明的t细胞可体内分化成中心记忆样状态。
196.本文还包括一种t细胞培养物,该培养物含有本文所述的t细胞以及合适的培养基。培养基可以是本领域常规用于培养t细胞的培养基。
197.本文还提供一种药物组合物,该药物组合物中含有本文所述的t细胞以及药学上可接受的辅料。本文中,药学上可接受的辅料是指在药理学和/或生理学上与受试者和活性成分相容的载体、稀释剂和/或赋形剂,包括但不限于:ph调节剂,表面活性剂,碳水化合物,佐剂,抗氧化剂,螯合剂,离子强度增强剂和防腐剂。更具体而言,合适的药学上可接受的辅料可以是本领域常用于t细胞(例如car-t细胞)给药的辅料。
198.通常,药物组合物中含有治疗有效量的t细胞。治疗有效量是指可在受试者中实现治疗、预防、减轻和/或缓解疾病或病症的剂量。可根据患者年龄、性别、所患病症及其严重程度、患者的其它身体状况等因素确定治疗有效量。本文中,受试者或患者通常指哺乳动物,尤其指人。
199.本文还提供了一种试剂盒,所述试剂盒含有本文所述的核酸构建物。试剂盒还可含有适用于将所述核酸构建物转染入细胞中的各种试剂,以及任选的指导本领域技术人员将所述重组表达载体转染入细胞的说明书。
200.本发明还包括一种细胞疗法,其中t细胞被基因修饰以表达本文所述的治疗用蛋白和多肽,和给对象施用t细胞。例如,施用的car-t细胞能够杀死接受者的肿瘤细胞。由car-t细胞引起的抗肿瘤免疫应答可为主动或被动免疫应答。另外,car介导的免疫应答可为过继免疫疗法步骤的一部分,其中car-t细胞诱导对car中的抗原结合部分特异性的免疫应答。
201.因此,适合使用本发明的car、多肽、它们的编码序列、核酸构建物、表达载体、病毒或car-t细胞治疗的疾病与car中所含的肿瘤抗原单链抗体有关。因此,本文所述的疾病包括与前文所述的肿瘤抗原相关的各类癌症,包括实体瘤和血液肿瘤,如腺癌、肺癌、结肠癌、
大肠癌、乳腺癌、卵巢癌、宫颈癌、胃癌、胆管癌、胆囊癌、食管癌、胰腺癌和前列腺癌等实体瘤,以及白血病和淋巴瘤,如b细胞淋巴瘤、套细胞淋巴瘤、急性淋巴细胞白血病、慢性淋巴细胞白血病、多毛细胞白血病和急性髓性白血病等。在肿瘤抗原是cd19的实施方案中,可采用本文所述的包含抗cd19单链抗体的car、多肽、它们的编码序列、核酸构建物、表达载体、病毒或car-t细胞治疗的疾病优选为cd19介导的疾病;例如急性/慢性b系淋巴细胞白血病、非霍奇金淋巴瘤、弥漫性大b细胞淋巴瘤、滤泡性淋巴瘤和套细胞淋巴瘤等。
202.本发明的t细胞可被单独施用或作为药物组合物施用。本发明的细胞或药物组合物可以以适于治疗(或预防)的疾病的方式施用。施用的数量和频率将由各种因素确定,如患者的病症、和患者疾病的类型和严重度。组合物的施用可以以任何方便的方式进行,包括通过注射、输液、植入或移植。本文描述的组合物可被皮下、皮内、瘤内、结内、脊髓内、肌肉内、通过静脉内注射或腹膜内施用给患者。在一个实施方案中,本发明的t细胞组合物通过皮内或皮下注射被施用给患者。在另一个实施方案中,本发明的t细胞组合物优选通过静脉注射施用。t细胞的组合物可被直接注入肿瘤、淋巴结或感染位置。
203.在本发明的一些实施方案中,本发明的t细胞或其组合物可与本领域已知的其它疗法结合。所述疗法包括但不限于化疗、放疗和免疫抑制剂。例如,可结合本领域周知的治疗肿瘤抗原介导的疾病的放疗或化疗制剂进行治疗。
204.本文中,“抗肿瘤效应”指一种生物学效应,其可由肿瘤体积的减少、肿瘤细胞数的减少、转移数的减少、预期寿命的增加或与癌相关的各种生理症状的改善表示。
205.本发明采用抗cd19抗体(具体是衍生自克隆号fmc63的scfv)的基因序列作为示例,并从ncbi genbank数据库中搜索到人cd8α铰链区、人cd8跨膜区、4-1bb胞内区、人cd3ζ胞内区、抗tcr单链抗体、ul49.5蛋白等序列信息,将各部分连接并插入到慢病毒载体中。重组质粒在293t细胞中包装病毒,感染t细胞,使t细胞表达该嵌合抗原受体。本发明实现嵌合抗原受体基因修饰的t淋巴细胞的转化方法是基于慢病毒转化方法。该方法具有转化效率高,外源基因能够稳定表达,且可以缩短体外培养t淋巴细胞到达临床级数量的时间等优点。在该转基因t淋巴细胞表面,转化的核酸通过转录、翻译表达在其上。本发明制备的car-t细胞在表达car的同时可以显著下调细胞表面的tcr/cd3复合物并显著下调细胞表面hla-1类分子的表达。因此,本发明的car-t细胞可以作为同种异体car-t细胞克服移植物抗宿主反应(gvhd)并避免被异体细胞表面的hla清除。与未下调tcr/cd3、hla
-ⅰ
的对照组相比,本发明的car-t细胞能较优的维持荷瘤小鼠的体重,并明显提高荷瘤小鼠的生存率。
206.本发明通过参考以下实验实施例进一步详细地进行描述。这些实施例仅出于说明性的目的提供,并不意欲为限制性的,除非另有规定。因此,本发明决不应被解释为限于以下实施例,而是应被解释为包括由于本文提供的教导变得显而易见的任何和全部的变化。实施例中所用的方法和试剂,除非另有说明,否则为本领域常规的方法和试剂。
207.实施例
208.实施例1-载体构建
209.1、从ncbi网站数据库搜索到人cd8α铰链区、人cd8跨膜区、4-1bb胞内区、人cd3ζ胞内区、功能蛋白、抗人cd19抗体(克隆fmc63)的重链和轻链可变区、tcr/cd3抗体序列来自专有的抗人cd3抗体克隆。所有相关的核苷酸序列在网站https://www.thermofisher.com/order/geneartgenes上进行密码子优化,保证在编码氨基酸序列不变的情况下更适合人类
细胞表达。抗tcr/cd3抗体1(抗体1)的序列如seq id no:44第797-1080所示,抗tcr/cd3抗体2(抗体2)的序列如seq id no:88所示。
210.2、采用重叠pcr将抗cd19-scfv、人cd8铰链区、人cd8跨膜区、4-1bb胞内区、人cd3ζ胞内区、f2a或ires、ehv-1ul49.5,kshv k5(uniprotkb登陆号:f5h9k4)、cd3-scfv、内质网滞留肽(aekdel)的核苷酸序列进行连接,形成完整的具有三重功能的核苷酸编码序列。用于构建在car-t细胞中表达car和下调其tcr/cd3复合物以及hla
-ⅰ
类分子的具有三重功能的核苷酸编码序列结构如图1a-f所示。
211.3、该具有三重功能的核苷酸编码的核苷酸序列经无缝克隆到慢病毒质粒pwpxl(addgene)的bamhi/ecori位点,转化到感受态大肠杆菌(stbl3)。
212.4、将重组质粒测序(苏州金唯智生物科技有限公司),验证序列正确。测序引物为
213.正义序列:tcaagcctcagacagtggttc(seq id no:49)
214.反义序列:ccagtcaatctttcacaaattttg(seq id no:50)。
215.实施例2-病毒包装
216.经测序正确后,使用质粒纯化试剂盒(qiagen公司)提取并纯化质粒,采用磷酸钙法将纯化的质粒转染293t细胞,制备慢病毒(molecular therapy-methods&clinical development,2016,3:16017),由此制备得到如下慢病毒载体:pctl135(car19-f2a-gfp)、pctl328(car19-f2a-抗tcr/cd3抗体1-f2a-ehv-1ul49.5)、
217.pctl329(car19-f2a-抗tcr/cd3抗体2-f2a-ehv-1ul49.5)、pctl330(car19-f2a-抗tcr/cd3抗体1-f2a-kshv k5)、pctl331(car19-f2a-抗tcr/cd3抗体2-f2a-kshv k5)、pctl386(car19-f2a-ehv-1ul49.5-f2a-抗tcr/cd3抗体1)、pctl441(car19-f2a-ehv-1ul49.5(缺失胞质段)-f2a-抗tcr/cd3抗体1)、pctl442(car19-f2a-ehv-1ul49.5-furin cleavage site-f2a-抗tcr/cd3抗体1)、pctl387(car19-f2a-kshv k5-f2a-抗tcr/cd3抗体1)、pctl416(car19-f2a-kshv k5-f2a-抗tcr/cd3抗体2)、pctl206(car19-f2a-ehv-1ul49.5)、pctl213(car19-f2a-kshv k5)、pctl272(car19-f2a-抗tcr/cd3抗体1)、pctl274(car19-f2a-抗tcr/cd3抗体2)、pctl518(抗tcr/cd3抗体2-ires-car19-ires-ehv-1ul49.5)、pctl519(抗tcr/cd3抗体2-ires-car19-ires-kshv k5)、pctl450(抗tcr/cd3抗体2-ires-car19-f2a-ehv-1ul49.5)、pctl451(car19-f2a-抗tcr/cd3抗体2-ires-ehv-1ul49.5)、pctl453(ehv-1ul49.5-ires-car19-f2a-抗tcr/cd3抗体2)。
218.实施例3-外周血pbmc的分离、t细胞分离活化
219.选择hbv、hcv和hiv检测阴性的健康供者,肘正中静脉抽血,ficoll密度梯度离心分离pbmc白膜层,根据全血流式检测cd3
+
t细胞百分比,计算cd3
+
t细胞数,按dynabeads cd3/cd28与cd3
+
t细胞比例3:1,吸取使用量磁珠,与白膜层细胞孵育30min,分离cd3
+
t细胞,cd3
+
t细胞经dynabeads cd3/cd28(life technology)活化24小时后流式检测cd25
+
cd69
+
t细胞比例。
220.实施例4-慢病毒转导和t细胞培养
221.cd3
+
t活化后,进行慢病毒转导。用novonectin包被24孔板37℃孵育2小时,将细胞悬液分别与前述制备得到的各种慢病毒(moi=3)、tscm(2u/ml,近岸蛋白)配置成转导体系,置于包被的24孔板中,细胞密度调整至1.0e+06/ml,500g离心30min,离心后置于37℃和5%co2的培养箱静置培养48小时。慢病毒转染完毕后,以含5%fbs的xvivo15培养液培养,
隔日补充tscm(终浓度2u/ml),计数并调整细胞密度至0.5e+06/ml,培养至第8-10天收获细胞。
222.实施例5-car阳性率以及car-t细胞tcr或cd3平均荧光强度
223.计数并收集5.0e+05细胞,洗涤细胞2次后重悬于100μl含4%bsa的缓冲液中。每管细胞加入抗人tcr或cd3或抗人hla
-ⅰ
抗体8μl,旋涡混匀,4℃孵育30分钟。染色孵育完毕后,重复洗涤细胞,将荧光标记的抗car19抗体或protein l稀释500x,重悬细胞,每管200ul,旋涡混匀,4℃孵育30分钟。重复洗涤细胞,重悬于500μl含4%bsa的缓冲液中,每管加入7aad染料4μl,旋涡混匀,常温避光孵育10分钟。最后,将样品转移至流式管,在calibr流式仪上检测car19转染效率以及car19+t细胞群体的tcr或cd3或hla
-ⅰ
表面水平。
224.表1列出图1a所示的具有三重功能的核苷酸编码结构的4个例子和1个对照结构。
225.表1
[0226][0227]
图2显示t细胞在转染了表1所列的质粒后,其细胞表面的car19,tcr/cd3复合物,和hla-i类分子的表达水平。从图2可以看出,当car19序列、内质网滞留下调tcr/cd3序列和下调hla
-ⅰ
类分子序列这3个元件依次通过f2a序列相连时,tcr/cd3复合物的表达没有降低,表明放在连接2的f2a元件前的两个带有内质网滞留信号的下调tcr/cd3序列都是不工作的。
[0228]
表2列出图1b所示的具有三重功能的核苷酸编码结构的5个例子和其他5个对照结构。
[0229]
表2
[0230][0231]
图3显示t细胞在转染了表2所列的质粒后,其细胞表面的car19,tcr/cd3复合物,和hla-i类分子的表达水平。从图3可以看出,当car19序列、ehv-1ul49.5下调hla
-ⅰ
类分子序列和内质网滞留下调tcr/cd3序列这3个元件依次通过f2a序列相连时,hla
-ⅰ
类分子的表达没有降低,表明放在连接2的f2a元件前的具有内质网滞留活性的ehv-1ul49.5分子序列是不工作的。
[0232]
当car19序列、kshv k5下调hla
-ⅰ
类分子序列和内质网滞留下调tcr/cd3序列这3个元件依次通过f2a序列相连时,tcr/cd3复合物和hla
-ⅰ
类分子的表达均降低,表明放在连接2的f2a元件前的细胞膜跨膜蛋白kshv k5分子序列是工作的。
[0233]
表3列出图1c所示的具有三重功能的核苷酸编码结构两个例子和一个对照。
[0234]
表3
[0235][0236]
图4显示t细胞在转染了表3所列的质粒后,其细胞表面的car19,tcr/cd3复合物,和hla-i类分子的表达水平。从图4可以看出,当内质网滞留下调tcr/cd3序列、car19序列和ehv-1ul49.5下调hla
-ⅰ
类分子序列这3个元件依次通过ires序列相连时,导致慢病毒滴度
太低,无法转导进t细胞。
[0237]
表4列出图1d所示的具有三重功能的核苷酸编码结构的1个例子。
[0238]
表4
[0239][0240]
表5列出图1e所示的具有三重功能的核苷酸编码结构的一个例子。
[0241]
表5
[0242][0243]
表6列出图1f所示的具有三重功能的核苷酸编码结构的一个例子和两个对照。
[0244]
表6
[0245][0246]
图5显示t细胞在转染了表4-6所列的质粒后,其细胞表面的car19,tcr/cd3复合物,和hla-i类分子的表达水平。从图5可以看出,当car19序列、ehv-1ul49.5下调hla
-ⅰ
类分子序列和内质网滞留下调tcr/cd3序列的连接如表4-6所示,tcr/cd3复合物和hla
-ⅰ
类分子的表达均降低。表明放在连接ires前时,下调hla
-ⅰ
类分子序列和内质网滞留下调tcr/cd3序列这2个元件均能有效工作。
[0247]
实施例6-t细胞分泌ifn-γ的能力
[0248]
pctl135、pctl450、pctl451、pctl453、pctl206和pctl274组慢病毒转染的t细胞体外培养至第8天,加入tcr依赖的t细胞激活抗体okt3(50ng/ml)。用x-vivo15培养液将各组car-t细胞样品稀释适当倍数,根据需要取出相应数量的条块,每孔加入100ul稀释液rd1-51,将稀释后的样品混匀,取100ul加入孔中(15分钟内完成);盖上封口膜,室温孵育2小时。孵育完成后,完全去除孔中溶液,加入洗涤液,静置1分钟,重复此步骤,总共清洗四次;每孔加200ul的人ifn-γ偶联试剂,盖上新的封口膜,室温孵育2小时;每孔加200ul底物溶液,室温避光孵育30分钟;孵育完成后,每孔加入50ul终止液,充分混合后上酶标仪检测(设置波长为450nm,校正波长570nm/540nm)。
[0249]
结果如图6所示。实验组(pctl450、pctl451和pctl453)与对照组相比,ifn-γ分泌均有所下调,表明细胞表面不存在功能性的tcr/cd3复合物,这与前述实验结果完全一致。
[0250]
实施例7-t细胞体外扩增分析
[0251]
pctl135、pctl450和pctl451组慢病毒载体转染的t细胞,隔日计数t细胞,体外培养t细胞至第23天,计算细胞增殖倍数(第23天的细胞数/用于转染的细胞数)。
[0252]
结果如图7所示。pctl451和pctl450组的t细胞与对照相比,均能保持水平相当的细胞扩增能力。
[0253]
实施例8-t细胞对肿瘤靶细胞的杀伤
[0254]
计数并收集nc-t细胞(未进行慢病毒转染的t细胞)和各组car-t细胞,用t细胞培养液x-vivo15(不含tscm)调整细胞密度至5.0e+07/ml。计数并收集靶细胞,用rpmi 1640(不含fbs)将细胞密度调整至5.0e+06/ml。于1.5毫升离心管中将上述调整好密度的效应细胞分别与靶细胞按不同效靶比(1:1、2.5:1、5:1、10:1、20:1)混合,用x-vivo15将总体积补足至200ul。移入96孔v型板中,在37℃和5%co2下孵育24小时后,轻轻吹打混匀各孔细胞并转移100ul细胞悬液至白壁实心底的96孔板中。加入80μl one-glo
tm
luciferase底物,吹吸混匀,室温避光孵育10分钟后上luminoskan ascent化学发光分析仪检测荧光强度。
[0255]
结果如图8所示。各组均具有高效的杀伤肿瘤靶细胞的能力。
[0256]
实施例9-体内实验
[0257]
选择实施例5中的包含pctl450和pctl451的car-t细胞作为试验组,选择pbs作为对照组。将pbs重悬的nalm-6细胞以1
×
106cell/只的体积通过尾静脉注射接种到ncg小鼠。肿瘤接种后第7天,小鼠随机分配到5个组中,每组各8只。分组当天开始给药,尾静脉回输car-t细胞,5
×
106cell/只给药后,每隔一定天数测量动物体重,并计算小鼠生存率。实验流程如图9所示,结果如图10和图11所示。
[0258]
表7
[0259][0260]
从图10和图11可以看出,截止到20天,对照组的小组全部死亡。与pctl450组以及未下调tcr/cd3、hla
-ⅰ
的pctl135组相比,pctl451组的car-t细胞能较优的维持荷瘤小鼠的体重,并明显提高荷瘤小鼠的生存率。
[0261]
实施例10-抗tcr/cd3抗体1突变文库的制备和筛选
[0262]
1)选取目标tcr/cd3抗体序列进行氨基酸点突变以找寻更有效下调表面tcr/cd3复合物表达的、或消除其mhc-i表位的,或能促进t细胞扩增等应用优势的突变体。突变文库的区域1位于目标scfv的轻链(seq id no:43的第90-95位氨基酸),区域2位于目标scfv的重链(seq id no:42的第50-55位氨基酸),区域3位于目标scfv的重链(seq id no:42第97-101位氨基酸)。
[0263]
2)设计nnk简并引物进行上述突变文库的构建。按照实施例1和实施例2的方法制备得到慢病毒目标突变体文库。
[0264]
3)按照实施例3和实施例4的方法制备得到目标突变t细胞文库。
[0265]
4)按照实施例5的方法检测目标突变t细胞文库的tcr和cd3的表达情况。结果如图
9所示,目标突变文库细胞表现出下调tcr和cd3表达的能力。
[0266]
5)流式分选出下调tcr能力最强的t细胞克隆亚群,并进行基因组高通量测序,表8展示了文库中示例性的23个突变体。随后挑选其中三个,确认它们能够下调细胞表面tcr/cd3复合物的表达,并能有效杀伤靶细胞。
[0267]
6)所选的三个突变体为:突变体1,vl-cdr3(seq id no:23);突变体2,vl-cdr3(seq id no:24);突变体3,vh-cdr3(seq id no:17)。构建相应的点突变质粒。
[0268]
表8
[0269]
测序结果频率突变位置氨基酸序列序列号0.26%vh-cdr2invyndvtseq id no:100.21%vh-cdr2inpandvtseq id no:110.20%vh-cdr2inpykdvtseq id no:120.20%vh-cdr2inplndvtseq id no:130.19%vh-cdr2innyndvtseq id no:140.54%vh-cdr3argsgydydgfvyseq id no:160.53%vh-cdr3akgsyydydgfvyseq id no:170.29%vh-cdr3argswydydgfvyseq id no:180.23%vh-cdr3argsgydydgfvyseq id no:190.22%vh-cdr3argsrydydgfvyseq id no:200.21%vh-cdr3argvyydydgfvyseq id no:210.73%vl-cdr3qqwsgnpltseq id no:230.56%vl-cdr3qqwsrnpltseq id no:240.44%vl-cdr3qqwssspltseq id no:250.41%vl-cdr3qqwfsnpltseq id no:260.35%vl-cdr3qqwssnpttseq id no:270.34%vl-cdr3qqwswnpltseq id no:280.32%vl-cdr3qqwsanpltseq id no:290.22%vl-cdr3qqwslnpltseq id no:300.21%vl-cdr3qqwssnpstseq id no:310.20%vl-cdr3qqwssnvltseq id no:320.20%vl-cdr3qqwssspltseq id no:330.19%vl-cdr3qqwsvnpltseq id no:34
[0270]
7)按照上述实施例的方法检测了所选3个突变体的相关car-t指标,结果如图10-12所示。
[0271]
如图12所示,突变体1、突变体2和突变体3表现出和未突变对照相同程度的下调tcr和cd3在细胞表面表达的能力。如图13所示,突变体1、2、3均能提高car-t细胞的扩增效率,因此生产周期可以缩短,增加终产品的干性,增强体内杀瘤活性和持久性,降低药品的单位生产成本,并提高产品质量;如图14所示,突变体表现出与未突变对照等效的肿瘤细胞杀伤能力。
[0272]
实施例11-抗tcr/cd3抗体2突变文库的制备和筛选
[0273]
1)选取目标cd3抗体序列进行氨基酸点突变以找寻更有效下调表面tcr/cd3复合物表达的、或消除其mhc-i表位的,或能促进t细胞扩增等应用优势的突变体。突变文库的位置1位于目标scfv的轻链(seq id no:87的第90-95位氨基酸wssnpp),位置2位于目标scfv的重链(seq id no:86的第50-54位氨基酸yinpr),位置3位于目标scfv的重链(seq id no:86第98-102位氨基酸rsayy)。
[0274]
2)设计nnk简并引物进行上述突变文库的构建。按照实施例1和实施例2的方法制备得到慢病毒目标突变体文库。
[0275]
3)按照实施例3和实施例4的方法制备得到目标突变t细胞文库。
[0276]
4)按照实施例5的方法检测目标突变t细胞文库的tcr和cd3的表达情况。结果如图9所示,目标突变文库细胞表现出下调tcr和cd3表达的能力。
[0277]
5)流式分选出下调tcr能力最强的t细胞克隆亚群,并进行基因组高通量测序以确定最终的突变文库结果,结果如表9所示,展示了文库中比例最高的前23个突变体。所发现的突变体可以进一步用于分析是否带来任何应用上的优势,包括但不限于,提高下调细胞表面tcr/cd3复合物的效率,加快t细胞的体外扩增,或消除原序列中存在的mhc表位等。
[0278]
6)示例性地,根据表9的文库结果,将发现的突变序列在网站http://www.iedb.org/home_v3.php上进行了mhc-i表位分析,根据该网站分析结果显示突变体vl-cdr3:qqwstqrpt(seq id no:76)和突变体vl-cdr3:qqwsgqppt(seq id no:78)消除了cd3抗体目标抗体序列中的mhc-i表位。
[0279]
表9
[0280]
[0281][0282]
7)选取突变体vl-cdr3:qqwstqrpt(seq id no:76)和突变体vl-cdr3:qqwsgqppt(seq id no:78)进行突变体质粒的构建。
[0283]
8)按照上述实施例的方法检测了含有2个突变体的相关car-t指标,结果如图10-13所示。
[0284]
根据图15,突变体1和突变体2表现出和未突变对照相同程度的抑制tcr和cd3在细胞表面表达的能力。图16a-16c显示,突变体1和突变体2表现出与未突变对照一致的t细胞免疫表型比例。图17-18显示扩增能力和肿瘤细胞杀伤,如图17所示,突变体表现出与未突变对照等效的扩增效率;如图18所示,突变体表现出与未突变对照等效的肿瘤细胞杀伤能力。
[0285]
这些结果表明,含有突变体1和突变体2的t细胞与未突变对照相比,消除了未突变抗体序列中存在的mhc-i表位,且这2个突变体与对照组相比,没有影响细胞的免疫表型分布,细胞扩增和嵌合抗原受体介导的靶细胞杀伤。
[0286]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。本文所涉序列如下表所示。
[0287]
本文序列
[0288]
[0289]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1