青环海蛇抗炎活性肽Hydrostatin-SN61及其编码基因和在制药中的应用的制作方法
本发明属于生物医药技术领域,具体涉及一种青环海蛇抗炎活性肽hydrostatin-sn61及其编码基因和在制药中的应用。
背景技术:
肿瘤坏死因子(tnf-α)是参与全身性炎症反应的细胞信号传导蛋白,也是构成急性期反应的细胞因子之一。它主要由活化的巨噬细胞产生,还可以由许多其他细胞类型产生,如cd4+淋巴细胞,nk细胞,中性粒细胞,肥大细胞,嗜酸性粒细胞和神经元细胞。作为一种多效的细胞因子,tnf-α是生物学过程中的关键性调控因子之一,在细胞再生、迁移、炎症和凋亡过程(程序性细胞死亡)等方面都具有作用。tnf-α是许多自身免疫性疾病的炎症介质,例如类风湿性关节炎,炎症性肠病(ibd)和多发性硬化症等。有证据表明,ibd患者的肠粘膜,粪便和血液样本中的tnf-α水平升高,且tnf-α的水平与克罗恩病患者的临床疾病活动性相关(参见文献:b.ngo,c.p.farrell,m.barretal.“tumornecrosisfactorblockadefortreatmentofinflammatoryboweldisease:efficacyandsafety”.currentmolecularpharmacology,vol.3,no.3,pp.145–152,2010.)。
tnf-α单抗类生物制剂的出现使ibd、类风湿性关节炎等复杂炎症疾病或自身免疫性疾病的治疗方法出现了根本改变。在短期和长期用药过程中,抗tnf治疗均显示出了减轻疾病症状,治愈肠粘膜溃疡,减少住院和手术以及减少糖皮质激素的使用等功效。但并不是所有患者对其治疗反应均相同,高达40%的患者无反应,甚至出现一定的不良反应如感染等,这可能是因为不加区别地阻断细胞因子活性,从而导致宿主抗感染能力下降所致。tnf-α是通过与细胞膜上的相应受体tnfr结合发挥多种生物学功能,tnfr包括tnfr1和tnfr2两种受体,tnf-α主要通过tnfr1传递促炎、凋亡信号,促使机体产生炎症或免疫反应,而tnfr2的主要功能是参与机体增殖与再生。随着对疾病发病机制的深入研究,当前更多的研究是把治疗的靶点转向tnfr。总体上从抗炎角度来说,现在该类药物的研发热点在于通过阻断tnfr1传递的信号通路来封闭tnf-α的生物学功能。
il-10是一种免疫调节性细胞因子,由不同类型的细胞产生,包括b淋巴细胞、t淋巴细胞、巨噬细胞、单核细胞、树突状细胞和肥大细胞。il-10同时能抑制t淋巴细胞、单核细胞的功能以及巨噬细胞的活化和效应作用,是一个对大多数造血细胞都有不同影响的细胞因子,其最主要的功能是限制和最终终止炎症反应。目前的研究发现,il-10参与了ibd的发病过程。il-10基因缺陷小鼠可自发产生结肠炎(参见文献:kühnr,
青环海蛇(hydrophiscyanocinctus)是记载于《本草纲目》中一种海洋来源的中药,其活性成分主要为蛋白质和多肽,具有抗炎、抗肿瘤、抗血栓、镇痛、降压等功效。
中国专利cn103030687a已公开了一种青环海蛇抗炎活性肽hydrostatin-sn1,含有二十二个氨基酸残基,分子量为2483.68道尔顿,等电点4.39,其基因序列为:5’-gacgaacaacacctagagaccgaactacacactctcaccagcgtgctgacagccaatggattccaa-3’,多肽全序列一级结构为:asp-glu-gln-his-leu-glu-thr-glu-leu-his-thr-leu-thr-ser-val-leu-thr-ala-asn-gly-phe-gln,与tnfr1的结合能力强于与tnfr2、tnf-α的结合能力,具有抗炎活性。但目前尚无文献报道有关青环海蛇的生物活性肽hydrostatin-sn61的报道。
技术实现要素:
本发明以tnfr1为靶点淘选青环海蛇毒腺噬菌体展示文库筛选获得一种新的抗炎活性肽hydrostatin-sn61。对其进行深入研究,发现该抗炎活性肽能够有效抑制tnfr1介导的生物活性,具有极大的药用前景。
本发明第一方面,提供了一种青环海蛇抗炎活性肽hydrostatin-sn61及其编码基因和在制药中的应用。
本发明第一方面,提供了一种青环海蛇抗炎活性肽hydrostatin-sn61,所述的青环海蛇抗炎活性肽的氨基酸序列如seqidno:2所示。
所述青环海蛇抗炎活性肽是一种直链多肽,含有十二个氨基酸残基,分子量为1210.22道尔顿,等电点7.4。
本发明还提供了一种青环海蛇抗炎活性肽hydrostatin-sn61的编码基因,该编码基因为如seqidno:1所示的dna分子。
本发明第二方面,提供了一种青环海蛇抗炎活性肽hydrostatin-sn61的筛选方法,该方法包括如下步骤:
(1)生物淘选:以人重组肿瘤坏死因子ⅰ型受体(tnfr1)作为靶点淘选青环海蛇蛇毒毒腺噬菌体展示文库,用1×pbs将人重组tnfr1稀释至浓度为1μg/ml,以1μl蛋白+99μl碳酸盐缓冲液(cbs)包被96孔elisa板;3h后用tbst洗涤3次,封闭液封闭过夜。包被好的elisa板,每孔加入200μl噬菌体,37℃孵育3小时;以tbst溶液洗板4次,加洗脱液于37℃孵育20分钟,从elisa板上将结合的噬菌体洗脱下来,以宿主菌blt5403(novagencompany)扩增洗脱下的噬菌体,完成第一轮淘选。按上述方法继续进行两次生物淘选,筛选获得多个噬菌体克隆(包含不同的插入片段,即不同的目的基因片段)。以引物up(seqidno:3)和down(seqidno:4)pcr扩增第三轮淘选所得噬菌体,其中一条插入片段(目的基因)经测序鉴定序列为:5’-tcggatccccgagcatcacacctgactggaatacga-3’(如seqidno:1所示),即sn61基因序列;其氨基酸序列一级结构为:ser-asp-pro-gly-ala-ser-his-leu-thr-gly-iie-arg(sdpgashltgir),如seqidno:2所示;
(2)合成:以固相多肽合成技术合成hydrostatin-sn61,并以hplc及ms分析其纯度和分子量,其分子量为1210.22道尔顿,等电点7.4。
本发明的第三方面,提供了青环海蛇抗炎活性肽hydrostatin-sn61及其编码基因在制药中的应用,所述应用为制备治疗与tnf-α相关的疾病的药物中的应用。
其中,所述与tnf-α相关的疾病,包括结肠炎、类风湿性关节炎等多种复杂炎症疾病或自身免疫性疾病的药物中的应用。
本发明采用噬菌体展示技术筛选得到抗炎活性肽hydrostatin-sn61,表面等离子共振技术(spr)分析hydrostatin-sn61与tnfr1之间的相互作用,证明hydrostatin-sn61可直接与tnfr1结合,并能与tnf-α及tnfr2以相对较弱的能力结合;hydrostatin-sn61可以竞争性抑制tnf-α与tnfr1的结合。并进一步利用内毒素(lps)诱导骨髓来源巨噬细胞(bmdm)细胞模型,检测hydrostatin-sn61对tnfr1下游的mapks信号通路的影响;同时建立lps诱导小鼠急性休克模型和il-10基因敲除小鼠自发性结肠炎模型来评价
hydrostatin-sn61的抗炎活性,结果证明hydrostatin-sn61能直接与tnfr1结合,在细胞和动物水平都能抑制tnf-α的生物活性,具有良好的抗炎活性。因此,可作为活性成分用于tnf-α相关的抗炎药物。
本发明的青环海蛇抗炎活性肽hydrostatin-sn61,含有十二个氨基酸残基,分子量比sn1小,其基因序列、多肽全序列一级结构和sn1不同,与tnfr1、tnfr2、tnf-α的结合能力也和sn1不用,是一种新的青环海蛇抗炎活性肽。
本发明的青环海蛇抗炎活性肽hydrostatin-sn61具有分子量小、结构简单、人工合成方便、抗炎活性强的特点。本发明所述药物可作为治疗与tnf-α相关的疾病如结肠炎、类风湿性关节炎等多种复杂炎症疾病或自身免疫性疾病的新用途,为治疗这些疾病提供了新的途径,有较大的临床应用价值。
附图说明
图1是hydrostatin-sn61的hplc分析结果。
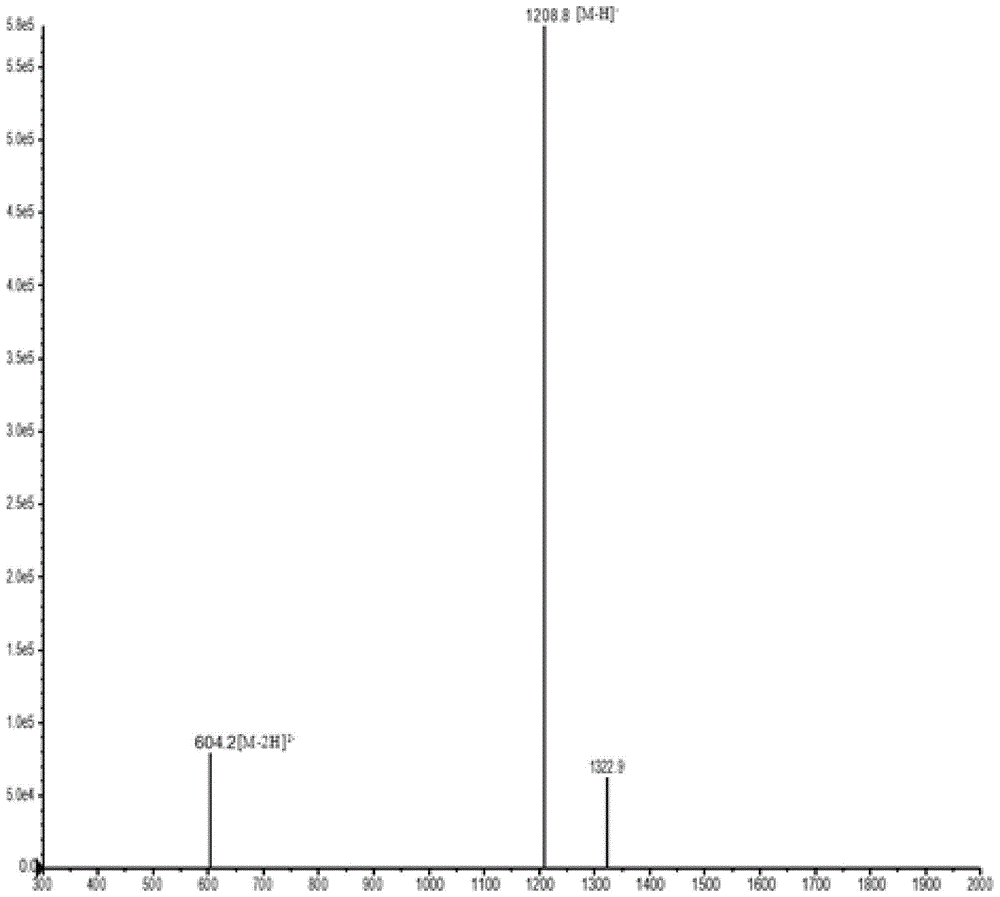
图2是hydrostatin-sn61的ms分析结果。
图3是tnf-α与芯片的偶联(最终偶联4200ru)。
图4是tnfr1与芯片的偶联(最终偶联3100ru)。
图5是tnfr2与芯片的偶联(最终偶联2900ru)。
图6是hydrostatin-sn61直接与偶联在芯片上的tnf-α的结合反应曲线。
图7是hydrostatin-sn61直接与偶联在芯片上的tnfr1的结合反应曲线。
图8是hydrostatin-sn61直接与偶联在芯片上的tnfr2的结合反应曲线。
图9是tnfr1偶联于芯片上,两条从上到下依次为:tnf-α单独,tnf-α:hydrostatin-sn61为1:100(n:n)。
图10是tnfr2偶联于芯片上,两条从上到下依次为:tnf-α单独,tnf-α:hydrostatin-sn61为1:50(n:n)。
图11是hydrostatin-sn61对lps诱导的小鼠bmdm炎症因子表达的影响;其中,a、小鼠血清中tnf-α表达情况;b、小鼠血清中il-6表达情况;c、小鼠血清中il-1β表达情况;d、小鼠血清中inos表达情况。
图12是hydrostatin-sn61对lps诱导的小鼠bmdm的tnfr1下游mapks信号通路的磷酸化水平的影响。
图13是hydrostatin-sn61对小鼠lps诱导的急性休克动物模型的作用。
图14是hydrostatin-sn61对il-10-/-小鼠自发性结肠炎模型中小鼠体重变化的影响。
图15是hydrostatin-sn61对il-10-/-小鼠自发性结肠炎模型中小鼠疾病活动指数的影响。
图16是hydrostatin-sn61对il-10-/-小鼠自发性结肠炎模型中小鼠脾脏指数的影响。
图17是hydrostatin-sn61对il-10-/-小鼠自发性结肠炎模型小鼠结肠组织中炎症因子il-1β表达情况的影响。
图18是hydrostatin-sn61对il-10-/-小鼠自发性结肠炎模型中小鼠结肠组织的tnfr1下游mapks信号通路的磷酸化水平的影响。
图19是hydrostatin-sn61对il-10-/-小鼠自发性结肠炎模型中小鼠结肠组织病理学损伤的影响,组织切片he染色光镜图(100倍)。
图20是hydrostatin-sn61对il-10-/-小鼠自发性结肠炎模型中小鼠结肠组织tnf-α表达水平的影响,组织切片光镜图(100倍)。
具体实施方式
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但下列实施例不应看作对本发明的限制。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干调整和改进。这些都属于本发明的保护范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
实施例1:青环海蛇抗炎活性肽hydrostatin-sn61的来源及合成。
1、青环海蛇蛇毒毒腺噬菌体展示文库的构建
取新鲜分离获得的青环海蛇蛇毒毒腺(0.18-0.2mg),trizol法提取总rna,straighta’smrnaisolationsystem试剂盒(novagencompany)磁珠法分离获得mrna,orientexpressoligo(dt)(novagencompany)反转录获得cdna第一条链,primercdnasynthesiskits(novagencompany)合成cdna第二条链。利用t7selectcloningkit(novagencompany)将上述所得cdna连接t7载体中,t7selectpackingextract试剂盒(novagencompany)对其进行包装,最终获得青环海蛇蛇毒毒腺噬菌体展示文库。以平板计数法测定文库滴度并扩增文库,所得扩增文库加入0.1%的80%甘油,混匀后于-80℃保存。
2、hydrostatin-sn61的筛选获得
以tnfr1作为靶点淘选青环海蛇蛇毒毒腺噬菌体展示文库:用1×pbs将人重组tnfr1稀释至浓度为1μg/ml,以1μl蛋白+99μlcbs包被96孔elisa板;3h后用tbst洗涤3次,封闭液封闭过夜。包被好的elisa板,每孔加入200μl噬菌体,37℃孵育3小时;以tbst溶液洗板4次,加洗脱液于37℃孵育20分钟,从elisa板上将结合的噬菌体洗脱下来,以宿主菌blt5403(novagencompany)扩增洗脱下的噬菌体,完成第一轮淘选。按上述方法继续进行两次生物淘选,筛选获得多个噬菌体克隆(包含不同的插入片段,即不同的目的基因片段)。
从第三轮淘选所得噬菌体中分离单克隆噬菌体,以引物up:5’-ggagctgtcgtattccagtc-3’(如seqidno:3所示),引物down:5’-ttggggagttctgggcaaat-3’(如seqidno:4所示)pcr扩增第三轮淘选所得噬菌体,其中一条插入片段(目的基因)经测序鉴定序列为:5’-tcggatccccgagcatcacacctgactggaatacga-3’(如seqidno:1所示),即sn61基因序列。其氨基酸序列一级结构为:ser-asp-pro-gly-ala-ser-his-leu-thr-gly-iie-arg(sdpgashltgir),如seqidno:2所示。
以固相多肽合成技术合成hydrostatin-sn61,并以hplc(图1)和ms(图2)分析其纯度及分子量,结果可知其纯度>98.22%,分子量为1210.22道尔顿,等电点7.4。
实施例1制得的hydrostatin-sn61用于下列实验。
实施例2:采用基于表面等离子共振技术(spr)的生物大分子相互作用分析仪biacoret200检测sn61与偶联于芯片上的tnf-α、tnfr1及tnfr2之间的相互作用。
1、pbs-prunningbuffer以10μl/min的流速分别流过两个cm-5传感芯片中设定的通道,直至达到基线水平。
2、用pbs-buffer活化芯片各通道的表面反应基团,同时进行配体的预富集,用1×pbsbuffer溶解tnf-α、tnfr1及tnfr2冻干粉,确定包被蛋白的最适ph值为4.5。
3、按ph4.5及蛋白浓度50ug/ml进样,将tnf-α、tnfr1及tnfr2蛋白用氨基偶联方法共价偶联在传感器芯片表面,tnf-α、tnfr1及tnfr2的偶联量分别约为4200(图3)、3100(图4)及2900(图5)反应单位(responseunit,ru)。
4、hydrostatin-sn61溶解于hbs-epbuffer,梯度稀释后进样,记录每个浓度的响应值,检测不同浓度药物和tnf-α、tnfr1及tnfr2间的结合能力。如图6所示,hydrostatin-sn61与tnf-α结合,hydrostatin-sn61浓度为15.625μm、31.25μm、62.5μm、125μm、250μm,与tnf-α的结合能力约为100μm;如图7所示,hydrostatin-sn61能与tnfr1直接相互作用,hydrostatin-sn61浓度为31.25μm、62.5μm、125μm、250μm、500μm,与tnfr1的结合能力约为77.4μm;如图8所示,hydrostatin-sn61与tnfr2结合,hydrostatin-sn61浓度为3.90625μm、7.8125μm、15.625μm、31.25μm、62.5μm、125μm,与tnfr2的结合能力约为200μm。
5、进一步检测hydrostatin-sn61对tnf-α与tnfr1、tnfr2结合的竞争性抑制作用:用epbuffer配制250nm浓度的tnf-α蛋白溶液,与hydrostatin-sn61混合,上机检测,比较加入hydrostatin-sn61前后tnf-α饱和浓度和响应值的变化,如图9所示,hydrostatin-sn61(tnf-α:hydrostatin-sn61为1:100,n:n)能够竞争性抑制tnf-α与tnfr1的相互作用;如图10所示,且hydrostatin-sn61(tnf-α:hydrostatin-sn61为1:50,n:n)能竞争性抑制tnf-α与tnfr2的相互作用。
实施例3:hydrostatin-sn61对lps诱导小鼠骨髓来源的bmdm炎症因子的抑制作用
进一步采用lps诱导小鼠bmdm,检测hydrostatin-sn61对lps诱导炎症反应的抑制作用。
具体实施步骤为:取4周龄的雄性c57bl/6小鼠,颈部脱臼处死后,浸泡在75%的乙醇溶液中。在超净工作台内剪开小鼠后肢皮肤,并剥离至脚踝处。用眼科剪分离股骨末端和脚踝处,去除肌肉,取出小鼠的股骨和胫骨置于rmpi1640培养基中,用无菌注射器吸取rmpi1640培养基,将其中的骨髓组织冲出。将含有骨髓组织的rmpi1640培养基收集至50ml无菌离心管中,25℃,1000rpm离心5min。弃去上清。在沉淀中加入红细胞裂解液,重悬沉淀,静置3min,加入红细胞裂解液两倍体积的rmpi1640完全培养基,吹打混匀,25℃,1000rpm离心5min。弃去上清。加入1mlrmpi1640完全培养基,吹打重悬后,计数并稀释至1×106个细胞/ml,接种至12孔细胞培养孔板中,并在培养基中加入终浓度为20ng/mlm-csf诱导分化。第三天换液,第六天观察伸出伪足的贴壁细胞即为分化完成的bmdm。分化完成,终浓度1μg/ml的lps与终浓度分别为50μmol/l、100μmol/l、200μmol/l的hydrostatin-sn61混合后加入12孔板中。在细胞培养箱中孵育6h后,使用总rna极速抽提试剂盒抽提各组细胞总rna,并进行rt-pcr实验检测细胞炎症因子表达水平(图11),结果表明100μmol/l、200μmol/l的hydrostatin-sn61能显著抑制炎症因子tnf-α、il-1β、inos、il-6的mrna表达水平。
实施例4:hydrostatin-sn61对lps诱导小鼠骨髓来源的bmdm的tnfr1下游mapks信号通路磷酸化水平的影响
具体实验步骤为:根据实施例3获得bmdm单细胞悬液,稀释细胞浓度至2×106个细胞/ml,接种至6孔细胞培养孔板中。分化完成,终浓度1μg/ml的lps与终浓度分别为50μmol/l、100μmol/l、200μmol/l的hydrostatin-sn61混合后加入6孔板中。在细胞培养箱中孵育6h后,提取细胞总蛋白进行westernblot实验检测mapks信号通路的变化(图12),结果表明hydrostatin-sn61能够有效抑制由lps诱导bmdm的tnfr1下游mapks信号通路的激活。
实施例5:hydrostatin-sn61对小鼠lps诱导的急性休克动物模型作用
具体实验步骤为:选取6-8周的c57bl/6雄鼠(每组8只),腹腔注射lps(15mg/kg)诱导建立急性休克模型,并进行10μg/kg、50μg/kg和250μg/kg的hydrostatin-sn61干预,统计小鼠存活率并绘制生存曲线(图13)。结果表明:hydrostatin-sn6150μg/kg和250μg/kg能够有效缓解lps诱发的急性休克,提高小鼠的生存率。
实施例6:hydrostatin-sn61对il-10基因敲除小鼠结肠炎的作用
具体实施步骤为:选取6-8周龄雄性il-10基因敲除小鼠,随机分为5组,每组包含6只小鼠。10mg/kg/d吡罗昔康灌胃给药加快自发性结肠炎发生,每日记录小鼠体重、状态,直至小鼠出现明显结肠炎症状(体重明显下降、直肠脱垂、腹泻、便血等)开始入组给药。正常组(normal)不做任何处理,其余各组均为腹腔给药。模型组(model)小鼠按照100μl/20g剂量注射生理盐水,阳性对照组英夫利昔单抗(ifx)给药剂量5mg/kg/d,hydrostatin-sn61组给药剂量400μg/kg/d,阴性对照组随机肽给药剂量400μg/kg/d。每日记录各组小鼠体重变化(图14),hydrostatin-sn61能够有效缓解结肠炎导致的体重下降。按照表1进行疾病活动指数(dai)评分,结果如图15所示,hydrostatin-sn61可有效缓解结肠炎小鼠腹泻、便血的症状,降低dai评分。于给药治疗40天后,颈椎脱臼处死小鼠,取出小鼠脾脏,测定脾重并计算脾脏指数,结果表明hydrostatin-sn61能够有效抑制结肠炎导致的脾脏肿胀(图16);提取结肠组织中的总rna,逆转录为cdna,rt-pcr技术检测炎症因子表达水平,结果表明hydrostatin-sn61能够降低促炎因子il-1β的mrna表达水平(图17);提取结肠组织总蛋白,进行westernblot检测mapks信号通路的变化,发现hydrostatin-sn61能抑制erk的磷酸化激活(图18);取结肠末端组织以10%福尔马林固定,组织切片,he染色后观察结肠变化,观察发现hydrostatin-sn61能够有效抑制il-10-/-小鼠自发性结肠炎的结肠病变(图19);观察小鼠结肠组织切片中的tnf-α表达量,同样验证了hydrostatin-sn61能减轻小鼠结肠组织炎症因子表达(图20)。
表1.dai评分标准
上述结果表明,hydrostatin-sn61能够有效治疗il-10-/-小鼠自发性结肠炎动物模型。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可作出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
序列表
<110>上海大学
<120>青环海蛇抗炎活性肽hydrostatin-sn61及其编码基因和在制药中的应用
<130>说明书,权利要求书
<160>4
<170>siposequencelisting1.0
<210>1
<211>36
<212>dna
<213>青环海蛇(hydrophiscyanocinctus)
<400>1
tcggatccccgagcatcacacctgactggaatacga36
<210>2
<211>12
<212>prt
<213>青环海蛇(hydrophiscyanocinctus)
<400>2
seraspproglyalaserhisleuthrglyilearg
1510
<210>3
<211>20
<212>dna
<213>人工序列(ggagctgtcgtattccagtc)
<220>
<223>ggagctgtcgtattccagtc
<400>3
ggagctgtcgtattccagtc20
<210>4
<211>20
<212>dna
<213>人工序列(ttggggagttctgggcaaat)
<400>4
ttggggagttctgggcaaat20
- 还没有人留言评论。精彩留言会获得点赞!