一种曲霉菌Aspergillussp.G12及其发酵制备异紫堇定碱的方法与流程
本发明涉及微生物代谢技术领域,具体涉及一种曲霉菌aspergillussp.g12及其发酵制备异紫堇定碱的方法。
背景技术:
曲霉属真菌(aspergillusspp.)隶属于曲霉目,自然界中分布极广,是引起霉腐的主要微生物之一,如:面包腐败、粮食霉变等,更有甚者,产生致癌性物质黄曲霉毒素。但是曲霉属菌也有有益的一面,如酿酒、酱油和豆酱等制作过程中,曲霉属产生大量有益物质如蛋白酶、衣康酸、柠檬酸等。由于在食品工业和医药生产中应用广泛,曲霉菌已经成为人们开发利用的重要真菌之一。
异紫堇定碱(isocorydine),又名异可利定,属于天然阿朴菲类生物碱,主要存在于植物中,如于樟科、马钱科、木兰科、芸香科、防己科、大戟科、小檗科、番荔枝科、毛茛科、马兜铃科、罂粟科等。异紫堇定碱具有抗菌、抗肿瘤、解痉镇痛、舒张血管、抗心律不齐、抗疟、抗氧化、等多种药理作用。国家食品药品监督管理局已于2010年批准异紫堇碱盐酸盐(盐酸异可利定片)作为解痉镇痛处方药用于胃、肠、胆、胰、子宫、血管痉挛所致的疼痛。
微生物代谢中会产生丰富的代谢产物,包括初级代谢产物和次级代谢产物,次级代谢产物往往结构复杂,其中包括大量具有生物活性的化合物。通过微生物发酵获取活性物质的技术在发酵工程技术在食品、医药、精细化学品、生物能源、生物材料以及生物质资源化方面发挥着重要作用,对国民经济所作的贡献令人瞩目。
目前,异紫堇定碱主要从植物中提取或化学合成方式制备得到,尚未见有其他制备方法得到异紫堇定碱的报道。
技术实现要素:
为了解决上述技术问题,本发明提供了一种曲霉菌aspergillussp.g12及其发酵制备异紫堇定碱的方法,本发明利用曲霉菌aspergillussp.g12固体发酵得到异紫堇定碱,且本发明制备异紫堇定碱的方法操作简单、绿色无污染、条件温和、易于产业化,制备得到的异紫堇定碱产量高。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种曲霉菌aspergillussp.g12,所述的曲霉菌aspergillussp.g12的保藏编号为cctccno:m2020128。
本发明还提供了一种利用上述的曲霉菌aspergillussp.g12发酵制备异紫堇定碱的方法,包括如下步骤:
1)将所述的曲霉菌aspergillussp.g12接到马铃薯葡萄糖种子培养基中培养,得到的种子培养液;
2)将得到的种子培养液接种于固体发酵培养基中,进行发酵培养,得到包括异紫堇定碱发酵产物。
优选地,上述制备异紫堇定碱的方法还包括如下步骤;
a)将得到的发酵产物用醇溶液浸泡、提取、过滤,得到滤液,干燥所述滤液得到异紫堇定碱的粗提物;
b)采用硅胶柱对所述异紫堇定碱的粗提物进行梯度洗脱分离,将含有异紫堇定碱的洗脱液合并,浓缩,得到浓缩液a,用凝胶柱柱层析纯化浓缩液a,收集层析液,将含有异紫堇定碱的层析液合并,得到组分b,干燥所述的组分b,得到纯品异紫堇定碱。
优选地,所述固体发酵培养基为马铃薯培养基;所述固体发酵培养基的制备方法包括将马铃薯去皮后切丁、灭菌获得所述固体发酵培养基。
优选地,所述发酵培养的时间为20~40天,所述发酵培养的温度为25~30℃。
优选地,步骤1)中,所述种子培养液的接种量为0.1~0.3ml/g。
优选地,所述醇溶液为体积分数为90~100%甲醇溶液或体积分数为90~95%乙醇溶液,所述浸泡的时间为10~15h,所述的提取方式为超声提取,所述超声提取的功率为200~250w,所述超声提取的频率35~45khz,所述超声提取的温度为35~45℃,所述超声提取的次数2~3次,所述超声提取的时间为25~35min/次。
优选地,所述的干燥为蒸发干燥。
优选地,所述的硅胶柱为开管闪式层析柱;所述的梯度洗脱过程依次用第一洗脱液、第二洗脱液洗脱、第三洗脱液和第四洗脱液进行洗脱;所述梯度洗脱的速率为4~8ml/min;所述的第一洗脱液为体积比为30:1的二氯甲烷:甲醇混合液,所述第一洗脱液的用量为250~350ml;所述第二洗脱液为体积比为10:1的二氯甲烷:甲醇混合液,所述第二洗脱液的用量为150~250ml;所述的第三洗脱液为体积比为8:1的二氯甲烷:甲醇混合液;所述第三洗脱液的用量为50~150ml;所述的第四洗脱液为体积比为5:1的二氯甲烷:甲醇混合液;所述第四洗脱液的用量为150~250ml。
优选地,所述tlc薄层层析法跟踪监测时的展开剂为体积比为8:1的二氯甲烷:甲醇混合溶液;所述的凝胶柱为sephadexlh-20,所述凝胶柱层析纯化时的洗脱过程为用300ml的100%甲醇洗脱液等度洗脱;所述洗脱的速率为1~1.5ml/min。
与现有技术相比,本发明技术方案的有益效果:
本发明提供了一种利用曲霉菌发酵制备异紫堇定碱的方法,通过采用曲霉菌aspergillussp.g12以固体发酵的方式得到异紫堇定碱,该制备方法设备要求低、操作简单、绿色无污染、条件温和、易于产业化,得到的异紫堇定碱产量高、纯度高。
生物保藏信息:
本发明所述曲霉菌aspergillussp.g12保藏于中国典型培养物保藏中心;保藏编号为cctccno:m2020128,保藏日期为2020年5月18日;保藏地址:湖北省武汉市武昌区八一路299号武汉大学校内,武汉大学保藏中心。
附图说明
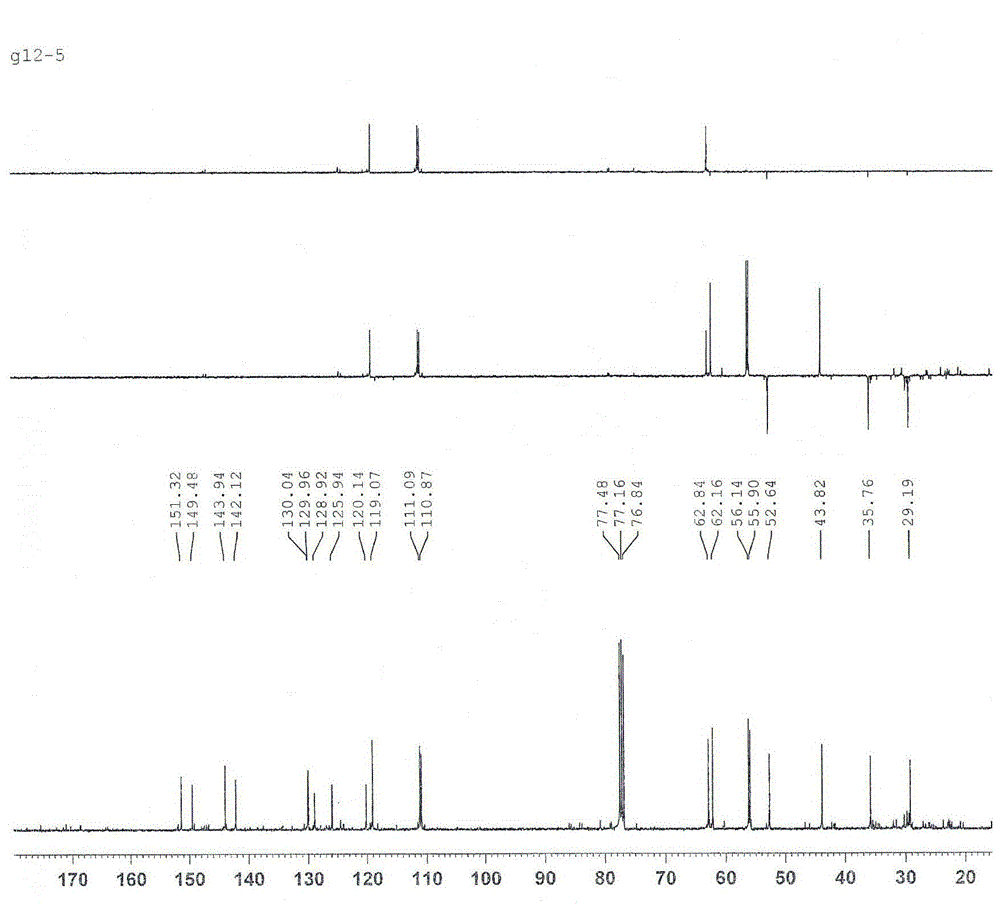
图1为发酵产物异紫堇定碱的13cnmr和dept谱;
图2为发酵产物异紫堇定碱的1hnmr谱;
图3为发酵产物异紫堇定碱的结构式。
具体实施方式
本发明提供了一种曲霉菌aspergillussp.g12,所述的曲霉菌aspergillussp.g12的保藏编号为cctccno:m2020128。
本发明还提供了一种利用上述的曲霉菌aspergillussp.g12发酵制备异紫堇定碱的方法,包括如下步骤:
1)将所述的曲霉菌aspergillussp.g12接到马铃薯葡萄糖种子培养基中培养,得到种子培养液;
2)将得到的种子培养液接种于固体发酵培养基中,进行发酵培养,得到包括异紫堇定碱的发酵产物。
在本发明所述的制备异紫堇定碱的方法中,在得到种子培养液前还包括曲霉菌aspergillussp.g12活化的步骤:将aspergillussp.g12接种至马铃薯葡萄糖琼脂(pda)培养基上,于28℃恒温培养中培养3~7d。本发明在所述活化后优选的立即进行种子培养步骤,或者将所述活化后的aspergillussp.g12置于4℃保存备用。
在本发明中,将曲霉菌aspergillussp.g12接到马铃薯葡萄糖种子培养基中培养,得到种子培养液。本发明中所述的培养方式优选为恒温振荡培养,所述恒温振荡培养的转速优选为110~140rpm,所述恒温震荡培养优选的在摇床中进行;所述恒温的温度为28℃;所述培养时间优选为3~7天,更优选为5天。
在本发明中,将得到的种子培养液接种于固体发酵培养基中,进行发酵培养,得到包括异紫堇定碱的发酵产物。在本发明中,所述的固体发酵培养基优选为马铃薯培养基;所述固体发酵培养的制备方法包括以下步骤:将马铃薯去皮后切丁、灭菌获得;所述的马铃薯去皮前还包括清洗的步骤,所述清洗优选为自来水洗,所述清洗的次数优选为3次,所述清洗的时间1min/次;所述去皮的方式优选为去皮刀去皮;所述切丁方式优选为手动切丁,所述切丁的尺寸优选为0.2~0.8cm3,更优选为0.3cm3;所述的灭菌温度优选为121℃,所述的灭菌时间优选为30min。在本发明中,所述发酵培养的时间优选为20~40天,更优选为30天,所述发酵培养的温度优选为25~30℃,更优选为28℃,所述的种子培养液的接种量优选为0.1~0.3ml/g,更优选为0.2ml/g。
在本发明中,上述制备异紫堇定碱的方法优选的还包括如下步骤;
1)将得到的发酵产物用醇溶液浸泡、提取、过滤,得到滤液,干燥所述滤液得到异紫堇定碱的粗提物;
2)采用硅胶柱对所述异紫堇定碱的粗提物进行梯度洗脱分离,将含有异紫堇定碱的洗脱液合并,浓缩,得到浓缩液a,用凝胶柱柱层析纯化浓缩液a,收集层析液,将含有异紫堇定碱的层析液合并,得到组分b,干燥所述的组分b,得到纯品异紫堇定碱。
在本发明中,将得到的发酵产物用醇溶液浸泡、提取、过滤,得到滤液,所述的醇溶液优选为甲醇溶液或乙醇溶液;所述甲醇溶液的体积分数优选为90~100%,更优选为100%;所述乙醇溶液的体积分数优选为90~95%,更优选为95%;所述浸泡的时间优选为10~15h,更优选为12h。在本发明中,所述的提取方式优选为超声提取;所述超声提取的功率优选为200~250w,更优选为240w;所述超声提取的频率优选为35~45khz,更优选为40khz;所述超声提取的温度优选为35~45℃,更优选为40℃;所述超声提取的次数优选为2~3次,更优选为3次;所述超声提取的时间为25~30min/次,更优选为30min/次。
在本发明中,干燥所述滤液得到异紫堇定碱的粗提物,所述的干燥优选为蒸发干燥,所述的干燥温度优选为55℃,所述的干燥设备优选为旋转蒸发仪。
在本发明中,为了检测所述粗提物中是否存在异紫堇定碱,在将粗提取物梯度洗脱分离前还包括将所述粗提物经tlc薄层层析法检测的步骤,用改良dragendoff试剂显色,颜色为橙色,通过纯品异紫堇定碱检测,测得的rf值为0.60,检测所述粗提取物的rf值也为0.60,所述tlc薄层层析时采用的展开剂优选为体积比8:1的二氯甲烷:甲醇混合溶液。
在本发明中,采用硅胶柱对所述异紫堇定碱的粗提物进行梯度洗脱分离,所述的硅胶柱优选为开管闪式层析柱(φ26×150mm,200~300目层析用硅胶),所述的梯度洗脱过程依次用第一洗脱液、第二洗脱液洗脱、第三洗脱液和第四洗脱液进行洗脱;所述梯度洗脱的速率优选为4~8ml/min;所述的第一洗脱液优选为体积比30:1的二氯甲烷:甲醇混合液,所述第一洗脱液的用量优选为250~350ml,更优选为300ml;所述第二洗脱液优选为体积比10:1的二氯甲烷:甲醇混合液,所述第二洗脱液的用量优选为150~250ml,更优选为200ml;所述的第三洗脱液优选为体积比8:1的二氯甲烷:甲醇混合液;所述第三洗脱液的用量优选为50~150ml,更优选为100ml;所述的第四洗脱液优选为体积比5:1的二氯甲烷:甲醇混合液;所述第四洗脱液的用量优选为150~250ml,更优选为200ml。
在本发明中,在收集洗脱液后,将含有异紫堇定碱的洗脱液合并,浓缩得到浓缩液a前,还包括采用tlc薄层层析法跟踪监测所述的洗脱液的步骤,用改良dragendoff试剂显色,颜色为橙色,通过纯品异紫堇定碱检测,测得的rf值为0.60,检测所述洗脱液的rf值也为0.60,tlc薄层层析法跟踪监测时的展开剂优选为体积比8:1的二氯甲烷:甲醇混合溶液。
在本发明中,将含有异紫堇定碱的洗脱液合并,浓缩,得到浓缩液a,所述的浓缩采用旋转蒸发仪进行,浓缩至无溶剂。
在本发明中,用凝胶柱将浓缩液a柱层析纯化,所述的凝胶柱优选为sephadexlh-20,所述凝胶柱层析纯化时的洗脱过程为用200~400ml的100%甲醇洗脱液等度洗脱;所述洗脱的速率为1~1.5ml/min。
在本发明中,在收集层析液后,将含有异紫堇定碱的层析液合并,得到组分b前,还包括采用tlc薄层层析法跟踪监测所述的层析液的步骤,用改良dragendoff试剂显色,颜色为橙色,通过纯品异紫堇定碱检测,测得的rf值为0.60,检测所述层析液的rf值也为0.60;在本发明中,合并相同组分b,干燥所述的组分b,tlc薄层层析时,采用的展开剂优选为体积比8:1的二氯甲烷:甲醇混合溶液,所述的干燥优选为采用旋转蒸发仪蒸发干燥。
在本发明中,若无特殊说明,所有的原料组分均为本领域技术人员熟知的市售商品。
下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
本实施例提供了一种利用所述曲霉菌aspergillussp.g12发酵制备异紫堇定碱的方法,包括如下步骤:
(1)将曲霉菌aspergillussp.g12接种至马铃薯葡萄糖琼脂(pda)培养基上进行活化,于28℃恒温培养箱中培养5d后,得到活化后的菌种,置于4℃冰箱中备用;
(2)将活化的菌种接到马铃薯葡萄糖(pdb)种子培养基中,于28℃恒温摇床中培养5d,摇床的转速为140rpm,得到种子培养液;
(3)将得到的5ml种子培养液接种于50g马铃薯固体发酵培养基中,进行发酵培养,于28℃条件下培养30天,得到包括异紫堇定碱的发酵产物;
(4)将所述的50g发酵产物用50ml体积分数为100%甲醇溶液浸泡12h,在超声功率为240w、超声频率为40khz、超声温度为40℃的条件下,超声提取3次,超声提取的时间为30min/次,采用常压过滤,合并滤液,于55℃下采用旋转蒸发仪蒸干后得到粗提物;
(5)将所述粗提物经tlc薄层层析法检测,用改良dragendoff试剂显色,颜色为橙色,通过纯品异紫堇定碱检测,测得的rf值为0.60,检测所述粗提取物的rf值也为0.60,tlc薄层层析时采用的展开剂为体积比8:1的二氯甲烷:甲醇混合溶液,采用开管闪式层析柱(φ26×150mm,200~300目层析用硅胶)所述粗提物进行梯度洗脱分离,收集洗脱液,所述的梯度洗脱过程依次用第一洗脱液、第二洗脱液洗脱、第三洗脱液和第四洗脱液进行洗脱;所述梯度洗脱的速率为6ml/min;所述的第一洗脱液为体积比为30:1的二氯甲烷:甲醇混合液,所述第一洗脱液的用量为300ml;所述第二洗脱液为体积比为10:1的二氯甲烷:甲醇混合液,所述第二洗脱液的用量为200ml;所述的第三洗脱液为体积比为8:1的二氯甲烷:甲醇混合液;所述第三洗脱液的用量为100ml;所述的第四洗脱液为体积比为5:1的二氯甲烷:甲醇混合液;所述第四洗脱液的用量为200ml;采用tlc薄层层析法跟踪监测所述的洗脱液,展开剂为体积比为8:1的二氯甲烷:甲醇混合溶液,用改良dragendoff试剂显色,检测所述洗脱液的rf值为0.60,将含有异紫堇定碱的洗脱液合并,浓缩,采用旋转蒸发仪浓缩,浓缩至无溶剂,得到浓缩液a,用sephadexlh-20凝胶柱将浓缩液a柱层析纯化,凝胶柱层析纯化时的洗脱过程为用300ml的100%甲醇洗脱液等度洗脱,洗脱的速率为1.5ml/min,收集层析液,采用tlc薄层层析法跟踪监测所述的层析液,展开剂为体积比为8:1的二氯甲烷:甲醇混合溶液,用改良dragendoff试剂显色,检测所述洗脱液的rf值为0.60,将含有异紫堇定碱的层析液合并,得到组分b,于55℃下采用旋转蒸发仪干燥所述的组分b,得到纯品异紫堇定碱。
通过称量计算得到的异紫堇定碱90mg,纯度为95%,通过13cnmr(见图1)和1hnmr(见图2)鉴定为异紫堇定碱,化学结构参见附图3。
实施例2
本实施例提供了一种利用实施例1所述的曲霉菌aspergillussp.g12发酵制备异紫堇定碱的方法,包括如下步骤:
(1)将曲霉菌aspergillussp.g12接种至马铃薯葡萄糖琼脂(pda)培养基上进行活化,于28℃恒温培养箱中培养7d后,得到活化后的菌种,置于4℃冰箱中备用;
(2)将活化的菌种接到马铃薯葡萄糖(pdb)种子培养基中,于28℃恒温摇床中培养7d,摇床的转速为140rpm,得到种子培养液;
(3)将得到的5ml种子培养液接种于50g马铃薯固体发酵培养基中,进行发酵培养,于28℃条件下培养30天,得到包括异紫堇定碱的发酵产物;
(4)将所述的50g发酵产物用50ml体积分数为100%甲醇溶液浸泡12h,在超声功率为240w、超声频率为40khz、超声温度为40℃的条件下,超声提取3次,超声提取的时间为30min/次,采用常压过滤,合并滤液,于55℃下采用旋转蒸发仪蒸干后得到粗提物;
(5)将所述粗提物经tlc薄层层析法检测,用改良dragendoff试剂显色,颜色为橙色,通过纯品异紫堇定碱检测,测得的rf值为0.60,检测所述粗提取物的rf值也为0.60,tlc薄层层析时采用的展开剂为体积比8:1的二氯甲烷:甲醇混合溶液,采用开管闪式层析柱(φ26×150mm,200~300目层析用硅胶)所述粗提物进行梯度洗脱分离,收集洗脱液,所述的梯度洗脱过程依次用第一洗脱液、第二洗脱液洗脱、第三洗脱液和第四洗脱液进行洗脱;所述梯度洗脱的速率为6ml/min;所述的第一洗脱液为体积比为30:1的二氯甲烷:甲醇混合液,所述第一洗脱液的用量为300ml;所述第二洗脱液为体积比为10:1的二氯甲烷:甲醇混合液,所述第二洗脱液的用量为200ml;所述的第三洗脱液为体积比为8:1的二氯甲烷:甲醇混合液;所述第三洗脱液的用量为100ml;所述的第四洗脱液为体积比为5:1的二氯甲烷:甲醇混合液;所述第四洗脱液的用量为200ml;采用tlc薄层层析法跟踪监测所述的洗脱液,展开剂为体积比为8:1的二氯甲烷:甲醇混合溶液,用改良dragendoff试剂显色,检测所述洗脱液的rf值为0.60,将含有异紫堇定碱的洗脱液合并,浓缩,采用旋转蒸发仪浓缩,浓缩至无溶剂,得到浓缩液a,用sephadexlh-20凝胶柱将浓缩液a柱层析纯化,凝胶柱层析纯化时的洗脱过程为用300ml的100%甲醇洗脱液等度洗脱,洗脱的速率为1.5ml/min,收集层析液,采用tlc薄层层析法跟踪监测所述的层析液,展开剂为体积比为8:1的二氯甲烷:甲醇混合溶液,用改良dragendoff试剂显色,检测所述洗脱液的rf值为0.60,将含有异紫堇定碱的层析液合并,得到组分b,于55℃下采用旋转蒸发仪干燥所述的组分b,得到纯品异紫堇定碱。
通过称量计算得到的异紫堇定碱105mg,纯度为96%,通过tlc薄层层析分析,体积比8:1的二氯甲烷:甲醇混合溶液展开,用改良dragendoff试剂显色,rf值与实施例1中所得化合物相同,斑点颜色相同,鉴定为异紫堇定碱,化学结构参见附图3。
实施例3
本实施例提供了一种利用实施例1所述的曲霉菌aspergillussp.g12发酵制备异紫堇定碱的方法,包括如下步骤:
(1)将曲霉菌aspergillussp.g12接种至马铃薯葡萄糖琼脂(pda)培养基上进行活化,于28℃恒温培养箱中培养7d后,得到活化后的菌种,置于4℃冰箱中备用;
(2)将活化的菌种接到马铃薯葡萄糖(pdb)种子培养基中,于28℃恒温摇床中培养7d,摇床的转速为110rpm,得到种子培养液;
(3)将得到的5ml种子培养液接种于50g马铃薯固体发酵培养基中,进行发酵培养,于28℃条件下培养40天,得到包括异紫堇定碱的发酵产物;
(4)将所述的50g发酵产物用50ml体积分数为95%乙醇溶液浸泡12h,在超声功率为240w、超声频率为40khz、超声温度为40℃的条件下,超声提取3次,超声提取的时间为30min/次,采用常压过滤,合并滤液,于55℃下采用旋转蒸发仪蒸干后得到粗提物;
(5)将所述粗提物经tlc薄层层析法检测,用改良dragendoff试剂显色,颜色为橙色,通过纯品异紫堇定碱检测,测得的rf值为0.60,检测所述粗提取物的rf值也为0.60,tlc薄层层析时采用的展开剂为体积比8:1的二氯甲烷:甲醇混合溶液,采用开管闪式层析柱(φ26×150mm,200~300目层析用硅胶)所述粗提物进行梯度洗脱分离,收集洗脱液,所述的梯度洗脱过程依次用第一洗脱液、第二洗脱液洗脱、第三洗脱液和第四洗脱液进行洗脱;所述梯度洗脱的速率为8ml/min;所述的第一洗脱液为体积比为30:1的二氯甲烷:甲醇混合液,所述第一洗脱液的用量为350ml;所述第二洗脱液为体积比为10:1的二氯甲烷:甲醇混合液,所述第二洗脱液的用量为250ml;所述的第三洗脱液为体积比为8:1的二氯甲烷:甲醇混合液;所述第三洗脱液的用量为150ml;所述的第四洗脱液为体积比为5:1的二氯甲烷:甲醇混合液;所述第四洗脱液的用量为250ml;采用tlc薄层层析法跟踪监测所述的洗脱液,展开剂为体积比为8:1的二氯甲烷:甲醇混合溶液,用改良dragendoff试剂显色,检测所述洗脱液的rf值为0.60,将含有异紫堇定碱的洗脱液合并,浓缩,采用旋转蒸发仪浓缩,浓缩至无溶剂,得到浓缩液a,用sephadexlh-20凝胶柱将浓缩液a柱层析纯化,凝胶柱层析纯化时的洗脱过程为用300ml的100%甲醇洗脱液等度洗脱,洗脱的速率为1.3ml/min,收集层析液,采用tlc薄层层析法跟踪监测所述的层析液,展开剂为体积比为8:1的二氯甲烷:甲醇混合溶液,用改良dragendoff试剂显色,检测所述洗脱液的rf值为0.60,将含有异紫堇定碱的层析液合并,得到组分b,于55℃下采用旋转蒸发仪干燥所述的组分b,得到纯品异紫堇定碱。
通过称量计算得到的异紫堇定碱108mg,纯度为95%,通过tlc薄层层析分析,体积比8:1的二氯甲烷:甲醇混合溶液展开,用改良dragendoff试剂显色,rf值与实施例1中所得化合物相同,斑点颜色相同,鉴定为异紫堇定碱,化学结构参见附图3。
实施例4
本实施例提供了一种利用实施例1所述的曲霉菌aspergillussp.g12发酵制备异紫堇定碱的方法,包括如下步骤:
(1)将曲霉菌aspergillussp.g12接种至马铃薯葡萄糖琼脂(pda)培养基上进行活化,于28℃恒温培养箱中培养5d后,得到活化后的菌种,置于4℃冰箱中备用;
(2)将活化的菌种接到马铃薯葡萄糖(pdb)种子培养基中,于28℃恒温摇床中培养5d,摇床的转速为110rpm,得到种子培养液;
(3)将得到的25ml种子培养液接种于100g马铃薯固体发酵培养基中,进行发酵培养,于28℃条件下培养40天,得到包括异紫堇定碱的发酵产物;
(4)将所述的100g发酵产物用50ml体积分数为95%乙醇溶液浸泡12h,在超声功率为240w、超声频率为40khz、超声温度为40℃的条件下,超声提取3次,超声提取的时间为30min/次,采用常压过滤,合并滤液,于55℃下采用旋转蒸发仪蒸干后得到粗提物;
(5)将所述粗提物经tlc薄层层析法检测,用改良dragendoff试剂显色,颜色为橙色,通过纯品异紫堇定碱检测,测得的rf值为0.60,检测所述粗提取物的rf值也为0.60,tlc薄层层析时采用的展开剂为体积比8:1的二氯甲烷:甲醇混合溶液,采用开管闪式层析柱(φ26×150mm,200~300目层析用硅胶)硅胶柱所述粗提物进行梯度洗脱分离,收集洗脱液,所述的梯度洗脱过程依次用第一洗脱液、第二洗脱液洗脱、第三洗脱液和第四洗脱液进行洗脱;所述梯度洗脱的速率为8ml/min;所述的第一洗脱液为体积比为30:1的二氯甲烷:甲醇混合液,所述第一洗脱液的用量为350ml;所述第二洗脱液为体积比为10:1的二氯甲烷:甲醇混合液,所述第二洗脱液的用量为250ml;所述的第三洗脱液为体积比为8:1的二氯甲烷:甲醇混合液;所述第三洗脱液的用量为150ml;所述的第四洗脱液为体积比为5:1的二氯甲烷:甲醇混合液;所述第四洗脱液的用量为250ml;采用tlc薄层层析法跟踪监测所述的洗脱液,展开剂为体积比为8:1的二氯甲烷:甲醇混合溶液,用改良dragendoff试剂显色,检测所述洗脱液的rf值为0.60,将含有异紫堇定碱的洗脱液合并,浓缩,采用旋转蒸发仪浓缩,浓缩至无溶剂,得到浓缩液a,用sephadexlh-20凝胶柱将浓缩液a柱层析纯化,凝胶柱层析纯化时的洗脱过程为用300ml的100%甲醇洗脱液等度洗脱,洗脱的速率为1.3ml/min,收集层析液,采用tlc薄层层析法跟踪监测所述的层析液,展开剂为体积比为8:1的二氯甲烷:甲醇混合溶液,用改良dragendoff试剂显色,检测所述洗脱液的rf值为0.60,将含有异紫堇定碱的层析液合并,得到组分b,于55℃下采用旋转蒸发仪干燥所述的组分b,得到纯品异紫堇定碱。
通过称量计算得到的异紫堇定碱130mg,纯度为93%,通过tlc薄层层析分析,体积比8:1的二氯甲烷:甲醇混合溶液展开,用改良dragendoff试剂显色,rf值与实施例1中所得化合物相同,斑点颜色相同,鉴定为异紫堇定碱,化学结构参见附图3。
实施例5
本实施例提供了一种利用实施例1所述的曲霉菌aspergillussp.g12发酵制备异紫堇定碱的方法,包括如下步骤:
(1)将曲霉菌aspergillussp.g12接种至马铃薯葡萄糖琼脂(pda)培养基上进行活化,于28℃恒温培养箱中培养5d后,得到活化后的菌种,置于4℃冰箱中备用;
(2)将活化的菌种接到马铃薯葡萄糖(pdb)种子培养基中,于28℃恒温摇床中培养5d,摇床的转速为125rpm,得到种子培养液;
(3)将得到的5ml种子培养液接种于50g马铃薯固体发酵培养基中,进行发酵培养,于28℃条件下培养20天,得到包括异紫堇定碱的发酵产物;
(4)将所述的50g发酵产物用50ml体积分数为90%甲醇溶液浸泡15h,在超声功率为200w、超声频率为35khz、超声温度为45℃的条件下,超声提取3次,超声提取的时间为25min/次,采用常压过滤,合并滤液,于55℃下采用旋转蒸发仪蒸干后得到粗提物;
(5)将所述粗提物经tlc薄层层析法检测,用改良dragendoff试剂显色,颜色为橙色,通过纯品异紫堇定碱检测,测得的rf值为0.60,检测所述粗提取物的rf值也为0.60,tlc薄层层析时采用的展开剂为体积比8:1的二氯甲烷:甲醇混合溶液,采用开管闪式层析柱(φ26×150mm,200~300目层析用硅胶)所述粗提物进行梯度洗脱分离,收集洗脱液,所述的梯度洗脱过程依次用第一洗脱液、第二洗脱液洗脱、第三洗脱液和第四洗脱液进行洗脱;所述梯度洗脱的速率为4ml/min;所述的第一洗脱液为体积比为30:1的二氯甲烷:甲醇混合液,所述第一洗脱液的用量为250ml;所述第二洗脱液为体积比为10:1的二氯甲烷:甲醇混合液,所述第二洗脱液的用量为150ml;所述的第三洗脱液为体积比为8:1的二氯甲烷:甲醇混合液;所述第三洗脱液的用量为50ml;所述的第四洗脱液为体积比为5:1的二氯甲烷:甲醇混合液;所述第四洗脱液的用量为150ml;采用tlc薄层层析法跟踪监测所述的洗脱液,展开剂为体积比为8:1的二氯甲烷:甲醇混合溶液,用改良dragendoff试剂显色,检测所述洗脱液的rf值为0.60,将含有异紫堇定碱的洗脱液合并,浓缩,采用旋转蒸发仪浓缩,浓缩至无溶剂,得到浓缩液a,用sephadexlh-20凝胶柱将浓缩液a柱层析纯化,凝胶柱层析纯化时的洗脱过程为用400ml的100%甲醇洗脱液等度洗脱,洗脱的速率为1ml/min,收集层析液,采用tlc薄层层析法跟踪监测所述的层析液,展开剂为体积比为8:1的二氯甲烷:甲醇混合溶液,用改良dragendoff试剂显色,检测所述洗脱液的rf值为0.60,将含有异紫堇定碱的层析液合并,得到组分b,于55℃下采用旋转蒸发仪干燥所述的组分b,得到纯品异紫堇定碱。
通过称量计算得到的异紫堇定碱85mg,纯度为95%,通过tlc薄层层析分析,体积比8:1的二氯甲烷:甲醇混合溶液展开,用改良dragendoff试剂显色,rf值与实施例1中所得化合物相同,斑点颜色相同,鉴定为异紫堇定碱,化学结构参见附图3。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!