一种海参肠肽及其制备方法和应用与流程
本发明属于生物技术
技术领域:
,尤其涉及一种海参肠肽及其制备方法和应用。
背景技术:
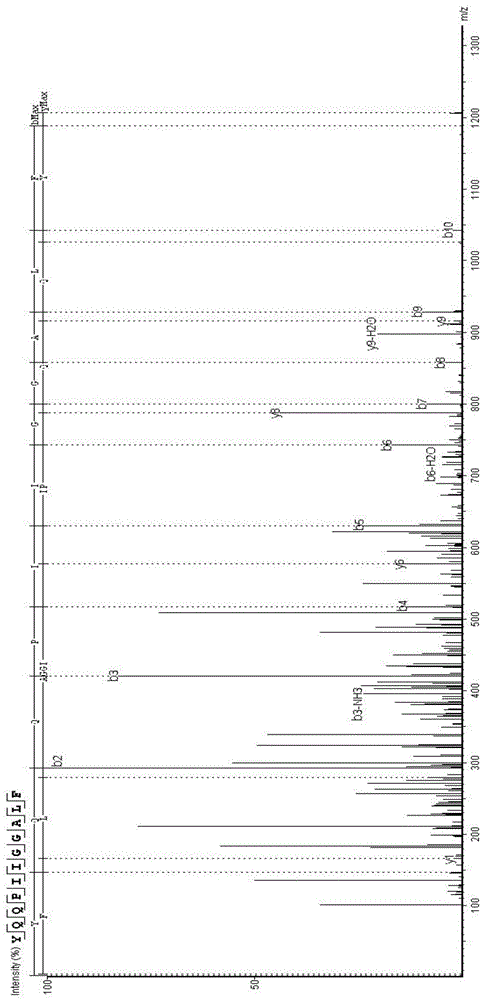
:海参肠卵中许多珍贵营养含量更高,如多糖、钒、核酸、精氨酸等,还含有极为丰富的性腺色素(β胡萝卜素、海胆紫酮、虾青素、玉米黄质、角黄素以及一些未知色素)、刺参脂质、刺参皂甙、硒、锌、铁等成分,具备较强的滋阴壮阳、改善消化系统微循环、增强心肌营养血液循环流量、抑制肿瘤细胞生长和扩散的功效。在现代生活环境的影响下,机体在环境污染、电脑辐射、自由基毒素、化学污染、遗传特性、内分泌失衡、免疫功能紊乱、致癌物质等一些致癌因素的作用下导致身体正常细胞发生癌变,目前治疗癌细胞的方法有很多,外科手术、放射治疗、化学药物治疗等,这些方法在治疗的同时也会把正常的细胞杀死,存在较强的不良反应。技术实现要素:有鉴于此,本发明的目的在于提供一种海参肠肽及其制备方法和应用,对乳腺癌和宫颈癌具有防治效果。为了实现上述发明目的,本发明提供了以下技术方案:本发明提供了一种海参肠肽,所述海参肠肽的氨基酸序列如seqidno.1所示。本发明还提供了上述技术方案所述的海参肠肽的制备方法,包括以下步骤:1)将海参肠与水混合,得到混合物,将所述混合物在50~55℃下处理50~70min,得到处理物;2)调节所述步骤1)得到的处理物的ph值为8.5,与碱性蛋白酶混合后在55~65℃下酶解2.5~3.5h,得到酶解物,调节所述酶解物的ph值为5,得到调节物;3)将所述步骤2)得到的调节物灭酶,得到灭酶物,将所述灭酶物在55~60℃下经活性炭吸附50~70min,再依次过30000da的陶瓷膜和1kd有机膜,干燥后,得到海参肠肽混合物;4)将所述步骤3)得到的海参肠肽混合物与水混合,得到混合液,将所述混合液经sephadexg-50层析柱分离纯化,收集保留时间为26.5min的组分,得到海参肠肽。优选的,所述步骤1)海参肠的质量与水的体积比为1000kg:2000l。优选的,所述步骤2)处理物与碱性蛋白酶的质量比为100:3。优选的,所述步骤1)水为无离子水。优选的,所述步骤4)分离纯化包括:流动相为体积百分含量为10%的甲醇溶液,流速为1ml/min。本发明还提供了上述技术方案所述的海参肠肽在制备抗肿瘤的药物中的应用。优选的,所述肿瘤包括乳腺癌和/或宫颈癌。本发明提供了一种海参肠肽,所述海参肠肽的氨基酸序列如seqidno.1所示。在本发明中,所述海参肠肽对乳腺癌和宫颈癌具有防治效果。附图说明图1为海参肠肽(yqqpiiggalf)液相色谱-qexactive质谱联用二级质谱图;图2为海参肠肽对于mcf-7细胞凋亡的作用;图3为海参肠肽对于hela细胞凋亡的作用;图4为海参肠肽对斑马鱼人乳腺癌(mcf-7)移植瘤的抑制作用表型图;图5为海参肠肽对斑马鱼人乳腺癌(mcf-7)移植瘤的抑制作用(荧光强度值总和),与模型对照组比较,***p<0.001;图6为海参肠肽对斑马鱼人乳腺癌(mcf-7)移植瘤,与模型对照组比较,***p<0.001。具体实施方式本发明提供了一种海参肠肽,所述海参肠肽的氨基酸序列如seqidno.1所示,具体如下:yqqpiiggalf。本发明还提供了上述技术方案所述的海参肠肽的制备方法,包括以下步骤:1)将海参肠与水混合,得到混合物,将所述混合物在50~55℃下处理50~70min,得到处理物;2)调节所述步骤1)得到的处理物的ph值为8.5,与碱性蛋白酶混合后在55~65℃下酶解2.5~3.5h,得到酶解物,调节所述酶解物的ph值为5,得到调节物;3)将所述步骤2)得到的调节物灭酶,得到灭酶物,将所述灭酶物在55~60℃下经活性炭吸附50~70min,再依次过30000da的陶瓷膜和1kd有机膜,干燥后,得到海参肠肽混合物;4)将所述步骤3)得到的海参肠肽混合物与水混合,得到混合液,将所述混合液经sephadexg-50层析柱分离纯化,收集保留时间为26.5min的组分,得到海参肠肽。本发明将海参肠与水混合,得到混合物,将所述混合物在50~55℃下处理50~70min,得到处理物。在本发明中,所述海参肠的质量与水的体积比优选为1000kg:2000l。在本发明中,所述水优选为去离子水。本发明将所述混合物在50~55℃下处理50~70min,优选在50~55℃下处理60min。本发明调节得到的处理物的ph值为8.5,与碱性蛋白酶混合后在55~65℃下酶解2.5~3.5h,得到酶解物,调节所述酶解物的ph值为5,得到调节物。本发明优选使用1m的氢氧化钠溶液调节处理物的ph值。在本发明中,所述处理物与碱性蛋白酶的质量比优选为100:3。在本发明中,所述酶解的时间优选为3h,所述酶解的温度优选为60℃。本发明优选使用1m的盐酸溶液调节酶解物的ph值。本发明将得到的调节物灭酶,得到灭酶物,将所述灭酶物在55~60℃下经活性炭吸附50~70min,再依次过30000da的陶瓷膜和1kd有机膜,干燥后,得到海参肠肽混合物。在本发明中,所述灭酶的温度优选为110℃,所述灭酶的时间优选为5min。在本发明中,所述干燥优选为喷雾干燥。本发明将得到的海参肠肽混合物与水混合,得到混合液,将所述混合液经sephadexg-50层析柱分离纯化,收集保留时间为26.5min的组分,得到海参肠肽。在本发明中,所述混合液中海参肠肽混合物的浓度优选为120mg/ml。在本发明中,所述sephadexg-50层析柱的规格为3×100cm。在本发明中,所述分离纯化的参数优选为:流动相为10%甲醇,流速为1ml/min,洗脱液214nm处测定吸光度。本发明还提供了上述技术方案所述的海参肠肽在制备抗肿瘤的药物中的应用。在本发明中,所述肿瘤优选包括乳腺癌和/或宫颈癌。本发明对所述药物的剂型没有特殊限定,采用海参肠肽在医学上可接受的剂型即可。下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。实施例1步骤一、海参肠肽的制备步骤一.取海参肠1000kg进行调浆,加入无离子水2000l,底物浓度为50%。步骤二.将步骤一的海参肠溶液搅拌均匀,并升温至55℃,保温1小时。步骤三.将步骤二的溶液用1mnaoh调ph至8.5,并升温至60℃。步骤四.将步骤三种的溶液加入3%的碱性蛋白酶(30kg),酶解3小时后加入1mhcl,调ph至5.0。步骤五.将步骤四中的溶液升温至110℃,保持5min。步骤六.将步骤五的灭酶溶液降温至55~60℃,加入活性炭,保温1小时后过30000da陶瓷膜,然后过1kd有机膜,喷雾干燥,得到海参肠肽混合物。步骤二、海参肠肽的分离纯化步骤一.将步骤一中生产的海参肠肽混合物加水溶解,配制成120mg/ml,采用sephadexg-50层析柱(3*100cm)进行分离纯化,流动相为10%甲醇,流速为1ml/min,洗脱液214nm处测定吸光度,按照色谱峰收集流份并将各流份浓缩后用真空干燥机冷冻干燥成粉。步骤二.将步骤一中所得到的不同组分利用斑马鱼肿瘤模型,验证不同组分的排铅效果,发现保留时间为26.5min的色谱峰具有良好的抗肿瘤效果。首先将此组分利用高效液相色谱进一步分离纯化,再进行结构鉴定。步骤三.纯度及结构的鉴定:采用纳升级液相色谱-qexactive质谱联用系统,对步骤一所得到的不同组分进行纯度和结构鉴定。色谱条件:(1)流动相:a相:100%纯净水+0.1%甲酸;b相:100%乙腈+0.1%甲酸;(2)流动相流速:300nl/min(3)进样量:1μl上清(4)流动相梯度程序:表1流动相梯度程序时间(分)02.036.038.041.042.045.0a(%)97976310109797b(%)3337909033利用纳升级液相色谱-qexactive质谱联用,鉴定其结构为yqqpiiggalf(tyr-gln-gln-pro-ile-ile-gly-gly-leu-phe)1206da的单链多肽,即为海参肠肽。图1。海参肠肽(yqqpiiggalf)的模拟体内消化反应人体摄入的海参肠肽(yqqpiiggalf)后,需要经过胃肠消化道才能被吸收利用;为此,展开了海参肠肽的体外消化稳定性测定,用胃蛋白酶和胰蛋白酶模拟胃肠道消化,将海参肠肽(1g)注入3ml0.1mol/l的磷酸缓冲液,加入6ml胃蛋白酶-瓜尔胶混合溶液,利用2mol/lhcl调ph至1.5,于37℃恒温水浴中磁力搅拌30min;将上述溶液中加入10ml磷酸缓冲液,利用naoh溶液调节ph为6.9;然后分别加入125μlmgcl2-cacl2、125μl胰酶,补水至50ml,于37℃摇床孵育120min。沸水浴灭酶,将样品于离心机以转速8000rpm离心10min取上清,将其冻干进行质谱分析,判断其经过胃肠道吸收后的稳定性。海参肠肽(yqqpiiggalf)在体外经过胃蛋白酶-胰蛋白酶消化酶解后,稳定性为91.28%,说明海参肠肽(yqqpiiggalf)在胃蛋白酶-胰蛋白酶作用下,不容易被酶解破坏。实施例2海参肠肽对肿瘤细胞的抑制作用采用科学研究中常见的两种人乳腺癌细胞株(mcf-7和mda-mb-231)和人宫颈癌细胞株(hela)为研究对象,釆用mtt法研究实施例1得到的海参肠肽(yqqpiiggalf)对癌细胞生长抑制的影响,利用双染法通过流式细胞仪检测三种多肽对癌细胞调亡的影响;明确海参肠肽(yqqpiiggalf)在体外对于癌细胞的抑制作用。1.实验材料与方法1.1.实验材料1.1.1细胞株实验中所用的乳腺癌细胞株(mcf-7和mda-mb-231)和人宫颈癌细胞株(hela)均购自武汉国家生物典藏中心细胞资源中心。1.1.2主要试剂细胞培养基培养基,小牛血清,胎牛血清,青霉素(80万iu),链霉素(100万iu),胰蛋白酶,mtt,dmso(分析纯),白蛋白肽,w海参肠肽,m海参肠肽,细胞凋亡试剂盒。1.1.3主要仪器流式细胞仪,酶标仪(128-c),微量移液器,纯水器恒温水浴箱,4℃层析柜,负80℃冰箱,co2培养箱,超净工作台,台式离心机,低温高速离心机,恒温磁力搅拌器,恒温振96孔细胞培养板,12孔细胞培养板,微量天平,倒置显微镜。1.2.实验方法1.2.1灭菌将各种需要灭菌的仪器试剂,置于高压灭菌锅,灭菌40min后,等到锅内压力降到0时,再将已灭菌的仪器和试剂,取出置于烘箱中,烘干使用。1.2.2细胞培养将癌细胞株置于相应培养液中培养,加入10%灭活的胎牛血清,2mmol/ll-谷氨酰胺、100u/ml青霉素以及100u/ml链霉素后,在有5%co2的37℃培养箱中进行培养。1.2.3细胞传代本次选用的癌细胞属于贴壁细胞,长满培养瓶后,在超净台中,利用移液器将细胞瓶内的培养基吸弃,吸管往细胞瓶内吸2ml的pbs,润洗二遍后,弃去细胞内的pbs,再往细胞瓶内加入2ml的0.25%胰蛋白酶,晃动细胞瓶,保证胰蛋白酶与细胞均匀接触,拍打细胞瓶,置于37℃温箱消化1至2min后,将细胞放在倒置显微镜下进行观察,发现原贴壁细胞回缩,细胞间隙变大,待细胞大部分掉下来,加入2ml含10%fbs的培养基,中止消化。用移液器反复吹打瓶壁,使细胞从瓶壁上脱落,形成细胞悬液。800r/min离心5min后,弃去上清液,加入新的培养液,反复吹打,制成单细胞悬液后,调整细胞浓度,并取3×105细胞接种于25ml培养瓶中继续培养。实验选择处于对数生长期的细胞进行。1.2.4细胞冻存取对数生长期的癌细胞,消化离心后,每1×106个细胞,加入1ml的冻存液,制成单细胞的悬液,移入冻存管,1ml/管。事先在冻存管上,标明细胞种类、冻存时间及浓度等。进行冻存时,以1~10℃/min的速度冻存为宜,将冻存管先置于4℃4h后,再放入-20℃冰箱24h,然后投入到液氮中保存。1.2.5复苏细胞在无菌超净工作台中,往无菌细胞瓶中加入5ml培养基,将冻存在-80℃冰箱中的细胞株取出,置于37℃的水浴锅中,不断振摇,必须在1分钟内使冻存液彻底融化。取出冻存管,75%酒精擦洗消毒,在无菌条件下取出细胞悬液,注入培养基中,轻轻吹匀。再将细胞悬液转至1无菌离心管中,用1100rpm离心6min,弃去的上清液。所得细胞用5ml含10%小牛血清的培养基吹打,得到细胞悬液置于细胞瓶中,放置于37℃,5%co2培养箱中进行培养。1.2.6贴壁细胞悬液的制备培养足够数量的细胞后,胰蛋白酶使胃癌细胞脱壁、分散;取无血清培养液洗涤两次。苔酚蓝染色,测定活细胞率在95%以上,离心后,加入适量生理盐水重悬,配置成l×107细胞/ml细胞悬液备用。1.2.7mtt检测海参肠肽对肿瘤细胞体外增殖能力的影响1983年由mosmann等人为了检测细胞存活和生长,专门发明了一种技术方法,就是现在被称作四唑盐比色实验(mtt)的检测技术。mtt为黄色化合物,但是当它在细胞色素c和琥珀酸脱氢酶的作用下却可以生成蓝紫色的结晶,这些结晶就是甲臜(formazan)结晶,是由于mtt作用于线粒体的呼吸链,导致四唑(tetrazolium)环开裂而形成的。但是由于死细胞中的琥珀酸脱氢酶活力消失,因此不能将mtt还原,也就无法生成结晶。细胞中形成的蓝紫色的甲臜结晶能够被dmso所溶解,因此在一定的光波内,通过酶联免疫检测标本的od值,就可以借此推断出活细胞的数量。因此,mtt的结晶物形成数量与存活的细胞数在一定的范围内,是成正相关的。此法敏感,可靠,容易普及,因此在检测生物活性因子的活性、检测细胞的毒性、筛选抗肿瘤的药物时,都会大量的使用mtt检测方法。1.2.7.1取正处于对数期生长的三种癌细胞细胞2×105细胞/ml,计数并接种于无菌的96孔板上培养,每孔200μl,37℃,5%co2孵箱内培养24h。1.2.7.2药物组:加入100μl含不同浓度多肽(20、200、600mg/l)的培养液,每组均设3个平行孔;对照组:加入100μl的培养液,每组均设3个平行孔;加药后,将96孔板均置于37℃,含5%co2且湿度饱和的培养箱内,分别培养一定的时间(24h、48h、72h)。1.2.7.3培养达到相应的时间后,台式离心机以室温,1000r/min,离心10min,将上清吸弃后,再将含10%mtt的培养基100μl加入每孔中,并在37℃继续培养4h。1.2.7.4离心,弃上清,每个培养孔内均加入100μldmso,振荡10min溶解甲臜后,设定波长492nm,在酶标仪上测定各组光密度(od)值,校正波长设定为630nm。1.2.7.5计算细胞生长抑制率,应用spss软件logistic曲线回归计算ic50。细胞抑制率=(1-实验组od)/对照组od×100%。1.2.8.流式细胞仪进行细胞凋亡的检测凋亡试剂盒检测细胞凋亡的原理:细胞凋亡早期的改变发生在细胞膜的表面,这些改变之一就是磷脂酰丝氨酸(ps)从细胞膜内转移到膜外。annexin-v是种ca2+依赖的磷脂结合蛋白,其和ps的结合非常的紧密高效而且特异。因此,annexin-v可作为探针用来检测暴露在细胞外侧的磷脂酰丝氨酸。利用对ps有高度亲和力的annexin-v,将其标记上荧光素(如异硫氰酸荧光素fitc等)。ps转移到细胞膜外这一现象可以发生在坏死细胞中,而并不是凋亡所特有的。凋亡和细胞坏死,是细胞死亡的两种不同方式,它们的差别在于,细胞膜在前者的初始阶段是没有损坏的,而细胞膜在后者的早期,其完好性就已经损伤了。碘化丙锭(propidineiodide,pi)是一种不能透过完整细胞膜的核酸染料,但能够透过凋亡中晚期的细胞和死细胞的细胞膜而使细胞核红染。因此,将annexin-v与pi匹配使用,可将不同凋亡阶段的细胞、死细胞等区分开来。1.2.8.1取对数期生长的癌细胞(mcf-7与hela),1×106细胞/ml,加入不同浓度的多肽(20、200、1000mg/l),置37℃,5%co2培养箱中过夜,药物处理24h。1.2.8.2用0.25%胰酶消化细胞,收集各孔细胞,预冷pbs洗涤2次,制成单细胞悬液,细胞浓度为0.5-1×106/ml。1.2.8.3取100μl(约1×105个细胞)置于流式管中,加入经pi和fitc标记的annexin-v各5μl,混匀后,常温孵育。1.2.8.4每管中再加入1×bindingbuffer充分混合后,上流式细胞仪检测细胞凋亡的情况。2.实验结果2.1海参肠肽对肿瘤细胞体外增殖能力的影响如表2数据所示,mtt法检测结果显示,海参肠肽(yqqpiiggalf)对于癌细胞mcf-7、mda-mb-231和hela细胞株的生长都有一定的抑制作用,且抑制作用的强度基本与多肽浓度呈正相关性,且随着作用时间的延长,对于癌细胞的生长抑制作用越明显。(**,p<0.01)。其中海参肠肽(yqqpiiggalf)对两个乳腺癌细胞株mcf-7和mda-mb-231抑制作用最强,海参肠肽(yqqpiiggalf)对hela细胞株抑制作用最强,海参肠肽(未分离纯化)对三种癌细胞抑制作用相比较而言都较弱。表2多肽对癌细胞生长的抑制率2.2海参肠肽对肿瘤细胞凋亡的影响研究中,为了将处于不同凋亡时期的细胞区分开来,常常把pi和annexinv结合起来使用。在散点图的结果中,右下象限的散点代表了发生早期凋亡的细胞,右上象限的散点代表了细胞发生了坏死或者是晚期凋亡的细胞,左下象限则代表了活的细胞。海参肠肽对mcf-7和hela癌细胞株的凋亡促进作用分别如图2与图3所示,海参肠肽(yqqpiiggalf)和海参肠肽(未分离纯化)都能起到一定的促肿瘤细胞凋亡活性,其中海参肠肽(yqqpiiggalf)表现出了很强的促癌细胞凋亡活性,海参肠肽(未分离纯化)相比较而言活性较弱。因此该活性差异是由水解得到的yqqpiiggalf片段含量不同引起的,表明了海参肠肽片段(yqqpiiggalf)起到了促进肿瘤细胞凋亡的抗肿瘤作用。现有研究对海参肠肽的抗肿瘤作用主要关注点在海参皂苷与多糖上,且活性主要表现为抑制肿瘤细胞生长与周期,本发明显示海参肠肽片段(yqqpiiggalf)能够通过促进癌细胞凋亡起到抗肿瘤作用,学术意义与实际应用价值十分巨大。实施例3海参肠肽对于斑马鱼肿瘤模型的作用使用cm-dil标记人乳腺癌(mcf-7)细胞,以显微注射的方式移植到2dpf野生型ab品系斑马鱼卵黄囊内,每尾移植约300个细胞,建立斑马鱼人乳腺癌(mcf-7)移植模型。通过与阳性药物卡培他滨的抗肿瘤作用对比,发现海参肠肽片段(yqqpiiggalf)具有很好的抗肿瘤效果,要优于海参肠肽(未分离纯化)的抗肿瘤效果。抗肿瘤作用评价使用cm-dil标记人乳腺癌(mcf-7)细胞,以显微注射的方式移植到2dpf野生型ab品系斑马鱼卵黄囊内,每尾移植约300个细胞,建立斑马鱼人乳腺癌(mcf-7)移植模型;将注射了人乳腺癌(mcf-7)细胞的斑马鱼放置于35℃培养至3dpf。在显微镜下挑选出移植肿瘤细胞一致性较好的斑马鱼,随机分配至6孔板中,以水溶给药方法分别给予海参肠肽(yqqpiiggalf)27.8、83.3和250μg/ml浓度,供试品海参肠肽(未分离纯化)80μg/ml浓度,阳性对照药卡培他滨20μg/ml浓度,同时设置模型对照组,每孔(浓度组)30尾斑马鱼,每孔容量为3ml。将各实验(浓度)组斑马鱼继续置于35℃培养,2天后,用荧光显微镜拍照获取mcf-7移植瘤的荧光图片,尼康nis-elementsd3.10高级图像处理软件进行图像分析,计算癌细胞荧光强度,以荧光强度的统计学意义评价“3#”对斑马鱼人乳腺癌(mcf-7)细胞移植瘤的抑制作用,并用以下公式计算肿瘤抑制作用。根据移植瘤的生长抑制作用绘制浓度效应曲线;统计学分析采用方差分析和dunnett’st-检验,p<0.05为显著性差异;提供具有代表性的实验图谱。特别说明:野生型ab系斑马鱼本身并不产生红色荧光,cm-dil标记的细胞注射到斑马鱼卵黄囊后,在一定波长下能激发产生红色荧光,荧光强度总和与癌细胞的数量成正相关,荧光强度总和越大,癌细胞数量越多。抗肿瘤作用评价结果显示:阳性对照药卡培他滨在20μg/ml浓度下,斑马鱼人乳腺癌(mcf-7)移植瘤细胞荧光强度值总和为171709像素,与模型对照组比较(385517像素)p<0.001,肿瘤抑制作用为55%,显示卡培他滨对斑马鱼人乳腺癌(mcf-7)移植瘤的生长有明显的抑制作用。供试品海参肠肽(未分离纯化)80μg/ml浓度斑马鱼人乳腺癌(mcf-7)移植瘤细胞荧光强度值总和为217993像素,与模型对照组比较p<0.001,肿瘤抑制作用为43%,显示海参肠肽(未分离纯化)对斑马鱼人乳腺癌(mcf-7)移植瘤的生长有明显的抑制作用;海参肠肽(yqqpiiggalf)在27.8、83.3和250μg/ml浓度下,斑马鱼乳腺癌(mcf-7)移植瘤细胞荧光强度值总和分别为284622、193586和183401像素,与模型对照组比较p<0.001,肿瘤抑制作用分别为26%、50%和52%。提示海参肠肽(yqqpiiggalf)在本实验浓度条件下对斑马鱼人乳腺癌(mcf-7)细胞移植瘤具有明显的抑制作用,其瘤体明显小于模型对照组。详见表3、图4、图5和图6。表3海参肠肽对斑马鱼人乳腺癌(mcf-7)移植瘤的抑制作用(n=10)与模型对照组比较,***p<0.001.以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。序列表<110>中食都庆(山东)生物技术有限公司<120>一种海参肠肽及其制备方法和应用<160>1<170>siposequencelisting1.0<210>1<211>11<212>prt<213>人工序列(artificialsequence)<400>1tyrglnglnproileileglyglyalaleuphe1510当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1