一种基于RAA-LFD检测新冠病毒的方法与流程
本发明涉及新冠病毒检测技术领域,特别涉及一种基于raa-lfd检测新冠病毒的方法。
背景技术:
新型冠状病毒-严重急性呼吸综合征冠状病毒2(severeacuterespiratorysyndromecoronavirus2,sars-cov-2)是一种先前未在人类中发现的病原体,能在人与人之间迅速传播。covid-19尚无有效治疗药物,目前的手段主要是隔离治疗和对症支持。因此加强covid-19实验室病原学快速检测则是covid-19有效监测和诊断的关键。
核酸检测技术是最直接、最本质的病原学证据,是确诊sars-cov-2感染的“金标准”,优于其他临床表现、临床体征及ct检测等经验判读。目前用于检测sars-cov-2的常规方法是采用实时荧光rt-pcr(reversetranscription-polymerasechainreaction),该方法能够从鼻腔或咽拭子、痰液或支气管肺泡灌洗液中检测sars-cov-2。然而,实时荧光rt-qpcr成本高昂,花费昂贵(3-4h),需要大量的实验室基础设施和培训,妨碍了它们在资源有限的领域中的使用(例如在医疗设施落后地区或者港口、机场或车站等人流密集的防控一线的快速检测)。此外,长时间的过程增加了sars-cov-2进一步传播的风险,并阻碍了对所有潜在接触的广泛检测;高通量测序技术(high-throughputsequencing)又称“下一代”测序技术("next-generation"sequencingtechnology,ngs),是对包括新冠病毒在内的所有病原体以及病原体的全基因序列进行完整测序,并与已知病毒序列进行全序列比对分析来诊断sars-cov-2是否存在。尽管ngs具有很多优势,包括可以对病毒进化来源、致病病理机制和病毒变异情况进行研究与分析,但ngs技术的自身限制(耗时更长、需要昂贵的二代测序设备和严格的操作环境),注定了高通量测序技术也只能作为实时荧光rt-pcr的补充,更不适合作为一项应急的快速筛查方法。因此,无论是上述的那种方法,均不适合在条件相对贫乏的地区或单位进行即时检验(point-of-caretesting,poct)。
近年新发展起来的核酸等温扩增技术,主要有核酸依赖性扩增检测技术(nuclearacidsequence-basedamplification,nasba)、环介导等温扩增技术(loop-mediatedisothermalamplification,lamp)、依赖解旋酶dna恒温扩增技术(helicase-dependentisothermaldnaamplification,hda)、滚环核酸扩增技术(rollingcircleamplification,rca)、重组酶聚合酶扩增技术(recombinasepolymeraseamplification,rpa)、重组酶介导等温核酸扩增技术(recombinaseaidedamplification,raa)等。其基本原理均是模仿体内核酸复制机制,由各种蛋白酶参与反应,帮助dna聚合酶复制dna,以实现dna的等温扩增。与pcr相比,等温扩增技术使得核酸在恒温条件下得以扩增,摆脱了昂贵的热循环实验仪器,并且可在短时间内实现目的片段的指数扩增,使在多种非实验室条件下进行核酸扩增检测成为现实。目前,已经有研究人员尝试使用lamp技术去检测sars-cov-2。同样,为了解决这个问题,拟基于重组酶介导等温核酸扩增结合免疫侧流向技术建立一种新的检测sars-cov-2的poct方法,去满足资源不足的地区的临床应急快速检测。
技术实现要素:
本发明的目的在于提供一种基于raa-lfd检测新冠病毒的方法,,以解决上述背景技术中提出的问题。
为实现上述目的,本发明提供如下技术方案:
一种基于raa-lfd检测新冠病毒的方法,包括如下步骤:
步骤1:样本留取:采集样本,包括咽拭子、鼻拭子、鼻咽抽取物或呼吸道抽取物、深咳痰液、支气管灌洗液、肺泡灌洗液、血液标本、血清标本、粪便标本、眼结膜拭子;
步骤2:核酸提取:采用闪电核酸释放剂提取全血、血清、血浆、尿液、唾液、口腔拭子、鼻咽拭子、细胞悬液等样品的核酸(rna);
步骤3:标准质粒构建:新冠病毒covid-19n基因全序列的重组质粒2019-ncovn全长质粒v2,以紫外分光光度计测量重组质粒od260、od280及od260/od280值,并重复3次,确定质粒dna浓度和纯度,按照梯度稀释:1×108拷贝/μl至1×101拷贝/μl,-20℃保存备用;
步骤4:以新冠病毒covid-19n基因作为靶基因,分析新冠病毒covid-19n基因的序列特点后,应用primerpremier5.0软件设计种属特异性扩增引物;
步骤5:使用raa核酸扩增试剂盒进行raa反应体系的配制;
步骤6:raa反应结束后,打开eppendorf管,吸取扩增产物至一新的eppendorf管中,做好标记,并稀释50倍,马上进行试纸条检测;
步骤7:利用试剂盒进行raa扩增和试纸条检测,获得产品的检测下限为1×101拷贝/μl;
步骤8:以超纯水作为阴性对照,以1×100拷贝/μl、1×101拷贝/μl、1×102拷贝/μl、重组质粒为模板,进行3次平行试验。
进一步地,步骤4中与相近的物种冠状病毒序列做比对,包括sars-cov、hcov-229e、hcov-u1、hcov-nl63和hcov-oc43。
进一步地,步骤4探针序列位于扩增引物中间区段,经四氢呋喃修饰。
进一步地,步骤5加样顺序为阴性质控样本、待检样本,每个样本添加完毕后均需立即扣好管盖。
进一步地,步骤7在初始模板为1×103~1×106拷贝/μl的情况下,试纸条显色速度很快,从试纸条插入pcr反应管,至条带显色不超过3分钟。
与现有技术相比,本发明的有益效果是:本发明基于raa-lfd技术,相较于其他分子诊断方法,此方法检测灵敏度高,操作简便快速,无需专门设备,结果准确可以满足临床样本的检测,特别适合资源匮乏地区或机场、学校等单位的流动应急检测。
附图说明
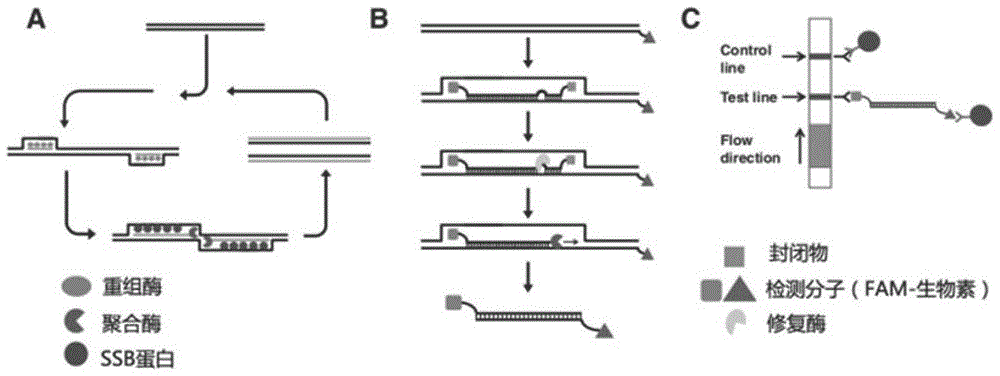
图1为本发明重组酶介导等温核酸扩增技术侧流免疫技术的原理图;
图2为本发明探针和引物位置的示意图;
图3为本发明一次性核酸检测试纸条结构示意图;
图4为本发明一次性核酸检测试纸条结果判读示意图;
图5为本发明新冠病毒核酸试纸条检测体系灵敏度及特异性示意图;
图6为本发明新冠病毒核酸试纸条检测体系扩增精密性和重复性示意图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
重组酶介导等温核酸扩增技术侧流免疫技术(recombinaseaidedamplification-lateralflowdevice,raa-lfd),是指将重组酶介导等温核酸扩增技术(raa)结合侧向流动免疫试纸条(lfd)的一种联用技术,其原理如图1所示:用带生物素标记的sars-cov-2特异性引物和fam(6-羧基荧光激素)标记的探针与靶核酸进行扩增反应,最终形成同时带有fam基团和生物素标记的扩增子。lfd前端带有fam抗体的纳米金粒,检测线上带有生物素抗体,将产物滴到试纸条上,扩增子上的fam基团与fam抗体反应,检测线处的生物素抗体与扩增子上的生物素结合。最终,检测线上显示深紫色条带,未被捕获的产物与质控线线处的特异性抗体结合显示深紫色条带。其中,a:双向引物重组酶聚合酶扩增;b:探针与靶核酸进行扩增反应;c:流免疫技术检测。具体包括如下步骤:
步骤1:样本留取:按照《新型冠状病毒肺炎实验室检测技术指南》(第四版)采集样本,包括咽拭子、鼻拭子、鼻咽抽取物或呼吸道抽取物、深咳痰液、支气管灌洗液、肺泡灌洗液、血液标本、血清标本、粪便标本、眼结膜拭子;
步骤2:核酸提取:采用闪电核酸释放剂(通用型)提取全血、血清、血浆、尿液、唾液、口腔拭子、鼻咽拭子、细胞悬液等样品的核酸(rna);
步骤3:标准质粒构建:新冠病毒covid-19n基因全序列的重组质粒2019-ncovn全长质粒v2(1μg质粒拷贝数:2.454×1011),以紫外分光光度计测量重组质粒od260、od280及od260/od280值,并重复3次,确定质粒dna浓度和纯度,按照梯度稀释:1×108拷贝/μl至1×101拷贝/μl,-20℃保存备用;
步骤4:新冠病毒的n基因部分序列扩增引物和探针设计:以新冠病毒covid-19n基因作为靶基因,分析新冠病毒covid-19n基因的序列特点后(与相近的物种冠状病毒序列做比对,包括sars-cov、hcov-229e、hcov-u1、hcov-nl63和hcov-oc43),应用primerpremier5.0软件设计种属特异性扩增引物。探针序列位于扩增引物中间区段,经四氢呋喃修饰。引物设计遵循以下原则。①扩增引物长度约20~30bp,不同引物的pcr退火温度尽可能一致或相似;②扩增产物长度约200~500bp,具物种特异性;③探针长度约为45~60bp;使用美国国家生物技术信息中心(ncbi)的blast功能对引物扩增区段序列进行比对,完成引物扩增特异性的初步鉴定。通过鉴定的引物合成,纯度级别为hplc。引物具体序列、探针及扩增下游引物标记情况、扩增片段大小详细见图2和表1;
表1新冠病毒covid-19n基因raa扩增引物序列
步骤5:rt-raa反应体系及反应时间:使用raa核酸扩增试剂盒(试纸条法)(jy0204)按照表2进行raa反应体系的配制(单个样品/反应)。加样顺序为阴性质控样本、待检样本(梯度稀释的重组质粒),每个样本添加完毕后均需立即扣好管盖,避免气溶胶污染。最后将反应管放置在39℃条件下反应25min;
表2.raa反应体系
步骤6:lfd操作:raa反应结束后,打开eppendorf管,吸取扩增产物至一新的eppendorf管中,做好标记,并稀释50倍,马上进行试纸条检测。试剂条结构见图3:lfd操作步骤如下:将试纸条的浸液区端(标示蓝色箭头向上)插入eppendorf管,液面不得超过浸液区的max指示线,待判读区域全部浸润(约需30-60sec),将试纸平放1min,等待红色条带出现。根据试纸条显色情况直接读取检测结果。10min内观察结果,10min后判读无效,图3中a表示吸液区,b表示质控线,c表示检测线,d表示浸液区。实验判断标准见图4。每个测试样品至少出现一条质控线,有或无检测线(图2)。阴性对照仅出现一条红线(在质控线c)。阳性对照出现两条红线,一条位于检测线(t),另一条位于质控线(c)。仅在质控线出现一条红线,表明样品中无新冠病毒,或其拷贝数低于试剂盒最低检测限。出现两条红线,一条位于检测线(t),另一条位于质控线(c),表示样品中存在新冠病毒。无红色条带出现,表明核酸试纸条失效。
步骤7:敏感性及特异性:利用试剂盒进行raa扩增和试纸条检测,获得产品的检测下限为1×101拷贝/μl。在初始模板为1×103~1×106拷贝/μl的情况下,试纸条显色速度很快,从试纸条插入pcr反应管,至条带显色不超过3分钟。当初始模板拷贝数为1×101~1×102拷贝/μl的情况下,阳性样品的t线显色时间与高拷贝数一致,仅条带略浅,整个检测过程也仅需3分钟即可完成。同时以健康人口腔拭子(—1)、健康人鼻咽拭子(—2)和超纯水(—3)作为阴性对照的情况下,试纸条的检测结果均显示为阴性(图5),图5表示新冠病毒核酸试纸条检测体系灵敏度及特异性(其中阴性1~3的扩增初始模板分别为健康人口腔拭子、健康人鼻咽拭子和超纯水);
步骤8:精密性和重复性试验:以超纯水作为阴性对照,以1×100拷贝/μl、1×101拷贝/μl、1×102拷贝/μl、重组质粒为模板,进行3次平行试验(a、b和c)。本检测体系均可稳定检测初始模板低至1×101拷贝/μl的raa扩增产物,且保证阴性对照无假阳性,检测结果稳定可靠(图6)。
重组酶介导等温核酸扩增技术侧流免疫技术(recombinaseaidedamplification-lateralflowdevice,raa-lfd),是指将重组酶介导等温核酸扩增技术(raa)结合侧向流动免疫试纸条(lfd)的一种联用技术。本发明基于raa-lfd技术,相较于其他分子诊断方法,此方法检测灵敏度高,操作简便快速,无需专门设备,结果准确可以满足临床样本的检测,特别适合资源匮乏地区或机场、学校等单位的流动应急检测。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!