一种取代吲哚并氮杂酮类化合物及其制备方法和应用与流程
本发明涉及药物化学技术领域,更具体地,涉及一种取代吲哚并氮杂酮类化合物及其制备方法和应用。
背景技术:
环核苷酸磷酸二酯酶(cyclicnucleotidephosphodiesterases,pdes)是一类重要的超级酶家族,通过对camp和cgmp的水解,有效控制细胞内的camp和cgmp浓度,从而调节体内第二信使所传导的生化作用。pdes(pde1-pde11)在哺乳动物组织中分布广泛,其多样性致使不同的pde酶在细胞和亚细胞水平有着特定的分布,可选择性调节多种细胞功能,是良好的药物设计与治疗靶点。
磷酸二酯酶5型(pde5)作为对cgmp特异的pde家族,最先在老鼠的血小板中被分离并确认,之后在老鼠的肺中也被发现并纯化得到。人类pde5a主要分布在主动脉血管平滑肌细胞、心脏、胎盘、骨骼肌细胞、胰腺、血小板,大脑、肝脏、肺部也有极少量分布。男性阴茎海绵体中的pde5含量远高过其他pde家族。
pde5a抑制剂是pdes抑制剂开发中最成功者之一。西地那非(sildenafil,viagra)、他达那非(tadalafil,cialis)、伐地那非(vardenafil,levitra)、阿伐那非(avanafil,stendra)为治疗勃起功能障碍药物,且西地那非与他达那非之后分别于2005年、2009年批准作为新型靶向抗pah药物。此外,人们还发现pde5抑制剂可用于提高记忆能力、抗肿瘤、治疗肺部疾病、治疗心脏疾病等方面。尽管如此,现有的pde5a抑制剂具有不可忽视的副作用:如头痛、视力模糊、脸红、鼻粘膜充血、消化功能紊乱、肌肉疼痛等。另一方面,现有药物也可能对严重肝肾功能不全者造成较严重的不良反应。因此,开发新一代疗效强、副作用小的pde5选择性抑制剂具有重要的社会与经济意义。
技术实现要素:
本发明的目的在于提供一种取代吲哚并氮杂酮类化合物。本发明所述化合物结构新颖,对于磷酸二酯酶5型均表现出优异的抑制作用,可以作为磷酸二酯酶5型抑制剂进行使用,进而制备成为药物,治疗和/或预防与磷酸二酯酶5型相关的疾病,例如男性性功能障碍、肺动脉高压、肺纤维化、器官纤维化和肿瘤耐药等疾病。
本发明的另一目的在于提供所述取代吲哚并氮杂酮类化合物的制备方法。
本发明的再一目的在于提供所述取代吲哚并氮杂酮类化合物的应用。
本发明的上述目的是通过以下方案予以实现的:
一种取代吲哚并氮杂酮类化合物,具有式(i)所示的结构或其药学上可接受的盐:
其中r1选自氢、c1-6取代或非取代烷烃、c1-6取代或非取代环烷烃;
r2选自取代或非取代苄基、c1-6取代或非取代烷烃、c1-6取代或非取代环烷烃;
r3选自氢、氘、卤素、羟基、巯基、羧基、磺酸基、甲砜基、甲基亚砜基、c1-3取代或非取代烷氧基;
其中所述c1-6取代或非取代烷烃、c1-6取代或非取代环烷烃、c1-3取代或非取代烷氧基中的取代基为c1-3烷氧基、c1-3醚烷基、c1-3羧酸、c1-3羧酸酯、c1-3胺基或c1-3酰胺团;
所述取代或非取代苄基中的取代基为卤素、c1-3烷基、c1-3卤代烷基、c1-3烷氧基或c1-3卤代烷氧基中的一种或多种。
优选地,所述r1选自氢、c1-6烷烃、c1-6醚烃基、c1-6烷胺基、c1-5羧酸、c1-5羧酸酯、c1-5烷酰胺基;
所述r2选自取代或非取代苄基,其中的取代基为卤素、甲基、乙基、甲氧基、乙氧基中的一种或多种;
所述r3选自氢、氘、卤素、羟基、巯基、羧基、甲氧基、乙氧基、氟代甲氧基、氟代乙氧基、氯代甲氧基或氯代乙氧基。
优选地,所述r1选自氢、
优选地,所述r2选自
所述r3选自氢、氟、羟基、甲氧基或二氟甲氧基。
优选地,所述取代吲哚并氮杂酮类化合物的结构如下之一所示:
优选地,所述取代吲哚并氮杂酮类化合物药学上可接受的盐,为式(i)化合物与酸反应得到的产物。
优选地,所述酸为盐酸、磷酸、硫酸、醋酸、三氟乙酸、甲磺酸、氢氟酸、氢溴酸、乙酸、草酸、水杨酸、三氟甲磺酸、萘磺酸、马来酸、富马酸、柠檬酸、酒石酸、琥珀酸、苹果酸或谷氨酸。
本发明同时还保护所述取代吲哚并氮杂酮类化合物的制备方法,当r3为除c2-3取代或非取代烷氧基外时,包括如下步骤:
s1.化合物1在溶剂中于-30~40℃条件下与还原剂混合,-30~40℃反应,得到化合物2;
s2.化合物2在溶剂中与还原剂混合并在氢气的作用下,于0~60℃反应,得到化合物3;
s3.化合物3在溶剂中于-30~40℃条件下与碱性物质混合并反应0~2小时,然后加入卤代烃,逐步升温至25~100℃反应,得到化合物4;
s4.化合物4在溶剂中于-30~40℃条件下与碱性物质混合并反应0-2小时,然后加入卤代烃,逐步升温至25~100℃反应,得到化合物5;
s5.化合物5与酸性物质混合,然后升温至25~120℃反应,得到式(i)化合物;
当r3为c2-3取代或非取代烷氧基时,包括如下步骤:
s11.化合物1’在溶剂中于-30~40℃条件下与还原剂混合,-30~40℃反应,得到化合物2’;
s21.化合物2’在溶剂中与还原剂混合并在氢气的作用下,于0~60℃反应,得到化合物3’;
s31.化合物3’在溶剂中于-30~40℃条件下与碱性物质混合并反应0~2小时,然后加入卤代烃,逐步升温至25~100℃反应,得到化合物4’;
s41.化合物4’在溶剂中于-30~40℃条件下与碱性物质混合并反应0-2小时,然后加入卤代烃,逐步升温至25~100℃反应,得到化合物5’;
s51.化合物5’与酸性物质混合,然后升温至25~120℃反应,得到化合物6’;
s61.化合物6’在溶剂中于-30~40℃条件下与碱性物质混合并反应0-2小时,然后加入烷基化试剂,逐步升温至25~100℃反应,得到式(i)化合物;
,其中r4为异丙基、二苯甲基、二烷基甲基或二芳基甲基,所述二烷基甲基中的烷基为c1-5取代或非取代烷烃,所述二芳基甲基中的芳基为取代或非取代苯基。
优选地,上述步骤s1至s5中,s11至s61中所述溶剂为四氢呋喃、甲醇、乙醇、丙醇、异丙醇、乙腈、二甲基甲酰胺、二甲基乙酰胺、二甲基亚砜、六甲基膦酰三胺、n-甲基吡咯烷酮、二氯甲烷、氯仿、二氯乙烷、乙醚、乙酸乙酯、1,4-二氧六环、苯、甲苯或二甲苯中的一种或多种。
优选地,步骤s1和s11中的还原剂为硼氢化钠、硼氢化锂、硼氢化钾、三乙酰氧基硼氢化钠或氰基硼氢化钠中的一种或多种。
更优选地,步骤s1和s11中的反应温度为-10~10℃;步骤s1和s11中的还原剂选自硼氢化钠、硼氢化锂、硼氢化钾中的一种或多种;所述反应在甲醇、乙醇、丙醇或四氢呋喃中的一种或多种溶剂中进行。
优选地,步骤s2和s21中的还原剂为钯、钯碳、氢氧化钯、铂碳、二氧化铂或镍中的一种或多种。
更优选地,步骤s2和s21中的反应温度为35~55℃;步骤s2和s21中的还原剂选自钯碳、氢氧化钯、铂碳、二氧化铂、镍中的一种或多种;所述反应在甲醇、乙醇、丙醇或四氢呋喃中的一种或多种溶剂中进行。
优选地,步骤s3、s4、s31、s41、s61中的碱性物质分别为氢氧化钠、氢氧化钾、碳酸钾、碳酸钠、三乙胺、二异丙基乙基胺、叔丁醇钾、叔丁醇钠、氢化钠、双三甲硅基氨基锂、双三甲硅基氨基钠、双三甲硅基氨基钾或二异丙基氨基锂中的一种或多种。
优选地,步骤s3和s31中的初始温度为-10~10℃,反应温度为15~35℃;步骤s3和s31中的碱性物质选自叔丁醇钾、氢化钠、氢化钾、双三甲硅基氨基锂、双三甲硅基氨基钠、双三甲硅基氨基钾中的一种或多种;所述反应在二甲基甲酰胺、二甲基乙酰胺、二甲基亚砜、六甲基膦酰三胺、n-甲基吡咯烷酮或四氢呋喃中的一种或多种溶剂中进行。
优选地,步骤s4和s41中的初始温度为-10~10℃,反应温度为25~45℃;步骤s4和s41中的碱性物质选自叔丁醇钾、氢化钠、氢化钾、双三甲硅基氨基锂、双三甲硅基氨基钠、双三甲硅基氨基钾中的一种或多种;所述反应在二甲基甲酰胺、二甲基乙酰胺、二甲基亚砜、六甲基膦酰三胺、n-甲基吡咯烷酮、四氢呋喃中的一种或多种溶剂中进行。
优选地,步骤s5和s51中的酸性物质为多聚磷酸、三氯化铝、浓硫酸或乙酸酐中的一种或多种。
优选地,步骤s5s51中的反应温度为50~100℃;步骤s5s51中的酸性物质选自多聚磷酸、三氯化铝中的一种或多种;所述反应在无溶剂或甲苯、二甲苯中的一种或多种溶剂中进行。
优选地,步骤s61中的初始温度为-10~10℃,反应温度为15~35℃;步骤s61中的碱性物质选自氢氧化钠、氢氧化钾、叔丁醇钾、氢化钠、氢化钾、双三甲硅基氨基锂、双三甲硅基氨基钠、双三甲硅基氨基钾中的一种或多种;所述反应在二甲基甲酰胺、二甲基乙酰胺、二甲基亚砜、六甲基膦酰三胺、n-甲基吡咯烷酮或四氢呋喃中的一种或多种溶剂中进行。
所述取代吲哚并氮杂酮类化合物或其药学上可接受的盐作为磷酸二酯酶5型抑制剂的应用也在本发明的保护范围之类。
所述取代吲哚并氮杂酮类化合物或其药学上可接受的盐制备成为治疗磷酸二酯酶5型相关疾病的药物中的应用也在本发明的保护范围之类。
优选地,所述药物的剂型为口服型片剂、丸剂、胶囊、注射用注射液、粉针、经皮或皮下吸收剂。
优选地,所述磷酸二酯酶5型相关疾病为男性性功能障碍、肺动脉高压、肺纤维化、器官纤维化和/或肿瘤耐药等疾病。
与现有技术相比,本发明具有以下有益效果:
本发明所述取代吲哚并氮杂酮类化合物结构新颖,对于磷酸二酯酶5型均表现出优异的抑制作用,即本发明所述化合物可以作为磷酸二酯酶5型抑制剂进行使用,制备成为药物,治疗和/或预防由磷酸二酯酶5型引发的相关疾病,例如男性性功能障碍、肺动脉高压、肺纤维化、器官纤维化和肿瘤耐药等疾病。
本发明同时还提供了一种取代吲哚并氮杂酮类化合物的合成方法,采用硝基烯烃及卤代烃为起始原料,经还原、环合、烷基化及重排等反应获得终产物。本发明合成方法具有原料廉价易得、低毒,反应条件温和、操作安全、合成步骤简洁等优点。
附图说明
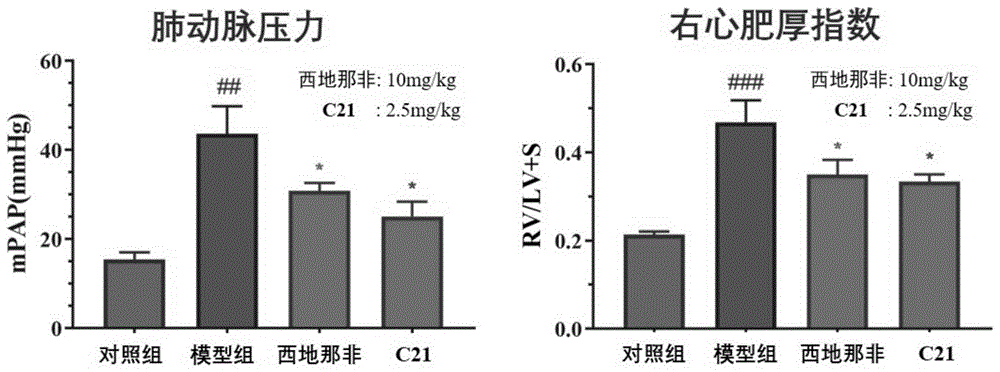
图1为化合物c21的抗肺动脉高压动物体内药效。
具体实施方式
下面结合具体实施例对本发明做出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
实施例1.化合物c1的合成
(1)中间体m1的合成
冰浴下,将硼氢化钠(57mg,1.5mmol)缓慢加入7-氟-3-(2-硝基乙烯基)-1h-吲哚-4-甲酸甲酯(264mg,1.0mmol)的10ml无水四氢呋喃溶液中,然后缓慢滴入3.0ml甲醇,冰浴条件下反应1小时。反应结束后,加入饱和氯化铵溶液淬灭反应,体系浓缩除去大部分有机溶剂,然后用乙酸乙酯萃取,有机相用无水硫酸钠干燥,柱层析分离获得中间体m1(165mg),白色固体,产率62%。1hnmr(400mhz,cdcl3)δ8.56(s,1h),7.84(dd,j=8.4,5.2hz,1h),7.25(d,j=2.5hz,1h),6.95(dd,j=9.9,8.5hz,1h),4.73(t,j=6.5hz,2h),3.96(s,3h),3.71(t,j=6.5hz,2h)。
(2)中间体m2的合成
将中间体m1(266mg,1.0mmol)溶于10ml甲醇中,加入pd/c(30mg),在氢气条件下45℃搅拌过夜。反应结束后,体系用硅藻土过滤、甲醇洗涤,滤液经柱层析分离获得中间体m2(118mg),白色固体,产率58%。1hnmr(400mhz,dmso)δ8.00(t,j=5.0hz,1h),7.65(dd,j=8.3,4.9hz,1h),7.32(s,1h),6.98(dd,j=11.0,8.3hz,1h),3.86(s,1h),3.08(dd,j=12.5,6.3hz,1h),2.92(s,2h),2.82(dd,j=13.9,7.2hz,1h)。
(3)中间体m3的合成
冰浴、干燥管保护下,将中间体m2(102mg,0.5mmol)溶于n,n-二甲基甲酰胺(3.0ml)中,往体系中缓慢加入氢化钠(60%分散于矿物油,20mg,0.5mmol),反应30分钟后加入4-氟苄溴(95mg溶于1.0mln,n-二甲基甲酰胺),然后转入室温反应1小时。反应结束后,体系倒入冰水中淬灭反应,用乙酸乙酯萃取,无水硫酸钠干燥,柱层析分离获得中间体m3(133mg),白色固体,产率85%。1hnmr(400mhz,cdcl3)δ7.96(dd,j=8.4,4.6hz,1h),7.14(dd,j=8.5,5.4hz,2h),7.02(dd,j=11.8,5.2hz,2h),6.97(dd,j=7.7,4.4hz,2h),6.54(s,1h),5.44(s,2h),3.65–3.51(m,2h),3.08–3.01(m,2h)。
(4)终产物c1的合成
将中间体m3(156mg,0.5mmol)混匀于多聚磷酸(5.0ml)中,氩气保护下逐步升温至90℃反应3小时。反应结束后将体系倒入冰水混合溶液中,乙酸乙酯萃取,水、饱和氯化钠分别洗涤,无水硫酸钠干燥,柱层析分离获得产物c1(47mg),白色固体,产率30%。纯度:96%。1hnmr(400mhz,acetone-d6)δ10.83(s,1h),7.84(dd,j=8.3,4.9hz,1h),7.47(s,1h),7.30(dd,j=8.3,5.6hz,2h),7.04(t,j=8.8hz,2h),6.95–6.85(m,1h),4.18(s,2h),3.60(s,2h),2.99(s,2h).13cnmr(126mhz,acetone-d6)δ169.65,161.48(d,j=242.5hz),151.06(d,j=248.1hz),136.07,135.18(d,j=3.1hz),130.16(d,j=8.1hz),124.14(d,j=7.2hz),123.36(d,j=13.5hz),120.74,120.33,115.07(d,j=21.4hz),113.01,105.89(d,j=17.4hz),42.32,30.96,27.41。
实施例2.化合物c2的合成
(1)中间体m4的合成
将原料替换为m2与4-氯苄溴反应,按照实施例1的方法得到中间体m4,白色固体,产率85%。1hnmr(400mhz,dmso-d6)δ8.08(t,j=5.7hz,1h),7.68(dd,j=8.4,4.7hz,1h),7.50(s,1h),7.38(d,j=8.4hz,2h),7.15(d,j=8.4hz,2h),7.01(dd,j=12.4,8.4hz,1h),5.48(s,2h),3.40(dd,j=9.6,5.4hz,2h),2.93(s,2h)。
(2)终产物c2的合成
将原料替换为m4在多聚磷酸中反应,按照实施例1的方法得到终产物c2,白色固体,产率40%。纯度:97%。1hnmr(400mhz,dmso-d6)δ11.69(s,1h),7.99(t,j=5.4hz,1h),7.65(dd,j=8.3,4.8hz,1h),7.34(d,j=8.3hz,2h),7.26(d,j=8.3hz,2h),6.96(dd,j=10.7,8.5hz,1h),4.07(s,2h),3.39(s,2h),2.85(s,2h).13cnmr(126mhz,dmso-d6)δ169.40,150.96(d,j=247.7hz),138.60,136.29,131.32,130.61(2c),129.89(2c),128.88,123.94(d,j=6.7hz),123.19(d,j=13.4hz),121.06,112.88,106.25(d,j=17.1hz),42.25,31.29,27.57.hrms(esi)m/zcalcdc18h14n2ofcl[m+h]+239.0851,found329.0858。
实施例3.化合物c3的合成
(1)中间体m5的合成
将原料替换为m2与3,4-二氟苄溴反应,按照实施例1的方法得到中间体m5,白色固体,产率85%。1hnmr(400mhz,cdcl3)δ7.97(dd,j=8.4,4.6hz,1h),7.12(dt,j=10.0,8.3hz,1h),7.03–6.91(m,3h),6.88(dd,j=5.2,3.2hz,1h),6.54(s,1h),5.42(s,2h),3.62(dd,j=9.8,5.7hz,2h),3.13–2.97(m,2h)。
(2)终产物c3的合成
将原料替换为m5在多聚磷酸中反应,按照实施例1的方法得到终产物c3,白色固体,产率30%。纯度:99%。1hnmr(400mhz,cdcl3)δ8.49(s,1h),7.93(dd,j=8.0,4.8hz,1h),7.09(dd,j=18.2,8.4hz,1h),7.03–6.92(m,2h),6.90(dd,j=6.7,3.1hz,1h),6.60(s,1h),4.07(s,2h),3.62(s,2h),2.96(s,2h)。
实施例4.化合物c4的合成
(1)中间体m6的合成
将原料替换为7-甲氧基-3-(2-硝基乙烯基)-1h-吲哚-4-甲酸甲酯与硼氢化钠反应,按照实施例1的方法得到中间体m6,白色固体,产率60%。1hnmr(400mhz,cdcl3)δ8.54(s,1h),7.89(d,j=8.3hz,1h),7.16(d,j=2.4hz,1h),6.66(d,j=8.4hz,1h),4.73(t,j=6.6hz,2h),4.02(s,3h),3.94(s,3h),3.72(t,j=6.6hz,2h)。
(2)中间体m7的合成
将原料替换为m6在pd/c、氢气条件下反应,按照实施例1的方法得到中间体m7,白色固体,产率60%。
(3)中间体m8的合成
将原料替换为m7与4-氟苄溴反应,按照实施例1的方法得到中间体m8,白色固体,产率88%。1hnmr(400mhz,cdcl3)δ7.99(d,j=8.3hz,1h),7.08(dd,j=8.4,5.5hz,2h),6.99(t,j=8.6hz,2h),6.87(s,1h),6.74(d,j=8.3hz,1h),6.39(s,1h),5.56(s,2h),3.92(s,3h),3.59(d,j=3.6hz,2h),3.07–2.96(m,2h)。
(4)终产物c4的合成
将原料替换为m8在多聚磷酸中反应,按照实施例1的方法得到终产物c4,白色固体,产率30%。纯度:97%。1hnmr(400mhz,cdcl3)δ8.10(s,1h),7.98(d,j=8.4hz,1h),7.16(dd,j=8.4,5.5hz,2h),7.02(t,j=8.6hz,2h),6.73(d,j=8.4hz,1h),6.63(s,1h),4.08(s,2h),3.98(s,3h),3.63(dd,j=9.7,5.6hz,2h),3.03–2.95(m,2h).13cnmr(126mhz,dmso-d6)δ170.27,162.12,160.20,148.61,136.33(d,j=2.9hz),134.91,130.50(d,j=8.0hz),127.41,125.04,124.50,117.60,115.59,115.42,111.95,101.84,55.73,42.41,31.07,27.79.hrms(esi)m/zcalcdc19h17n2o2f2[m+h]-323.1201,found323.1201。
实施例5.化合物c5的合成
(1)中间体m9的合成
将原料替换为m7与4-氯苄溴反应,按照实施例1的方法得到中间体m9,白色固体,产率60%。1hnmr(400mhz,cdcl3)δ7.98(d,j=8.4hz,1h),7.27(d,j=8.4hz,2h),7.02(d,j=8.4hz,2h),6.87(s,1h),6.74(d,j=8.3hz,1h),6.41(s,1h),5.56(s,2h),3.90(s,3h),3.60(dd,j=9.3,5.2hz,2h),3.10–2.94(m,2h)。
(2)化合物c5的合成
将原料替换为m9在多聚磷酸中反应,按照实施例1的方法得到化合物c5,白色固体,产率51%。纯度:95%。1hnmr(500mhz,cdcl3)δ8.27(s,1h),7.96(d,j=8.3hz,1h),7.26(d,j=4.0hz,2h),7.10(d,j=8.3hz,2h),6.70(d,j=8.3hz,1h),6.50(s,1h),4.05(s,2h),3.96(s,3h),3.60(s,2h),2.95(s,2h).13cnmr(126mhz,cdcl3)δ171.60,148.56,136.65,132.62,132.52,129.82(2c),128.96(2c),127.33,125.82,125.21,116.65,113.11,102.10,55.50,43.05,31.76,27.52.hrms(esi)m/zcalcdc19h17n2o2cl2[m+h]+341.1051,found341.1047。
实施例6.化合物c6的合成
(1)中间体m10的合成
将原料替换为m7与4-溴苄溴反应,按照实施例1的方法得到中间体m10,白色固体,产率80%。
(2)化合物c6的合成
将原料替换为m10在多聚磷酸中反应,按照实施例1的方法得到化合物c6,白色固体,产率30%。纯度:99%。1hnmr(400mhz,cdcl3)δ8.09(s,1h),7.97(d,j=8.3hz,1h),7.43(d,j=8.3hz,2h),7.05(d,j=8.3hz,2h),6.71(d,j=8.4hz,1h),6.28(s,1h),4.04(s,2h),3.96(s,3h),3.60(dd,j=9.7,5.7hz,2h),2.98–2.92(m,2h).13cnmr(126mhz,dmso-d6)δ170.26,148.62,139.61,134.41,131.68(2c),130.98(2c),127.38,125.07,124.53,119.54,117.62,112.14,101.89,55.74,42.40,31.27,27.77。
实施例7.化合物c7的合成
(1)中间体m11的合成
将原料替换为m7与3-氯苄溴反应,按照实施例1的方法得到中间体m11,白色固体,产率80%。
(2)化合物c7的合成
将原料替换为m11在多聚磷酸中反应,按照实施例1的方法得到化合物c7,白色固体,产率28%。纯度:98%。13cnmr(126mhz,dmso-d6)δ170.22,148.63,142.69,134.20,133.40,130.74,128.58,127.50,127.32,126.50,125.10,124.56,117.64,112.23,101.95,55.75,42.41,31.49,27.78.。
实施例8.化合物c8的合成
(1)中间体m12的合成
将原料替换为m7与3-氯-4-甲氧基苄溴反应,按照实施例1的方法得到中间体m11,白色固体,产率86%。1hnmr(400mhz,cdcl3)δ8.01(s,1h),7.96(d,j=8.4hz,1h),7.19(d,j=2.1hz,1h),6.94(dd,j=8.5,2.1hz,1h),6.94(dd,j=8.5,2.1hz,1h),6.84(d,j=5.4hz,2h),6.73(d,j=8.4hz,1h),6.40(s,1h),5.48(s,2h),3.93(s,3h),3.85(s,3h),3.56(dd,j=9.7,5.6hz,2h),3.03–2.98(m,2h)。
(2)化合物c8的合成
将原料替换为m12在多聚磷酸中反应,按照实施例1的方法得到化合物c8,白色固体,产率30%。纯度:95%。1hnmr(400mhz,cdcl3)δ8.12(s,1h),7.97(d,j=8.3hz,1h),7.20(d,j=2.0hz,1h),7.02(dd,j=8.3,1.9hz,1h),6.86(d,j=8.4hz,1h),6.71(d,j=8.3hz,1h),6.41(s,1h),4.00(s,2h),3.96(s,3h),3.88(s,3h),3.61(s,2h),3.01–2.87(m,2h).13cnmr(126mhz,cdcl3)δ171.76,153.82,148.58,132.92,131.37,130.18(2c),127.68(2c),127.41,125.71,125.22,122.64,116.67,112.91,112.33,102.02,56.21,55.49,43.07,31.23,27.5.hrms(esi)m/zcalcdc20h19n2o3cl[m+h]+371.1157,found371.1144。
实施例9.化合物c9的合成
将化合物c5(68mg,0.2mmol)溶于0.5ml二氯甲烷中,室温下加入三溴化硼(100μl),加热至50℃反应4小时。反应结束后,将反应液倒入冰水中淬灭反应,乙酸乙酯萃取,饱和食盐水洗涤,有机相用无水硫酸钠干燥,柱层析分离得到产物c9(15mg),砖红色固体,产率23%。1hnmr(400mhz,dmso-d6)δ10.99(s,1h),10.11(s,1h),7.63(t,j=5.5hz,1h),7.52(d,j=8.1hz,1h),7.34(d,j=8.5hz,2h),7.26(d,j=8.5hz,2h),6.54(d,j=8.1hz,1h),4.02(s,2h),2.81(s,2h)。
实施例10.化合物c10的合成
将化合物c9(33mg,0.1mmol)溶于3.0ml乙腈:水=1:1的混合溶液中,冰浴下加入氢氧化钾(56mg,1.0mmol),待体系澄清后,滴加溴氟甲基膦酸二乙酯(0.5mmol)。转入室温反应15分钟。冰水淬灭反应,乙酸乙酯萃取,有机相用无水硫酸钠干燥,柱层析分离获得产物c10(23mg),白色固体,产率60%。纯度:99%。1hnmr(400mhz,acetone-d6)δ10.66(s,1h),7.83(d,j=8.3hz,1h),7.34(d,2h),7.31(d,j=4.5hz,2h),7.28,7.15,6.97(t,1h),7.23(s,1h),7.00(d,j=8.3hz,1h),4.22(s,2h),3.65–3.56(m,2h),3.01(s,2h).13cnmr(126mhz,acetone-d6)δ169.42,139.28,138.22,135.41,131.56,130.12(2c),128.80,128.45(2c),126.85,123.71,121.63,116.58(t,j=258.3hz),113.10,108.66,42.31,31.04,27.46.
实施例11.化合物c11的合成
(1)中间体m13的合成
室温下,将氢化钠(60%分散于矿物油,80mg,2.0mmol)溶于n,n-二甲基甲酰胺(2.0ml)中,然后将中间体m9(170mg,0.5mmol)的n,n-二甲基甲酰胺(1.0ml)溶液滴加入上述体系,滴加完毕后,转入40℃反应30分钟。然后再往体系中加入n,n-二甲胺基溴乙烷氢溴酸盐(291mg,1.25mmol)并于40℃反应过夜。反应结束后,将反应液倒入冰水中淬灭反应,乙酸乙酯萃取,有机层用无水硫酸钠干燥,柱层析纯化获得中间体m13(161mg),白色固体,产率78%。1hnmr(400mhz,cdcl3)δ7.95(d,j=8.4hz,1h),7.26(d,j=8.4hz,2h),7.00(d,j=8.4hz,2h),6.85(s,1h),6.73(d,j=8.4hz,1h),5.55(s,2h),3.89(s,3h),3.77(d,j=28.2hz,4h),3.08–2.94(m,2h),2.69(s,2h),2.39(s,6h)。
(2)化合物c11的合成
将原料替换为m13在多聚磷酸中反应,按照实施例1的方法得到化合物c11,白色固体,产率67%。纯度:95%。1hnmr(400mhz,cdcl3)δ8.04(s,1h),7.93(d,j=8.4hz,1h),7.28(d,j=1.7hz,2h),7.10(d,j=8.4hz,2h),6.69(d,j=8.4hz,1h),4.04(s,2h),3.95(s,3h),3.80(s,4h),2.96–2.89(m,2h),2.71(s,2h),2.39(s,6h).13cnmr(126mhz,cdcl3)δ169.36,148.15,136.75,132.52,132.32,129.80(2c),128.90(2c),127.30,125.93,124.98,118.02,113.05,102.12,57.11,55.42,50.29,48.26,45.44,31.78,26.61.hrms(esi)m/zcalcdc23h26n3o2cl[m+h]-410.1641,found410.1647。
实施例12.化合物c12的合成
(1)中间体m14的合成
将原料替换为m9与3-溴-n,n-二甲基-1-丙胺氢溴酸盐反应,按照实施例11的方法得到中间体m14,白色固体,产率57%。1hnmr(400mhz,cdcl3)δ7.95(d,j=8.4hz,1h),7.27(d,j=10.1hz,2h),6.99(d,j=8.3hz,2h),6.85(s,1h),6.73(d,j=8.4hz,1h),5.54(s,2h),3.88(s,3h),3.71(s,4h),3.00(d,j=4.0hz,2h),2.46(t,j=7.4hz,2h),2.32(s,6h),2.01–1.84(m,2h)。
(2)化合物c12的合成
将原料替换为m14在多聚磷酸中反应,按照实施例1的方法得到化合物c12,白色固体,产率24%。纯度:95%。1hnmr(400mhz,cdcl3)δ8.11(s,1h),7.92(d,j=8.4hz,1h),7.30(d,j=3.6hz,2h),7.13(d,j=8.3hz,2h),6.71(d,j=8.4hz,1h),4.06(s,2h),3.97(s,3h),3.76(s,4h),3.00–2.88(m,4h),2.65(s,6h),2.24–2.13(m,2h)。
实施例13.化合物c13的合成
(1)中间体m15的合成
将原料替换为m9与2-溴乙基甲基醚反应,按照实施例11的方法得到中间体m15,白色固体,产率81%。1hnmr(400mhz,cdcl3)δ7.96(d,j=8.4hz,1h),7.25(d,j=8.4hz,2h),6.99(d,j=8.4hz,2h),6.84(s,1h),6.73(d,j=8.4hz,1h),5.55(s,2h),3.88(s,3h),3.83(d,j=22.9hz,4h),3.70(t,j=5.3hz,2h),3.40(s,3h),3.01(s,2h)。
(2)化合物c13的合成
将原料替换为m15在多聚磷酸中反应,按照实施例1的方法得到化合物c13,白色固体,产率35%。纯度:98%。1hnmr(400mhz,cdcl3)δ8.00(s,1h),7.97(d,j=8.3hz,1h),7.31(d,j=7.5hz,2h),7.12(d,j=8.3hz,2h),6.72(d,j=8.4hz,1h),4.06(s,2h),3.97(s,3h),3.84(s,4h),3.71(t,j=5.3hz,2h),3.40(s,3h),2.99–2.91(m,2h).13cnmr(126mhz,cdcl3)δ169.35,148.06,136.71,132.58,132.10,129.83(2c),128.93(2c),127.35,125.90,124.98,118.24,113.39,102.15,71.82,58.88,55.42,51.29,50.52,31.81,26.42.hrms(esi)m/zcalcdc22h23n2o3cl[m+h]+399.1470,found399.1459。
实施例14.化合物c14的合成
(1)中间体m16的合成
将原料替换为m9与3-溴丙基甲基醚反应,按照实施例11的方法得到中间体m16,白色固体,产率66%。1hnmr(400mhz,cdcl3)δ7.94(d,j=8.4hz,1h),7.23(d,j=8.4hz,2h),6.97(d,j=8.3hz,2h),6.83(s,1h),6.71(d,j=8.4hz,1h),5.53(s,2h),3.86(s,3h),3.70(s,4h),3.49(t,j=6.2hz,2h),3.35(s,3h),3.03–2.95(m,2h),2.05–1.92(m,2h)。
(2)化合物c14的合成
将原料替换为m16在多聚磷酸中反应,按照实施例1的方法得到化合物c14,白色固体,产率29%。纯度:99%。1hnmr(400mhz,cdcl3)δ8.10(s,1h),7.96(d,j=8.4hz,1h),7.29(d,j=7.1hz,2h),7.12(d,j=8.4hz,2h),6.71(d,j=8.4hz,1h),4.06(s,2h),3.96(s,3h),3.74(s,4h),3.51(t,j=6.2hz,2h),3.37(s,3h),2.93(s,2h),2.07–1.93(m,2h).13cnmr(126mhz,cdcl3)δ168.20,146.99,135.63,131.58,131.10,128.79(2c),127.91(2c),126.23,124.87,123.93,117.31,112.13,101.13,69.49,57.63,54.39,48.89,46.76,30.80,27.41,25.65.hrms(esi)m/zcalcdc23h25n2o3cl[m+h]+413.1626,found413.1625。
实施例15.化合物c15的合成
(1)中间体m17的合成
将原料替换为m9与4-溴丁基甲基醚反应,按照实施例11的方法得到中间体m17,白色固体,产率86%。1hnmr(400mhz,cdcl3)δ7.96(d,j=8.4hz,1h),7.25(d,j=8.4hz,2h),7.00(d,j=8.4hz,2h),6.84(s,1h),6.73(d,j=8.4hz,1h),5.55(s,2h),3.88(s,3h),3.69(s,4h),3.46(t,j=6.3hz,2h),3.36(s,3h),3.03–2.91(m,2h),1.83–1.74(m,2h),1.71–1.62(m,2h)。
(2)化合物c15的合成
将原料替换为m17在多聚磷酸中反应,按照实施例1的方法得到化合物c15,白色固体,产率43%。纯度:97%。1hnmr(400mhz,cdcl3)δ8.21(s,1h),7.96(d,j=8.4hz,1h),7.29(d,j=2.1hz,2h),7.11(d,j=8.4hz,2h),6.70(d,j=8.4hz,1h),4.05(s,2h),3.95(s,3h),3.66(s,4h),3.45(t,j=6.3hz,2h),3.35(s,3h),2.92(s,2h),1.80–1.73(m,2h),1.71–1.65(m,2h).13cnmr(126mhz,acetone-d6)δ168.27,148.19,138.67,133.49,133.35,131.39,130.10(2c),128.36(2c),127.40,125.11,118.67,112.52,101.46,72.13,57.57,54.85,49.26(d,j=4.1hz),31.13,28.49,27.05,26.72,24.79.hrms(esi)m/zcalcdc24h27n2o3cl[m+h]+427.1783,found427.1781.。
实施例16.化合物c16的合成
(1)中间体m18的合成
将原料替换为m9与1-溴-2-(2-甲氧基乙氧基)乙烷反应,按照实施例11的方法得到中间体m18,白色固体,产率54%。1hnmr(400mhz,cdcl3)δ7.95(d,j=8.3hz,1h),7.25(d,j=8.4hz,2h),7.00(d,j=8.3hz,2h),6.84(s,1h),6.73(d,j=8.4hz,1h),5.55(s,2h),3.88(s,4h),3.84–3.77(m,4h),3.69–3.64(m,2h),3.58–3.54(m,2h),3.39(s,3h),3.01(s,2h)。
(2)化合物c16的合成
将原料替换为m18在多聚磷酸中反应,按照实施例1的方法得到化合物c16,白色固体,产率24%。纯度:96%。1hnmr(400mhz,cdcl3)δ8.05(s,1h),7.95(d,j=8.3hz,1h),7.30(d,j=7.5hz,2h),7.12(d,j=8.3hz,2h),6.71(d,j=8.4hz,1h),4.06(s,2h),3.97(s,3h),3.85(dd,j=10.2,5.4hz,4h),3.80(t,j=5.2hz,2h),3.68–3.63(m,2h),3.60–3.49(m,2h),3.38(s,3h),2.95(s,2h).13cnmr(126mhz,cdcl3)δ169.44,148.13,136.89,132.44,132.30,129.80(2c),128.84(2c),127.38,125.81,124.99,118.17,113.28,102.04,71.89,70.34,70.21,59.01,55.40,51.30,50.49,31.77,26.40.hrms(esi)m/zcalcdc24h24n2o4cl[m+h]-441.1587,found441.1585。
实施例17.化合物c17的合成
(1)中间体m19的合成
将原料替换为m9与3-溴丙酸甲酯反应,按照实施例11的方法得到中间体m19,白色固体,产率57%。
(2)化合物c17的合成
将原料替换为m19在多聚磷酸中反应,按照实施例1的方法得到化合物c17,白色固体,产率35%。纯度:99%。1hnmr(400mhz,cdcl3)δ8.14(s,1h),7.96(d,j=8.3hz,1h),7.29(d,j=5.7hz,2h),7.11(d,j=8.0hz,2h),6.71(d,j=8.4hz,1h),4.05(s,2h),3.96(s,3h),3.93(s,2h),3.78(s,2h),3.71(s,3h),2.93(s,2h),2.80(s,2h).13cnmr(126mhz,cdcl3)δ172.94,169.51,148.27,136.67,132.58,132.40,129.82(2c),128.92(2c),127.30,126.04,124.98,117.70,112.94,102.15,55.47,51.75,50.75,47.19,33.33,31.83,26.75.hrms(esi)m/zcalcdc23h23n2o4cl[m+h]+427.1419,found427.1419。
实施例18.化合物c18的合成
将化合物c17(63mg,0.15mmol)溶于甲醇和四氢呋喃中(2ml),40℃下反应3小时。反应结束后,体系用1m稀盐酸调节ph至4左右,体系有白色沉淀生成。过滤获得的滤饼经柱层析纯化获得产物c18(50mg),白色固体,产率80%。纯度:98%。1hnmr(400mhz,meod)δ7.75(d,j=8.4hz,1h),7.24(d,j=8.2hz,2h),7.16(d,j=8.1hz,2h),6.72(d,j=8.4hz,1h),4.05(s,2h),3.97(s,3h),3.85(s,2h),3.72(s,2h),2.89(s,2h),2.66(s,2h).13cnmr(126mhz,dmso-d6)δ168.65,148.49,139.13,134.52,131.11,130.58(2c),128.78(2c),127.37,125.11,124.84,117.96,111.95,101.94,55.74,49.97,46.74,31.28,29.49,26.75.hrms(esi)m/zcalcdc22h21n2o4cl[m+h]+413.1263,found413.1262。
实施例19.化合物c19的合成
将化合物c18(20mg,0.05mmol),hatu(46mg,0.12mmol)和甲胺盐酸盐(7.0mg,0.1mmol)溶于n,n-二甲基甲酰胺中(1.0ml),然后加入dipea(25μl,0.15mmol),室温反应过夜。反应结束后,体系用乙酸乙酯稀释,水洗涤三次,有机层用无水硫酸钠干燥,柱层析分离获得产物c19(8.3mg),白色固体,产率39%。纯度:99%。1hnmr(400mhz,meod)δ8.06(s,1h),7.74(d,j=8.3hz,1h),7.24(d,j=7.8hz,2h),7.16(d,j=7.9hz,2h),6.73(d,j=8.4hz,1h),4.05(s,2h),3.98(s,3h),3.87(s,2h),3.71(s,2h),2.86(s,2h),2.68(s,3h),2.56(s,2h).13cnmr(126mhz,dmso-d6)δ171.50,168.55,148.46,139.17,134.54,131.11,130.60(2c),128.77(2c),127.39,125.02,124.81,118.03,111.92,101.92,55.74,50.25,47.31,35.00,31.31,26.71,25.90.hrms(esi)m/zcalcdc23h24n3o3cl[m+h]+426.1579,found426.1577。
实施例20.化合物c20的合成
(1)中间体m20的合成
将原料替换为3-(2-硝基乙烯基)-1h-吲哚-4-甲酸甲酯与硼氢化钠反应,按照实施例1的方法得到中间体m20,白色固体,产率70%。1hnmr(400mhz,cdcl3)δ8.36(s,1h),7.80(d,j=7.5hz,1h),7.54(d,j=8.1hz,1h),7.21(t,j=7.8hz,1h),7.18(d,j=2.3hz,1h),4.70(t,j=6.6hz,2h),3.95(s,3h),3.67(t,j=6.6hz,2h)。
(2)中间体m21的合成
将原料替换为m20在pd/c、氢气条件下反应,按照实施例1的方法得到中间体m21,白色固体,产率50%。1hnmr(400mhz,dmso)δ11.11(s,1h),7.98(s,1h),7.66(d,j=7.4hz,1h),7.53(d,j=7.9hz,1h),7.26(s,1h),7.17(t,j=7.7hz,1h),3.41(s,2h),2.93(s,2h)。
(3)中间体m22的合成
将原料替换为m21与4-氯苄溴反应,按照实施例1的方法得到中间体m22,白色固体,产率85%。1hnmr(400mhz,cdcl3)δ7.99(d,j=7.5hz,1h),7.38(d,j=8.1hz,1h),7.28(dd,j=8.0,4.7hz,3h),7.03(d,j=8.3hz,2h),6.97(s,1h),6.50(s,1h),5.27(s,2h),3.62(dd,j=9.7,5.5hz,2h),3.10–3.02(m,2h)。
(4)终产物c20的合成
将原料替换为m22在多聚磷酸中反应,按照实施例1的方法得到终产物c20,白色固体,产率35%。纯度:99%。1hnmr(400mhz,dmso-d6)δ11.14(s,1h),7.97(t,j=5.7hz,1h),7.65(d,j=7.4hz,1h),7.45(d,j=7.9hz,1h),7.35(d,j=8.4hz,2h),7.25(d,j=8.4hz,2h),7.12(t,j=7.7hz,1h),4.06(s,2h),3.46–3.37(m,2h),2.87(s,2h).13cnmr(126mhz,dmso-d6)δ170.38,138.83,136.35,134.89,131.29,130.66(2c),128.88(2c),126.06,124.41,122.37,120.55,114.58,111.58,42.47,31.40,27.82.hrms(esi)m/zcalcdc18h15n2ocl[m+h]+311.0946,found311.0947。
实施例21.化合物c21的合成
(1)中间体m23的合成
将原料替换为7-异丙氧基-3-(2-硝基乙烯基)-1h-吲哚-4-甲酸甲酯与硼氢化钠反应,按照实施例1的方法得到中间体m23,白色固体,产率70%。1hnmr(400mhz,cdcl3)δ8.52(s,1h),7.87(d,j=8.4hz,1h),7.16(d,j=2.5hz,1h),6.65(d,j=8.4hz,1h),4.91–4.78(m,1h),4.73(t,j=6.6hz,2h),3.93(s,3h),3.72(t,j=6.6hz,2h),1.45(d,j=6.1hz,6h)。
(2)中间体m24的合成
将原料替换为m23在pd/c、氢气条件下反应,按照实施例1的方法得到中间体m24,白色固体,产率90%。1hnmr(400mhz,acetone-d6)δ10.23(s,1h),7.81(d,j=8.3hz,1h),7.15(s,1h),7.01(s,1h),6.78(d,j=8.3hz,1h),4.92–4.78(m,1h),3.57–3.49(m,2h),3.03–2.92(m,2h),1.39(d,j=6.0hz,6h)。
(3)中间体m25的合成
将原料替换为m24与4-氯苄溴反应,按照实施例1的方法得到中间体m25,白色固体,产率70%。
(4)中间体m26的合成
将原料替换为m25与3-溴丙基甲基醚反应,按照实施例11的方法得到中间体m26,白色固体,产率80%。1hnmr(400mhz,cdcl3)δ7.94(d,j=8.4hz,1h),7.26(d,j=21.1hz,3h),6.92(d,j=8.3hz,2h),6.84(s,1h),6.69(d,j=8.5hz,1h),5.58(s,2h),4.80–4.66(m,1h),3.73(s,4h),3.52(t,j=6.3hz,2h),3.38(s,3h),3.04–2.98(m,2h),2.07–1.93(m,2h),1.23(d,j=5.9hz,6h)。
(5)中间体m27的合成
将原料替换为m26在多聚磷酸中反应,按照实施例1的方法得到终产物m27,白色固体,产率30%。1hnmr(400mhz,cdcl3)δ9.70(s,1h),7.77(d,j=8.3hz,1h),7.08(d,j=8.3hz,2h),6.91(d,j=8.3hz,2h),6.61(d,j=8.3hz,1h),3.91(s,2h),3.73(s,4h),3.43(t,j=6.0hz,2h),3.30(s,3h),2.90(s,2h),1.94(s,2h)。
(5)终产物c21的合成
将中间体m27(40mg,0.1mmol)溶于2.0ml乙腈:水=1:1的混合溶液中,冰浴下加入氢氧化钾(56mg,1.0mmol),体系澄清后,滴加溴氟甲基膦酸二乙酯(0.5mmol)。转入室温反应15分钟。冰水淬灭反应,乙酸乙酯萃取,无水硫酸钠干燥,柱层析纯化获得产物c21(27mg),白色固体,产率60%。纯度:99%。1hnmr(400mhz,cdcl3)δ8.25(s,1h),7.94(d,j=8.3hz,1h),7.31(d,j=8.4hz,2h),7.12(d,j=8.4hz,2h),6.96(d,j=8.3hz,1h),6.66(t,j=73.8hz,1h),4.08(s,2h),3.75(brs,4h),3.51(t,j=6.2hz,2h),3.37(s,3h),2.94(brs,2h),2.08–1.96(m,2h).13cnmr(126mhz,cdcl3)δ168.54,138.77,136.34,133.94,132.67,129.72(2c),128.95(2c),128.65,126.63,124.95,122.49,116.08(t,j=260.9hz),113.32,109.78,70.38,58.65,49.83,47.91,31.78,28.32,26.53.hrms(esi)m/zcalcdc23h23n2o3f2cl[m+h]-447.1293,found447.1287。
实施例22.化合物c11盐酸盐的合成
将化合物c11(206mg,0.5mmol)溶于20ml二氯甲烷中,然后往体系中加入4mhcl的1,4-二氧六环溶液(1.5ml,6.0mmol),室温搅拌反应1小时,析出的固体经过滤、二氯甲烷洗涤后获得产物c11-hcl,白色固体,产率95%。1hnmr(400mhz,cdcl3)δ8.04(s,1h),7.93(d,j=8.4hz,1h),7.28(d,j=1.7hz,2h),7.10(d,j=8.4hz,2h),6.69(d,j=8.4hz,1h),4.04(s,2h),3.95(s,3h),3.80(s,4h),2.96–2.89(m,2h),2.71(s,2h),2.39(s,6h)。
实施例23.化合物对pde5酶的抑制活性测试
待测化合物与含有重组pde5a1蛋白(该重组蛋白的制备方法参见文献:bioorganic&medicinalchemistryletters,2012年,22卷,页码:3261–3264),20mmtris-hcl,ph7.5,2mm二硫苏糖醇(dithiothreitol),10mmmgcl2以及30,000cpm的3h-cgmp在室温下孵育15分钟,然后分别用0.2mznso4和ba(oh)2中止反应,然后利用perkinelmer2910计数仪测量上清液中未反应的3h-cgmp,每个分子至少测量三次。对pde5a1蛋白活性抑制的ic50值通过浓度测试及非线性回归,计算获得。
实施例化合物对pde5酶的抑制活性测试数据如表1所示(同等条件下,阳性对照物西地那非sildenafil对pde5酶的抑制活性ic50为5.1nm)。
表1.化合物对pde5酶的抑制活性测试结果
从表1中结果可看出,本发明所述的取代吲哚并氮杂酮类化合物对磷酸二酯酶5型具有良好的抑制活性,其中化合物c5、c8、c10、c11、c16、c18和c19对pde5酶的抑制作用处于20-60nm级别;化合物c14、c15、c17和c21对pde5酶的抑制作用处于nm级别、与阳性药物西地那非相当。可见,本发明所述取代吲哚并氮杂酮类化合物作为磷酸二酯酶5型抑制剂具有广阔的应用空间。
实施例24.化合物c21的抗肺动脉高压动物体内药效研究
以化合物c21为代表进行抗肺动脉高压药效学研究。实验动物模型采用本专利申请人前期研究中已成功构建并多次应用的“大鼠腹腔注射野百合碱诱发的pah实验动物模型”。将spf级雄性wistar大鼠60只,体重220-250g,随机分4组,即正常组、模型组、给药组(2.5mg/kg)阳性对照西地那非组(5.0mg/kg)。
建模及给药方法:随机分组后的动物适用性饲养三天,除正常对照组给予生理盐水外,对模型组和各给药组一次性腹腔注射2%野百合碱(60mg/kg)构建大鼠肺动脉高压模型。然后第二天开始给药、每天给药1次、连续给药4周,并每天记录各组大鼠质量。所涉动物实验皆遵循我国关于实验动物福利和伦理的相关规定。
大鼠平均肺动脉压检测:采用右心导管法,末次给药1h后,将大鼠用3%的戊巴比妥钠(45ml/kg)腹腔注射麻醉动物,麻醉后将大鼠仰位固定于手术台上,于大鼠颈部正中切口,游离右颈外静脉,采用右心导管做右颈静脉插管及肝素抗凝。将导管从右颈外静脉插入经上腔静脉、右心房、右心室,进入肺动脉。导管另一端连压力传感器,并连接med-lab-u/8c生物信号采集系统,分别记录10、30、60分钟时的肺动脉压,连续记录30秒,取其平均值为平均肺动脉压。
肺组织标本制备及相关指标计算:取大鼠右肺上、中二叶,左肺下叶组织,约1.0cm×2.0cm大小,生理盐水漂洗,立即至于10%中性甲醛中固定,组织修块、脱水、石蜡包埋、切片、he染色、光镜下观察拍照。每组大鼠随机选择100-200μm肺肌型小动脉,测其内外径,计算肺小动脉的中膜厚度与血管外径的比值,用于评估肺小动脉中膜增厚程度(wt%)。取心脏,分离称取右心室(rv)和左心室加室间隔(lv+s)的重量,并以rv/(lv+s)比值作为右心肥厚指数(rvhi)。实验结果如图1所示。
从上述结果可以看出,与正常组相比,模型组大鼠肺动脉压力显著上升、肺小动脉血管壁肥厚及动脉腔狭窄;与模型组大鼠相比,阳性药物西地那非组及化合物c21组都可显著降低肺动脉压、右心肥厚指数显著降低,且化合物c21组仅需阳性药物西地那非1/4的剂量即可表现出相似的药效。因此,受试药c21具有良好的降低肺动脉压力的药理学作用,可进一步开发成为治疗肺动脉高压的新药。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!