一种嗜酸乳杆菌的食品级基因表达体系及其制备方法和应用与流程
本发明属于基因工程和发酵工程技术领域,尤其是涉及一种嗜酸乳杆菌的食品级基因表达体系及其制备方法和应用。
背景技术:
嗜酸乳杆菌ncfm(lactobacillusacidophilusncfm;分类学id:272621)是由moro于1900年首次从婴儿粪便中分离得到的短杆状革兰氏阳性菌,其完整基因组由1,993,564个核苷酸组成,不含质粒,是研究乳酸菌常用的模式菌株。嗜酸乳杆菌ncfm具有改善肠道菌群结构、调节代谢水平、增强免疫功能、降低血清胆固醇、预防癌症等功效,是公认安全的(gras)菌株。嗜酸乳杆菌ncfm的最适生长温度为37–42℃,最适ph为5.5-6.0,耐酸性强,属于同型发酵的菌株,能将葡萄糖经过糖酵解(emp)途径只产生两分子的乳酸,是发酵工业中使用最为广泛的一种益生菌。
近年来,嗜酸乳杆菌ncfm的另一代谢途径——乳糖代谢,因其产物安全无毒,与嗜酸乳杆菌调节免疫、抗感染、抗病毒、抗氧化、降血糖等益生功效有着密切的联系而备受关注。在乳糖代谢途径中,utp-葡萄糖-1-磷酸尿苷酰基转移酶(utp-glucose-1-phosphateuridylytransferase;ec2.7.7.9),能催化反应glucose-1-phosphate(葡萄糖-1-磷酸)与utp(尿苷三磷酸)反应生成udp-glucose(udp-glc,udpg),为各种糖苷、寡糖、多糖等的合成提供活化形式的糖基供体,在单糖的互变或糠、醛、酸生成时作为重要的中间产物,是多糖代谢中至关重要的代谢中心。2017年9月,在美国国立生物技术信息中心的保守结构数据库ncbi中,公布了嗜酸乳杆菌ncfm的utp-葡萄糖-1-磷酸尿苷酰基转移酶的编码基因galu位于其dna上第611190至612107个核苷酸(geneid:lba0625)。
基因的表达离不开标记基因与启动子。标记基因能赋予宿主菌某种特殊的性能来筛选阳性克隆,如导入氨苄抗性基因能使宿主菌对氨苄青霉素产生抗性,从而利用氨苄抗性平板筛选出导入了具有氨苄抗性基因的菌株,但抗性基因的导入会使细菌产生耐药性,不能用于食品级的菌株中,使得抗性基因的删除成为基因工程领域的研究热点。
技术实现要素:
本发明所要解决的技术问题是提供一种无需利用抗性标记基因进行筛选,只需要在以乳糖为唯一糖源的培养基上正常培养,便可高效筛选出阳性克隆子的嗜酸乳杆菌的食品级基因表达体系及其制备方法和应用。
本发明解决上述技术问题所采用的技术方案为:
1、一种嗜酸乳杆菌的食品级基因表达体系,包括乳糖缺陷型宿主菌la0625和携带乳糖操纵子与galu基因的表达载体两个部分。通过基因无痕敲除获得了一株galu基因缺陷型嗜酸乳杆菌la0625,该菌的乳糖代谢途径被阻断,不能单独利用乳糖以及半乳糖进行生长代谢,难以在以乳糖为唯一糖源的平板上生长。
2、上述嗜酸乳杆菌的食品级基因表达体系的制备方法,包括以下步骤:
(1)galu基因缺陷型宿主菌δgalu的制备
1.1同源臂及标记基因的扩增
以提取的嗜酸乳杆菌la的dna为模板,以galu-1-f/r和galu-2-f/r扩增引物通过pcr技术分别扩增出galu基因的上、下游目的片段;以大肠杆菌克隆质粒puc57质粒为模板,以amp-f/r为扩增引物通过pcr技术扩增出氨苄抗性基因;
1.2打靶片段knock的构建
将扩增出的氨苄抗性基因通过无缝连接插入到扩增出的嗜酸乳杆菌galu基因上下游之间,得到基因片段knock;
1.3打靶片段knock与敲除质粒pk18mobsacb的连接
将纯化后的基因片段knock与敲除质粒pk18mobsacb均采用bamhi和psti限制性酶进行过夜酶切;将酶切后的基因片段knock与酶切后的敲除质粒pk18mobsacb用t4-dna连接酶连接过夜;
1.4敲除载体knock-pk18mobsacb的克隆表达
将连接好的knock片段与质粒pk18mobsacb转入大肠感受态细胞trans-t1,克隆表达获得大量敲除质粒knock-pk18mobsacb;
1.5制备嗜酸乳杆菌感受态细胞
挑取嗜酸乳杆菌la单菌落至50mlmrs肉汤中过夜培养得种子液,向100ml含0.5wt%葡萄糖和0.5wt%甘氨酸的mrs培养基中加入2ml种子液,培养至od600=0.8,于3000rpm离心菌液10min,收集菌体,无菌去离子水洗2次之后,用20ml预冷的含有10wt%甘油和10wt%蔗糖的无菌蒸馏水洗涤细胞2次,于3000rpm离心10min得到嗜酸乳杆菌感受态细胞菌体;
1.6敲除载体导入嗜酸乳杆菌感受态细胞
取0.8-1.2μg的敲除质粒knock-pk18mobsacb与100µl嗜酸乳杆菌感受态细胞混合,然后一同转入已预冷的电极杯中,以1.0kv,25μf,200ω,5.1ms脉冲转化,迅速往电极杯中加入1ml预冷的mrs培养基中,于37℃复苏2~3h;
1.7抗性筛选与鉴定
吸取100µl复苏菌液均匀涂布在含有5µg/ml卡那霉素的mrs平板上,37℃静置培养3~5d,挑取肉眼可见的所有单菌落于含有5µg/ml氨苄青霉素的mrs肉汤中孵育24h,以galu-1-f与galu-2-r作为引物进行pcr扩增,通过琼脂糖凝胶电泳鉴定,出现目的条带的则为阳性克隆子;
1.8蔗糖致死性筛选与鉴定
将阳性克隆子菌液涂布于含有10wt%蔗糖和5wt%氨苄青霉素的samrs琼脂培养基上,37℃静置培养2-3d,每个平板上分别挑取10个阳性单菌落于含有10wt%蔗糖和5wt%氨苄青霉素的samrs肉汤中,37℃孵育8h,取阳性菌株dna作为模板,以galu-1-f(la)与galu-2-r(la)作为引物进行pcr扩增,获得galu基因敲除菌株δgalu;
(2)构建携带乳糖操纵子与galu基因的表达载体
2.1galu基因的扩增
根据ncbi中嗜酸乳杆菌ncfm的基因序列,设计引物galu-7-f与galu-7-r,以嗜酸乳杆菌ncfm的基因组dna为模板,进行pcr扩增得到galu基因;
2.2表达质粒pnz8149的提取
将乳酸乳球菌的菌种nz3900以体积比2%的接种量接种于添加0.5wt%葡萄糖的m17肉汤中,于30℃,150rmp培养16h后,取5ml培养菌液,于12000r/min离心2min,收集菌液;将菌液用250μlthms缓冲液和0.5mg溶菌酶重悬,在37℃下孵育10min;再加入500μl0.2mol/lnaoh和5μl十二烷基硫酸钠在冰上孵育5min;加375μl冰预冷ph5.5的3mol/l的乙酸钾溶液后冰上孵育5min;离心5min,吸取上层到新的离心管,离心管加满异丙醇,在室温孵育5-10min;离心10min,弃上清,用70vt%乙醇溶液洗涤后,离心2min;弃上清,在室温下干燥后,加50μl的超纯水溶解;
2.3重组表达载体pnz8149-0625的构建
将步骤2.1扩增得到的galu基因片段进行琼脂糖凝胶电泳,切割其目的条带,将pcr产物进行纯化回收,具体步骤参见pcr产物纯化试剂盒(中美泰和生物技术有限公司,中国北京),测定纯化后的galu基因片段浓度,将galu基因片段与pnz8149载体按摩尔比1:1进行无缝克隆连接;
2.4重组质粒pnz8149-0625导入宿主菌δgalu中
将重组表达载体pnz8149-0625通过电转导入敲除菌株δgalu感受态细胞中,得到嗜酸乳杆菌的食品级基因表达体系。
步骤(1)中所述的galu-1-f/r、galu-2-f/r和amp-f/r的核苷酸序列如下:
步骤(2)中所述的galu-7-f与所述的galu-7-r的核苷酸序列如下:galu-7-f:5’-ttgaattaagagaaagtgt;galu-7-r:5’-tattgttgtatttattttttcgcttatc。
上述嗜酸乳杆菌的食品级基因表达体系可与各种启动子结合,实现靶基因的高效转录。
与现有技术相比,本发明的优点在于:本发明首次公开了一种嗜酸乳杆菌的食品级基因表达体系及其制备方法和应用,其选取嗜酸乳杆菌galu基因(geneid:lba0625)作为靶基因进行敲除,敲除后的嗜酸乳杆菌klba的乳糖代谢途径被阻断,无法利用乳糖或者半乳糖进行代谢而导致细胞死亡。也就是说,在以乳糖或者半乳糖为唯一糖源的培养基上,敲除菌株klba是不会生长的。在将含有galu基因的多种表达载体进行导入乳糖代谢缺陷型宿主菌株klba细胞后,成功导入表达载体的菌株恢复了乳糖及半乳糖的代谢功能,从而能够在以乳糖或半乳糖为唯一糖源的培养基上形成肉眼可见的菌落。以乳糖代谢缺陷型菌株klba作为标准宿主菌,以含有galu基因片段的质粒作为表达载体,可获得一个仅由乳糖或半乳糖培养基就可获得嗜酸乳杆菌基因的高表达菌株。优点如下:
(1)以嗜酸乳杆菌自身基因galu作为筛选标记,无需引入外源标记,不会对嗜酸乳杆菌基因组的表达产生干扰;
(2)在菌株筛选过程中,只需要根据能否在乳糖或半乳糖为唯一糖源的培养基上生长进行判断,且筛选出的菌株90%以上为成功转入表达载体的阳性菌株。整个筛选过程无需添加抗生素等非食用性试剂,安全高效,可用于食品级嗜酸乳杆菌的基因表达;
(3)无需额外添加诱导剂,在乳糖或半乳糖为唯一糖源的培养基上,乳糖可作为诱导剂,诱导表达载体上的乳糖操纵子lacz/y/a对其下游的目的基因进行高调表达;
(4)构建了含有galu基因的多种表达载体组合,均能高效快速地筛选出阳性菌株。如以galu基因+乳糖操纵子lacz/y/a+启动子nisa/f构建的表达载体,galu基因+乳糖操纵子lacz/y/a+启动子trp构建的表达载体等。
综上所述,本发明一种嗜酸乳杆菌的食品级基因表达体系及其制备方法和应用,该体系简单高效,无需利用抗性标记基因进行筛选,只需要在以乳糖为唯一糖源的培养基上正常培养,便可高效筛选出阳性克隆子。此外,该体系还可与各种启动子结合,实现靶基因的高效转录。
附图说明
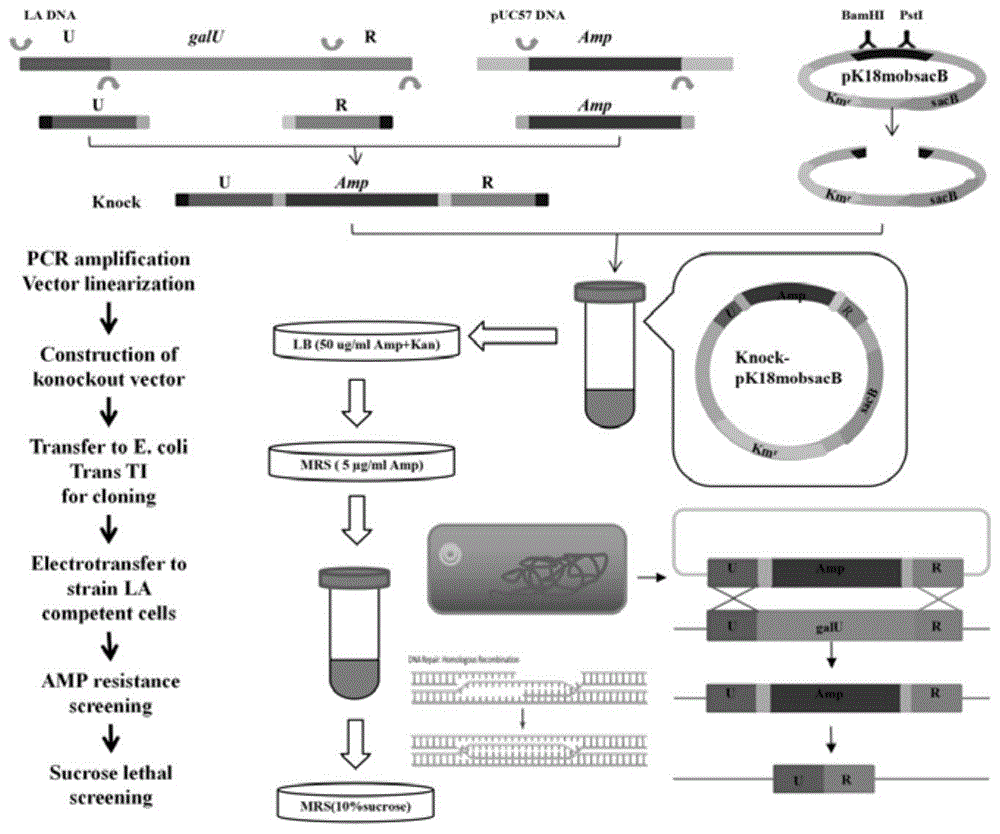
图1为galu基因敲除的原理及流程示意图;
图2为galu基因的上、下游目的片段以及氨苄抗性基因(amp基因)的pcr扩增电泳图;lanem:1000bpdnamarker;lane1-4:分别在58.3℃、60.5℃、65.5℃、68.8℃的退火温度下的galu基因上游pcr扩增片段(662bp);lane5-8:分别在58.3℃、60.5℃、65.5℃、68.8℃的退火温度下的galu基因下游pcr扩增片段(592bp);lane9-10:分别在55.6℃、56.4℃的退火温度下的氨苄(amp)抗性基因片段(974bp);
图3为敲除载体knock-pk18mobsacb的重组质粒图谱及其双酶切电泳图;lane1:plasmiddna;lane2:基因片段knock片段为2180bp;敲除质粒pk18mobsacb片段为5719bp;lanem:1000bpdnamarker;
图4为重组菌抗性筛选电转菌阳性克隆子的pcr扩增电泳图;lanem:2000bpdnamarker;lane1-11:以0625-1-f(la)与0625-2-r(la)为引物,将挑选出的11株阳性菌进行菌液pcr而得到的条带。其中,lane1、lane3、lane8、lane10、lane11均出现了目的条带(2180bp),但条带杂多,只有lane11通过pcr扩增出条带单一的重组成功的纯合子;
图5为蔗糖致死筛选电转菌阳性克隆子的pcr扩增电泳图;lanem:8000bpdnamarker;lane1-8:分别对应从蔗糖致死平板所挑出的8株菌,以0625-1-f(la)与0625-2-r(la)为引物进行pcr电泳所扩增出的条带;
图6为galu基因敲除验证的pcr扩增电泳图;lanem:8000bpdnamarker;lane1/2:以0625-4-f/r为引物,分别对敲除菌δgalu与野生型菌株(wt)进行pcr扩增所得条带;lane3/4:以0625-5-f/r为引物,分别对敲除菌δgalu与野生型菌株(wt)进行pcr扩增所得条带;lane5/6:以0625-6-f/r为引物,分别对敲除菌δgalu与野生型菌株(wt)进行pcr扩增所得条带;
图7为出发菌株la、抗性初筛菌株no.36、敲除菌株δgalu对乳糖、半乳糖和蔗糖利用情况图;
图8为重组表达载体pnz8149-0625的质粒图谱及其双酶切电泳图;lanem:2,000bpdnamarker;lane1-6:重组表达载体pnz8149-0625的质粒;
图9为回补表达菌株pgalu阳性克隆子在bm17平板上的筛选图;
图10为回补表达菌株pgalu阳性克隆的pcr验证图;lanem:5,000bpdnamarker;lane1-23:pgalu阳性克隆的pcr验证电泳;
图11为过表达菌株在pgalu在bm17平板上的生长图;
图12为utp-葡萄糖-1-磷酸尿苷酰基转移酶含量与测定的od450之间的线性关系图;
图13为la、δgalu、pgalu菌株上清及沉淀中相应的utp-葡萄糖-1-磷酸尿苷酰基转移酶的含量。
具体实施方式
以下结合附图实施例对本发明作进一步详细描述。
具体实施例一
一种嗜酸乳杆菌的食品级基因表达体系,包括乳糖缺陷型宿主菌δgalu和携带乳糖操纵子与galu基因的表达载体两个部分。通过基因无痕敲除获得了一株galu基因缺陷型嗜酸乳杆菌δgalu,该菌的乳糖代谢途径被阻断,不能单独利用乳糖以及半乳糖进行生长代谢,难以在以乳糖为唯一糖源的平板上生长。
具体实施例二
革兰氏阳性菌的基因敲除方法:根据革兰氏阳性菌a的x基因,通过分别扩增x基因的上下游同源臂与amp抗性基因构建打靶片段knock,通过双酶切将打靶片段knock与携带amp抗性基因与sacb蔗糖致死基因的pk18mobsacb质粒进行连接得到重组打靶载体knock-pk18mobsacb,导入大肠杆菌transt1中进行验证与克隆。提取重组打靶载体knock-pk18mobsacb,通过电转导入出发菌株的感受态细胞中,先以amp抗性平板筛选出成功转入重组打靶载体knock-pk18mobsacb的阳性菌株,在含有10wt%蔗糖的mrs培养基中培养,使带有sacb基因质粒的菌株在果聚糖致死效应中死亡,从而选出不含标记基因的x基因缺失菌株a-x。
上述具体实施例一中嗜酸乳杆菌的食品级基因表达体系的制备方法,如图1所示,包括以下步骤:
1、galu基因缺陷型宿主菌δgalu的制备
1.1同源臂及标记基因的扩增
以提取的嗜酸乳杆菌la的dna为模板,以galu-1-f/r和galu-2-f/r扩增引物通过pcr技术分别扩增出galu基因的上、下游目的片段;以大肠杆菌克隆质粒puc57质粒为模板,以amp-f/r为扩增引物通过pcr技术扩增出氨苄抗性基因,如图2所示。
表1本发明中所用的寡核苷酸dna引物
1.2打靶片段knock的构建
将扩增出的氨苄抗性基因通过无缝连接插入到扩增出的嗜酸乳杆菌galu基因上下游之间,得到基因片段knock;
1.3打靶片段knock与敲除质粒pk18mobsacb的连接
提取质粒pk18mobsacb,将纯化后的基因片段knock与敲除质粒pk18mobsacb均采用bamhi和psti限制性酶进行过夜酶切;将酶切后的基因片段knock与酶切后的敲除质粒pk18mobsacb用t4-dna连接酶连接过夜。如图3所示,lane1重组质粒knock-pk18mobsacb为7986bp,lane2基因片段knock和酶切质粒pk18mobsacb相应为5719bp和2180bp;
1.4敲除载体knock-pk18mobsacb的克隆表达
将连接好的knock片段与质粒pk18mobsacb转入大肠感受态细胞trans-t1,以便于获得大量的敲除质粒knock-pk18mobsacb进行下一步试验;
1.5制备嗜酸乳杆菌感受态细胞
挑取嗜酸乳杆菌la单菌落至50mlmrs肉汤中过夜培养得种子液,向100mlmrs培养基(含0.5wt%葡萄糖+0.5wt%甘氨酸)中加入2ml种子液,培养至od600=0.8,于3000rpm离心菌液10min(此时的离心力不能太大,以防细胞受到损伤),收集菌体,无菌去离子水洗2次之后,用20ml预冷的a液(含有10wt%甘油和10wt%蔗糖的无菌蒸馏水)洗涤细胞2次,于3000rpm离心10min得到嗜酸乳杆菌感受态细胞菌体,向菌体加入0.5ml预冷的a液,100µl分装于200µl小管中,液氮速冻后,立即放入-80℃冰箱中冻存,备用;
1.6敲除载体导入嗜酸乳杆菌感受态细胞
将嗜酸乳杆菌感受态细胞从-80℃冰箱取出,于0℃冰上融化10-20min,洗电转杯:从100%乙醇中取出0.1cm间隙的电极杯,用无菌去离子水冲洗3遍后,放于75wt%乙醇溶液中浸泡10min(100ml75%乙醇为75ml100%乙醇+25ml无菌去离子水),取出电极杯用滤纸擦干多余水分后,将电极杯敞口正对紫外灯,于超净台吹干10min,放冰箱备用。取0.8-1.2μg的敲除质粒knock-pk18mobsacb与100µl嗜酸乳杆菌感受态细胞混合,然后一同转入已预冷的电极杯中,以1.0kv,25μf,200ω,5.1ms脉冲转化,迅速往电极杯中加入1ml预冷的mrs培养基中,于37℃复苏2~3h;
1.7抗性筛选与鉴定
吸取100µl复苏菌液均匀涂布在含有5µg/ml卡那霉素的mrs平板上,37℃静置培养3~5d,挑取肉眼可见的所有单菌落于含有5µg/mlamp氨苄青霉素的mrs肉汤中孵育24h,以galu-1-f(la)与galu-2-r(la)作为引物进行pcr扩增,通过琼脂糖凝胶电泳鉴定,出现目的条带的则视为阳性克隆子,进行下一步蔗糖致死筛选。如图4,lane11通过pcr扩增出单一条带,说明lane11所对应的菌株为重组成功的纯合子;
1.8蔗糖致死性筛选与鉴定
将阳性菌液涂布于samrs琼脂培养基上(含有10wt%蔗糖+5wt%氨苄青霉素),37℃静置培养2-3d,每个平板上分别挑取10个阳性单菌落于samrs肉汤中(10wt%蔗糖+5wt%氨苄青霉素),37℃孵育8h,分管标号。(samrs肉汤指的是含有10wt%蔗糖+5wt%氨苄青霉素的mrs肉汤,即往mrs肉汤中加入了肉汤质量10wt%的蔗糖和5wt%的氨苄青霉素)。
以野生型菌株作为对照,设计三对不同的galu基因引物进行pcr验证,引物见表2中galu-4-f/r、galu-5-f/r、galu-6-f/r所示。同时,以galu-1-f(la)与galu-2-r(la)作为引物进行pcr扩增。将不含galu基因而能扩增出galu基因上游+下游目的片段的菌初步判定为阳性菌株。如图5,从蔗糖致死平板所挑出的8株菌中,有7株出现目的条带。
表2三对不同的galu基因所用的寡核苷酸dna引物
以galu-1-f(la)与galu-2-r(la)作为引物将阳性菌株送往华大基因测序。测序结果与原始序列进行比对,匹配率达99%以上,为galu基因敲除菌株(δgalu)。如图6,敲除菌δgalu无法扩增出条带,野生型菌株(wt)可扩增出条带;
1.9galu基因的缺失对la乳糖、半乳糖、蔗糖代谢的影响
如图7(a)(b)所示,菌株la和δgalu虽都不能直接利用乳糖,但la菌株在以乳糖为唯一糖源的m17平板上的生长良好,而δgalu菌株却难以在该平板上生长,无菌落出现;如图7(c)所示,在半乳糖发酵管中,la菌株的溶液变黄,说明la菌株可直接利用半乳糖,而δgalu不能直接利用半乳糖,通过与no.36菌株(导入敲除质粒knock-pk18mobsacb但未丢失galu基因)的对比,可排除δgalu菌株不能利用半乳糖发酵是受到knock-pk18mobsacb质粒影响的可能;如图7(d)所示,从蔗糖发酵结果来看,knock-pk18mobsacb质粒的导入与galu基因的缺失并未对嗜酸乳杆菌自身的蔗糖代谢造成影响。总而言之,galu基因的缺失造成了敲除菌株δgalu的乳糖及半乳糖代谢途径被阻断,使δgalu菌株不能在以乳糖为糖源的培养基上生长。
乳糖操纵子能调控分解乳糖生产葡萄糖和半乳糖。galu基因缺失菌株δgalu虽然不能利用乳糖和半乳糖,但能在有葡萄糖的条件下进行生长代谢并产生乳酸。在导入重组载体筛选阳性时,在以乳糖为唯一糖源的平板上出现以下三种情况:
a、未导入质粒的宿主菌,不能利用乳糖,在以乳糖为唯一糖源的平板上不生长,无菌落;
b、导入未插入靶基因质粒的宿主菌,乳糖操纵子分解乳糖产生葡萄糖,通过emp代谢,生成乳酸使溴甲酚紫变黄,在以乳糖为唯一糖源的平板上有黄色晕圈的菌落生成;
c、导入插入靶基因质粒的宿主菌,乳糖操纵子关闭,galu基因表达,能利用乳糖进行代谢,但不产酸,不能使溴甲酚紫变黄,在以乳糖为唯一糖源的平板上有白色的菌落生成,无黄色晕圈。
在以乳糖为唯一糖源的培养基中,乳糖能以极高的浓度与乳糖操纵子的阻遏蛋白迅速结合,从而改变阻遏蛋白的构象,使之与操纵区解离,失去阻遏作用,启动下游基因的转录,因此即使在没有添加诱导剂iptg的情况下,也能使目的基因高效表达。
乳糖缺陷型嗜酸乳杆菌δgalu的应用:以乳糖缺陷型嗜酸乳杆菌δgalu作为宿主菌进行基因工程菌株的筛选。如在乳糖缺陷型嗜酸乳杆菌δgalu中导入具有乳糖操纵子的表达载体进行某个基因的表达。在以乳糖为唯一糖源的培养基上,唯有导入含有乳糖操纵子的质粒才能使乳糖缺陷型菌株δgalu进行生长,从而挑选出成功导入质粒的重组菌株。此外,培养基上的乳糖将以极高的浓度与乳糖操纵子结合,即使没有诱导剂的情况下,也能启动下游基因的转录,进行靶基因的高效表达。
2、构建携带乳糖操纵子与galu基因的表达载体
2.1galu基因的扩增
根据ncbi中嗜酸乳杆菌ncfm的基因序列,设计引物galu-7-f(la)与galu-7-r(la),以嗜酸乳杆菌ncfm的基因组dna为模板,pcr扩增galu基因,序列如表2所示。
2.2表达质粒pnz8149的提取
将乳酸乳球菌的菌种nz3900以2%体积比接种量接种于添加0.5wt%葡萄糖的m17肉汤中,于30℃,150rmp培养16h后,取5ml培养菌液;于12000r/min离心2min,收集菌液;将菌液用250μlthms缓冲液(thms缓冲液配制方法为购买已配置好的thms缓冲试剂包,按其说明加水配置即可)和0.5mg溶菌酶重悬,在37℃下孵育10min;再加入500μl0.2mol/lnaoh和5μl十二烷基硫酸钠(sds)在冰上孵育5min;加375μl冰预冷ph5.5的3mol/l的乙酸钾溶液后冰上孵育5min;离心5min,吸取上层到新的离心管,离心管加满异丙醇,在室温孵育5-10min;离心10min,用70%乙醇溶液洗dna,离心2min;弃上清,室温下干燥dna,加50μl的超纯水溶解dna。
2.3重组表达载体pnz8149-0625的构建
测定纯化回收的pcr产物浓度,pnz8149线性化载体的浓度为100ng/μl,galu基因片段的浓度为200ng/μl,按pnz8149载体与galu基因片段的摩尔比为1:1计算得到:
最适pnz8149载体使用量=0.02×2550ng÷100ng/μl≈0.5μl,
最适galu基因片段使用量=0.04×935ng÷200ng/μl≈0.2μl,
按pnz8149载体与galu基因片段的摩尔比为1:1计算得到载体用量和插入片段用量,按无缝克隆试剂盒说明书(碧云天生物科技有限公司,中国上海)进行操作,得到重组表达载体pnz8149-0625;重组表达载体pnz8149-0625质粒图谱及其双酶切电泳图如图8所示。
2.4重组质粒pnz8149-0625导入宿主菌δgalu中
制备δgalu感受态细胞,具体步骤参见1.5。将重组表达载体pnz8149-0625通过电转导入δgalu感受态中,具体步骤参见1.6。
2.5阳性回补表达克隆菌株pgalu的筛选
取200µl转化液均匀涂布于以溴甲酚紫为指示剂,以乳糖为唯一糖源的bm17培养基上,37℃静置培养12h,观察菌落生长情况,其结果如图9所示。挑取可疑菌落作为阳性克隆子于2mlmrs肉汤中37℃静置培养12h,提取其dna作为模板,以galu-7-f/r为引物进行pcr扩增,通过核酸电泳检测是否含有目的条带,并将该pcr产物送检测序。
2.6阳性回补表达菌株pgalu的pcr验证
在bm17平板上挑取了所有黄色菌落与白色菌落,共23株菌,以galu-7-f/r为引物进行菌落pcr,其结果如图10所示,11号菌与23号菌出现了明亮且单一的条带,测序比对率分别为98.8%、99.1%,确定23号菌为回补表达菌株pgalu。将确定的回补表达菌株pgalu在bm17平板上培养,结果如图11。
2.7utp-葡萄糖-1-磷酸尿苷酰基转移酶含量测定
utp-葡萄糖-1-磷酸尿苷酰基转移酶含量测定的标准曲线如图12所示,根据标准曲线中utp-葡萄糖-1-磷酸尿苷酰基转移酶酶浓度与od450的对应值,计算出la、δgalu、pgalu菌株上清及沉淀中相应的utp-葡萄糖-1-磷酸尿苷酰基转移酶的含量,如图13所示。utp-葡萄糖-1-磷酸尿苷酰基转移酶大部分都存在于la菌株的沉淀中,极少存在于上清液中,表明utp-葡萄糖-1-磷酸尿苷酰基转移酶通常是以包含体存在于la菌株中,由蛋白质中的肽链折叠形成的致密蛋白,难溶于水,只能溶于盐酸胍、脲等变性溶液中,难以提取。在galu基因缺失菌株δgalu中,utp-葡萄糖-1-磷酸尿苷酰基转移酶的活性较低,几乎检测不到。在表达菌株pgalu中,utp-葡萄糖-1-磷酸尿苷酰基转移酶总含量增大了229%,在上清中的酶含量提高了203.86%,可见表达质粒上的galu基因的确在菌体内被大量表达,且表达出的蛋白大多数分布于上清液中,非常有利于utp-葡萄糖-1-磷酸尿苷酰基转移酶的提取。
2.8回补表达菌株pgalu的应用
目前,utp-葡萄糖-1-磷酸尿苷酰基转移酶在全球范围内出售只有3家厂商能生产,不仅每毫升的价格高达30000元,订货期也需要半年以上。表达菌株pgalu是一株utp-葡萄糖-1-磷酸尿苷酰基转移酶的高产菌株,由菌株pgalu生产的utp-葡萄糖-1-磷酸尿苷酰基转移酶大部分分布于细胞质中,可通过离心获取菌体后,对细胞进行破碎,得到分布于上清液utp-葡萄糖-1-磷酸尿苷酰基转移酶溶液。再通过溶液浓缩或者冷冻干燥,可得到纯度较高的utp-葡萄糖-1-磷酸尿苷酰基转移酶的产品,可实现utp-葡萄糖-1-磷酸尿苷酰基转移酶的工业化大量生产。
上述说明并非对本发明的限制,本发明也并不限于上述举例。本技术领域的普通技术人员在本发明的实质范围内,做出的变化、改型、添加或替换,也应属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!