检测转基因大豆MON87712的试剂盒及方法与流程
本发明涉及生物检测领域,具体涉及一种转基因大豆的检测试剂盒,更具体地涉及一种转基因大豆mon87712的试剂盒及方法。
背景技术:
大豆是人类主要的油料作物和植物性蛋白来源,也是重要的工业原料,在中国粮食安全及国民经济中占有重要地位。大豆是一种“土地密集型”产品,一年一熟。中国人多地少,大豆绝对产量很低,因此,在种植大豆方面不具有优势。中国大豆主要依靠进口,大豆进口量占全球大豆贸易量的60%。据海关总署2020年1月14日发布数据,2019年12月中国大豆进口量为954.3万吨,同比飙升67%。
全球首例抗草甘膦转基因大豆诞生以来,转基因作物新品种培育不断取得突破进展,在改善农作物生产中发挥了明显的作用,也显露出巨大的潜力。随着转基因作物及其产品的不断推广和应用,各个国家对转基因作物的监管逐渐加强,建立准确的转基因生物检测方法是实现监管的前提,因此急需建立准确可靠、适用性广的定量检测方法做为相应的技术支撑。
据国际农业生物应用技术应用咨询服务中心(isaaa)的官方统计报告,世界上公布的已被批准商业化/种植和进口(食品和饲料)的转基因大豆品系共41种,jointresearchcentreofeuropeanunionreferencelaboratoryforgmfoodandfeed公布了其中26种品系的检测鉴定方法。目前,世界上还没有转基因大豆mon87712检测方法研究的报道。
mon87712品系转基因大豆是由美国孟山都公司研发,通过根瘤农杆菌介导的植物转化进行转基因性状的导入。转基因特性有草甘膦除草剂耐受性和增强光合作用/产量。2013年在美国首次被批准种植。截至2020年也只有美国批准其用作饲料和加工原料。关于mon87712研究的报道仅有cole,roberth.等人的发明专利。由于缺少标准品及相应的检测方法,还没有关于mon87712的检测研究。在应用pcr方法检测转基因产品时,需要设置阳性对照对检测活动进行监控,通常以从转基因基体标准物质中提取的基因组dna作为阳性质控对照。然而,像mon87712这种转基因大豆,目前世界上还没有阳性基体标准物质出售,这也成为建立相应检测方法的瓶颈所在。质粒标准物质是包含待测目的基因和内标基因的重组质粒分子,可作为标准阳性物质替代物,也可根据分子量换算计算拷贝数,在定量pcr检测中应用广泛。目前尚未见有关转基因大豆mon87712检测用质粒标准分子的报道。
近年来随着转基因技术的推广及商业化程度的加深,进口产品或市售大豆制品所含转基因成分越来越复杂,实际检测过程中常常会遇到样品混杂、纯度低或多拷贝整合等情况。本研究建立了一种转基因大豆品系的双重实时荧光定量pcr检测方法,验证了检测特异性、灵敏度、定量范围等参数。结果显示实验所设计的转基因大豆mon87712品系引物探针组合在双重实时荧光pcr方法中仅对目标大豆品系有荧光信号产生,可以进行特异性扩增,用于大豆转基因品的筛选与鉴别,方法也可以准确检测出大豆中转基因成分的含量,定量检测限可达10copy/μl。该方法的建立,为我国转基因监管工作提供了有力的技术支撑,同时也为未来我国转基因产品标识阈值管理增添了新的技术储备。
技术实现要素:
基于上述背景技术,本发明拟解决的技术问题在于提供一种检测转基因大豆mon87712的试剂盒及方法,其能够避免其它转基因大豆的干扰,并且具有高灵敏度的检测限。为了实现本发明的发明目的,拟采用如下技术方案:
本发明一方面涉及一种检测转基因大豆mon87712的试剂盒,其包括大豆内源性基因引物seqidno.02,lectin上游引物seqidno.03和下游引物seqidno.04,mon87712品系特异性检测基因seqidno.05、seqidno.06和seqidno.06。
在本发明的一个优选实施方式中,所述的试剂盒还包括线性质粒标准分子。
在本发明的一个优选实施方式中,所述的线性质粒标准分子包含序列为seqidno.01的核苷酸序列。
在本发明的一个优选实施方式中,所述的lectin下游引物seqidno.04的两端分别连接hex和bhq1。
在本发明的一个优选实施方式中,所述mon87712品系特异性检测基因seqidno.07的两端分别连接fam和bhq1。
本发明另一方面还涉及一种检测转基因大豆mon87712的方法,其特征在于采用上述试剂盒对大豆样品进行检测。
在本发明的一个优选实施方式中,所述的方法是双重实时荧光定量pcr检测方法。
在本发明的另一优选实施方式中,所述的方法是定量检测方法,其包括基于线性质粒标准分子得到标准曲线的步骤。
在本发明的一个优选实施方式中,所述的定量检测方法的检测限为10copy/ul。
在本发明的一个优选实施方式中,所述的待测样品还含有其它转基因大豆。
有益效果
本发明所涉及的转基因大豆mon87712品系引物探针组合在双重实时荧光pcr方法中仅对目标大豆品系有荧光信号产生,可以进行特异性扩增,用于大豆转基因品的筛选与鉴别。本发明建立的mon87712线性质粒标准分子将转基因大豆内源lectin基因和转基因大豆mon87712品系特异性检测基因整合到同一质粒载体上,可实现代替阳性基体标准物质,对转基因大豆mon87712进行品系特异性qpcr检测,可以准确检测出大豆中转基因成分的含量,定量检测限可达10copy/μl。
附图说明
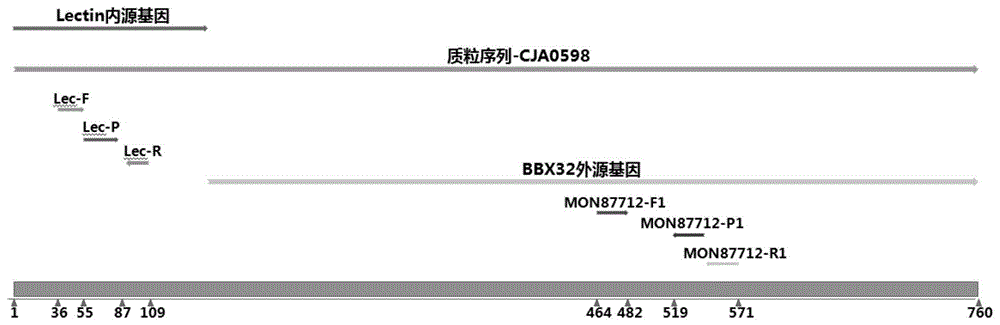
图1转基因大豆mon87712线性质粒标准分子示意图。
图2大豆内源基因和转基因大豆mon87712品系特异性检测基因电泳图谱。
图3转基因大豆mon87712品系特异性基因实时荧光pcr扩增图谱:其中a1、a2为大豆内源基因lectin扩增曲线;b1、b2为转基因大豆mon87712品系特异性检测qpcr扩增曲线。
图4大豆内源基因lectinqpcr扩增曲线及标准曲线:其中上图为大豆内源基因lectinqpcr扩增曲线;下图为大豆内源基因lectinqpcr标准曲线及参数。
图5转基因大豆mon87712品系特异性检测基因qpcr扩增曲线(上图)及标准曲线(下图)。
具体实施方式
为了进一步理解本发明,下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
如无特殊说明,本发明实施例中所涉及的试剂均为市售产品,均可以通过商业渠道购买获得。在本发明中,如果没有特别说明,所述的百分比以及比例关系是指质量百分比或质量比。
实施例1
材料与方法
材料与仪器
1.1.1试验材料
本研究使用的45种试验材料,具体信息见表1。
表1转基因材料来源
1.1.2试验试剂
dnaextractionkitofgeneticallymodifiedorganism(gmo)detectionver2.0(d9093,日本takara公司);tris-edta(te)溶液(ryx262,青岛捷世康科技有限公司);premixextaq(probeqpcr)(2xconc.)(rr390a,日本takara公司)。
1.1.3引物及探针
转基因大豆mon87712特异性引物及探针使用oligo7软件设计;相关的dna序列数据从公共数据库、专利和实验室内部dna序列分析获得。大豆内标基因lectin的探针5’荧光标记使用hex(六氯-6-甲基荧光素),mon87712侧翼序列探针5’荧光标记使用fam(6-羧基荧光素)。引物和探针序列及所使用的荧光标记如表2所示。引物和探针合成由宝生物工程(大连)有限公司合成。
表2引物和探针
1.1.4试验仪器
nd-1000超微量分光光度计(美国nanodrop公司);5910r高速冷冻离心机(德国eppendorf公司);qs6型和abi7500型实时荧光pcr反应仪(美国ab公司)。
1.2试验方法
1.2.1基因组核酸提取
试验材料放入液氮中研磨,然后采用takara公司的dnaextractionkitofgeneticallymodifiedorganism(gmo)detectionver2.0试剂盒进行基因组dna的提取。提取的基因组dna溶于100μltris-edta(te)溶液中。纯化后的dna样品用nd-1000超微量分光光度计测定浓度。
1.2.2生物信息学分析及检测质粒标准分子合成
mon87712转基因大豆是利用农杆菌介导的质粒载体pv-gmap5770对常规大豆a3525品种进行转化制备的(参见monsanto(2011)petitionforthedeterminationofnonregulatedstatusformon87712soybean.usdaaphispetitionnumber11-202-01p.)。质粒载体pv-gmap5770约为11.4kb,包含两个由左右边界区域划定的t-dna,以促进这种转化。第一个t-dna(i)包含在e35s启动子和e63'非翻译区调控下的bbx32编码序列。这种蛋白质调节植物的昼夜生理过程,从而增加同化物的利用率,延长光合作用活动时间,显著提高产量。第二个t-dna(t-dnaii)包含cp4epsps编码序列及其相关的启动子、引导子、内含子、靶向序列、3’utr作为标记基因,能够合成产生一种5-烯醇式丙酮酸-3-磷酸合成酶(epsps),降低了对草甘膦的结合亲和力,从而提高了对草甘膦除草剂的耐受性。
由于市面上没有转基因大豆mon87712标准品,因此,只能通过人工合成的方法进行检测质粒的合成。根据大豆内源基因lectin序列(genbank登录号:k00821)及mon87712大豆3’端和5’端旁侧序列,利用合成基因、连接、转化、质粒提取、酶切等分子克隆技术,将lectin基因片段(150bp)、mon87712转基因大豆中插入的外源基因bbx32基因及其边界序列(610bp)依次克隆到pmd-19t载体上(空载长度2692bp),构建检测质粒标准分子。后采用xbai酶切,进行线性化处理。制备出适用于检测的线性化质粒标准分子,其序列为seqidno.01,线性质粒标准分子的浓度为77.1ng/μl。
1.2.3检测方法
1.2.3.1反应组成及反应条件
总体系25μl,其中premixextaqtm(probeqpcr)(2xconc.)12.5μl,mon87712侧翼序列正向引物10μm1μl、反向引物10μm1μl、探针5μm1μl,大豆内源lectin基因正向引物10μm1μl、反向引物10μm1μl、探针5μm1μl,质粒标准分子(模板浓度按照不同试验要求加入)2μl,使用双蒸水补足至25μl。实时荧光pcr的反应参数为:预变性95℃30s;95℃5s,55℃10s,72℃20s,40个循环。
1.2.3.2引物特异性分析
采用双重实时荧光定量qpcr方法和46种试验材料验证mon87712引物探针的特异性,其中mon87712转基因大豆含量为100copy/μl。反应组成和反应条件按照1.2.3.1方法进行。
1.2.3.3稳定性、灵敏度和定量限测试
线性质粒标准分子的浓度为77.1ng/μl。根据其分子量大小(dna的平均分子量为660)计算出拷贝数,用te缓冲液梯度稀释至5×106、5×105、5×104、5×103、5×102、50、25、12.5、5、0.5、0.05copy/μl等11个浓度梯度。根据试验需要选取不同浓度分别进行稳定性、灵敏度和定量限测试。反应组成和反应条件按照1.2.3.1方法进行。每个浓度梯度设置6次平行。实时荧光定量qpcr数据分析采用ct值相对标准差(relativestandarddeviation,rsd)分析方法。
1.2.3.4标准曲线建立
以浓度为5×106、5×105、5×104、5×103、5×102、50、5copy/μl的mon87712线性质粒标准分子梯度稀释液为模板,采用大豆内源lectin基因引物探针和转基因大豆mon87712品系特异性检测基因引物探针进行双重实时荧光定量qpcr检测,反应组成和反应条件按照1.2.3.1方法进行。每个浓度梯度设置6次平行。利用公式ct=k×lga+b分别建立mon87712特异序列和lectin的标准曲线方程,其中ct为荧光qpcr反应中荧光信号超过相应阈值的循环数,k为曲线斜率,a为拷贝数值,b为截距。
2结果与分析
2.1质粒标准分子
由于市面上没有转基因大豆mon87712标准品,因此,只能通过人工合成的方法进行检测质粒标准分子的合成。将lectin基因片段(150bp)、mon87712转基因大豆中插入的外源基因bbx32基因及其边界序列(610bp)依次克隆到pmd-19t载体上(空载长度2692bp),构建检测质粒标准分子。后采用xbai酶切,进行线性化处理。制备出适用于检测的线性化质粒标准分子。线性化质粒标准分子全长760bp序列信息为seqidno.01所示。线性化质粒标准分子的基因位点及引物探针位点示意图如图1所示。
2.2引物特异性
对扩增的大豆内源基因和转基因大豆mon87712品系特异性检测基因扩增产物进行2%琼脂糖凝胶电泳,结果如图2所示。大豆内源基因引物扩增片段长度为74bp,转基因大豆mon87712品系特异性基因扩增片段长度为107bp。
qpcr方法特异性验证结果显示:转基因大豆mon87712品系特异性检测引物探针除扩增mon87712转基因大豆质粒标准分子外,其余大豆、玉米、油菜、苜蓿、红豆、绿豆、花生、大米、转基因棉籽、大麦、小麦等45种试验材料均未出现扩增曲线;大豆内源lectin基因引物探针,除扩增mon87712质粒标准分子和其余大豆品系外,其他的玉米、油菜、苜蓿、红豆、绿豆、花生、大米、转基因棉籽、大麦、小麦等26种试验材料均未出现扩增曲线。上述结果表明供试引物探针具有很好的特异性(如表3所示)。转基因大豆mon87712质粒标准分子双重实时荧光pcr扩增图谱见图3。
表3转基因大豆mon87712品系双重实时荧光定量pcr检测特异性结果
2.3双重实时荧光定量qpcr检测方法建立
2.3.1标准曲线
根据eurl对qpcr标准回归曲线的各项参数的详细规定,标准曲线的线性相关系数r2≥0.98,扩增效率e[efficiency=10(-1/slpoe)-1]的范围为90%~110%,斜率(slope)范围为-3.1~-3.6。本研究中的大豆内源基因lectin的标准曲线方程为y=-3.093lgx+39.77,转基因大豆mon87712品系特异性检测基因的标准曲线方程为y=-3.196lgx+39.81,qpcr的标准曲线方程中各项参数均在规定范围内,表示该方法适合转基因大豆mon87712品系特异性的定量分析。大豆内源基因lectinqpcr扩增曲线及标准曲线见图4,转基因大豆mon87712品系特异性检测基因qpcr扩增曲线及标准曲线见图5。
2.3.2稳定性分析
qpcr方法的稳定性是影响转基因定量结果的重要指标。对105、104、103、102、50、25、10copy/μl的7种不同转基因含量的质粒标准分子进行实时荧光qpcr试验,大豆内源lectin基因检测ct值sd范围为0.04~0.29,rsd范围为0.16%~0.82%;转基因大豆mon87712品系特异性基因检测ct值sd范围为0.13~0.90,rsd范围为0.40%~2.65%,均符合eurl规定的rsd范围≤25%的阈值范围,说明试验的稳定性较好。结果见表4。
表4转基因大豆mon87712质粒标准分子双重qpcr检测效果
2.3.3灵敏度和定量限测试
对105、104、103、102、50、25、10、1、0.1copy/μl等9个浓度mon87712质粒标准分子进行双重qpcr测试,含量为105~0.1copy/μl的样品均能被检出,说明该方法的灵敏度较好,检出限可达到0.1copy/μl。但模板在1、0.1copy/μl浓度条件下,其6次重复的相对标准差rsd高于25%的阈值范围,说明在这个相对含量下的定量结果精密度较差,而10copy/μl浓度以上含量的定量结果精密度小于25%,因此该方法的定量下限可达到10copy/μl。结果见表5。
表5qpcr方法灵敏度测试:lectin和mon87712
以上描述了本发明优选实施方式,然其并非用以限定本发明。本领域技术人员对在此公开的实施方案可进行并不偏离本发明范畴和精神的改进和变化。
序列表
<110>大连海关技术中心
<120>检测转基因大豆mon87712的试剂盒及方法
<160>7
<170>siposequencelisting1.0
<210>1
<211>760
<212>dna
<213>大豆(glycinemax(linn.)merr.)
<400>1
catccacatttgggacaaagaaaccggtagcgttgccagcttcgccgcttccttcaactt60
caccttctatgcccctgacacaaaaaggcttgcagatgggcttgccttctttctcgcacc120
aattgacactaagccacaaacacatgcaggctcaaataaagtacagtatttctacatttg180
atgtgtgatttgtgaagaacatcaaacaaaacaagcactggctttaatatgatgataagt240
attatggtaattaattaattggcaaaaacaacaatgaagctaaaattttatttattgagc300
cttgcggttaatttcttgtgatgatctttttttttattttctaattatatatagtttcct360
ttgctttgaaatgctaaaggtttgagagagttatgctctttttttcttcctctttctttt420
ttaactttatcatacaaattttgaataaaaatgtgagtacattctcgagcaggacctgca480
gaagctagcttgatggggatcagattgtcgtttcccgccttcagtttaaactatcagtgt540
ttgatttacttaaacgaggtaattgtaaaacttaaacttgatatagttaaatgttatata600
tatatatatataatacttaacttatttaattatcaaaatttattttgaaccaaactttta660
ctaatttaatattaatttatttttttgttaaaaaggcaagtaaagtaataaaaaaattca720
taaaatgatttaaaattatagagtgataaacttatctttt760
<210>2
<211>20
<212>dna
<213>大豆(glycinemax(linn.)merr.)
<400>2
ccagcttcgccgcttccttc20
<210>3
<211>23
<212>dna
<213>大豆(glycinemax(linn.)merr.)
<400>3
gaaggcaagcccatctgcaagcc23
<210>4
<211>24
<212>dna
<213>大豆(glycinemax(linn.)merr.)
<400>4
cttcaccttctatgcccctgacac24
<210>5
<211>18
<212>dna
<213>大豆(glycinemax(linn.)merr.)
<400>5
gtgagtacattctcgagc18
<210>6
<211>22
<212>dna
<213>大豆(glycinemax(linn.)merr.)
<400>6
cctcgtttaagtaaatcaaaca22
<210>7
<211>22
<212>dna
<213>大豆(glycinemax(linn.)merr.)
<400>7
cgggaaacgacaatctgatccc22
- 还没有人留言评论。精彩留言会获得点赞!