一种单波长激发区分检测GSH和H2Sn(n>1)的荧光探针的制作方法
本发明属于化学分析检测技术领域,具体涉及一种单波长激发同时区分检测gsh和h2sn(n>1)的荧光探针,以及该探针在检测gsh和h2sn(n>1)中的应用。
背景技术:
活性硫物种是生物体中不可或缺的,在生理和病理过程中有着重要的作用。谷胱甘肽(gsh)和多硫化氢(h2sn(n>1))在抗氧化作用、细胞凋亡以及信号传导方面有着重要的作用。随着对gsh和h2sn生物学功能的深入研究,越来越多的研究表明这两种活性硫在生物体系中相互关联。例如,细胞以gsh为硫源,通过胱硫醚-γ-裂合酶(cse)和胱硫醚-β-合酶(cbs)酶促产生。在哺乳动物的血浆、细胞和组织中均能检测到高水平含量的h2sn前体,即谷胱甘肽氢过硫化物(>100μm)。细胞内每种活性硫物种的浓度异常可能对其他活性硫物种的浓度产生影响,这会引起严重的健康问题。为研究gsh和h2sn之间复杂的生物学关系,开发能同时区分检测gsh和h2sn的荧光探针非常有价值。
荧光探针技术因其操作方便、无损检测、时空分辨率高等优点,已成为有效的分析检测方法。2017年,chen等(analyticalchemistry,2017,89(23),12984-12991)报导了区分检测gsh和h2sn(n>1)的荧光探针,但该荧光探针发射波长较短,在蓝光和绿光区域;此外在应用的过程中需要双波长激发。双波长激发型探针需根据分析目标的不同,设置不同激发波长等相关仪器参数,使得操作较为繁琐,并且多波长激发会造成不必要的背景干扰,对检测结果的准确性造成影响。与之相反,单波长激发型探针在单一波长激发工作,使荧光检测和生物成像更加便利和高效,并且能减少多波长激发引起的背景干扰,在细胞成像时可以有效降低细胞自身产生的荧光干扰,准确性更高。此外,红光或近红外光具有很好的组织穿透性、较小的背景干扰性,以提高检测的准确度。目前,开发单波长激发且具有长波长发射,用于区分检测gsh和h2sn(n>1)的荧光探针仍是挑战。
技术实现要素:
为克服现有技术的不足,本发明旨在提供一种单波长激发区分检测gsh和h2sn(n>1)并具有红光发射的荧光探针。
本发明中的荧光探针,其分子结构如下:
本发明中的荧光探针通过以下反应制备,合成过程如下:
具体合成方法如下:将化合物4和化合物8溶于无水二氯甲烷中,再加入1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐和4-二甲氨基吡啶。在氮气保护下,室温反应,得到粗产品,用硅胶柱层进行分离提纯得到橙黄色固体产品,即探针。
本发明的荧光探针的检测机制如下:
荧光探针与gsh反应时,由于巯基的亲核性,苯硒醚部分(site1)被gsh的巯基取代,发出绿色荧光。与h2sn反应时,先与探针位点1发生亲核取代反应,接着与位点2发生分子内环化反应,发出红色荧光。
本发明的荧光探针选择na2s2作为h2sn的来源,因h2s2与其他多硫化氢(h2sn,n>2)间存在动态平衡。
本发明的荧光探针是单波长激发型区分检测gsh和h2sn(n>1)的荧光探针,在测试过程中设置激发波长为480nm。
本发明的荧光探针与gsh反应后最大发射峰在530nm,与na2s2反应后最大发射峰在670nm。
本发明的荧光探针选择性好。探针分子的测试体系为ph为7.4的10mm的pbs缓冲溶液包含1.0mmctab,25℃下测试。探针分子本身处于荧光猝灭状态,在加入4.0倍当量谷胱甘肽(gsh)之后,在最大发射波长530nm处荧光强度增大了2.7倍。而在加入其检测物(nacl、kcl、cacl2、zncl2、mgcl2、naclo、na2s2o3、na2so3、nahso3、na2so4、na2s、h2o2、l-pro、l-ser、l-glu、dl-tyr、cys和hcy)后,荧光几乎没有增加。
本发明的荧光探针选择性好。探针分子的测试体系为ph为7.4的10mm的pbs缓冲溶液包含1.0mmctab,25℃下测试。在加入18倍当量过硫化钠(na2s2)后,在最大发射波长670nm处荧光强度增大了8倍。而在加入其检测物(nacl、kcl、cacl2、zncl2、mgcl2、naclo、na2s2o3、na2so3、nahso3、na2so4、na2s、h2o2、l-pro、l-ser、l-glu、dl-tyr、cys和hcy后,荧光几乎没有增加。
本发明的荧光探针抗干扰能力较强,在其他检测物(nacl、kcl、cacl2、zncl2、mgcl2、naclo、na2s2o3、na2so3、nahso3、na2so4、na2s、h2o2、l-pro、l-ser、l-glu、dl-tyr、cys和hcy)的存在下几乎不影响检测谷胱甘肽(gsh)和过硫化钠(na2s2)的效果。
本发明的荧光探针与分别加入4.0倍当量谷胱甘肽(gsh)作用后,荧光立即增强,在4.5分钟达到最大值。加入18倍当量过硫化钠(na2s2)后,荧光立即增强,在45分钟达到最大值。
本发明的荧光探针可以对谷胱甘肽(gsh)和过硫化钠(na2s2)分别进行定量检测。本发明的荧光探针线性较好,线性相关系数分别为:谷胱甘肽(gsh)r=0.9959,过硫化钠(na2s2)r=0.9976。
本发明的荧光探针具有很好的细胞膜穿透性,可以用于细胞内谷胱甘肽(gsh)和过硫化钠(na2s2)的检测。
本发明所述的探针ph应用范围较宽,从ph=6.0到ph=9.0均可检测。
本发明所述的探针分子对过硫化钠(na2s2)响应后具有红光发射。
本发明所述的探针分子在单波长激发下即可实现对谷胱甘肽(gsh)和过硫化钠(na2s2)的同时区分检测。
附图说明
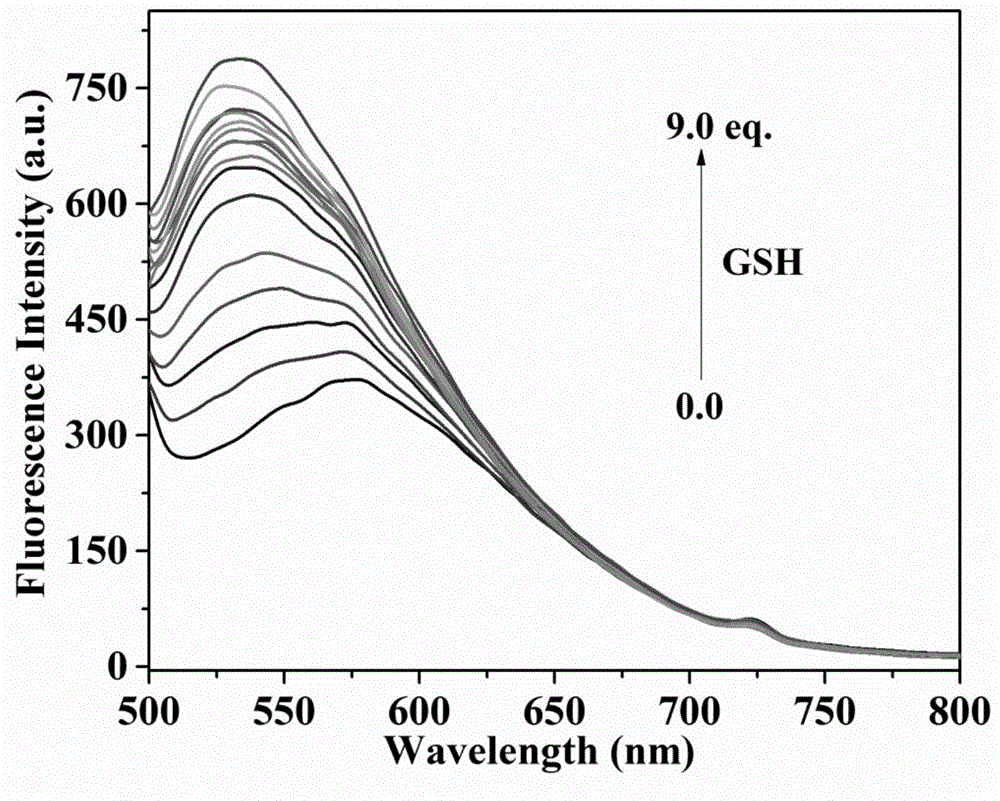
图1为本发明的荧光探针(10.0μm)在pbs缓冲溶液(10mm,ph=7.4,1.0mmctab)中,与不同浓度谷胱甘肽(gsh)作用后的荧光光谱变化,横坐标为波长,纵坐标为荧光强度。
图2为本发明的荧光探针(10.0μm)在pbs缓冲溶液(10mm,ph=7.4,1.0mmctab)中,与谷胱甘肽(gsh)作用过程中530nm处荧光强度随浓度的线性关系,横坐标为浓度,纵坐标为荧光强度。
图3为本发明的荧光探针(10.0μm)在pbs缓冲溶液(10mm,ph=7.4,1.0mmctab)中,与不同浓度过硫化钠(na2s2)作用后的荧光光谱变化,横坐标为波长,纵坐标为荧光强度。
图4为本发明的荧光探针(10.0μm)在pbs缓冲溶液(10mm,ph=7.4,1.0mmctab)中与半同型过硫化钠(na2s2)作用过程中670nm处荧光强度随时间的线性关系,横坐标为浓度,纵坐标为荧光强度。
图5为本发明的荧光探针的选择性,荧光探针在(10.0μm)在pbs缓冲溶液(10mm,ph=7.4,1.0mmctab)与gsh和其他分析物(nacl、kcl、cacl2、zncl2、mgcl2、naclo、na2s2o3、na2so3、nahso3、na2so4、na2s、h2o2、l-pro、l-ser、l-glu、dl-tyr、cys和hcy)作用后的荧光强度比值(iprobe+others/iprobe)柱状图。
图6为本发明的荧光探针的选择性,荧光探针在(10.0μm)在pbs缓冲溶液(10mm,ph=7.4,1.0mmctab)与na2s2和其他分析物(nacl、kcl、cacl2、zncl2、mgcl2、naclo、na2s2o3、na2so3、nahso3、na2so4、na2s、h2o2、l-pro、l-ser、l-glu、dl-tyr、cys和hcy)作用后的荧光强度比值(iprobe+others/iprobe)柱状图。
图7为本发明的荧光探针的抗干扰性,谷胱甘肽(gsh)与分析物(nacl、kcl、cacl2、zncl2、mgcl2、naclo、na2s2o3、na2so3、nahso3、na2so4、na2s、h2o2、l-pro、l-ser、l-glu、dl-tyr、cys和hcy)共存时,与荧光探针(10.0μm)在pbs缓冲溶液(10mm,ph=7.4,1.0mmctab)中与谷胱甘肽(gsh)作用后的荧光强度比值(iprobe+others/iprobe+gsh)柱状图。
图8为本发明的荧光探针的抗干扰性,过硫化钠(na2s2)与分析物(nacl、kcl、cacl2、zncl2、mgcl2、naclo、na2s2o3、na2so3、nahso3、na2so4、na2s、h2o2、l-pro、l-ser、l-glu、dl-tyr、cys和hcy)共存时,与荧光探针在(10.0μm)在pbs缓冲溶液(10mm,ph=7.4,1.0mmctab)中与同型半胱氨酸(hcy)作用后的荧光强度比值(iprobe+others/iprobe+na2s2)柱状图。
图9为本发明的荧光探针(10.0μm)在pbs缓冲溶液(10mm,ph=7.4,1.0mmctab)中,探针与谷胱甘肽(gsh)作用过程中530nm处荧光强度随时间的变化,横坐标为时间,纵坐标为荧光强度。
图10为本发明的荧光探针(10.0μm)在pbs缓冲溶液(10mm,ph=7.4,1.0mmctab)中,探针与过硫化钠(na2s2)作用过程中670nm处荧光强度随时间的变化,横坐标为时间,纵坐标为荧光强度。
图11为本发明的荧光探针(10.0μm)在不同ph值缓冲溶液中,与谷胱甘肽(gsh)作用前后的荧光强度,横坐标为ph,纵坐标为荧光强度。
图12为本发明的荧光探针(10.0μm)在不同ph值缓冲溶液中,与过硫化钠(na2s2)作用前后的荧光强度,横坐标为ph,纵坐标为荧光强度。
图13为本发明的荧光探针检测raw264.7细胞内谷胱甘肽(gsh)与过硫化钠(na2s2)的共聚焦细胞成像。a1-a3为为探针(10.0μm)在37℃时在细胞内培育30分钟的成像效果。b1-b3为细胞在37℃时先用过硫化钠(na2s2)(220.0μm)培育15分钟,随后用探针(10.0μm)培育30分钟的成像效果。c1-c3为细胞在37℃时先用n-乙基马来酰亚胺(1mm)预处理15分钟,再用探针(10.0μm)培育30分钟的成像效果。
图14为本发明的荧光探针检测raw264.7细胞内源性过硫化钠(na2s2)的共聚焦细胞成像。a1-a3为细胞在37℃时先用脂多糖(lps)(1μg/ml)孵育8小时。再用nem(1mm)处理15分钟。然后,与胱氨酸(200μm)一起孵育30分钟。最后,与探针(10.0μm)一起孵育30分钟的成像效果。b1-b3为细胞在37℃时先用nem(1mm)处理15分钟。然后,与胱氨酸(200μm)一起孵育30分钟。最后,与探针(10.0μm)一起孵育30分钟的成像效果。
具体实施实例
实施例1:化合物2的合成
将间苯二酚(7.707g,70.0mmol)和化合物1(0.979g,3.5mmol)溶于10.0ml乙腈。将混合物在0℃下搅拌5分钟。将亚氯酸钠(1.112g,12.3mmol)和磷酸二氢钠(1.896g,15.8mmol;溶于1.5ml水中)加入到上述混合物中。0℃下搅拌反应30分钟后,倒入50ml冰水中。用1mol/l盐酸溶液酸化混合物,形成大量黄色沉淀。抽滤并洗涤得到0.751g黄褐色固体为化合物2,产率:76.2%。
实施例2:化合物3的合成
将二苯基二硒醚(0.218g,0.7mmol)和硼氢化钠(0.034g,0.9mmol)溶于2.5ml无水乙醇。在氮气保护下,将混合物在室温搅拌反应10分钟,得到化合物3,无色透明溶液。本步产物无需纯化可直接用于下一步合成。
实施例3:化合物4的合成
将化合物2(0.180g,0.6mmol)和化合物3(0.110g,0.7mmol)溶于5.0ml无水n,n-二甲基甲酰胺。并加入三乙胺(240.0μl,1.8mmol)作为缚酸剂。在室温下搅拌反应20分钟,然后将混合物倒入50ml水中。并用二氯甲烷萃取,合并有机层。减压除去有机溶剂,得到0.243g橙色固体为化合物4,产率98.0%。
实施例4:化合物6的合成
将化合物5(0.760g,5.5mmol)、丙二腈(0.436g,6.6mmol)溶于10.0ml无水乙醇。然后加入催化量的哌啶和乙酸,搅拌溶解均匀。在氮气保护下将混合物加热至回流,反应6小时。反应结束后,将混合物倒入去离子水中,用二氯甲烷萃取,保留有机相。减压除去溶剂后,将所得粗产物通过硅胶(100-200目)柱层析纯化,洗脱剂为石油醚/乙酸乙酯(体积比:4/1)。得到0.809g浅黄色固体为化合物6,产率:79.0%。
实施例5:化合物8的合成
将化合物6(0.745g,4.0mmol)和化合物7(0.525g,4.3mmol)溶于15.0ml甲苯。搅拌均匀后,依次加入600.0μl乙酸和1.5ml哌啶。在氮气保护下,加热至回流,搅拌反应6小时。反应结束后,减压除去溶剂,得到粗产物。粗产物用硅胶(100-200目)柱层析纯化,洗脱剂为二氯甲烷/石油醚(体积比:9/1)。得到0.607g橙色固体为化合物8,产率52.3%。
实施例6:探针的合成
分别称取化合物4(0.835g,2.0mmol)、化合物8(0.638g,2.2mmol)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(0.421g,2.2mmol)和4-二甲氨基吡啶(0.269g,2.2mmol)。以5.0ml二氯甲烷作溶剂。在氮气保护下,室温搅拌反应5小时。反应完成后,减压除去溶剂,得粗产物。粗产物用硅胶(100-200目)柱层析纯化,洗脱剂为二氯甲烷/乙酸乙酯(体积比:10/1)。得到0.777g橙色固体为探针,产率56.4%。
实施例7:探针分子检测细胞中半谷胱甘肽(gsh)与过硫化钠(na2s2)的应用
内源性gsh检测:将raw264.7细胞先与含探针(10μm)的pbs缓冲液一起孵育30分钟。用pbs缓冲液清洗细胞3次后,用激光共聚焦荧光显微镜进行细胞荧光成像实验。可以看到绿色荧光信号。
外源性na2s2检测:将raw264.7细胞先与含na2s2(220μm)的pbs缓冲液一起孵育15分钟。然后,用pbs缓冲液漂洗细胞3次,再与含探针(10μm)的pbs缓冲液孵育30分钟,用pbs缓冲液漂洗细胞3次,进行细胞荧光成像实验。可以看到红色荧光信号。
对照实验:先将raw264.7细胞用含n-乙基马来酰亚胺(nem,1mm)的pbs缓冲液预处理15分钟。随后用pbs缓冲液漂洗细胞3次,再与含探针(10μm)的pbs缓冲液孵育30分钟。最后,用pbs缓冲液漂洗细胞3次后,进行细胞荧光成像实验。无明显荧光信号。
实施例8:探针分子检测细胞中内源性过硫化钠(na2s2)的应用
内源性na2s2检测:将raw264.7细胞用含1μg/ml脂多糖(lps)的pbs缓冲液一起孵育8小时。然后,将细胞用pbs缓冲液漂洗3次,用含nem(1mm)的pbs缓冲液预处理15分钟。接下来,用pbs缓冲液漂洗细胞3次,与含胱氨酸(200μm)的pbs缓冲液一起孵育30分钟。最后,将细胞用pbs缓冲液漂洗3次,与含探针(10μm)的pbs缓冲液孵育30分钟。用pbs缓冲液漂洗细胞3次后,进行细胞荧光成像实验。可以观察到红色荧光信号,实现内源性na2s2检测。
对照实验:将细胞用含nem(1mm)的pbs缓冲液预处理15分钟。然后,用pbs缓冲液漂洗细胞3次,与含胱氨酸(200μm)的pbs缓冲液一起孵育30分钟。最后,用pbs缓冲液漂洗细胞3次,与含探针(10μm)的pbs缓冲液一起孵育30分钟。用pbs缓冲液漂洗细胞3次后,进行细胞荧光成像实验。无明显荧光荧光信号。
- 还没有人留言评论。精彩留言会获得点赞!