高效分离培养乳鼠心肌细胞和心肌成纤维细胞的方法与流程
本发明属于细胞分离培养技术领域,具体涉及一种高效分离培养乳鼠心肌细胞和心肌成纤维细胞的方法。
背景技术:
心肌细胞和心肌成纤维细胞是心脏生长发育、生理、代谢、病理等研究中的主要研究对象。因此,心肌细胞和心肌成纤维细胞原代培养技术已经广泛应用于心血管疾病基础研究及心血管药物开发等研究中。目前,对大/小鼠乳鼠的心肌细胞和成纤维细胞的分离方法有:1、机械分离法;2、langendorff离体灌流法;3、酶消化法。其中langendorff法需要特殊的设备,且操作复杂,多用于大/小鼠成鼠的分离;机械分离法对细胞损伤较大,细胞存活率较低;酶消化操作简单,对细胞伤害较小,细胞得率高,能够更高效地分离和培养大/小鼠乳鼠原代心肌细胞和成纤维细胞。
专利cn104830759a公开了一种大鼠乳鼠心肌细胞的分离方法,该方法采用单纯胰蛋白酶消化分离心肌细胞的方法。胰蛋白酶消化的原理是使细胞间的蛋白质水解,从而使细胞离散。但是胰蛋白酶对细胞的伤害极大,很难控制单次消化时间和吹打细胞的力度,并且胰蛋白酶工作效率与动物种属,组织来源,浓度,温度和工作时间均有关系。单纯胰蛋白酶消化分离心肌细胞的过程中,对任意一个条件控制不到位,都会影响细胞分离效率。因此,单纯胰蛋白酶消化分离的心肌细胞往往活力差,死细胞多,贴壁细胞少,且基本无法观察到心肌细胞搏动。
专利cn105907708a公开了一种原代小鼠或大鼠心肌细胞的分离培养方法,该方法采用质量比为1:1:1:1的i型胶原酶、ii型胶原酶、iv型胶原酶和dispase酶(一种非特异的金属蛋白酶)的复合酶进行4度消化过夜的方法进行分离。此方法可以对心肌组织中不同分型的胶原成分进行特异性消化,有效减少胰蛋白酶对细胞的损伤。但是不使用胰蛋白酶消化会降低消化效率,并且复合酶的配置大大增加了每次细胞分离的成本,不适用于大量原代细胞的分离培养。
专利cn111154715a公开了一种心肌细胞分离培养方法,该方法适用于大/小鼠,采取先用i型胶原酶消化0.5~3小时,再用加入胰蛋白酶吹打10~300次,终止消化后种板培养。此方法较前一种方法降低了消化酶成本,但胰蛋白酶反复吹打对细胞伤害极大。方法中提到的消化时间和吹打次数较为宽泛,并且并未提到消化时间和吹打次数的确定条件,需要使用者多次预实验确定,不利于快速建立实验方法。
技术实现要素:
本发明要解决的技术问题为:现有大/小鼠乳鼠心肌细胞及心肌成纤维细胞分离效率低、活性差、操作条件不易控制的问题。
本发明解决上述技术问题的技术方案为:提供了一种高效分离培养乳鼠心肌细胞及心肌成纤维细胞的方法。该方法包括以下步骤:
a、取乳鼠心脏,置于含blebbistatin的pbs溶液中清洗后,转移至含胰蛋白酶的分离液中,剪碎心脏成小的组织块;
b、将步骤a所述组织块在10~15ml分离液中消化,2~8℃消化4~12小时后,吸走上清,剩余物中加入消化液,在37℃下消化20~30min;
c、步骤b消化完成后,采用移液管吹打混匀,静置,转移上部悬浮液,对静置后下部的组织块再加入消化液,在37℃下消化20~30min,直至无肉眼可见组织块;
d、将步骤c消化后得到的悬浮液混合,离心,弃上清,采用铺板培养基重悬细胞,孵育30~60min,成纤维细胞铺于相应孔板中,上清中的细胞即为心肌细胞。
其中,上述高效分离培养乳鼠心肌细胞及心肌成纤维细胞的方法中,步骤a所述的blebbistatin为购自medchemexpress公司的货号为hy-13813的产品,浓度为3~5um。
其中,上述高效分离培养乳鼠心肌细胞及心肌成纤维细胞的方法中,步骤a所述的分离液组成包括:3~5umblebbistatin,0.25%胰蛋白酶,不含钙镁的hbss缓冲液。
其中,上述高效分离培养乳鼠心肌细胞及心肌成纤维细胞的方法中,步骤a所述的乳鼠为大鼠或小鼠,组织块大小为0.5~1mm3。
其中,上述高效分离培养乳鼠心肌细胞及心肌成纤维细胞的方法中,步骤b、c所述的消化液组成包括:3~5umblebbistatin,1~1.5mg/mlii型胶原酶,l15培养基。
其中,上述高效分离培养乳鼠心肌细胞及心肌成纤维细胞的方法中,步骤b、c所述消化的具体操作过程为:在水浴37℃条件下,2~3min内将组织块与消化液摇匀,之后置于旋转混匀器中旋转摇晃消化,旋转转速为10~20rpm,倾斜角度10~15°。
其中,上述高效分离培养乳鼠心肌细胞及心肌成纤维细胞的方法中,步骤b、c所述消化液加入量为5~10ml。
其中,上述高效分离培养鼠乳鼠心肌细胞及心肌成纤维细胞的方法中,步骤d所述离心为200~300g,离心3~5min。
其中,上述高效分离培养乳鼠心肌细胞及心肌成纤维细胞的方法中,步骤d所述铺板培养基组成包括:65%dmem培养基,19%m-199培养基,15%胎牛血清fbs,1%双抗。
本发明的有益效果为:
本方法能够高效分离心肌细胞,同时获得心肌成纤维细胞,本发明采用胰蛋白酶消化一次,配合ii型胶原酶消化两次,消化效果好,得到的细胞活性强,能在显微镜下观察到明显的自发性搏动,分离的心肌成纤维细胞得率高,能够最大程度满足实验人员对心肌细胞和心肌成纤维细胞分离数量的要求。本发明方法操作简单,且条件容易控制,分离时间较现有方法缩短,分离成本较现有方法降低,适宜用来工业化分离心肌细胞和成纤维细胞。
附图说明
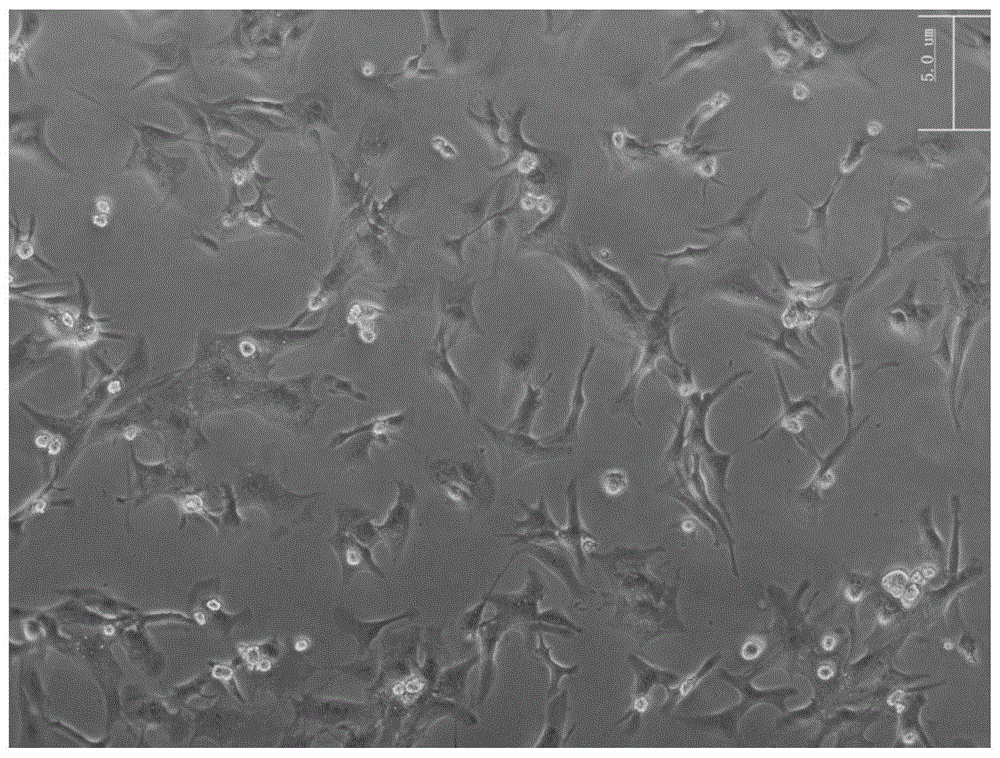
图1所示为本发明实施例1分离培养的大鼠乳鼠心肌细胞培养1天后的形态图(bar=5um);
图2所示为本发明实施例1分离培养的大鼠乳鼠心肌成纤维细胞培养1天后的形态图(bar=20um);
图3所示为本发明实施例2分离培养的小鼠乳鼠心肌细胞培养1天后的形态图(40x);
图4所示为本发明实施例2分离培养的小鼠乳鼠心肌成纤维细胞培养1天后的形态图(40x)。
具体实施方式
本发明提供了一种高效分离培养乳鼠心肌细胞及心肌成纤维细胞的方法,包括以下步骤:
a、取乳鼠心脏,置于含blebbistatin的pbs溶液中清洗后,转移至含胰蛋白酶的分离液中,剪碎心脏成小的组织块;
b、将步骤a所述组织块在10~15ml分离液中消化,2~8℃消化4~12小时后,吸走上清,剩余物中加入消化液,在37℃下消化20~30min;
c、步骤b消化完成后,采用移液管吹打混匀,静置,转移上部悬浮液,对静置后下部的组织块再加入消化液,在37℃下消化20~30min,直至无肉眼可见组织块;
d、将步骤c消化后得到的悬浮液混合,离心,弃上清,采用铺板培养基重悬细胞,孵育30~60min,成纤维细胞铺于相应孔板中,上清中的细胞即为心肌细胞。
本发明在整个消化体系中应用了3~5umblebbistatin,这种低剂量的blebbistatin一方面可最大程度减少心肌细胞在消化过程中自主收缩而导致的能耗增加,也不至于产生明显的细胞毒性,有助于提高原代心肌细胞的活性及得率。
其中,上述高效分离培养大/小鼠乳鼠心肌细胞及心肌成纤维细胞的方法中,步骤a所述的分离液组成包括:3~5umblebbistatin,0.25%胰蛋白酶,不含钙镁的hbss缓冲液。
本发明所用的分离液采用hbss缓冲液配制,其中含有葡萄糖,相较于pbs缓冲液,能够为组织细胞提供能量。使用胰蛋白酶的浓度为0.25%,该浓度不足以对细胞膜蛋白进行水解,不会造成过度消化,避免了胰蛋白酶对细胞的伤害。
其中,上述高效分离培养乳鼠心肌细胞及心肌成纤维细胞的方法中,步骤a所述的乳鼠为大鼠或小鼠,组织块大小为0.5~1mm3。
其中,上述高效分离培养大/小鼠乳鼠心肌细胞及心肌成纤维细胞的方法中,步骤b、c所述的消化液组成包括:3~5umblebbistatin,1~1.5mg/mlii型胶原酶,l15培养基。
本发明采用l15培养基来配置ii型胶原酶,相较其他培养基配制的酶溶液,该培养基更适合胚胎或新生小鼠原代细胞的分离。本发明仅使用一种胶原酶,且用量较少,使配制消化液的过程简化,配制成本降低。同时,胶原酶消化的总时长明显缩短,仅需1~2次ii型胶原酶消化,便能使所有心肌细胞从组织中释放出来,缩短了心肌细胞或心肌成纤维细胞与胶原酶接触的时间。
其中,上述高效分离培养乳鼠心肌细胞及心肌成纤维细胞的方法中,步骤b、c所述消化的具体操作过程为:在水浴37℃条件下,2~3min内将组织块与消化液摇匀,之后置于旋转混匀器上旋转摇晃消化,旋转转速为10~20rpm,倾斜角度10~15°。本发明在旋转混匀仪(混匀仪角度为10~15°,转速:每分钟10~20rpm)上消化组织,相较于以往的人工手摇消化或在水平摇床上震荡消化的方法,可降低细胞在消化时的机械应力,增加组织与空气接触机会,提高了原代细胞的活性,并可以保证批次间的一致性。
其中,上述高效分离培养乳鼠心肌细胞及心肌成纤维细胞的方法中,步骤b、c所述消化液加入量为5~10ml。
其中,上述高效分离培养鼠乳鼠心肌细胞及心肌成纤维细胞的方法中,步骤d所述离心为200~300g,离心3~5min。
其中,上述高效分离培养乳鼠心肌细胞及心肌成纤维细胞的方法中,步骤d所述铺板培养基组成包括:65%dmem培养基,19%m-199培养基,15%胎牛血清fbs,1%双抗。
现有方法中因多次胰蛋白酶/胶原酶的方法,在消化时间、消化强度及消化等一系列操作均难以标准化,导致实验批次间细胞得率及活性差异较大。尤其是对于新手,由于不易把握消化的程度,因此学习曲线陡峭。本发明方法几乎全部操作均有机器完成,可保证每次心肌细胞及成纤维细胞活性及得率的稳定,避免了此前的方法对成纤维细胞造成的损伤,极大程度提升成纤维细胞的得率,能够高效稳定地获得心肌细胞和心肌成纤维细胞。
下面将通过实施例对本发明的具体实施方式做进一步的解释说明,但不表示将本发明的保护范围限制在实施例所述范围内。
本发明所用的仪器及试剂,除实施例中明确给出的外,其余试剂均为普通市售产品。
实施例1用本发明方法分离大鼠乳鼠心肌细胞和成纤维细胞
具体的操作步骤如下:
实验所需的试剂,按照比例配制:
试剂1:50mlpbs(不含钙镁)(hyclone)+5umblebbistatin。
试剂2:10ml分离液:5umblebbistatin,0.25%胰蛋白酶(碧云天,c0201~100ml)inhbss(碧云天,c0218)(不含钙镁)。
试剂3:30ml消化液:5umblebbistatin,1.5mg/mlii型胶原酶(worthington,ls004176)inl15培养基。
试剂4:20mll15培养基(hyclone,sh30525.01)+5umblebbistatin。
试剂5:铺板培养基:65%dmem(高葡萄糖)(hyclone,sh30243.01)+19%m-199(hyclone,sh30253.01)+15%胎牛血清fbs(bi)+1%双抗(碧云天,c0222)。
试剂6:成纤维细胞培养基:dmem+10%fbs+1%双抗。
实验步骤:
1、取出生1~3天大鼠乳鼠的心脏,放入试剂1中,并置于冰上操作;
2、用pbs(含5umblebbistatin)充分清洗心脏,至心脏中的血清洗干净;
3、将心脏收集,转移到另一培养皿的,用巴士吸管滴1~2滴试剂2,并用弯剪剪碎心脏,剪至大小约0.5mm3的组织块;
4、加入10ml试剂2冲洗组织块,并转移至50ml离心管中,4℃过夜(12h)混匀孵育,可平放至水平摇床,以20~30rpm的转速孵育;
5、从4℃冰箱取出消化12小时后的混悬液(此时组织块将结团),将上清吸走(避免吹散组织块,可剩余1ml消化液)。然后加入10ml试剂3,和10ml的试剂4,并用吸管吹打混合液1min,以减少组织缺氧;
6、将盛有组织块的50mlbd管在37℃水浴锅中摇匀3min,以迅速平衡消化液温度;
7、将组织块置于旋转混匀器上,放入37℃培养箱中,旋转混匀(20rpm,倾斜角度15°),30min;
8、用5ml试剂4提前润湿细胞滤网(70um),将装有组织块的50ml离心管从混匀器取出,用胶头滴管反复轻柔吹打混匀组织块(20次),组织块将很容易的被吹散,细胞将释放到上清;
9、静置混匀液,待大的组织块沉淀到管底,将混有细胞的悬液通过提前润湿的细胞筛网,转移到新的50ml离心管;
10、剩余的大组织块再用5ml试剂3消化,重复步骤7;
11、消化完后,用胶头滴管轻柔吹打混匀细胞沉淀20次,过细胞滤网,5mll15培养基(含5umblebbistatin)洗滤网;
12、离心200g,5min,弃上清,用10ml的试剂5重悬。
13、将细胞铺于12孔板中,差速贴壁40分钟,使成纤维细胞尽可能贴壁,用习惯轻柔吹打下贴壁不牢的心肌细胞,并将上清(其中含大部分心肌细胞),转移到12孔板中。
14、培养成纤维细胞的12孔板中每孔加入1ml试剂6,放入细胞培养箱中继续培养。
15、铺板1天后,培养心肌细胞的12孔板中的试剂5换成试剂6继续培养。
实施例1分离培养的大鼠乳鼠心肌细胞和成纤维细胞培养1天后的形态图;分别如图1和图2所示。由图1可见:心肌细胞完全贴壁生长,形态由圆形变为梭形,细胞逐渐展开,部分伸出伪足,变为三角形、星形、不规则的多边形等形态,且有部分细胞出现自发性搏动,搏动频率和节律不同。说明实施例1的分离方法能够有效保护心肌细胞活性。图2中心肌成纤维细胞完全贴壁,细胞伸展成梭形,细胞核清晰可见,部分伸出伪足,分布均匀,散在生长,不聚集成团,无自发搏动。说明实施例1的分离方法对成纤维细胞几乎无损伤,保证得率和细胞活性。
实施例2用本发明方法分离小鼠乳鼠心肌细胞和成纤维细胞
具体的操作步骤如下:
实验所需的试剂,按照比例配置:
试剂1:50mlpbs(不含钙镁)(hyclone)+5umblebbistatin。
试剂2:10ml分离液:5umblebbistatin,0.25%胰蛋白酶(碧云天,c0201~100ml)inhbss缓冲液(碧云天,c0218)(不含钙镁)。
试剂3:30ml消化液:5umblebbistatin,1.5mg/mlii型胶原酶(worthington,ls004176)inl15培养基。
试剂4:20mll15培养基(hyclone,sh30525.01)+5umblebbistatin。
试剂5:铺板培养基:65%dmem(高葡糖糖)(hyclone,sh30243.01)+19%m-199(hyclone,sh30253.01)+15%胎牛血清fbs(bi)+1%双抗(碧云天,c0222)。
试剂6:成纤维细胞培养基:dmem+10%fbs+1%双抗。
操作步骤如下:
1、取出生1~3天小鼠乳鼠的心脏,放入试剂1中,并置于冰上操作;
2、用pbs(含5umblebbistatin)充分清洗心脏,至心脏中的血清洗干净;
3、将心脏收集,转移到另一培养皿的,用巴士吸管滴1~2滴试剂2,并用弯剪2~3下,剪至大小约0.5mm3的组织块(注意:小鼠乳鼠的心脏本身就很小,不要剪得过多,变成匀浆对细胞有损伤);
4、加入10ml试剂2冲洗组织块,并转移至50ml离心管中,4℃混匀孵育4小时,可平放至水平摇床,以20~30rpm的转速孵育;
5、从4度冰箱取出消化(4小时)的混悬液(此时组织块将结团),将上清吸走(避免吹散组织块,可剩余1ml消化液)。然后加入10ml试剂3,和5ml的试剂4,并用吸管吹打混合液1min,以减少组织缺氧;
6、将盛有组织块的50mlbd管在37℃水浴锅中摇匀2min,以迅速平衡消化液温度;
7、将组织块置于旋转混匀器上,放入37℃培养箱中,旋转混匀(10rpm,倾斜角度10°),20min;
8、用5ml试剂4提前润湿细胞滤网(70um),将装有组织块的50ml离心管从混匀器取出,用胶头滴管反复轻柔吹打混匀组织块(20次),组织块将很容易的被吹散,细胞将释放到上清;
9、静置混匀液,待大的组织块沉淀到管底,将混有细胞的悬液通过提前润湿的细胞筛网,转移到新的50ml离心管;
10、剩余的大组织块再用5ml试剂3重悬,重复步骤7;
11、消化完后,用胶头滴管轻柔吹打混匀细胞沉淀20次,过细胞滤网,5mll15培养基(含5umblebbistatin)洗滤网;
12、离心200g,5min,弃上清,用10ml的试剂5重悬。
13、将细胞铺于12孔板中,差速贴壁35分钟,使成纤维细胞尽可能贴壁,用习惯轻柔吹打下贴壁不牢的心肌细胞,并将上清(其中含大部分心肌细胞),转移到12孔板中。
14、培养成纤维细胞的12孔板中每孔加入1ml试剂6,放入细胞培养箱中继续培养。
15、铺板1天后,培养心肌细胞的12孔板中的试剂5换成试剂6继续培养。
实施例2分离培养的小鼠乳鼠心肌细胞和成纤维细胞培养1天后的形态图(40x)分别如图3和图4所示。由图3可见:心肌细胞基本贴壁,部分形态为圆形,部分变为梭形,且有部分细胞出现自发性搏动,搏动频率和节律不同。说明实施例2的分离方法能够有效保护心肌细胞活性。图4中心肌成纤维细胞完全贴壁,细胞伸展成梭形,部分伸出伪足,分布均匀,散在生长,不聚集成团,无自发搏动。说明实施例2的分离方法对成纤维细胞几乎无损伤,保证得率和细胞活性。
- 还没有人留言评论。精彩留言会获得点赞!