一种植物乳酸杆菌MMB-07及其发酵沙光鱼制备发酵酸鱼的方法与流程
本发明涉及微生物领域,尤其是一种植物乳酸杆菌mmb-07及其发酵沙光鱼制备发酵酸鱼的方法。
背景技术:
发酵酸鱼制品在我国食用历史悠久,主要分布在我国的西南地区,贵州、广西、云南等少数民族聚居地,包括发酵鱼块、发酵鱼酱、发酵鱼露和发酵鱼糜等,其加工形式主要是有酸鱼、臭鳜鱼、醉鱼;现有发酵酸鱼在加工过程中有两种方式:(1)用去除内脏的整鱼加工,(2)去除鱼肉、鱼骨的鱼肉进行加工;使用整鱼加工时,鱼肉的利用率高,鱼骨对发酵酸鱼有一定的支撑作用,可保持鱼体的完整;仅使用鱼肉加工发酵酸鱼,发酵过程更加迅速,一般接种发酵菌24h后,鱼肉经过发酵,鱼腥味降低,由于鱼类中蛋白质含量丰富,发酵过程中这些蛋白质会被降解成氨基酸和多肽物质,部分氨基酸会继续降解生成酮类和醛类物质,对发酵酸鱼的风味起重要作用。鱼肉中的脂肪氧化后会释放游离脂肪酸,通过代谢反应产生酯类,对鱼肉的风味也产生重要影响,整个发酵过程中微生物将鱼肉中的蛋白质、脂类物质分解转化,产生了独特的发酵气味。现有传统的发酵鱼制品大多通过家庭自制和手工作坊加工而成,依靠自然环境和鱼体本身的微生物和内源酶完成发酵酸鱼的制作,发酵酸鱼中微生物的种类难以把控,发酵酸鱼制品容易污染致病菌,食用处理不当的发酵酸鱼容易引起腹泻、呕吐,影响身体健康,并且传统的发酵过程中酸鱼质量参差不齐,对酸鱼品质把控难度大,因此接种发酵菌发酵酸鱼,特别是接种在发酵过程中可产抑菌物质的发酵菌发酵酸鱼,对于控制酸鱼中食源性致病菌,提高发酵酸鱼的品质具有重要意义。
沙光鱼肉含有丰富的营养物质,有益人体健康,但是新鲜的鱼肉极易腐败变质,因此微生物发酵沙光鱼制成发酵酸鱼,是保存沙光鱼的一个有效途径,对于发酵酸鱼制品来说,发酵剂的菌种应具备无毒害、生长繁殖旺盛、可产酸性物质、可产抑菌物质如细菌素等条件,从传统的发酵制品中分离筛选菌株,主要有植物乳杆菌、发酵乳杆菌、清酒乳杆菌和戊片糖球菌等,得到的微生物种类较多,不仅有乳酸菌还有酵母菌、霉菌等。发酵酸鱼接种不同的发酵菌株对发酵酸鱼的风味也会产生不同的影响,其中发酵过程中理化性质主要为ph的降低、蛋白质的降解和脂肪的氧化。由于发酵条件的不同,发酵酸鱼的ph会产生不同的变化,且发酵酸鱼受盐度影响较大,低盐环境中发酵酸鱼的ph会低于高盐环境的ph,当有发酵剂的接入时,发酵酸鱼的ph变化加快,接种戊糖片球菌发酵酸鱼,其ph比自然发酵酸鱼更低。鱼类中蛋白质含量丰富,发酵过程中这些蛋白质会被降解成氨基酸和多肽物质,部分氨基酸会继续降解生成酮类和醛类物质,对发酵酸鱼的风味起重要作用;鱼肉中的脂肪氧化后会释放游离脂肪酸,通过代谢反应产生酯类,对鱼肉的风味也产生重要影响,因此接种不同发酵菌株的发酵酸鱼,在发酵过程中的不同的变化反应,同时会产生不同的理化性质和风味物质,而控制发酵酸鱼风味物质主要有两种,一种是具有挥发性的气味,另一种是不具有挥发性的尝味物质,其挥发性成分主要包括酮类、酯类、醛类、含氮化合物等十大类物质。本发明公开了一种利用产植物乳杆菌素的植物乳杆菌mmb-07(lactobacillusplantarumsubsp.argentoratensis)发酵沙光鱼制作酸鱼制品,植物乳杆菌mmb-07所产的植物乳杆菌素对致病菌和腐败菌的具有良好的抑菌性,接种植物乳杆菌mmb-07发酵酸鱼,可以有效抑制发酵过程中腐败微生物对酸鱼品质的影响,增加植物乳杆菌mmb-07应用于食品中的潜力,大大提高了沙光鱼的经济价值和社会价值,值得推广。
技术实现要素:
本发明针对传统发酵酸鱼方法技术的不足,提供一种植物乳酸杆菌mmb-07发酵沙光鱼制备酸鱼制品,植物乳杆菌mmb-07所产的植物乳杆菌素对致病菌和腐败菌的具有良好的抑菌性,接种植物乳杆菌mmb-07发酵酸鱼,可以有效抑制发酵过程中腐败微生物对酸鱼品质的影响,该植物乳杆菌mmb-07,于2020年06月08日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmccno.20032,保藏单位地址为北京市朝阳区北辰西路1号院3号,其具体技术方案如下:
一种植物乳酸杆菌mmb-07,其特征在于:所述植物乳酸杆菌mmb-07菌落为乳白色,边缘整齐,菌体呈弯杆状或者短杆状,无芽孢,无荚膜,于2020年06月08日保藏于中国微生物菌种保藏管理委员会普通微生物中心,其分类命名为lactobacillusplantarumsubsp.argentoratensis,保藏编号为cgmccno.20032,genbank登录号为:mn700261。
一种如权利要求1所述的植物乳酸杆菌mmb-07发酵沙光鱼制备发酵酸鱼的方法,其特征在于:包括如下步骤:
(1)植物乳酸杆菌mmb-07的筛选:从传统发酵沙光鱼制作酸鱼样品中经采集、分离、初筛、复筛提取植物乳酸杆菌mmb-07;
(2)植物乳酸杆菌mmb-07的培养:制备mrs培养基,将步骤(1)中获取的植物乳酸杆菌mmb-07接种至mrs培养基中,于37℃倒置培养48h,培养结束后在mrs培养基平板上划线获取单菌落;
(3)植物乳酸杆菌mmb-07发酵酸鱼制品:
s1:将新鲜沙光鱼清洗干净,于超净工作台上将鱼肉分解成长5cm,宽1cm,厚1cm的长条装入无菌均质袋中备用;
s2:将步骤(2)中的植物乳杆菌mmb-07从甘油管中接种到mrs培养基,传代2次后,培养mmb-07至对数期,离心分离并收集沉淀物质,用无菌水清洗沉淀物质后,调节od600至0.6-0.7,将s1中的鱼肉接种至沉淀物质的菌液中发酵,同时设置发酵乳杆菌、德氏乳杆菌和干酪乳杆菌发酵剂作为对比组于同等条件下进行发酵,发酵比例为30g鱼肉接种1ml菌液;
s3:所述s2发酵条件为37℃培养24h,其每间隔6h取样,并测定发酵过程中鱼肉的ph、tvb-n值、tba值;
s4:所述s2中于37℃培养24h过程中,采用顶空固相微萃取法测定使用不同发酵菌株作为发酵剂发酵酸鱼是的挥发性物质。
进一步的,所述s3中ph测定方法为:称取5.0g发酵的沙光鱼肉绞碎于烧杯中,加入45ml已灭菌的中性蒸馏水,均质混匀1min后置于4℃冰箱,静置30min后,使用ph计测定鱼肉的ph。
进一步的,所述s3中tvb-n值测定方法为:取鱼肉5g绞碎均匀,置于消化管中,使用自动凯式定氮仪,加碱加水体积均为0ml,硼酸接收液30ml,蒸馏时间5min,使用0.1000mol/l标准盐酸滴定液滴定并计算挥发性盐基氮含量。
进一步的,所述s3中tba测定方法为:称10g绞碎鱼肉与40ml预冷的体积分数5%的三氯乙酸混合,混匀1min,然后在冷冻离心机上以5000r/min离心5min,过滤上清液,吸取5ml滤液于比色管中,随即再加5ml0.02mol/l的硫代巴比妥酸试剂并充分混匀,于沸水中反应30min取出,流动水冷却到室温,同时以蒸馏水为参照,在532nm处测定溶液的吸光值并计算tba值。
进一步的,所述s4中挥发性物质的测定步骤为:精确称取2.00±0.10g鱼肉置于20ml顶空瓶中,在鱼肉样品中加入5ml饱和氯化钠溶液、1μl环己酮内标液,微型磁力搅拌子后密封,置于60℃水浴中磁力搅拌平衡10min,将老化后的萃取头插入顶空瓶,伸出50/30μmdvb/car/pdms涂层,在60℃萃取30min,待萃取结束,取出插入气相色谱进样口,于250℃解吸3min。
进一步的,hp-innowax毛细管色谱柱(30m×0.32mm×0.15μm),载气为he(1ml/min),不分流模式进样,进样口温度为250℃,起始柱温为40℃,保持3min,以5℃/min升温至120℃,保持3min,再以20℃/min升温至230℃,保持5min,其中质谱离子源温度为200℃,离子源使用ei源,电子能70ev,质量扫描范围为35~550m/z,使用nist2005标准图库自动检索。
本发明与现有技术相比,有如下优点:
本发明植物乳酸杆菌mmb-07可产植物乳杆菌素,对鱼肉中含有的杂菌具有良好的抑制作用,作为发酵菌发酵酸鱼比使用其他发酵菌发酵的酸鱼具有更好的品质和质量,有利于酸鱼风味物质的形成。
附图说明
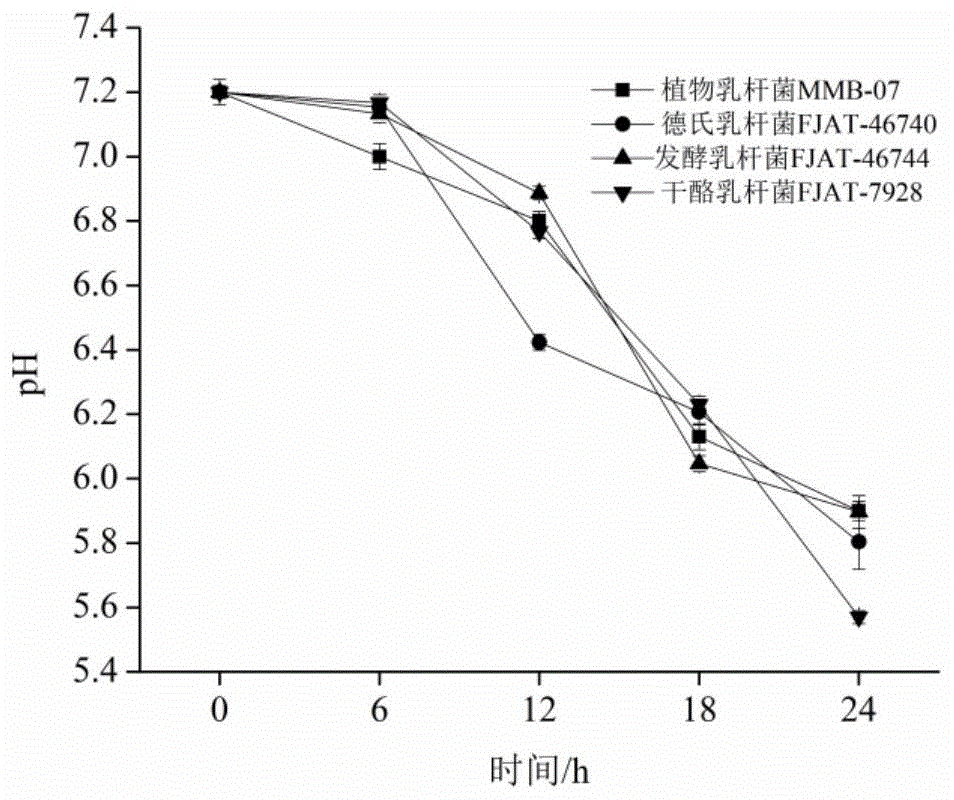
图1为发酵沙光鱼制备酸鱼过程中ph的变化。
图2为发酵沙光鱼制备酸鱼过程中tvb-n的变化。
图3为发酵沙光鱼制备酸鱼过程中tba的变化。
图4为植物乳杆菌mmb-07生长曲线及ph变化。
图5菌株mmb-07菌落形态及革兰氏染色图。
下面结合附图对本发明做详细说明,如图1-5所示:一种植物乳酸杆菌mmb-07,形态特征为为乳白色,边缘整齐,菌体呈弯杆状或者短杆状,无芽孢,无荚膜,于2020年06月08日保藏于中国微生物菌种保藏管理委员会普通微生物中心,其分类命名为lactobacillusplantarumsubsp.argentoratensis,保藏编号为cgmccno.20032,genbank登录号为:mn700261。
一种植物乳酸杆菌mmb-07发酵沙光鱼制备发酵酸鱼的方法,包括如下步骤:
(1)植物乳酸杆菌mmb-07的筛选:从传统发酵沙光鱼制作酸鱼样品中经采集、分离、初筛、复筛获得植物乳酸杆菌mmb-07:
s1:植物乳杆菌mmb-07的采集:
使用干净灭菌的勺子取酸鱼酸汤后用无菌纱布过滤,将酸汤清液置于灭菌三角瓶中,封口膜封口,做好标记,4℃冰箱保存备用;
s2:酸鱼样品中乳酸菌的分离:
取10ml酸鱼酸汤,加入盛有90mlmrs培养基的三角瓶中,瓶口覆盖报纸,以降低通透性,37℃静置培养,富集酸鱼酸汤中的菌株,富集培养结束后,使用接种环挑取一环菌液,划线于含有添加有0.3%碳酸钙的mrs固体培养基中,倒置于37℃的培养箱中培养48h,挑选革兰氏染色阳性的单菌落,-80℃条件下保存备用;
s3:产植物乳杆菌素植物乳杆菌初筛:
产植物乳杆菌素植物乳杆菌初筛采用打孔法,将分离得到的菌株接种于液体mrs培养基中,37℃培养48h,8000r/min离心15min后取上清,上清液4℃保存备用;将指示菌按1%的接种量接种于固体lb培养基中,无菌打孔器打孔,每孔加入50μl上清液,于37℃温度下培养12h后测定抑菌圈大小,通过游标卡尺测量抑菌圈直径,以抑菌圈的直径表示发酵液的抗菌活性;
s4:产植物乳杆菌素植物乳杆菌复筛:
有机酸的排除:保藏的菌株接种于mrs液体培养基,37℃下静置培养48h,4℃下8000r/min,离心15min,得上清液,上清液用3nnaoh调至ph4.0和4.5,以用乳酸调节ph值至4.0和4.5的mrs培养基作为空白对照,采用打孔法测试其抑菌活性;鉴于细菌素的产量都非常低,故上清液体积浓缩1倍,提高细菌素的浓度,对照则同样浓缩处理;
过氧化氢的排除:保藏的菌株接种于mrs液体培养基,37℃下静置培养48h,4℃下8000r/min离心15min,得上清液,上清液体积浓缩一倍后,调节ph至5.2备用;取适量上清液于10ml离心管中,添加4ku/ml过氧化氢酶处理上清液,同样处理mrs培养基作为对照,37℃水浴处理2h后采用打孔法测试其抑菌活性。
蛋白酶分解实验:保藏的菌株接种于mrs液体培养基,37℃下静置培养48h,4℃下8000r/min离心15min,得上清液,上清液浓缩一倍体积后,调节ph至各种酶的最适ph备用;取适量上清液于10ml离心管中,添加3ku/mg胃蛋白酶,2500u/mg胰蛋白酶,酶解上清液,同样处理mrs培养基作为对照,37℃水浴4h后,以3nnaoh或3nhcl调节ph值至3.7~3.8,采用打孔法测试其抑菌活性。
(2)植物乳酸杆菌mmb-07的筛选培养:制备mrs培养基,将步骤(1)中获取的植物乳杆菌mmb-07接种至mrs培养基中,于37℃倒置培养48h,培养结束后在mrs培养基平板上划线获取单菌落;
(3)植物乳酸杆菌mmb-07发酵酸鱼制品:
s1:将新鲜沙光鱼清洗干净,于超净工作台上将鱼肉分解成长5cm,宽1cm,厚1cm的长条装入无菌均质袋中备用;
s2:将步骤(2)中的植物乳杆菌mmb-07从甘油管中接种到mrs培养基,传代2次后,培养mmb-07至对数期,离心分离并收集沉淀物质,用无菌水清洗沉淀物质后,调节od600至0.6-0.7,将s1中的鱼肉接种至沉淀物质的菌液中发酵,同时设置发酵乳杆菌、德氏乳杆菌和干酪乳杆菌发酵剂作为对比组于同等条件下进行发酵,发酵比例为30g鱼肉接种1ml菌液;
s3:所述s2发酵条件为37℃培养24h,其每间隔6h取样,并测定发酵过程中鱼肉的ph、tvb-n值、tba值;
s4:所述s2中于37℃培养24h过程中,采用顶空固相微萃取法测定使用不同发酵菌株作为发酵剂发酵酸鱼是的挥发性物质。
进一步的,所述s3中ph测定方法为:称取5.0g发酵的沙光鱼肉绞碎于烧杯中,加入45ml已灭菌的中性蒸馏水,均质混匀1min后置于4℃冰箱,静置30min后,使用ph计测定鱼肉的ph。
进一步的,所述s3中tvb-n值测定方法为:
取鱼肉5g绞碎均匀,置于消化管中,使用自动凯式定氮仪,加碱加水体积均为0ml,硼酸接收液30ml,蒸馏时间5min,使用标准盐酸滴定液(0.1000mol/l)滴定。试样中挥发性盐基氮含量按照如下计算公式计算:
式中:
x:试样中挥发性盐基氮的含量,单位为毫克每百克(mg/100g)或毫克每百毫升(mg/100ml);
v1:试液消耗盐酸或硫酸标准滴定溶液的体积,单位为毫升(ml);gb5009.228—20165;
v2:试剂空白消耗盐酸或硫酸标准滴定溶液的体积,单位为毫升(ml);
c:盐酸或硫酸标准滴定溶液的浓度,单位为摩尔每升(mol/l);
14:滴定1.0ml盐酸[c(hcl)=1.000mol/l]或硫酸[c(1/2h2so4)=1.000mol/l]标准滴定溶液相当的氮的质量,单位为克每摩尔(g/mol);
m:试样质量,单位为克(g)或试样体积,单位为(ml);
100:计算结果换算为毫克每百克(mg/100g)或毫克每百毫升(mg/100ml)的换算系数;
实验结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
进一步的,所述s3中tba测定方法为:称10g绞碎鱼肉与40ml预冷的体积分数5%的三氯乙酸混合,混匀1min,然后在冷冻离心机上以5000r/min离心5min,过滤上清液,吸取5ml滤液于比色管中,随即再加5ml0.02mol/l的硫代巴比妥酸(准确称取tba0.288g溶于水中,并稀释至100ml,如tba不易溶解,可加热至全溶澄清,然后稀释至100ml)试剂并充分混匀,于沸水中反应30min取出,流动水冷却到室温(约15min),以蒸馏水为参照,在532nm处测定溶液的吸光值,并按照下列公式计算tba值:
tba=d×7.8
式中:tba为硫代巴比妥酸值,单位:mg/kg(每kg样品中丙二醛含量);d为溶液在532nm处的光密度值;7.8为常数。
进一步的,所述s4中挥发性物质的测定步骤为:精确称取2.00±0.10g鱼肉置于20ml顶空瓶中,在鱼肉样品中加入5ml饱和氯化钠溶液、1μl环己酮内标液,微型磁力搅拌子后密封,置于60℃水浴中磁力搅拌平衡10min,将老化后的萃取头插入顶空瓶,伸出50/30μmdvb/car/pdms涂层,在60℃萃取30min,待萃取结束,取出插入气相色谱进样口,于250℃解吸3min。
进一步的,gc-ms条件为:hp-innowax毛细管色谱柱(30m×0.32mm×0.15μm),载气为he(1ml/min),不分流模式进样,进样口温度为250℃,起始柱温为40℃,保持3min,以5℃/min升温至120℃,保持3min,再以20℃/min升温至230℃,保持5min,其中质谱离子源温度为200℃,离子源使用ei源,电子能70ev,质量扫描范围为35~550m/z,使用nist2005标准图库自动检索。
实施例:
一、原料及仪器:
(1)沙光鱼:购买于连云港海鲜市场;
(2)发酵剂:植物乳杆菌mmb-07(lactobacillusplantarummmb-07)来自实验室保藏,德氏乳杆菌(lactobacillusdelbrueckiifjat-46740)、发酵乳杆菌(lactobacillusfermentumfjat-46744)、干酪乳杆菌(lactobacilluscaseifjat-7928)来自福建省农业科学院保藏。
(3)高速冷冻离心机,美国赛默飞世尔科技有限公司;5977a型气相色谱质谱联用仪,美国安捷伦公司;sj-3f型ph计,上海雷磁仪器厂;无菌均质袋。
二、实施例1:
(1)mrs分离培养基,具体组分和配比如下:牛肉膏10g/l,蛋白胨10g/l,葡萄糖20g/l,磷酸氢二钾2g/l,乙酸钠5g/l,一水合硫酸锰0.19g/l,七水合硫酸镁0.58g/l,柠檬酸氢铵2g/l,吐温-80为1ml/l。补充蒸馏水至1000ml,条培养基的ph值至6.2-6.4,115℃灭菌20min,自然冷却后备用。
(2)固体培养基在分离培养基的基础上加1.5%~2%琼脂粉。
(3)取保藏的植物乳杆菌mmb-07甘油管1管,划线接种到固体mrs培养基平板中,37℃培养,划线两次后取单菌落接种到液体mrs培养基中,培养至对数期待用。
(4)取1ml富集培养结束的株植物乳杆菌mmb-07菌液进行浓度梯度稀释,选择稀释度为10-4、10-5、10-6,移液枪吸取100μl浓度稀释液涂布到固体mrs培养基中,每个梯度稀释液涂布三块平板于37℃倒置培养48h,培养结束后,挑选革兰氏染色阳性菌株重复在mrs培养基平板上划线3次,获得株植物乳杆菌mmb-07单菌落。
(5)按1%接种量制作含菌平板,发酵分离的株植物乳杆菌mmb-07单菌落,挑选出代谢产物对所有指示菌均有良好抑制效果的菌株,进行菌种筛选;排除发酵液中过氧化氢、乳酸物质对抑菌作用的影响,蛋白酶分解后菌株代谢产物的抑菌活性显著下降,说明株植物乳杆菌mmb-07菌株可产细菌素,进行产细菌素菌株筛选;本发明获取的株植物乳杆菌mmb-07培养48h后,菌落颜色乳白色,边缘整齐,显微镜观察菌体弯杆状或者短杆状,无芽孢,无荚膜;株植物乳杆菌mmb-07菌株不能使明胶液化,发酵葡萄糖不产气,不能够水解精氨酸产氨,能够发酵利用乳糖、菊糖、木糖、蔗糖、葡萄糖、海藻糖、麦芽糖、果糖、蜜二糖、阿拉伯糖、甘露糖、纤维二糖、棉籽糖、水杨苷、七叶苷、山梨醇和甘露醇。
(6)利用16srdna全长序列分析鉴定本发明获得的株植物乳杆菌mmb-07:
取过夜培养的菌液与2mlep管中,12000rpm/min离心2min,弃上清,使用细菌基因组提取试剂盒提取细菌的基因组,进行pcr扩增,其中以27f(5'-agagtttgatcctggctcag-3')和1492r(5'-ggttaccttgttacgactt-3')为引物,50μl的pcr总反应体系进行pcr扩增,其中50μl的pcr反应体系如下:
pcr反应程序:反应程序:94℃预变性5min;94℃变性30s,54℃退火30s,72℃延伸90s,35个循环;72℃终延伸5min;pcr扩增产物送至南京思普金公司进行序列检测;通过blast程序对比显示,该菌株序列与植物乳杆菌序列相似性为100%确定筛选得到的菌株为植物乳杆菌(lactobacillusplantarum)。
本发明公开的植物乳酸杆菌mmb-07生长曲线以及ph变化如图4所示:植物乳杆菌mmb-07接种到新的培养基后,0~4h处于生长延滞期,为了适应新的接种环境,植物乳杆菌在此阶段生长缓慢,发酵液的ph变化缓慢,在此过程中无抑菌物质产生;接种4h后,菌株进入对数期,菌株生长极其旺盛,植物乳杆菌mmb-07分裂增殖速度加快,吸光值迅速提高,发酵液酸性增强,但发酵上清液没有抑菌能力;接种16h后,植物乳杆菌mmb-07开始进入稳定生长期,od600值变化平缓,ph值呈下降趋势,植物乳杆菌mmb-07分裂增殖速度减慢,代谢产物不断增加,进入稳定期后,植物乳杆菌素抑菌性显著增强;植物乳杆菌mmb-07在48h左右逐渐进入衰退期,发酵液的酸性下降缓慢,基本保持不变,其抑菌能力也基本保持不变。
三、发酵沙光鱼制备酸鱼制品:
(1)沙光鱼发酵酸鱼的制备:
将鲜活的沙光鱼,去除头和内脏后使用清水冲洗干净,沥干表面水分,在超净工作台中,将鱼肉分解成长5cm、宽1cm、厚1cm的长条装入无菌均质袋备用,将植物乳杆菌mmb-07(lactobacillusplantarummmb-07)、德氏乳杆菌(lactobacillusdelbrueckiifjat-46740)、发酵乳杆菌(lactobacillusfermentumfjat-46744)、干酪乳杆菌(lactobacilluscaseifjat-7928)发酵菌株分别活化,培养至对数期,离心弃上清,收集沉淀,沉淀使用无菌水清洗两遍后,调节od600至0.6-0.7,按照30g鱼肉接种1ml菌液的比例接种发酵菌,37℃静置培养24h。
(2)发酵过程中ph的变化:
活化后的植物乳杆菌mmb-07(lactobacillusplantarummmb-07)、德氏乳杆菌(lactobacillusdelbrueckiifjat-46740)、发酵乳杆菌(lactobacillusfermentumfjat-46744)、干酪乳杆菌(lactobacilluscaseifjat-7928)发酵菌分别接种于鱼肉中,37℃静置培养24h,每6h称取5.0g沙光鱼绞碎于烧杯中,加入45ml已灭菌的中性蒸馏水,均质混匀1min后置于4℃冰箱,静置30min后,使用ph计测定鱼肉的ph,以此测定杀光鱼肉在发酵过程中ph的变化。
发酵酸鱼的ph变化如图1所示,随着发酵时间的延长,沙光鱼鱼肉的ph呈不断下降的趋势,使用发酵菌发酵沙光鱼酸鱼的过程中,伴随着乳酸的产生,使得沙光鱼鱼肉中的ph下降,随着发酵时间的延长,发酵菌开始分解鱼肉中的蛋白质,产生了一些碱性的含氮物质,中和了一部分产生的乳酸,使得ph下降有一定的减缓趋势,发酵沙光鱼酸鱼中,酸性物质积累促进了鱼肉蛋白质的分解,乳酸的增加对于营养物质的吸收有重要意义。本发明利用植物乳杆菌mmb-07发酵酸鱼,发酵过程中ph的降低对杂菌的生长起到抑制作用,其抑菌特性如下所示:
(2)tvb-n值的测定:
鱼肉的tvb-n值,即挥发性盐基氮,反应了鱼肉的新鲜程度,将四种发酵菌分别接种于鱼肉中,37℃静置培养24h,每6h取样一次,测定鱼肉在发酵过程中tvb-n值的变化,鱼肉的tvb-n值的测定采用gb5009《食品中挥发性盐基氮的测定》中的第二法自动凯氏定氮法。
挥发性盐基氮(tvb-n值)反应了鱼肉中新鲜程度,其中tvb-n≤15.00mg/100g为一级鲜度标准,tvb-n≤20.00mg/100g为二级鲜度标准。当鱼肉的tvb-n>20.00mg/100g时,鱼肉已经腐败变质,不能食用。四种不同发酵菌发酵酸鱼的变化趋势如图2所示,在0-6h时,tvb-n值基本不变主要是这段时间内发酵菌在大量繁殖,分解蛋白质产生的氨基酸较少,随着发酵时间的延长,四种发酵菌将鱼肉中的蛋白质大量分解成为氨、三甲胺等物质,使得鱼肉中挥发性盐基氮不断升高,发酵24h后,四种发酵酸鱼的tvb-n≤20.00mg/100g,在二级鲜度内,发酵酸鱼鱼肉保持在二级鲜度的水平,鱼肉中的蛋白发生一定程度的氧化。
(3)tba的测定:
鱼肉的tba值反应了鱼肉中脂肪氧化的程度,将四种发酵菌分别接种于鱼肉中,37℃静置培养24h,每6h取样一次,测定鱼肉在发酵过程中脂肪氧化的程度,tba测定的方法参考金枝等的测定方法,结果如图3所示。
tba反应鱼肉中脂肪氧化的程度,tba的值越高表示鱼肉中的脂肪氧化程度越高,优质的肉制品中tba的值不允许超过5mg/kg,新鲜的沙光鱼,鱼肉的tba值为0.28mg/kg,植物乳杆菌mmb-07发酵沙光鱼结束后,tba<5mg/kg,结果显示,鱼肉中的脂肪已经发生了氧化,但其氧化程度不高,发酵酸鱼的品质较好,因此乳酸菌对发酵酸鱼中的脂肪酸具有良好的抗氧化活性。
(4)挥发性风味物质的测定:
分别使用植物乳杆菌mmb-07(lactobacillusplantarummmb-07)、德氏乳杆菌(lactobacillusdelbrueckiifjat-46740)、发酵乳杆菌(lactobacillusfermentumfjat-46744)、干酪乳杆菌(lactobacilluscaseifjat-7928)为发酵剂发酵制作沙光鱼酸鱼,鱼肉样品中挥发性气味成分的提取采用顶空固相微萃取法(hs-spme),精确称取2.00±0.10g鱼肉置于20ml顶空瓶中,在鱼肉样品中加入5ml饱和氯化钠溶液、1μl环己酮内标液,微型磁力搅拌子后密封,置于60℃水浴中磁力搅拌平衡10min,将老化后的萃取头插入顶空瓶,伸出50/30μmdvb/car/pdms涂层,在60℃萃取30min,待萃取结束,取出插入气相色谱进样口,于250℃解吸3min。
gc-ms条件:hp-innowax毛细管色谱柱(30m×0.32mm×0.15μm);载气为he(1ml/min);不分流模式进样;进样口温度为250℃,起始柱温为40℃,保持3min,以5℃/min升温至120℃,保持3min,再以20℃/min升温至230℃,保持5min,质谱离子源温度为200℃,离子源使用ei源,电子能70ev,质量扫描范围为35-550m/z;使用nist2005标准图库自动检索,测定使用不同发酵菌株作为发酵剂发酵酸鱼是的挥发性物质的差异。
按照30g鱼肉接种1ml处理菌液的比例分别接种植物乳杆菌mmb-07(lactobacillusplantarummmb-07)、德氏乳杆菌(lactobacillusdelbrueckiifjat-46740)、发酵乳杆菌(lactobacillusfermentumfjat-46744)、干酪乳杆菌(lactobacilluscaseifjat-7928)于新鲜的沙光鱼鱼肉中,37℃静置发酵24h,发酵结束后测定各种发酵酸鱼中的不同风味物质,酸鱼发酵的过程中,产生的挥发性物质主要有酸类、醇类、醛类、酯类和烃类物质,这些物质是构成发酵酸鱼风味的主要成分,这四种发酵菌株发酵酸鱼结束后,酸鱼中部分挥发性成分见表1。
表1发酵酸鱼挥发性物质
参见表1:使用乳酸菌接种发酵酸鱼,通过对酸鱼中风味物质组成的分析,发酵酸鱼的风味主要是烃类化合物、醛类、醇类、酯类和酮类物质共同作用的结果,其中醇类和酯类物质所占总种类的比例最高,分别使用植物乳杆菌mmb-07、德氏乳杆菌fjat-46740、发酵乳杆菌fjat-46744和干酪乳杆菌fjat-7928作为发酵剂发酵酸鱼,植物乳杆菌mmb-07发酵的酸鱼风味物质种类最多,使用德氏乳杆菌发酵酸鱼检测出的挥发性成分最少。
鱼肉中烃类物质有烷烃、烯烃和芳香烃,主要来自鱼肉脂肪中烷基自由基的均裂,由于烷类物质中c8-c20的气味阈值比较高,因此在鱼肉的整体风味中,c8-c20烷类物质提供的影响较小,烯类物质影响鱼肉中鱼腥味的产生,在一定的反应条件下,烯类物质可以转化为具有水产品风味的物质,影响发酵酸鱼风味物质的形成,使用植物乳杆菌mmb-07发酵的酸鱼中,烷类物质和烯类物质的种类多于使用其他三株发酵菌发酵的酸鱼,反应出植物乳杆菌mmb-07作为发酵剂发酵酸鱼,形成的风味物质更加丰富。
鱼肉中的多不饱和脂肪酸在微生物的作用下降解成醛类物质,醛类物质大多具有令人愉悦的香气,例如壬醛具有玫瑰香味,庚醛具有青草香气,3-甲基丁醛具有苹果香气,相比于使用其他3种发酵剂发酵酸鱼,使用植物乳杆菌mmb-07发酵酸鱼时产生的苯甲醛和苯乙醛具有的杏仁味和花香味为发酵酸鱼提供了更愉悦的风味。
醇类物质和酸类物质的形成大多与醛类物质相关,使用四种发酵剂发酵酸鱼,在所有的挥发性成分检测中,醇类物质的种类最为丰富,挥发性成分都检测到苯乙醇,苯乙醇是鱼肉中苯丙氨酸的代谢产物,具有玫瑰香和蜂蜜香味,在酒类风味物质的检测中,几乎都有苯乙醇的存在,苯乙醇对发酵酸鱼的风味起了重要作用,而植物乳杆菌mmb-07中的长链醇对酸鱼的油脂风味起了重要的作用。
四种发酵酸鱼中都检测到的酯类物质中有乙酸丁酯、甲酸辛酯和棕榈酸甲酯。乙酸丁酯和甲酸辛酯具有浓郁的果香味。酯类物质的阈值较低,为发酵酸鱼提供了良好的香气。
鱼肉中的胺类化合物一般具有腥臭味,对发酵酸鱼的风味产生不良的影响,在四种发酵酸鱼中,使用发酵乳杆菌和干酪乳杆菌发酵的酸鱼中都检测到三甲胺,三甲胺可以反应发酵酸鱼的新鲜程度,使用发酵乳杆菌和干酪乳杆菌发酵的酸鱼,鱼肉已经开始腐败,失去了食用价值,使用植物乳杆菌mmb-07和德氏乳杆菌发酵的酸鱼中都没有检测到三甲胺的存在,但使用植物乳杆菌mmb-07发酵酸鱼产生的挥发性成分种类比使用德氏乳杆菌发酵酸鱼产生的挥发性成分种类多;为发酵酸鱼提供主要风味物质的醛类、醇类和酯类物质中,植物乳杆菌mmb-07发酵酸鱼产生的挥发性成分种类比使用德氏乳杆菌发酵酸鱼产生的挥发性成分种类多。综合以上分析,分别使用植物乳杆菌mmb-07、发酵乳杆菌、干酪乳杆菌和德氏乳杆菌发酵沙光鱼生产酸鱼的过程中,在同样的发酵条件下,使用发酵乳杆菌和干酪乳杆菌发酵的酸鱼在发酵结束后已经开始腐败,失去食用价值,虽然德氏乳杆菌发酵酸鱼鱼肉仍然新鲜,但其中的挥发性成分种类比使用植物乳杆菌mmb-07发酵酸鱼产生的挥发性成分少,导致德氏乳杆菌发酵酸鱼的风味比植物乳杆菌mmb-07发酵酸鱼的风味差,同时,植物乳杆菌mmb-07在发酵过程中,产生的细菌素对腐败菌有良好的抑制作用,有效减缓了食品的腐败变质,因此,相较于其他三种发酵剂菌株,植物乳杆菌mmb-07可作为食品加工种的发酵菌使用,具有更高的经济价值和社会价值,值得推广。
本发明的上述实施例仅仅是为清楚地说明本发明所做的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其他不同形式的变化或变动。这里无法对所有的实施方式予以穷举。凡是属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。
- 还没有人留言评论。精彩留言会获得点赞!