一种干细胞由Primed态向*态转化的方法与流程
本发明涉及细胞生物学领域,具体涉及一种primed态干细胞向态干细胞转化的方法。
背景技术:
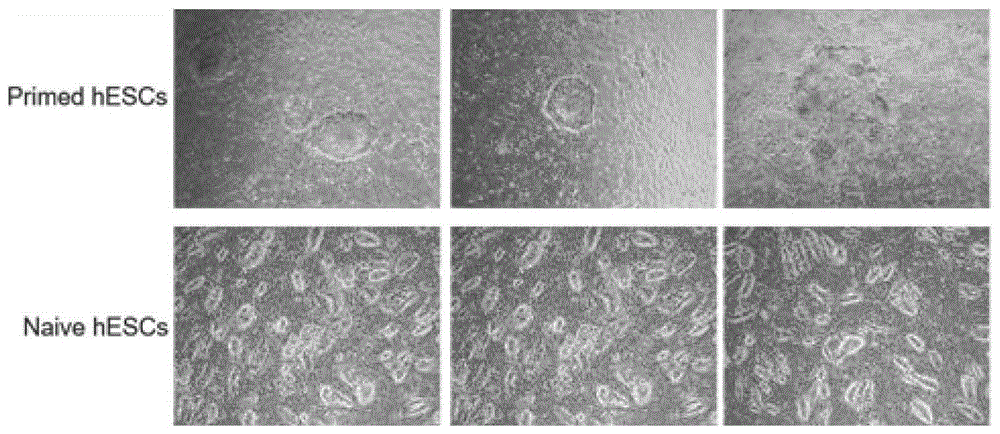
:多能性的细胞具有产生除胚外滋养层细胞谱系的所有胚胎胚层及原始生殖细胞的潜力。最近的一系列研究关注了具有不同的遗传和表观遗传性状的多能细胞:(原始态)状态多能干细胞(pluripotentstemcells,pscs)和primed(激发态)状态pscs。在着床前小鼠胚胎内细胞群(innercellmass,icm)中,外胚层启动了多能性因子nanog的表达,基因组结构呈现低甲基化状态,雌性体内失活的x等位基因重新激活,这种多能性状态被称为状态。小鼠胚胎着床后,状态的icm很快被primed多能性的外胚层(epiblast)细胞所取代。这些primed多能性的细胞内nanog表达量下降,基因组甲基化水平上升,雌性个体中的一条x染色体失活。和primed状态的pscs最显著的差异体现在发育潜能上,状态的小鼠胚胎干细胞(mesc)可以通过四倍体胚胎互补技术(tetraploidembryocomplementation,tec)得到完全的由escs来源的小鼠,这是检测mescs是否具有性状的黄金标准,primed状态mescs不能通过tec获得干细胞来源的小鼠后代。总的来说状态pscs与primed状态pscs相比拥有更高的多能性,因此在再生医学及疾病建模等领域拥有更广阔的应用前景。化学小分子化合物在细胞重编程领域的作用逐渐被大家应用,它们有的可以提高重编程诱导效率,有的可以取代某一个或几个转录因子。化学小分子还具有转基因方法不可比拟的优势,例如小分子浓度和加入时间可控、不产生免疫原性、耗费低以及便于生产保存和标准化。但是,转基因重编程方法潜在的临床应用上有一定的不安全性,因此探索化学小分子完全替代外源的转录因子实现体细胞重编程极为重要,亟需一种primed态干细胞向态干细胞转化的方法。技术实现要素:本发明为了解决上述问题,提供了激发态干细胞向原始态干细胞转化的方法,化学诱导细胞重编程,利用小分子组合将激发态干细胞转化成原始态干细胞。本发明目的之一在于提供一种primed态干细胞向态干细胞转化的组合物,具体技术方案如下:一种primed态干细胞向态干细胞转化的主药组合物,其特征在于,所述组合物由1xn2补充剂、1xb2补充剂、β-氢硫基乙醇、达沙替尼、azd5438、sb590885、pd0325901、y-27632、il6/sil-6r、重组人激活素-a组成。本发明目的之二在于提供一种primed态干细胞向态干细胞转化的制剂组合物,具体技术方案如下:一种primed态干细胞向态干细胞转化的制剂组合物,所述制剂组合物由主药成分和辅料成分组成,所述主药成分由1xn2补充剂、1xb2补充剂、β-氢硫基乙醇、达沙替尼、azd5438、sb590885、pd0325901、y-27632、il6/sil-6r、重组人激活素-a组成。进一步的,所述制剂组合物还包括f12dmem培养基、neurobasal培养基、1xl-谷氨酰胺、1x-非必要氨基酸、柠檬酸钠、牛血清白蛋白、基本成纤维细胞生长因子。进一步的,所述f12dmem培养基和所述neurobasal培养基的体积比为1:1。进一步的,牛血清白蛋白和柠檬酸钠的摩尔比为1:1。进一步的,牛血清白蛋白和il6/sil-6r的摩尔比为5:2。进一步的,β-氢硫基乙醇与达沙替尼的摩尔比为1000:1。进一步的,所述达沙替尼、azd5438和sb590885的摩尔比为1:1:1。进一步的,所述达沙替尼、azd5438、sb590885、pd0325901和y-27632的摩尔比为1:1:1:10:100。进一步的,所述pd0325901和y-27632的摩尔比为1:10。进一步的,所述il6/sil-6r、重组人激活素-a和基本成纤维细胞生长因子的摩尔比为5:5:2。本发明目的之三在于提供一种primed态干细胞向态干细胞转化的方法,具体步骤如下:(1)将primed态干细胞加入权利要求2所述的制剂组合物里以一定的培养时间进行培养。(2)用胰蛋白酶tryple(gibco)溶液在30×稀释的matrigel胶包被或者铺满feeder的培养皿中将步骤(1)中培养的细胞传代为单个细胞。(3)用1×pbs清洗步骤(2)中得到的单个细胞,并用胰蛋白酶分离细胞至细胞培养基中以一定孵育条件进行孵育。(4)步骤(3)中孵育得到的细胞以高比例1:2接种在涂覆的板上,移至缺氧环境进行后续传代培养,通过检测相关基因表达情况,筛选得到态干细胞。进一步的,步骤(1)中所述的培养时间为4-5天。进一步的,步骤(3)中所述孵育条件为温度37℃下孵育1-2分钟。进一步的,步骤(4)中所述缺氧环境为5%o2,5%co2。进一步的,步骤(4)中所述传代培养至少为5代。进一步的,步骤(4)中所述相关基因为klf4、klf5、dppa3、dppa5、dnmt3l、nanog。进一步的,步骤(4)中所述态干细胞的相关基因的表达活跃于primed态干细胞。本发明的目的之四在于提供一种primed态干细胞向态干细胞转化的主药组合物在制备primed态干细胞向态干细胞转化的培养基中的运用。本发明的目的之五在于提供一种primed态干细胞向态干细胞转化的制剂组合物在制备primed态干细胞向态干细胞转化的培养基中的运用。本发明的有益之处在于:解决了因为人体多能干细胞的直接获取受到伦理限制,导致获取多能干细胞受限。本发明利用小分子组合将激发态干细胞转化成原始态干细胞的方法,化学诱导细胞重编程扩展多潜能干细胞的获取技术,为干细胞在再生医学领域的应用提供了材料基础,为细胞命运决定研究的模型,为生殖医学及拯救濒危野生动物提供实践基础。附图说明图1为本发明的primed态干细胞及naive态干细胞的细胞表型图2为本发明的primed态干细胞及naive态干细胞状态细胞的相关基因表达情况图3为本发明的primed态干细胞及naive态干细胞的蛋白表达情况具体实施方式下面通过实施例和附图,对本发明进行进一步详细说明,应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明,本领域技术人员应该理解的是,在不偏离本发明的结构思路、使用范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。实施例中未注明具体条件的实验方法,通常按照常规条件,例如分子克隆实验指南(第三版,j.萨姆布鲁克等著)中所述的条件,或按照制造厂商所建议的条件,采用原料如下:本发明通过对细胞培养的组分和浓度的调整,从而激发primed态干细胞向态干细胞转化,此组分及其相应浓度是现有技术中没有记载的,是发明人通过多种创造性实验取得的成果,尤其是组分中的n2补充剂、b2补充剂、达沙替尼和il6/sil-6r,如果没有上述组分,则primed态干细胞不能向态干细胞转化。各组分之间的浓度比也是本申请技术人员通过长期的实验和运用理性的科学思维创造性的得到具体比例,细胞培养基中组分和浓度的相辅相成,从而激发primed态干细胞向态干细胞转化。实施例1primed态干细胞向naive态干细胞转化首先提前一天在培养皿上铺上30×稀释的matrigel胶或者feeder细胞。第二天,以1:6的传代率在30×稀释的matrigel胶上或者feeder细胞上接种primed态干细胞。细胞成团接种,mtesr1培养基培养48h。为了将primed态转化态干细胞状态,去除mtesr1培养基,加入了转化培养基(配方如表1)。基础培养基化学小分子f12dmem培养基0.1um达沙替尼neurobasal培养基0.1umazd54381xb2补充剂0.1umsb5908851xn2补充剂1umpd03259011xl-谷氨酰胺10umy-276321x-非必要氨基酸20ng/mlil6/sil-6r0.1mmβ-氢硫基乙醇20ng/ml重组人激活素-a50ng/ml牛血清白蛋白8ng/ml基本成纤维细胞生长因子50ng/ml柠檬酸钠表1primed态干细胞转化naive态干细胞的培养基配方细胞在常温常氧条件下(21%o2,5%co2)培养4—5天,每天更换转化培养基。转化结束后,用胰蛋白酶tryple(gibco)溶液在30×稀释的matrigel胶包被或者铺满feeder的培养皿中将细胞传代为单个细胞(培养皿在使用前至少包被1h)。传代过程:用1×pbs清洗细胞,并在每个孔(6孔板,falcon)的干细胞中加入500ul胰蛋白酶。细胞在37摄氏度下孵育1-2分钟。当细胞开始彼此分离并保持粘附在培养板上时,彻底抽吸胰蛋白酶并用1mlpbs清洗。加入1ml细胞培养基后,用细胞刮刀轻轻分离细胞,用1ml移液管分离成单个细胞。细胞以高比例1:2接种在涂覆的板上,并转移到缺氧环境(5%o2,5%co2)培养箱中用于后续培养。每天更换培养基。随后以1:2-1:4的比例传代培养细胞。对大多数细胞系来说,分化细胞在最初的2-3代中被观察到,并在随后的几代中逐渐减少。对于所描述的实验,除非另有说明,否则在使用前,细胞在培养基中至少培养五代。实施例2观察primed态干细胞和naive态干细胞形态人类primed态干细胞:克隆较大,扁平,边缘次光滑。人类态干细胞:克隆较小,隆起,边缘光滑。如图1,显示我们利用转化培养基转化的naive细胞形状符合要求。实施例3通过qrt-pcr检测培养过程中干性基因的表达qrt-pcr检测培养过程中干性基因的表达(klf4、klf5、dppa3、dppa5、dnmt3l、nanog)。首先完成rna提取。使用qiagen公司的rna提取试剂盒rneasyminikit,按照产品说明书操作。实验中用到的试剂,耗材都是不含rna酶的。具体操作如下:a.cipscs通过差速贴壁法去除feeder细胞,用pbs洗一次,离心后加入含1%β-巯基乙醇的bufferrlt350μl,充分吹打重悬。b.加入350μl70%的无水乙醇,吹打混匀后转移到吸附柱中,10000g离心15秒,弃流出液。c.加入350μlbufferrw1,10000g离心15秒,弃流出液。d.将10μldnasei加入到70μl的bufferrdd中,混合均匀,垂直加到吸附柱的膜上,使之与膜充分接触,室温静置15分钟。e.加入350μlbufferrw1,10000g离心20秒。f.更换收集管,加入500μlbufferrpe,10000g离心20秒,弃流出液。g.加入500μlbufferrpe,10000g离心2分钟,弃流出液。h.更换收集管,最高转速离心2分钟。i.将吸附柱置于1.5ml离心管中,根据细胞量加入30ul左右rnase-free水,静置1分钟,8000rpm离心1分钟收集rna。用nanodrop测定rna的浓度和纯度。将rna反转录为cdna使用invitrogen公司的m-mlvreversetranscriptas体系,按照产品说明书进行操作:a.将以下成分在200μlpcr管内混合:oligo(dt)(500μg/ml)1μldntp(10mm)1μl总rna2μgrnase-free水补足12μlb.pcr仪中,65℃加热变性5分钟,迅速置于冰上冷却。c.将以下成分在pcr管内混合:5×fisrtstrandbuffer4μldtt(0.1m)2μlrnaseinhibitor(20u/μl)1μlm-mlv1μld.将c中的成分混匀,每管8μl加入到b中的pcr管里。pcr仪中37℃反应60分钟后70℃反应15分钟,灭活m-mlv。得到的cdna可于-20℃长期保存。实时荧光定量pcr(rt-qpcr)检测基因表达(1)实时荧光定量qpcr的反应体系为:sybrgreenmix(roche)10μl上游引物(4μm)1μl下游引物(4μm)1μlcdna1μlddh2o补到20μl反应条件为:95℃预变性10分钟,95℃变性15秒,58℃退火延伸1分钟,40个循环,荧光采集设在退火延伸结束之后。扩增反应完成后,进行融解曲线反应分析产物特异性:从55℃开始,每30秒增加0.5℃,至95℃结束,共81个循环。结果使用2-△△ct的方法进行分析,用gapdh作为内参基因。primed态干细胞及naive态干细胞的相关基因表达情况如图2所示:naive态干细胞细胞的相关基因表达明显活跃于primed态干细胞状态细胞。dppa3-fatcggaagctttactccgtcgagdppa3-rcccttaggctccttgtttgttggklf5-ftcagacagcagcaatggacactcklf5-rgtggcctgttgtggaagaaactgnanog-fttctgctgagatgcctcacacggnanog-rtcttgaccgggaccttgtcttccklf4-fctgggtcttgaggaagtgctgagklf4-rgtggcatgagctcttggtaatggdnmt3l-fctgcggaagtctccaggttcadnmt3l-rgtagcatcgggtgcaatcagg表2相关定量基因的引物序列实例4通过westernblot检测培养过程中干性基因的表达具体步骤如下:a.细胞收集后用pbs洗一次,加入适量配置好的蛋白裂解液,吹打均匀后冰上裂解30分钟。(一个六孔的cipscs可用100μl蛋白裂解液裂解)b.超声破碎1分钟后,4℃,12000rpm离心10分钟。c.收集上清,bca法测定蛋白浓度。d.测定浓度后,蛋白样品加入适量5×sds,95℃金属浴煮5分钟变性,立即上样或于-80℃保存。e.配置分离胶和浓缩胶,用1×sds将蛋白稀释成5μg/5μl进行上样。(一般上样量为3-5μg,目的蛋白表达量低可适当增加上样量)f.电泳:80v电压电泳30分钟用于浓缩,当样品跑至分离胶时,换成100v电压进行电泳约1小时。g.转膜:100v冰水浴中转膜2小时。h.封闭:用tbst配置的5%脱脂奶粉进行封闭,室温封闭2小时。i.孵育一抗:用封闭液按1:1000稀释一抗,室温孵育2小时或4℃过夜。j.洗涤一抗:tbst洗三次,每次15分钟,室温,摇床上摇晃。k.孵育二抗:用封闭液按1:5000稀释二抗,室温孵育1小时。l.洗涤二抗:tbst洗涤三次,每次15分钟,室温,摇床上摇晃。m.显色曝光:将化学发光底物试剂盒中a液和b液按1:1混合,一般每张膜使用500ul。在暗室中用保鲜膜包好放入x光片夹中,压片10秒至3分钟不等。之后x光片经显影和定影后晾干保存,如图3所示。本发明解决了因为人体多能干细胞的直接获取受到伦理限制,导致获取多能干细胞受限,利用小分子组合将激发态干细胞转化成原始态干细胞的方法,化学诱导细胞重编程扩展多潜能干细胞的获取技术,为干细胞在再生医学领域的应用提供了材料基础,为细胞命运决定研究的模型,为生殖医学及拯救濒危野生动物提供实践基础。以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1