水稻基因LJS5-2及其同源基因在控制水稻叶枕发育和叶夹角大小中的应用的制作方法
本发明属于植物基因工程领域,具体涉及水稻基因ljs5-2及其同源基因在控制水稻叶枕发育和叶夹角大小中的应用。
背景技术:
水稻叶片分为三类,包括胚芽鞘、不完全叶和完全叶。胚芽鞘是发芽时最先出现的白色芽鞘,是叶的变形,没有叶绿素。不完全叶是从胚芽鞘中长出的第一片绿叶,只有叶鞘,没有叶片和叶枕结构。完全叶是自第二片绿叶开始,具有叶片、叶鞘、叶枕。叶片的主要功能是作为光合作用的器官。叶鞘包裹主茎,可以增强茎的支撑作用。叶枕是单子叶禾本科植物特有的一类机械组织,是连接叶片和叶鞘的机械组织,包括叶枕带、叶耳、叶舌。叶枕带作为机械组织,当叶片与叶鞘生长完成后,可以使叶片偏离主茎形成夹角(hoshikawaandichii,1989)。所以,叶枕的有无和发育程度直接决定了叶夹角的大小,从而影响水稻株型和产量。
日益增长的人口,对于粮食的需求也日益增加。提高水稻产量,一直是水稻育种研究和基因功能研究的热点和重点。1968年,donald提出了作物理想株型育种的概念,即影响植物光合作用、生长和籽粒产量相关的性状选择(donald,1968)。影响水稻株型的性状主要包括株高、分蘖数、穗型、粒型、叶形、叶夹角和分蘖角度等,其中叶夹角大小是决定叶片直立性的重要农艺性状(冯荣坤,2006)。直立叶片可以增强光合作用的光捕获能力,作为籽粒灌浆的氮源,还可以增加种植密度,从而提高叶面积指数和水稻产量(sakamoto,etal.,2006)。
技术实现要素:
本发明的目的在于获得调控水稻叶枕发育和叶夹角大小的基因ljs5-2及其同源基因ljs5-2l。
本发明的另一个目的是提供ljs5-2及其同源基因ljs5-2l在控制水稻叶枕发育和叶夹角大小中的应用。
为了实现上述目的,本发明通过反向遗传学的方法,从水稻叶枕组织中克隆了调控叶枕发育基因ljs5-2基因及其同源基因ljs5-2l。
具体的,用于克隆ljs5-2基因及其同源基因ljs5-2l的引物序列如下:
ljs5-2-fcgggatccatggtgcgggggaggacgga
ljs5-2-rgcgtcgacacctgtctccgaccggttgga
ljs5-2l-fcgggatccatggtgcgggggaagacgcaga
ljs5-2l-rgcgtcgacagaatggggcatcgcttggcta
具体的,用于克隆ljs5-2基因及其同源基因ljs5-2l的pcr条件为:94℃变性3min,94℃30s、55℃1min、68℃2min35cycles,68℃延伸10min。
具体的,用于克隆ljs5-2基因及其同源基因ljs5-2l的pcr反应体系的总体积为50μl,模板为日本晴cdna1μl(约50ng)、10×kod酶反应缓冲液5μl、25mmmgcl22μl、5mmdntp5μl、5μm引物5μl(每条引物均为2.5μl)、1μlkod酶,加ddh2o(无菌去离子水)至50μl。
本发明通过上述方法获得了包含有seqidno.1所述核苷酸的ljs5-2基因序列和包含有seqidno.2所述核苷酸的ljs5-2l基因序列。
本发明同时还获得了ljs5-2基因编码的氨基酸序列,如seqidno.3所示,ljs5-2l基因编码的氨基酸序列,如seqidno.4所示。
本发明通过生物信息学的方法鉴定所获得的基因均为调控叶枕发育基因,利用不同时期叶枕的rna-seq数据验证了基因ljs5-2基因及其同源基因ljs5-2l在叶枕发育过程中的表达特异性。
ljs5-2基因及其同源基因ljs5-2l在禾本科作物改良中的应用。
ljs5-2基因及其同源基因ljs5-2l在改善水稻株型和提高水稻产量的应用。
ljs5-2基因及其同源基因ljs5-2l在调控水稻叶枕发育和叶夹角大小中的应用,应用时,构建含有ljs5-2基因及其同源基因ljs5-2l的crispr/cas9载体,并转入日本晴,敲除ljs5-2及其同源基因ljs5-2l基因,所获得的转基因系表现为叶夹角比野生型(日本晴)小,因此可通过该方法减小叶枕近轴薄壁细胞的大小,减小叶夹角,改良植物株型和种植密度,提高产量,实现了对水稻叶枕发育和叶夹角大小的调控。
与现有技术相比,本发明的有益效果为:
1.ljs5-2基因及其同源基因ljs5-2l是一个在水稻叶枕发育后期特异表达的基因,这使利用该基因只改变作物夹角,而不影响其它性状成为可能。
2.ljs5-2基因及其同源基因ljs5-2l是一个改变叶夹角大小的有效基因,它可以改变叶枕近轴面薄壁细胞的大小,进而改变作物的叶夹角。
3.目前,通过改变叶枕细胞学结构对叶夹角大小进行调控的基因较少,该基因揭示了其通过控制叶枕近轴面薄壁细胞的大小,参与叶夹角大小的调控。
4.目前,植物直立株型提高产量的机制研究的比较少,ljs5-2与ljs5-2l利用crispr/cas9成功敲除后,在高密度下通过提高单位面积可育穗数增加了水稻产量(如图6所示)。
附图说明
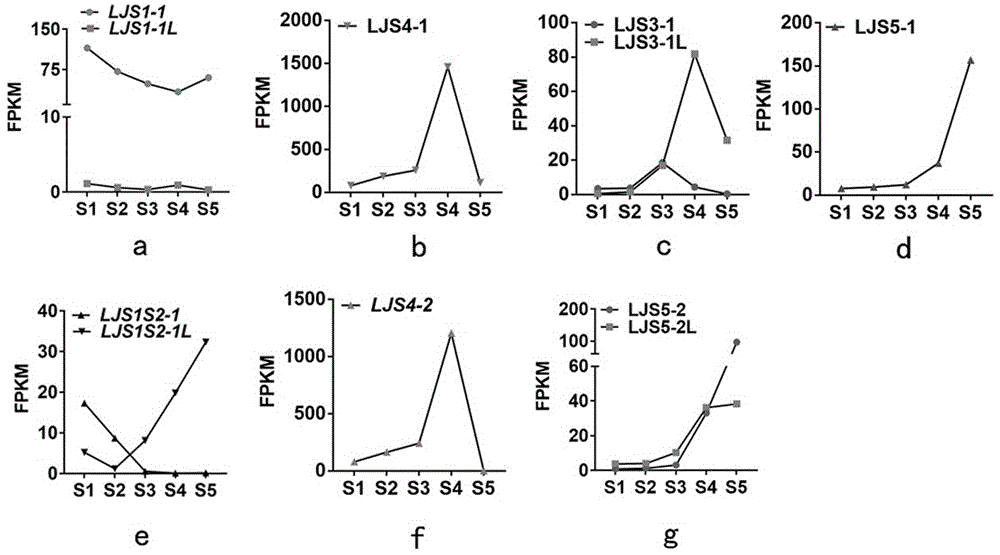
图1为rna-seq测序结果,其中图1a为ljs1-1在水稻叶枕发育早期特异表达,图1b为ljs4-1在水稻叶枕发育后期特异表达,图1c为ljs3-1及其同源基因ljs3-1l分别在水稻叶枕发育的s3和s4期特异表达,图1d为ljs5-1在水稻叶枕发育后期特异表达,图1e为ljs1s2-1在水稻叶枕发育早期特异表达,图1f为ljs4-2在水稻叶枕发育后期特异表达,图1g为ljs5-2及其同源基因ljs5-2l在水稻叶枕发育的s4和s5期特异表达;
图2为crispr/cas9敲除目标基因的转基因水稻幼苗叶夹角表型和抽穗期植株表型以及敲除后转基因水稻幼苗和野生型(日本晴)的叶夹角大小统计,其中图2a目标基因为ljs1-1及其同源基因ljs1-1l;图2b目标基因为ljs4-1;图2c目标基因为ljs3-1及其同源基因ljs3-1l;图2d目标基因为ljs5-1;图2e目标基因为ljs1s2-1及其同源基因ljs1s2-1l;图2f目标基因为ljs4-2;图2g目标基因为ljs5-2及其同源基因ljs5-2l;
图3为crispr/cas9敲除目标基因的转基因水稻和野生型(日本晴)的抽穗期幼苗剑叶叶枕的细胞学结构变化图,其中图3a目标基因为ljs1-1及其同源基因ljs1-1l;图3b目标基因为ljs4-1;图3c目标基因为ljs3-1及其同源基因ljs3-1l;图3d目标基因为ljs5-1;图3e目标基因为ljs1s2-1及其同源基因ljs1s2-1l;图3f目标基因为ljs4-2;图3g目标基因为ljs5-2及其同源基因ljs5-2l;
图4a为real-timepcr验证目标基因调控的促进和抑制木质素合成的靶基因在crispr/cas9敲除目标基因后转基因水稻中的表达量变化,其中图4a目标基因为ljs4-1,图4b目标基因为ljs3-1及其同源基因ljs3-1l,图4c目标基因为ljs1s2-1及其同源基因ljs1s2-1l,图4d目标基因为ljs4-2;
图5为pljs1s2-1::ljs1s2-1转基因水稻转基因株系的幼苗表型和表达量分析;
图6为crispr/cas9敲除目标基因的转基因水稻对产量的影响,其中,图6a目标基因为ljs1-1及其同源基因ljs1-1l,图6b目标基因为ljs4-1,图6c目标基因为ljs3-1及其同源基因ljs3-1l,图6d目标基因为ljs5-1,图6e目标基因为ljs1s2-1及其同源基因ljs1s2-1l,图6f目标基因为ljs4-2,图6g目标基因为ljs5-2及其同源基因ljs5-2l。
具体实施方式
本发明通过反向遗传学的方法,从水稻叶枕组织中克隆了基因ljs1-1(geneid:os01g0922800)及其同源基因ljs1-1l(geneid:os08g0531900,同源性为45.83%)、基因ljs4-1(geneid:os03g0182800)、基因ljs3-1(geneid:os04g0549700)及其同源基因ljs3-1l(geneid:os02g0656600,同源性为57.58%)、基因ljs5-1(geneid:os06g0166400)、基因ljs1s2-1(geneid:os06g0181700)及其同源基因ljs1s2-1l(geneid:os02g0797100,同源性为71.59%)、基因ljs4-2(geneid:os07g0674800)、基因ljs5-2(geneid:os10g0536100)及其同源基因ljs5-2l(geneid:os03g0122600,同源性为63.88%),通过生物信息学的方法鉴定所获得的基因均为调控叶枕发育基因,并利用不同时期叶枕的rna-seq数据验证了所获得的基因在叶枕发育过程中的表达特异性。本发明通过转基因的方法将上述基因转入日本晴,发现目标基因可以调控水稻叶夹角大小,改良植物株型和种植密度,提高产量,实现了对水稻叶枕发育和叶夹角大小的调控。
具体的实施方法如下,需要说明的是,下述基因合成过程或水稻应用试验中,如未特别说明,均为本领域的常规试验方法和技术手段;所涉及的试剂或生物材料,如未特别说明,均已公开或为可以直接购买的市售产品。
实施例
(一)ljs1-1基因及其同源基因ljs1-1l在控制水稻叶枕发育和叶夹角大小中的应用试验,具体步骤如下:
1.调控水稻叶枕发育和叶夹角大小基因ljs1-1及其同源基因ljs1-1l的获得
1.1反应体系的总体积为50μl,模板为日本晴cdna1μl(约50ng)、10×kod酶反应缓冲液5μl、25mmmgcl22μl、5mmdntp5μl、5μm引物5μl(采用分步pcr方式,使用引物ljs1-1-f和ljs1-1-r以及ljs1-1l-f和ljs1-1l-r(每条引物均为2.5μl)、1μlkod酶,加ddh2o(无菌去离子水)至50μl。
1.2反应程序为:94℃变性5min,94℃30s、55℃1min、68℃2min35cycles,68℃延伸10min。
1.3所用引物如下:
ljs1-1-fcgggatccatggcgcggagggggaga
ljs1-1-rgcgtcgactgcacttccttcctcctgcc
ljs1-1l-fcgggatccatggagggaggagggaggagg
ljs1-1l-rgcgtcgacagagctcactcctgatcttggct
2.利用rna-seq数据验证基因ljs1-1及其同源基因ljs1-1l在水稻叶枕中特异表达
正常条件下从浸种开始生长4、5、6、7、9天的水稻日本晴小苗,定义为叶枕发育的第一期(s1)、第二期(s2)、第三期(s3)、第四期(s4)、第五期(s5)。分别取第一完全叶的叶片和叶枕,利用tiangenrnapreppureplantkit(tiangen)提取总rna,然后进行rna-seq测序。
通过生物信息学分析,获得在五个时期特异表达的差异基因集合和相对应的功能富集分析的goterms,选取差异基因集合,包括单时期特异表达基因集合m01-m05和叶枕发育相关的goterms基因集合,提取启动子序列,利用meme软件分析启动子上富集的基序(motifs),选取前10个且符合e-value≤10-6的基序作为可能的转录因子结合位点(ptfbss);然后利用tomtom软件和jasparcore数据库将ptfbss与已知的tfbss做对比,选择符合q-value≤0.05和p-value≤10-4条件的已知tfbss,从而获得ptfbss对应的已知tfs;再利用blastp(e-value≤10-10)寻找这些已知tfs在水稻中的同源基因;候选tfs的界定符合两个条件,第一个是planttfdb认定属于相应的转录因子家族,第二是tfs与其对应的同时期特异表达的靶基因具有表达趋势的高度相关性(pcc≥0.9)。本发明通过对s1期特异表达的差异基因集合m01进行如上分析,获得了基因ljs1-1及其同源基因ljs1-1l。最终,获得了基因ljs1-1及其同源基因ljs1-1l在五个时期的叶片和叶枕中的表达量。发现基因ljs1-1在叶枕发育s1特异表达(图1a所示)。
3.ljs1-1基因及其同源基因ljs1-1l对水稻叶枕的调控
3.1crispr/cas9载体的构建
采用含有基因ljs1-1及其同源基因ljs1-1l的crispr靶位点序列的片段,利用kpni酶切位点将片段克隆到pcxun-cas9载体上,具体方法参见文献he,y.,zhang,t.,yang,n.,xu,m.,yan,l.,wang,l.,wang,r.,andzhao,y.(2017).self-cleavingribozymesenabletheproductionofguidernasfromunlimitedchoicesofpromotersforcrispr/cas9mediatedgenomeediting.journalofgeneticsandgenomics=yichuanxuebao44,469-472。
其中,获取基因ljs1-1及其同源基因ljs1-1l的crispr靶位点片段的反应体系的总体积为50μl,ljs1-1基因采用的模板为u6载体1μl(约50ng);ljs1-1l基因采用的模板为u3载体1μl(约50ng)、1×kod酶反应缓冲液5μl、25mmmgcl22μl、5mmdntp5μl、5um引物5μl(正向和反向引物分别为2.5μl)、1μlkod酶,加ddh2o(无菌去离子水)至50μl。
反应程序为:94℃变性5min,94℃30s、55℃1min、68℃2min35cycles,68℃延伸10min。
所用引物为:
ljs1-1-u6fggtgcggttctccaagaggagttttagagctagaaatagcaagtta
ljs1-1-u6rtcctcttggagaaccgcaccaacctgagcctcagcgcagc
ljs1-1l-u3fatcgcacctgccggctcgtcgttttagagctagaaatagcaagtta
ljs1-1l-u3fgacgagccggcaggtgcgatgccacggatcatctgcacaactc
得到ljs1-1靶位点的序列片段序列和ljs1-1l靶位点的序列片段序列,并利用kpni酶切位点将片段克隆到pcxun-cas9载体上。
取2μl含有ljs1-1和ljs1-1l靶点的pcxun-cas9载体,加入50μleha105感受态中,充分混匀。加入预冷的电击杯中,进行电激转化。电激仪参数设置:电压2.45kv,电阻200ω,电容200μf。
3.2水稻遗传转化
以下方法中的水稻转化采用农杆菌eha105介导的遗传转化方法,具体步骤如下:
3.2.1愈伤诱导
将水稻种子去壳,取饱满清亮的籽粒先用70%乙醇浸泡1min,无菌水冲洗1-2次;再用含2%活性氯的naclo溶液(40ml含>5.2%活性氯的naclo溶液加60ml水),加1-3滴tween20,浸泡30min以上(一般40min,最长可至1h)。不时摇动,然后用无菌水冲洗4-5次。倒在灭菌的平板和滤纸上吸干,约1h左右;将之置入n6d固体培养基上(10粒/25ml/瓶),种胚朝上或接触培养基,28℃,暗培养25~30d。n6d培养基:n6盐分和维生素,0.5g/l酪蛋白水解物,30g/l蔗糖,2mg/l2,4-d,2.5g/lphytagel(sigma),ph5.8。
3.2.2农杆菌的培养及其与水稻愈伤组织的共培养
取灭菌小勺刮取农杆菌,用勺背面将菌体贴在管壁轻轻拍散,od600=0.8~1.0;将前培养的愈伤在无菌滤纸上晾一下,然后集中至一个平皿一次性转入菌液中,轻轻转动离心管使菌液均匀分布,静置时间约15~20min;将菌液倒出,愈伤在无菌滤纸上放约1.5h,保证菌液吸干,接至1/2n6das中,20℃、暗培养2~3天,看到愈伤与培养基接触部分有菌膜,就可以除菌了;1/2n6das培养基:n6d2,10g/l葡萄糖,100~400μmol/l乙酰丁香酮(用时现加),ph5.2。
3.2.3农杆菌的去除
将共培养的愈伤装入50ml的离心管,用无菌水清洗3次以上,至液体比较清亮,倒出无菌水,n6d+cn500mg/l(或ap500ml/l),100rpm,,15-20min,2-3次;将愈伤倒在无菌滤纸上吸干2h左右,视情况而定;将干燥的愈伤转入n6d-as中,加头孢霉素cn250mg/l,28℃,暗培养7~10d。
3.2.4愈伤组织的筛选
挑出没被农杆菌污染的愈伤,第一次加cn250mg/l和hn(50mg/l),15~20d;第二次同上,不加cn,加潮霉素hn,把所有的愈伤全部再转一次,15~20d。第三次选出新的愈伤,用hn筛选,15~20d;次数部用一定按上述安排,但应保证愈伤在hn上筛选的时间至少45d以上,第三次挑出的新长出的愈伤最好筛选20d;n6d筛选培养基:n6d+cn250mg/l+hn50mg/l,ph=5.8~5.9。
3.2.5分化和生根
将第四次筛选的全部愈伤组织移入ms中,hn50mg/l,暗培养,预分化(ph5.9)12~15d。选出长势好的新鲜的愈伤,移入ms(ph6.0)中,光培养15~20d,可看到有绿芽长出,一般15d换一次培养基;选长出1cm以上的绿芽,剥去周围多余的愈伤,剪去根(可留约0.5cm长)移入试管中,1/2ms生根培养。ms分化培养基:ms盐分和维生素,2g/l酪蛋白水解物,30g/l蔗糖,25g/l山梨醇,2mg/l6-ba,0.5mg/lnaa,0.2mg/l玉米素(zeatin),0.5mg/lkt,3.0g/lphytagel,ph5.8,50mg/l潮霉素b,200mg/l头孢霉素。1/2ms生根培养基:1/2ms盐分,,ms维生素,30g/l蔗糖,1mg/l多效唑,0.5mg/lnaa,50mg/l潮霉素,2.5g/lphytagel,ph5.8。
4.移栽、表达量鉴定和表型分析
将生根的转基因植株每个遗传构建20个系,移栽温室,基因ljs1-1及其同源基因ljs1-1l的crispr转基因植株采取叶片提取dna,扩增编辑片段鉴定突变单株。
所用引物如下:
ljs1-1-genomefcatccgcctcgtcaaatgc
ljs1-1-genomercgggatagcagaacgaaatgg
ljs1-1l-genomefggattccctcaccaccacatta
ljs1-1l-genomercgcagtggagtggagtacat
5.产量测定
在田间对ljs1-1-cri/ljs1-1l-cri和野生型ni进行不同种植密度下的产量测定。正常密度(normal,n)以30cm行距和15cm株距进行种植,平均每平方米种植22.2株水稻。高密(dense,d)以15cm行距和15cm株距进行种植,平均每平方米种植44.4株水稻。每种处理在随机区组中重复三次。每个小区为长2m,宽2m。性状调查,选择除周边植物以外的中间植株进行统计。数据处理使用spss17.0进行。多重比较采用tukey’shonestsignificantdifferencetest(p<0.05)。
(二)ljs4-1基因在控制水稻叶枕发育和叶夹角大小中的应用试验,试验方法同上。
步骤1.3中所用引物为:
ljs4-1-fcgggatccatgtgcggcggtgcaatcctc
ljs4-1-rgcgtcgacgtcgagcagaagagaggcctg
步骤2.中通过对s4期特异的表达差异基因的细胞壁相关goterm基因集合进行如上分析,获得了ljs4-1。最终,获得ljs4-1在五个时期叶枕中的表达量。发现基因ljs4-1在叶枕发育s4特异表达(图1b所示)。
步骤3.1中基因ljs4-1采用模板为u6载体,所用引物为:
ljs4-1-u6fgggggacgacacacatgacagttttagagctagaaatagcaagtta
ljs4-1-u6rtgtcatgtgtgtcgtcccccaacctgagcctcagcgcagc
步骤4.中所用引物为:
ljs4-1-genomefcaatcctcgccgatttcacc
ljs4-1-genomergctcttcttgctcgccttc
(三)ljs3-1基因及其同源基因ljs3-1l在控制水稻叶枕发育和叶夹角大小中的应用试验,试验方法同上。
步骤1.3中所用引物为:
ljs3-1-fcgggatccatggaagcagacgcgagccata
ljs3-1-rgcgtcgacctcggcccacaagagtggctca
ljs3-1l-fcgggatccatggaagctgccgcgatcc
ljs3-1l-rgcgtcgacgtcaggctgcacgggcgc
步骤2.中通过对s3期和s4期特异的表达的差异基因集合m03和m04进行如上分析,分别获得了ljs3-1和ljs3-1l。最终,获得ljs3-1及其同源基因ljs3-1l在五个时期叶枕中的表达量。发现基因ljs3-1及其同源基因ljs3-1l分别在叶枕发育的s3和s4特异表达(图1c所示)。
步骤3.1中ljs3-1基因采用的模板为u6载体1ul(约50ng);ljs3-1l基因采用的模板为u3载体1ul(约50ng),所用引物为:
ljs3-1-u6fggccgctctcttgcgcttctgttttagagctagaaatagcaagtta
ljs3-1-u6ragaagcgcaagagagcggccaacctgagcctcagcgcagc
ljs3-1l-u3facaagcagctcaagcggaaggttttagagctagaaatagcaagtta
ljs3-1l-u3rcttccgcttgagctgcttgtgccacggatcatctgcacaactc
步骤4.中所用引物为:
ljs3-1-genomefcagaccgcacttccatcga
ljs3-1-genomergatctccgacacccacttcc
ljs3-1l-genomefcatctccttcctgcggtattct
ljs3-1l-genomeragccagatgcgcgacttct
(四)ljs5-1基因在控制水稻叶枕发育和叶夹角大小中的应用试验,试验方法同上。
步骤1.3中所用引物为:
ljs5-1-fcgggatccatggataggagggaggccacc
ljs5-1-rgcgtcgacctcgtcgtcggaggtgtccg
步骤2.中通过对s5期特异的表达的差异基因集合m05进行如上分析,获得了ljs5-1。获得ljs5-1在五个时期叶枕中的表达量。发现基因ljs5-1在叶枕发育s5特异表达(图1d所示)。
步骤3.1中所用引物为:
ljs5-1-u6fgcgagccgaacaagcggtcggttttagagctagaaatagcaagtta
ljs5-1-u6rcgaccgcttgttcggctcgcaacctgagcctcagcgcagc
步骤4.中所用引物为:
ljs5-1-genomefgcgaggatggataggaggga
ljs5-1-genomertagaacacggcggtgtcgta
(五)ljs1s2-1基因及其同源基因ljs1s2l-1l在控制水稻叶枕发育和叶夹角大小中的应用试验,试验方法同上。
步骤1.3中所用引物为:
ljs1s2-1-fcgggatccatggcgcggccgcagca
ljs1s2-1-rgcgtcgacgcaggagatctccatggagaagt
ljs1s2-1l-fcgggatccatggcgaggccgcagcaacgat
ljs1s2-1l-rgcgtcgacgtagcagatctccatggagaag
步骤2.中通过对s1和s2期均表达特异的差异基因集合m06进行如上分析,获得了ljs1s2-1和ljs1s2l-1l。最终,获得ljs1s2-1和ljs1s2l-1l在五个时期的叶片和叶枕中的表达量。发现基因ljs1s2-1和ljs1s2l-1l在叶枕发育s1和s2特异表达(图1e所示)。
步骤3.1中基因ljs1s2-1采用模板为u6载体,基因ljs1s2l-1采用模板为u3载体,所用引物为:
ljs1s2-1-u6fggcacgcgcgtacgacgagggttttagagctagaaatagcaagtta
ljs1s2-1-u6rcctcgtcgtacgcgcgtgccaacctgagcctcagcgcagc
ljs1s2-1l-u3faggccgcagcaacgataccggttttagagctagaaatagcaagtta
ljs1s2-1l-u3rcggtatcgttgctgcggcctgccacggatcatctgcacaactc
步骤3.还包括植物表达载体pljs1s2-1::ljs1s2-1的构建,具体步骤为:
利用分步法先将ljs1s2-1启动子(ljs1s2-1启动子序列的获得方法同上)区连接到本实验室改造的融合flag标签的pcambia1300载体骨架上(ljs1s2-1-prof和ljs1s2-1-pror),获得pcambia1300-pljs1s2-1,然后再将ljs1s2-1全长cdna利用bamhi/sali克隆到pcambia1300-pljs1s2-1上(ljs1s2-1-oe-f和ljs1s2-1-oe-r),获得植物表达载体pljs1s2-1::ljs1s2-1,转入日本晴中。所用引物如下:
ljs1s2-1-oe-fcgggatccatggcgcggccgcagca
ljs1s2-1-oe-rgcgtcgacgcaggagatctccatggagaagt
ljs1s2-1-profctatgacatgattacgaattctggttggcttggctgtgat
ljs1s2-1-prorccgctgcgtggggttggtacctgccgacgtcctcgagctcg
步骤4.将生根的转基因植株每个遗传构建20个系,移栽温室,ljs1s2-1的crispr转基因植株采取叶片提取dna,扩增编辑片段鉴定纯合单株(ljs1s2-1-genomef和ljs1s2-1-genomer)。pljs1s2-1::ljs1s2-1转基因植株,采用取叶片提取植物蛋白,利用westernblot进行表达量鉴定。所用引物如下:
ljs1s2-1-genomefgctcatgggtctccgagat
ljs1s2-1-genomergagctctggtccacgtactgctcct
ljs1s2-1l-genomeftcggcgaagtgctcgatca
ljs1s2-1l-genomercgaacgtgcccagccatat
(六)ljs4-2基因在控制水稻叶枕发育和叶夹角大小中的应用试验,试验方法同上。
步骤1.3中所用引物为:
ljs4-2-fcgggatccatgtgtggcggcgcgatcattt
ljs4-2-rgcgtcgaccatcggcacggccgtgtggat
步骤2.中通过对s4期特异的表达差异基因的细胞壁相关goterm基因集合进行如上分析,获得了ljs4-2。最终,获得ljs4-2在五个时期叶枕中的表达量。发现基因ljs4-2在叶枕发育s4特异表达(图1f所示)
步骤3.1中基因ljs4-2采用模板为u3载体,所用引物为:
ljs4-2-u3facggccgccgcctgatgccagttttagagctagaaatagcaagtta
ljs4-2-u3rtggcatcaggcggcggccgtgccacggatcatctgcacaactc
步骤4.中所用引物为:
ljs4-2-genomefcagaggagccgaccaagaag
ljs4-2-genomerggcgtcgtagtccatgaact
(七)ljs5-2基因及其同源基因ljs5-2l在控制水稻叶枕发育和叶夹角大小中的应用试验,试验方法同上。
步骤1.3中所用引物为:
ljs5-2-fcgggatccatggtgcgggggaggacgga
ljs5-2-rgcgtcgacacctgtctccgaccggttgga
ljs5-2l-fcgggatccatggtgcgggggaagacgcaga
ljs5-2l-rgcgtcgacagaatggggcatcgcttggcta
获得包含有seqidno.1所述核苷酸的ljs5-2基因序列和包含有seqidno.2所述核苷酸的ljs5-2l基因序列,ljs5-2基因编码的氨基酸序列为seqidno.3所示,ljs5-2l基因编码的氨基酸序列为seqidno.4所示。
步骤2.中通过对s5期特异的表达的差异基因集合m05进行如上分析,获得了ljs5-2和ljs5-2l。最终,ljs5-2在五个时期叶枕中的表达量。发现基因ljs5-2在叶枕发育的s5期特异表达(图1g所示)。
步骤3.1中基因ljs5-2基因采用的模板为u6载体,ljs5-2l基因采用的模板为u3载体,所用引物为:
ljs5-2-u6fggattgagaacccgacgagcgttttagagctagaaatagcaagtta
ljs5-2-u6rgctcgtcgggttctcaatccaacctgagcctcagcgcagc
ljs5-2l-u3fattcgtagagcttgccgcgcgttttagagctagaaatagcaagtta
ljs5-2l-u3rgcgcggcaagctctacgaatgccacggatcatctgcacaactc
得到ljs5-2靶位点的序列片段ggattgagaacccgacgagc和ljs5-2l靶位点的序列片段gcgcggcaagctctacgaat。
步骤4.中所用引物为:
ljs5-2-genomefcctcgtctcgtctcgtctct
ljs5-2-genomertgctttatagcggtcgatggt
ljs5-2l-genomefcgtgtggttggttggttca
ljs5-2l-genomerctgatgctaatgaggcttctct。
以上参照(一)中ljs1-1基因及其同源基因ljs1-1l的试验方法对(二)至(七)中基因进行相关应用试验,试验结果如图1至6所示。
试验结果与结论
1、从图1a中可以看出ljs1-1在叶枕发育早期特异表达;从图1b中可以看出ljs4-1在叶枕发育s4期特异表达;从图1c中可以看出ljs3-1及其同源基因ljs3-1l分别在叶枕发育的s3和s4期特异表达;从图1d中可以看出ljs5-1在叶枕发育后期特异表达;从图1e中可以看出ljs1s2-1在叶枕发育早期特异表达;从图1f中可以看出ljs4-2在叶枕发育s4期特异表达;从图1g中可以看出ljs5-2及其同源基因ljs5-2l在叶枕发育的s4和s5期特异表达。
2、从图2a中可以看出成功敲除后,纯合突变植株苗期夹角变小和抽穗期株型直立并且纯合突变植株苗期的叶夹角比野生型(日本晴)显著减小;从图2b中可以看出成功敲除后,纯合突变植株抽穗期夹角变小、株型直立;从图2c中可以看出成功敲除后,纯合突变植株抽穗期夹角变小、株型直立;从图2d中可以看出成功敲除后,纯合突变植株夹角变小;从图2e中可以看出成功敲除后,纯合突变植株的叶夹角比野生型(日本晴)小;从图2f中可以看出成功敲除后,纯合突变植株抽穗期夹角变小、株型直立;从图2g中可以看出成功敲除后,纯合突变植株夹角变小、株型直立。
3、从图3a中可以看出成功敲除后,纯合突变植株的苗期叶枕结构发生变化,叶枕细胞层数比野生型(日本晴)增多;从图3b中可以看出成功敲除后,纯合突变植株抽穗期剑叶叶枕的厚壁组织木质素积累比野生型(日本晴)增多,机械强度增大;从图3c中可以看出成功敲除后,纯合突变植株抽穗期剑叶叶枕的厚壁组织木质素积累比野生型(日本晴)增多,叶枕机械强度增大;从图3d中可以看出成功敲除后,纯合突变植株的苗期叶枕结构发生变化,叶枕近轴面薄壁细胞比野生型(日本晴)小;从图3e中可以看出成功敲除后,纯合突变植株的苗期叶枕结构发生变化,远轴面厚壁细胞比野生型(日本晴)增多;从图3f中可以看出成功敲除后,纯合突变植株抽穗期剑叶叶枕的厚壁组织木质素积累比野生型(日本晴)增多,机械强度增大;从图3g中可以看出同时成功敲除后,纯合突变植株叶枕的近轴面薄壁细胞比野生型(日本晴)小。
4、从图4a中可以看出qrt-pcr检测促进和抑制木质素积累的ljs4-1靶基因在ljs4-1-cri转基因株系中的表达量变化,表明ljs4-1在叶枕发育s4的表达,与叶枕厚壁组织的木质素积累相关;从图4b中可以看出qrt-pcr检测促进和抑制木质素积累的靶基因在ljs3-1及其同源基因ljs3-1l的crispr转基因株系中的表达量变化,表明ljs3-1及其同源基因ljs3-1l在叶枕发育的s3和s4的表达,与叶枕厚壁组织的木质素积累相关;从图4c中可以看出通过qrt-pcr检测细胞周期相关基因在ljs1s2-1-cri/ljs1s2-1l-cri转基因株系中的表达量分析,表明ljs1s2-1在叶枕发育早期的表达,与叶枕细胞的增殖相关;从图4d中可以看出qrt-pcr检测促进和抑制木质素积累的ljs4-2靶基因在ljs4-2-cri转基因株系中的表达量变化,表明ljs4-2在叶枕发育s4的表达,与叶枕厚壁组织的木质素积累相关。
5、从图5可以看出将ljs1s2-1的启动子和全长cds克隆到pcambia1300上,转入日本晴中,所获得的转基因系的叶夹角比野生型(日本晴)大,说明ljs1s2-1具有控制水稻叶枕发育和叶夹角大小的功能。
6、从图6中可以看出目标基因成功敲除后,通过在高密度下提高单位面积可育穗数增加了水稻产量。
序列表
<120>水稻基因ljs5-2及其同源基因在控制水稻叶枕发育和叶夹角大小中的应用
<160>4
<170>siposequencelisting1.0
<210>1
<211>702
<212>dna
<213>水稻(oryzasativa)
<400>1
atggtgcgggggaggacggagctgaagcggattgagaacccgacgagccggcaggtgacc60
ttctccaagcgccggaatggcctcctcaagaaggcgttcgagctctccgtcctctgcgac120
gccgaggtcgccctcatcgtcttctccccccgcggccgcctctacgagttcgccagcgcc180
cccagcctacagaaaaccatcgaccgctataaagcatacacaaaggatcatgtcaacaat240
aagacaattcaacaagatatccagcaagtcaaagatgatactttaggcttggccaagaaa300
cttgaagctcttgatgagtccagacggaaaatattgggagaaaatttagaaggattctct360
attgaagaactgcgtggtctagaaatgaaacttgagaagagcctccacaagataagacta420
aagaagaccgagcttctggagcagcagatagccaagctgaaagagaaggagcggactttg480
cttaaagacaacgaaaatttacgcggaaagcatcgcaaccttgaggctgcggcgctggtg540
gctaaccacatgacgacgacgacggcgccggcggcgtggccgcgggacgtgcctatgacg600
agcagcacagccggcgccgccgacgccatggacgtggagactgatctgtacattggattg660
cccggcactgagcgctcctccaaccggtcggagacaggttga702
<210>2
<211>693
<212>dna
<213>水稻(oryzasativa)
<400>2
atggtgcgggggaagacgcagatgaagcggatagagaaccccacgagccgccaggtcacc60
ttctccaagcgccgcaacggcctgctcaagaaggccttcgagctctccgtcctctgcgac120
gccgaggtcgcgctcatcgtcttctccccgcgcggcaagctctacgaattcgccagcgcc180
agtacgcagaaaacaattgaacgctataggacgtatacaaaggaaaatatcggcaacaag240
acagtacagcaagatatagagcaagtaaaagctgacgctgatggtttggcaaagaaactt300
gaagctcttgaaacttacaaaagaaaactgctgggtgaaaagttggatgaatgttctatt360
gaagaactgcatagcctggaggtcaagctggagagaagcctcattagcatcaggggaagg420
aagacaaagctgcttgaggagcaggttgccaaactgagagagaaggagatgaagctgcgc480
aaggacaatgaagagttacgcgaaaagtgtaagaatcagcctcccttgtctgctcctttg540
actgtccgggccgaagatgagaacccggaccgtaacatcaacaccaccaacgacaacatg600
gatgtcgaaactgagctattcatagggctgcctggcagaagtcgctccagcggcggtgct660
gcagaagatagccaagcgatgccccattcttaa693
<210>3
<211>233
<212>prt
<213>水稻(oryzasativa)
<400>3
metvalargglyargthrgluleulysargilegluasnprothrser
151015
argglnvalthrpheserlysargargasnglyleuleulyslysala
202530
phegluleuservalleucysaspalagluvalalaleuilevalphe
354045
serproargglyargleutyrgluphealaseralaproserleugln
505560
lysthrileaspargtyrlysalatyrthrlysasphisvalasnasn
65707580
lysthrileglnglnaspileglnglnvallysaspaspthrleugly
859095
leualalyslysleuglualaleuaspgluserargarglysileleu
100105110
glygluasnleugluglypheserileglugluleuargglyleuglu
115120125
metlysleuglulysserleuhislysileargleulyslysthrglu
130135140
leuleugluglnglnilealalysleulysglulysgluargthrleu
145150155160
leulysaspasngluasnleuargglylyshisargasnleugluala
165170175
alaalaleuvalalaasnhismetthrthrthrthralaproalaala
180185190
trpproargaspvalprometthrserserthralaglyalaalaasp
195200205
alametaspvalgluthraspleutyrileglyleuproglythrglu
210215220
argserserasnargsergluthrgly
225230
<210>4
<211>230
<212>prt
<213>水稻(oryzasativa)
<400>4
metvalargglylysthrglnmetlysargilegluasnprothrser
151015
argglnvalthrpheserlysargargasnglyleuleulyslysala
202530
phegluleuservalleucysaspalagluvalalaleuilevalphe
354045
serproargglylysleutyrgluphealaseralaserthrglnlys
505560
thrilegluargtyrargthrtyrthrlysgluasnileglyasnlys
65707580
thrvalglnglnaspilegluglnvallysalaaspalaaspglyleu
859095
alalyslysleuglualaleugluthrtyrlysarglysleuleugly
100105110
glulysleuaspglucysserileglugluleuhisserleugluval
115120125
lysleugluargserleuileserileargglyarglysthrlysleu
130135140
leuglugluglnvalalalysleuargglulysglumetlysleuarg
145150155160
lysaspasnglugluleuargglulyscyslysasnglnproproleu
165170175
seralaproleuthrvalargalagluaspgluasnproaspargasn
180185190
ileasnthrthrasnaspasnmetaspvalgluthrgluleupheile
195200205
glyleuproglyargserargserserglyglyalaalagluaspser
210215220
glnalametprohisser
225230
- 还没有人留言评论。精彩留言会获得点赞!