一种生物样本分选方法、声表面波微流控芯片、系统、终端以及存储介质与流程
本申请属于生物样本分选技术领域,特别涉及一种生物样本分选方法、声表面波微流控芯片、系统、终端以及存储介质。
背景技术:
生物学的一个基本挑战是研究细胞之间存在的巨大差异。即使是那些具有相同基因组的细胞,其组成、结构和形态也会因其生理功能而产生差异。为了理解并利用这些细胞间的差异,需要从大量的异质群体中分选出具有特定形态特征的细胞。
目前的特异细胞分选方法主要包括:
(1)荧光激活细胞分选(fluorescence-activatedcellsorting,facs):能将处在快速直线流动状态中的细胞或生物颗粒进行多参数的、快速的定量分析和分选,并且能够精确计数和测量抗体与抗原结合所发出的荧光,具有快速、准确的优点,常用在骨髓和体液中的肿瘤细胞的检测,研究发现流式细胞术检测外周血肿瘤细胞的敏感性为每1000个外周血淋巴细胞中可检测出一个肿瘤细胞。然而该技术的缺点在于:设备昂贵,且缺乏特异性抗原,因此也限制了该技术的推广。该技术在分选细胞时,细胞的信息只是散点图上的一个点,而不是真实的细胞图像,只能处理低分辨率数据(约20个光散射和荧光信号)并用于实时数据处理和操作(即分选),且缺乏细胞形态学、细胞结构及亚细胞水平信号分布的相关信息。
(2)成像流式细胞术(imagingflowcytometry,ifc):成像流式细胞仪将标准流式细胞仪的统计能力和荧光敏感性与数字显微镜的空间分辨率和定量形态相结合。该技术提供了一种方便的方法来直接对血液中的细胞进行成像和分析,因此非常适合临床应用。该技术存在的缺点在于:通过成像流式细胞术对细胞样本进行评估会由于许多因素而变得复杂,而且由于数据传输和图像处理的速度有限,无法获得高维数据,因此无法执行实时驱动。提高数据处理吞吐量的典型策略是使用多台计算机并行处理数据,但这通常仅限于“离线”操作,因此需要较长的周转时间(超过几秒钟),并且不允许实时启动。
(3)智能荧光激活细胞分选(intelligentimage-activatedcellsorting,iacs):通过流式细胞术,从光(通常是激光)与流动的细胞悬浮液之间的相互作用中收集信息,从而通过测量前向和侧向散射信号,得出细胞的大小,形状和荧光特性(弹性散射),或用作特异性标记细胞的荧光标记物的生物标记物的发射波长(非弹性散射)并识别和收集靶标细胞群体。该技术使用频分复用显微镜(frequencydivisionmultiplexing,fdm),通过将连续波激光束转换为具有不同调制频率的多个激光束,以此扫描细胞,并把透射的光束进行处理与合并同时得到清晰的明场和荧光图像。然而该光路系统对时间的调控极为严格,成本极高。且由于使用了荧光标记试剂,标记试剂可能会在收集之前或靶向过程中意外激活或抑制结合细胞,从而改变其行为导致不准确的细胞分析。而且所使用的学习算法是有监督学习(supervisedlearning),需要大量标注(label)好的数据作为训练集,成本高,且不易于推广。
(4)无荧光标记的流式细胞术:一种新颖的流式细胞仪,可以利用其生物物理特征分析细胞,无需荧光标记,仅仅依靠前向和侧向散射信号。在时间拉伸成像中,目标细胞被在空间上分散的宽带脉冲照亮,在亚纳秒的短脉冲持续时间内将目标的空间特征编码到脉冲频谱中。同时捕获相位和强度定量图像,提供丰富的特征,包括蛋白质浓度、光学损耗和细胞形态。该技术的缺点在于:在缺乏荧光标记信息的情况下仅依靠前向和侧向散射信号作为分析来源,缺乏灵敏性和选择性,并且所使用的学习算法仍然是有监督学习。
综上所述,现有的特异细胞分选方法存在一定的局限性,无法兼顾分选效率和细胞活性以及系统成本或者缺少空间信息等导致特异性弱。因此有必要开发一种高效准确并行无损伤的细胞分选方法,已解决现有技术的不足。
成像对细胞分析是必不可少的,因为图像能有效地传达细胞的某些信息,如细胞的形状形态以及细胞内标记的生物分子的分布或位置等。近年来,由于高速成像技术能够以高帧频获取信息丰富的图像,从而在短时间内获得大量的细胞图像,使得能够将复杂的工具应用于基于图像的分析,例如机器学习(machinelearning)或深度学习(deeplearning)。随着半导体技术的发展,使得机器学习和深度学习在图像处理领域大放异彩,大大降低了其算法的耗时。即便是现有的基于图像分析的细胞筛选技术,也仍需要荧光标记物或者手动标注的数据作为分类依据。
技术实现要素:
本申请提供了一种生物样本分选方法、声表面波微流控芯片、系统、终端以及存储介质,旨在解决现有特异细胞分选方法基于有监督学习,需要荧光标记物作为分类依据或注释数据,存在局限性,且无法兼顾分选效率和细胞活性以及系统成本或者缺少空间信息等导致特异性弱的技术问题。
为了解决上述问题,本申请提供了如下技术方案:
一种生物样本分选方法,包括以下步骤:
将含有生物样本的混合液注入声表面波微流控芯片内,并向所述声表面波微流控芯片施加第一正弦信号,在所述声表面波微流控芯片内形成驻波声场,使所述生物样本在声辐射力作用下聚集在所述驻波声场中的节点位置;
采集所述聚集后的生物样本图像;
利用深度学习模型对所述生物样本图像进行运动目标识别及追踪,对所追踪到的运动目标进行聚类分析并分类,得到目标样本,并根据所述目标样本的运动速度生成所述目标样本的延时使能信号;
根据所述延时使能信号向所述声表面波微流控芯片施加第二正弦信号控制所述目标样本移动,以对所述目标样本进行分选。
本申请实施例采取的技术方案还包括:所述声表面波微流控芯片包括至少两对叉指换能器和腔道;
所述至少两对叉指换能器分别位于所述腔道的外壁两侧,且每对叉指换能器分别包括用于聚集生物样本的第一区域、用于分选目标样本的第三区域以及用于连接所述第一区域与第三区域的过渡带;
所述腔道包括两个入口和与所述目标样本类别数目相同的出口,且所述腔道的长度为四分之一个波长。
本申请实施例采取的技术方案还包括:所述将含有生物样本的混合液注入所述声表面波微流控芯片内,并向所述声表面波微流控芯片施加第一正弦信号,在所述声表面波微流控芯片内形成驻波声场,使所述生物样本在声辐射力作用下聚集在所述驻波声场中的节点位置包括:
通过所述两个入口分别将含有生物样本的悬浮液和缓冲液腔道内,通过信号发声器对所述至少两对叉指换能器的第一区域施加高频连续的第一正弦信号,在所述腔道内形成一个驻波声场,使得散落在腔道内的生物样本在声辐射力作用下向所述驻波声场的节点位置移动并排列成一条直线。
本申请实施例采取的技术方案还包括:所述深度学习模型包括fcn网络和孪生神经网络,所述利用深度学习模型对所述生物样本图像进行运动目标识别及追踪包括:
通过所述fcn模型利用运动目标检测算法对所述生物样本图像中的生物样本进行运动目标识别;
通过所述孪生神经网络采用运动目标追踪算法对所述识别到的运动目标进行追踪并实时计算所述运动目标的运动速度。
本申请实施例采取的技术方案还包括:所述孪生神经网络包括两个共享权值的卷积神经网络,所述两个卷积神经网络的输入分别是当前帧图像以及上一帧图像中含有运动目标的子图,在经过所述卷积神经网络的采样与编码后,使用所述含有运动目标的子图的结果对所述当前帧图像的结果进行卷积,得到所述当前帧图像中与上一帧图像最相似的区域,以对所述运动目标进行追踪。
本申请实施例采取的技术方案还包括:所述对所追踪到的运动目标进行聚类分析并分类,得到目标样本,并根据所述目标样本的运动速度生成所述目标样本的延时使能信号包括:
基于在线学习的方式,根据预设的目标样本类别数目对所述追踪的运动目标进行无监督分析并分类,得到目标样本,并根据运动速度计算各类目标样本到达所述叉指换能器第三区域的时间,根据所述时间生成各类目标样本对应的延时使能信号。
本申请实施例采取的技术方案还包括:所述根据所述延时使能信号向所述声表面波微流控芯片施加第二正弦信号控制所述目标样本移动,以对所述目标样本进行分选包括:
当所述目标样本到达所述叉指换能器的第三区域时,通过所述延时使能信号驱动所述信号发声器对所述叉指换能器的第三区域施加连续的第二正弦信号,在所述腔道内形成所述驻波声场的至少一个节点,并通过调节所述施加第二正弦信号的电压控制所述目标样本移动至所述驻波声场的节点位置,以对所述目标样本进行分选。
本申请实施例采取的另一技术方案为:一种用于生物样本分选的声表面波微流控芯片,所述声表面波微流控芯片包括至少两对叉指换能器和腔道;
所述至少两对叉指换能器分别位于所述腔道的外壁两侧,且每对叉指换能器分别包括用于聚集生物样本的第一区域、用于分选目标样本的第三区域以及用于连接所述第一区域与第三区域的过渡带;
所述腔道包括两个入口和与所述目标样本类别数目相同的出口,且所述腔道的长度为四分之一个波长。
本申请实施例采取的又一技术方案为:一种生物样本分选系统,包括:
样本聚集模块:用于将含有生物样本的混合液注入声表面波微流控芯片内,并向所述声表面波微流控芯片施加第一正弦信号,在所述声表面波微流控芯片内形成驻波声场,使所述生物样本在声辐射力作用下聚集在所述驻波声场中的节点位置;
样本成像模块:用于采集所述聚集后的生物样本图像;
样本识别及分类模块:用于利用深度学习模型对所述生物样本图像进行运动目标识别及追踪,对所追踪到的运动目标进行聚类分析并分类,得到目标样本,并根据所述目标样本的运动速度生成所述目标样本的延时使能信号;
样本分选模块:用于根据所述延时使能信号向所述声表面波微流控芯片施加第二正弦信号控制所述目标样本移动,以对所述目标样本进行分选。
本申请实施例采取的又一技术方案为:一种终端,所述终端包括处理器、与所述处理器耦接的存储器,其中,
所述存储器存储有用于实现所述生物样本分选方法的程序指令;
所述处理器用于执行所述存储器存储的所述程序指令以控制生物样本分选。
本申请实施例采取的又一技术方案为:一种存储介质,存储有处理器可运行的程序指令,所述程序指令用于执行所述生物样本分选方法。
相对于现有技术,本申请实施例产生的有益效果在于:本申请实施例的生物样本分选方法、声表面波微流控芯片、系统、终端以及存储介质以声表面波微流控芯片为实验平台,在声波的作用下聚集生物样本,借助深度学习使用无需标注训练集数据的基于无监督学习图像追踪算法并结合聚类分析算法对生物样本图像进行目标样本的识别、追踪与分析,并生成特定的使能信号,节约成本的同时,可以更加高效、精确、稳定、高通量地筛选特异性样本,而不会影响样本的生物活性且设备成本更低,可实现高灵活性、高可扩展性以及用于智能图像处理和决策的实时自动化操作。
附图说明
图1是本申请实施例的生物样本分选方法的流程图;
图2为不同粒径的荧光小球在驻波声场下的受力情况;
图3为本申请实施例的深度学习模型的图像分析及分类过程示意图;
图4为本申请实施例的声学细胞分选过程示例图;
图5为本申请实施例的生物样本分选系统结构示意图;
图6为本申请实施例对粒径不同的微粒进行追踪与分类的效果示意图,其中,图6(a)是分类效果,小球以黑色框标记,大球以白色框标记;图6(b)是对运动物体的识别并生成掩膜,确定运动区域;
图7为本申请实施例的终端结构示意图;
图8为本申请实施例的存储介质的结构示意图。
具体实施方式
为了使本申请的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本申请进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本申请,并不用于限定本申请。
针对现有技术的不足,本申请实施例的生物样本分选方法通过构建声表面波微流控芯片,将含有生物样本的悬浮液注入声表面波微流控芯片内进行样本聚集,通过显微成像采集样本图像后,深度学习模型使用无需标注训练集数据的基于无监督学习(unsupervisedlearning)图像追踪算法并结合聚类分析(clusteringanalysis)算法对样本图像进行目标样本的识别、追踪与分析,根据目标样本的流速输出使能信号,通过使能信号驱动信号发声器向叉指换能器施加连续的正弦信号以控制目标样本移动到驻波声场的节点位置,最终分选出目标样本。
本申请可适用于声学细胞、纳米生物颗粒以及微小动物(例如线虫)等生物样本的分选,为了便于说明,以下实施例仅以声学细胞分选为例进行具描述。
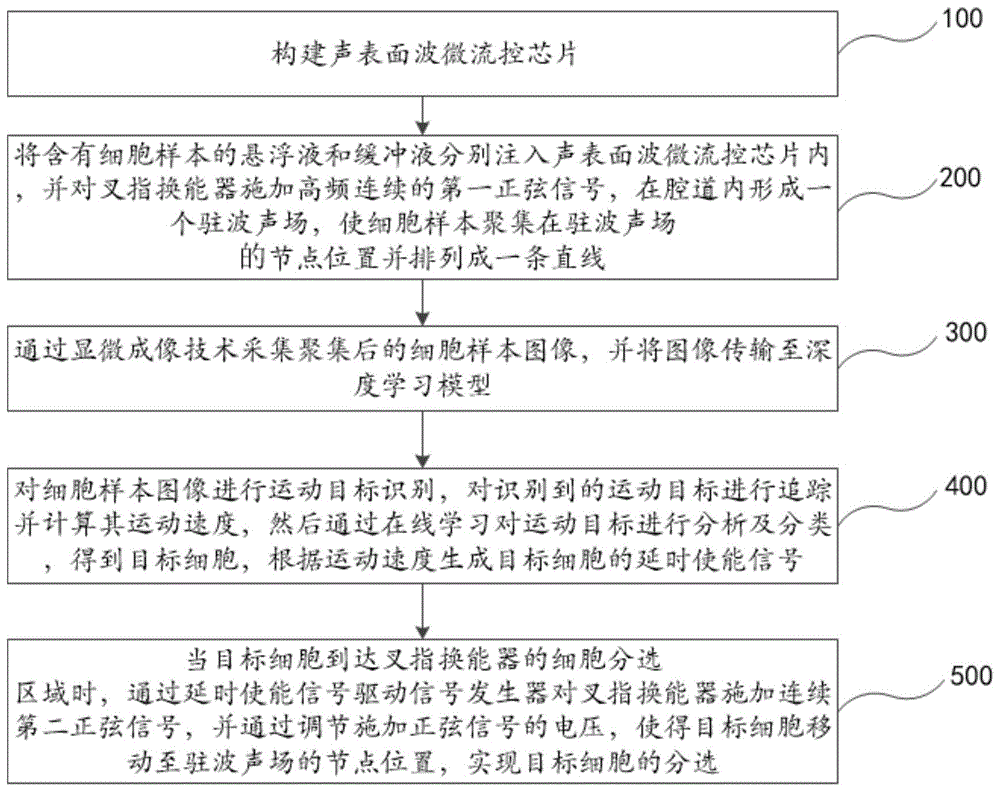
具体的,请参阅图1,是本申请实施例的生物样本分选方法的流程图,该生物样本为声学细胞。本申请实施例的生物样本分选方法包括以下步骤:
步骤100:构建声表面波微流控芯片;
步骤100中,声表面波微流控芯片的构建方式具体为:采用mems(micro-electro-mechanicalsystem,微机电系统)技术制备至少两对的叉指换能器,并利用软光刻工艺制作腔道,然后将至少两对叉指换能器与腔道通过等离子处理方法进行绑定,使至少两对叉指换能器位于腔道外壁的两侧,形成声表面波微流控芯片。其中,每个叉指换能器分别包括三个部分:
用于聚集细胞样本的第一区域;第一区域的叉指电极对应的声表面波共振频率为15mhz,对应的指条宽度为65微米;
用于分选目标细胞的第三区域;第三区域的叉指电极对应的声表面波共振频率为30mhz,对应的指条宽度为32.5微米;
用于连接第一区域和第三区域的过渡带;由于第一区域与第三区域的指条宽度不同,因此需要过渡带进行连接,由于过渡带的指条斜率及插入损耗较大,无法进行细胞分选。
本申请实施例中,为获得较大的机电耦合系数,叉指换能器的压电基底为128°yx双面抛光的铌酸锂晶体,实际应用中,可根据细胞分选的种类数量制备多对叉指换能器提高通量,同时根据级联分选提高细胞分选的效率与精确度。
本申请实施例中,腔道的宽度为65微米,深度为50微米,具体可根据实际应用进行设定。腔道包括两个入口,分别用于注入含有细胞样本的悬浮液以及缓冲液,腔道的出口可根据细胞分选的种类数量而设定。腔道包括pdms(polydimethylsiloxane,聚二甲基硅氧烷)腔道或利用其他高分子材料及单晶硅等材料制备而成的腔道,本申请实施例优选为pdms腔道。
基于上述,本申请实施例采用工艺成熟的mems技术进行声表面波微流控芯片的制备,能够保持性能的一致性良好,并且成本低廉,便于大量生产。
步骤200:通过注射泵将含有细胞样本的悬浮液和缓冲液分别注入声表面波微流控芯片的腔道内,并通过信号发声器对叉指换能器施加高频连续的第一正弦信号,在腔道内形成一个驻波声场,使细胞样本聚集在驻波声场中的节点位置(即腔道的中心部位)并排列成一条直线;
步骤200中,当含有细胞样本的悬浮液与缓冲液分别注入到腔道内后,细胞样本均匀的散落在腔道内。对叉指换能器同时施加连续的第一正弦信号后,在腔道内构建一平面驻波声场,细胞样本在驻波声场内受到的声辐射力可表达为:
通过式(1)可以得出声辐射力(fr)与颗粒体积(vc),施加的正弦信号频率(1/λ)和声学对比度系数(acousticcontrastfactor)(φ(β,ρ))成正比。由式(2)可知,声学对比度系数(φ(β,ρ))取决于颗粒密度(ρc)、悬浮介质的密度(ρw)、颗粒的可压缩比(βc)以及该介质的可压缩比(βw)。由于颗粒体积与颗粒的立方半径成比例,因此声辐射力在很大程度上取决于粒径。除了密度分量等于式(2)中可压缩分量的少数情况外,粒子将受到如式(1)所示的声辐射力,声学对比系数的符号将决定粒子运动的方向。具体如图2所示,是不同粒径的荧光小球在驻波声场下的受力情况。可以发现全部微粒均朝向驻波声场的节点位置移动,并且粒径更大的微粒的移动速度更大,这表明粒径与声辐射力在密度相似的情况下成正比,更容易受到声波的作用。
本申请实施例中,由于细胞的密度大于液体介质密度,因此,在驻波声场中,细胞会向节点移动,腔道的长度为四分之一个波长,从而使得细胞聚集在驻波声场中节点的位置,并能够使得细胞排列成一条直线,便于后续进行的细胞识别与追踪,减少了不必要的时间开销。
本申请实施例中,使用的细胞聚集方式为声镊,不会因流体动力聚集的同时产生加速度,从而实现较高的颗粒分析速率。另外,本申请不需要使用鞘流,可以使流体消耗和有害废物输出最小化,更大程度上保护了细胞的生物效应。
步骤300:通过显微成像技术采集聚集后的细胞样本图像,并将图像传输至深度学习模型;
步骤400:深度学习模型对细胞样本图像进行运动目标识别,对识别到的运动目标进行追踪并计算其运动速度,然后通过在线学习(onlinelearning)的方式对运动目标进行分析及分类,得到目标细胞,并根据运动速度对各类目标细胞生成延时使能信号;
步骤400中,如图3所示,为本申请实施例的深度学习模型的图像分析及分类过程结构示意图。深度学习模型包括基于差帧法的fcn(fullyconvolutionalnetworks,全卷积神经网络)网络和孪生神经网络(siamesenetwork),深度学习模型对细胞进行的识别、追踪及分类包括具体包括以下步骤:
步骤401:通过fcn模型利用运动目标检测算法对细胞样本图像中无标记的细胞样本进行运动目标识别,剔除无关像素;
优选地,fcn模型采用帧差法对细胞样本图像进行运动目标识别。当图像中存在移动物体的时候,相邻帧的像素值会存在差异,即:两帧差分后,静止区域的数值为0,有移动物体的区域因存在灰度变化而为非0值,当相邻两帧同一区域的数值差值超过设定阈值时,即可判断该区域为运动区域,从而实现运动目标的识别。可以理解,在本申请其他实施例中,也可采用其他运动目标检测算法,例如光流法或其他根据前后帧信息差异对未来帧的运动区域进行识别的运动目标检测算法等。
步骤402:通过孪生神经网络对识别到的运动目标进行追踪并实时计算其运动速度;
其中,孪生神经网络包括两个共享权值的卷积神经网络,两个卷积神经网络的输入分别是当前帧图像以及上一帧中含有运动目标的子图,在经过网络的采样与编码后,使用含有运动目标的子图的结果对当前帧图像的结果进行卷积,得出当前帧中与上一帧最相似的区域,实现运动目标的追踪。
本申请实施例中,运动目标追踪算法可以通过模板匹配实现,或通过相关滤波器实现。
步骤403:基于在线学习(onlinelearning)的方式,根据提前设定的细胞分类类别数目对追踪的运动目标进行无监督分析并分类,得到目标细胞,并根据运动速度计算各类目标细胞到达叉指换能器第三区域的时间,根据该时间生成各类目标细胞对应的延时使能信号;
其中,本申请实施例通过在线学习的方式对追踪的运动目标进行无监督分析并以此进行分类,无需注释数据以及事先经过大型数据集的训练,节约了大量的数据注释成本;在使用过程中,对遇到的每一个数据进行实时学习,根据设定的分类数量进行聚类分析,寻找未知的细胞亚种。同时,由于本申请采用在线学习方式,在不断的使用过程中,精准度也会不断提高,并且可以基于上一次的模型进行集成学习,获得精确的分类结果,同时在线学习的通用特性为大规模使用提供保障。
可以理解,在本申请其他实施例中,也可采用强化学习方法等其他图像分析算法进行运动目标的分析;也可通过少量的注释数据进行弱监督学习,或通过自编码的方式进行数据分析后再进行分类。
步骤500:当目标细胞到达叉指换能器的第三区域时,通过延时使能信号驱动信号发生器对叉指换能器施加连续的第二正弦信号,并通过调节施加正弦信号的电压,使得目标细胞移动至驻波声场的节点位置,实现目标细胞的分选;
步骤500中,在微流体中,流体的雷诺数(reynoldsnumber)很低,流体为层流。层流效应使聚集的细胞样本经过叉指换能器的第一区域及过渡带后依旧沿着腔道的中心移动,通过延时使能信号驱动叉指换能器在腔道内形成驻波声场,接收到延时使能信号后,通过信号发声器对叉指换能器施加一定的连续的第二正弦信号,在腔道内形成驻波声场的两个节点,分别位于腔道两侧靠近内壁的位置。有公式(1)与公式(2)可知,声辐射力在很大程度上取决于粒径,而在粒径相似的时候,可以根据图像分析得出需要分选的目标细胞,根据目标细胞的运动速度预先计算其到达叉指换能器第三区域的时间,当目标细胞到达该区域时通过信号发声器立即施加连续的第二正弦信号,并通过调节其施加电压以控制目标细胞的移动,使得目标细胞移动到驻波声场的两个节点位置,而非目标细胞不会激活产生声场的信号,因此不会受到声辐射力的作用,依然在层流引起的拽力下沿着腔道的中心移动。具体如图4所示,为本申请实施例的细胞分选过程示例图。
进一步地,在进行多个(两个以上)类别的细胞分选时,可以按需级联多个叉指换能器,在声辐射力的作用下,第一级目标细胞移动到驻波声场中节点位置,实现第一级目标细胞的分选;而其他细胞在较小的声辐射力作用下不足以抵抗层流引起的拽力作用,依旧沿腔道中心移动,在抵达第二级叉指换能器时重复第一级的操作,对第二级目标细胞进行分选,从而实现了多级分选的目的。
本申请实施例中,细胞成像、分析以及驱动之间分别使用以太网进行数据交换。以太网使用internet协议在多台计算机、多个传感器和多个执行器之间发送和接收信号,可实现高灵活性,高可扩展性以及用于智能图像处理和决策的实时自动化操作。
本申请实施例通过图像分析实现细胞分选的目的,无需荧光标记物,减少成本的同时避免特异性抗原带来的影响,保证了细胞的生物活性。可以理解,也可在荧光标记物的荧光信息的基础上结合空间信息进行细胞分选,增加细胞分选的特异性,或在图像分析结果的基础上利用光、电、磁等方法实现细胞的分选。
本申请实施例中,细胞的聚集与分选仅仅依靠图像分析结果调节叉指换能器的射频信号,而不需要改变声表面波微流控芯片的结构,降低了重复制作芯片的成本,具有较好的普遍适用性。
请参阅图5,是本申请实施例的生物样本分选系统的结构示意图。本申请实施例的生物样本分选系统包括:
细胞聚集模块:用于将含有细胞样本的悬浮液和缓冲液分别注入声表面波微流控芯片内,并通过信号发声器对叉指换能器施加高频连续正弦信号,在腔道内形成一个驻波声场,使细胞样本聚集在驻波声场中的节点位置(即腔道的中心部位)并排列成一条直线;
其中,声表面波微流控芯片的构建方式具体为:采用mems技术制备至少两对的叉指换能器,并利用软光刻工艺制作腔道,然后将至少两对叉指换能器与腔道通过等离子处理方法进行绑定,使至少两对叉指换能器位于腔道外壁的两侧,形成声表面波微流控芯片。其中,每个叉指换能器分别包括三个部分:
用于聚集细胞样本的第一区域;第一区域的叉指电极对应的声表面波共振频率为15mhz,对应的指条宽度为65微米;
用于分选目标细胞的第三区域;第三区域的叉指电极对应的声表面波共振频率为30mhz,对应的指条宽度为32.5微米;
用于连接第一区域和第三区域的过渡带;由于第一区域与第三区域的指条宽度不同,因此需要过渡带进行连接,由于过渡带的指条斜率及插入损耗较大,无法进行细胞分选。
本申请实施例中,为获得较大的机电耦合系数,叉指换能器的压电基底为128°yx双面抛光的铌酸锂晶体,实际应用中,可根据细胞分选的种类数量制备多对叉指换能器提高通量,同时根据级联分选提高细胞分选的效率与精确度。
本申请实施例中,腔道的宽度为65微米,深度为50微米,具体可根据实际应用进行设定。腔道包括两个入口,分别用于注入含有细胞样本的悬浮液以及缓冲液,腔道的出口可根据细胞分选的种类数量而设定。腔道包括pdms腔道或利用其他高分子材料及单晶硅等材料制备而成的腔道,本申请实施例优选为pdms腔道。
基于上述结构的,声表面波微流控芯片当含有细胞样本的悬浮液与缓冲液分别注入到腔道内后,细胞样本均匀的散落在腔道内。对叉指换能器同时施加连续的第一正弦信号后,在腔道内构建一平面驻波声场,细胞样本在驻波声场内受到的声辐射力可表达为:
通过式(1)可以得出声辐射力(fr)与颗粒体积(vc),施加的正弦信号频率(1/λ)和声学对比度系数(φ)成正比。由式(2)可知,声学对比度系数(φ)取决于颗粒密度(ρc)、悬浮介质的密度(ρw)、颗粒的可压缩比(βc)以及该介质的可压缩比(βw)。由于颗粒体积与颗粒的立方半径成比例,因此声辐射力在很大程度上取决于粒径。除了密度分量等于式(2)中可压缩分量的少数情况外,粒子将受到如式(1)所示的声辐射力,声学对比系数的符号将决定粒子运动的方向。具体如图2所示,是不同粒径的荧光小球在驻波声场下的受力情况。可以发现全部微粒均朝向驻波声场的节点位置移动,并且粒径更大的微粒的移动速度更大,这表明粒径与声辐射力在密度相似的情况下成正比,更容易受到声波的作用。
本申请实施例中,由于细胞的密度大于液体介质密度,因此,在驻波声场中,细胞会向节点移动,腔道内包含的长度为四分之一个波长,从而使得细胞聚集在驻波声场中节点的位置,并能够使得细胞排列成一条直线,便于后续进行的细胞识别与追踪,减少了不必要的时间开销。
细胞成像模块:用于通过显微成像技术采集聚集后的细胞样本图像,并将图像传输至深度学习模型;
细胞识别及分类模块:用于采用深度学习模型对细胞样本图像进行运动目标识别,对识别到的运动目标进行追踪并计算其运动速度,然后通过在线学习的方式对运动目标进行分析及分类,得到目标细胞,并根据运动速度对各类目标细胞生成延时使能信号;其中,深度学习模型包括基于差帧法的fcn(卷积神经网络)网络和孪生神经网络(siamesenetwork),深度学习模型对细胞进行的识别、追踪及分类包括具体包括:
通过fcn模型利用运动目标检测算法对细胞样本图像中无标记的细胞样本进行运动目标识别,剔除无关像素;优选地,fcn模型采用帧差法对细胞样本图像进行运动目标识别。当图像中存在移动物体的时候,相邻帧的像素值会存在差异,即:两帧差分后,静止区域的数值为0,有移动物体的区域因存在灰度变化而为非0值,当相邻两帧同一区域的数值差值超过设定阈值时,即可判断该区域为运动区域,从而实现运动目标的识别。可以理解,在本申请其他实施例中,也可采用其他运动目标检测算法,例如光流法或其他根据前后帧信息差异对未来帧的运动区域进行识别的运动目标检测算法等。
通过孪生神经网络对识别到的运动目标进行追踪并实时计算其运动速度;
其中,孪生神经网络包括两个共享权值的卷积神经网络,两个卷积神经网络的输入分别是当前帧图像以及上一帧中含有运动目标的子图,在经过网络的采样与编码后,使用含有运动目标的子图的结果对当前帧图像的结果进行卷积,得出当前帧中与上一帧最相似的区域,实现运动目标的追踪。
基于在线学习的方式,根据提前设定的细胞分类种类数目对追踪的运动目标进行无监督分析并分类,并根据运动速度针对各类目标细胞生成对应的的延时使能信号。
细胞分选模块:用于在目标细胞到达叉指换能器的第三区域时,通过延时使能信号驱动信号发生器对叉指换能器施加连续的第二正弦信号,并通过调节施加第二正弦信号的电压,使得目标细胞移动至驻波声场的节点位置,实现目标细胞的分选;在微流体中,流体的雷诺数很低,流体为层流。层流效应使聚集的细胞样本经过腔道的第一区域及过渡带后依旧沿着腔道的中心移动,通过延时使能信号驱动叉指换能器在腔道内形成驻波声场,接收到延时使能信号后,通过信号发声器对叉指换能器施加一定的连续的第二正弦信号,在腔道内形成驻波声场的两个节点,分别位于腔道两侧靠近内壁的位置。有公式(1)与公式(2)可知,声辐射力在很大程度上取决于粒径,而在粒径相似的时候,可以根据图像分析得出需要分选的目标细胞,根据目标细胞的运动速度预先计算其到达叉指换能器第三区域的时间,当目标细胞到达该区域时通过信号发声器立即施加连续的第二正弦信号,并通过调节其施加电压以控制目标细胞的移动,使得目标细胞移动到驻波声场的两个节点位置,而非目标细胞不会激活产生声场的信号,因此不会受到声辐射力的作用,依然在层流引起的拽力下沿着腔道的中心移动。
为了验证本申请实施例的可行性和有效性,以不同粒径的两种微粒混合,作为实验样本,将样本以10μl/min的速度注入到pdms腔道中进行实验。如图6所示,为对粒径不同的微粒进行追踪与分类的效果示意图,其中,图6(a)是分类效果,小球以黑色框标记,大球以白色框标记;图6(b)是对运动物体的识别并生成掩膜,确定运动区域。注射泵压力驱动样本悬浮液,微粒在腔道内快速移动,当移动到成像范围内时,根据前后两帧变化,识别出运动(微粒)区域并生成掩膜(mask)。原图像根据掩膜各个有效区域提取到其中的微粒子图,再经过分类算法后被识别出如图6(a)所示的各个子图中微粒的种类。实验结果表明,本申请实施例能够更加智能有效、准确且快速的对未知的新型生物样本进行识别与分选。
请参阅图7,为本申请实施例的终端结构示意图。该终端50包括处理器51、与处理器51耦接的存储器52。
存储器52存储有用于实现上述生物样本分选方法的程序指令。
处理器51用于执行存储器52存储的程序指令以控制生物样本分选。
其中,处理器51还可以称为cpu(centralprocessingunit,中央处理单元)。处理器51应该包括gpu(graphicsprocessingunit,图形处理器),用于图像处理与分析。处理器51可能是一种集成电路芯片,具有信号的处理能力。处理器51还可以是通用处理器、数字信号处理器(dsp)、专用集成电路(asic)、现成可编程门阵列(fpga)或者其他可编程逻辑器件、分立门或者晶体管逻辑器件、分立硬件组件。通用处理器可以是微处理器或者该处理器也可以是任何常规的处理器等。
请参阅图8,为本申请实施例的存储介质的结构示意图。本申请实施例的存储介质存储有能够实现上述所有方法的程序文件61,其中,该程序文件61可以以软件产品的形式存储在上述存储介质中,包括若干指令用以使得一台计算机设备(可以是个人计算机,服务器,或者网络设备等)或处理器(processor)执行本发明各个实施方式方法的全部或部分步骤。而前述的存储介质包括:u盘、移动硬盘、只读存储器(rom,read-onlymemory)、随机存取存储器(ram,randomaccessmemory)、磁碟或者光盘等各种可以存储程序代码的介质,或者是计算机、服务器、手机、平板等终端设备。
本申请实施例的生物样本分选方法、声表面波微流控芯片、系统、终端以及存储介质以声表面波微流控芯片为实验平台,在声波的作用下将生物样本聚集成一条直线,借助深度学习使用无需标注训练集数据的基于无监督学习图像追踪算法并结合聚类分析算法对生物样本图像进行目标样本的识别、追踪与分析,并生成特定的使能信号,通过调控声波的幅值与频率,实现生物样本的分选。相对于现有技术,本申请实施例无需注释数据以及大型数据集的训练,节约成本的同时,可以更加高效、精确、稳定、高通量地筛选特异性样本,而不会影响样本的生物活性且设备成本更低,可实现高灵活性、高可扩展性以及用于智能图像处理和决策的实时自动化操作。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本申请。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本申请中所定义的一般原理可以在不脱离本申请的精神或范围的情况下,在其它实施例中实现。因此,本申请将不会被限制于本申请所示的这些实施例,而是要符合与本申请所公开的原理和新颖特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!