新化合物、其制备方法及其应用与流程
本发明属于一种生物医学用功能荧光分子合成领域,具体涉及一类具有激发态分子内质子转移和聚集诱导发光效应的2-(2’-羟基苯基)苯并唑类化合物,以及该类型化合物的制备方法和在线粒体靶向荧光成像中的应用。
背景技术:
常规的有机发光材料通常具有平面芳环,一般在稀溶液中具有较高的发光效率,但在浓溶液或聚集态时发生π-π堆积,增加了非辐射能的损耗,表现为发光效率降低甚至不发光,即产生聚集诱导发光淬灭现象(acq),acq效应限制了它们在诸如有机发光二极管(oled)和生物检测和成像等领域中的应用。在2001年,唐院士等人首次提出“聚集诱导发光”(aggregation-inducedemission,aie)这一全新的概念。与传统的acq染料不同,aie荧光团在稀溶液中显示出微弱或可忽略的荧光发射,但在聚集态或固态下具有强的荧光发射。aie现象与acq完全相反,因此具有aie效应的荧光分子能有效解决传统荧光染料acq的问题。目前,aie分子在光电、传感、生物医学等领域得到了广泛应用,并展现出相对于传统发光材料的独特优势。因此,如何制备具有aie效应的荧光分子是当前研究的热点和难点问题。
目前发展的具有esipt和aie效应的荧光分子种类十分有限,主要包括水杨醛肼类。然而,上述化合物种类单一,发射波长较短,荧光量子产率低。因此,迫切需要发展一类结构多样,易于调控发射波长且兼具aie和esipt效应的荧光分子。
技术实现要素:
本发明旨在提供一种结构新颖具有激发态分子内质子转移和聚集诱导发光效应的2-(2’-羟基苯基)苯并唑类化合物,同时提供其制备方法和在线粒体靶向荧光成像中的应用。
为了实现上述技术目的,本发明提供了一种具有激发态分子内质子转移和聚集诱导发光效应的2-(2’-羟基苯基)苯并唑类化合物,具有式ⅰ结构:
式ⅰ中,x选自-o-、-s-、-nh-或-c(o)nh-,
r1为具有分子转子特性的芳烃共轭结构单元,
r2选自氢、醛基或与苯环通过双键共轭的吸电子单元。
具有式ⅱ所示结构的化合物,
式ⅱ中,x选自-o-、-s-、-nh-或-c(o)nh-,
r1为具有分子转子特性的芳烃共轭结构单元。
具有式ⅲ所述结构的化合物,
式ⅲ中,
x选自-o-、-s-、-nh-或-c(o)nh-,
r1为具有分子转子特性的芳烃共轭结构单元。
一些方式中,r1选自以下任一,
一些方式中,r2选自以下任一,
其中,r4选自i-,br-,clo4-或pf6-中任一。
式ⅰ化合物的制备方法,包括以下步骤:
s1,将硼酸化芳烃和2-(2’-羟基苯基)苯并唑,催化剂溶于有机溶剂中,加入强碱溶液,在惰性气体保护下反应,萃取有机相,合并有机相并浓缩,硅胶柱层析分离提纯后获取产物;
s2,将s1产物溶于三氟乙酸溶液中,加入六甲基次胺,加热回流,反应结束后用氢氧化钠溶液调节体系的ph值为6±0.5,一种情况为6,过滤得滤饼,硅胶柱层析分离纯化获取产物;
s3,将s2产物和含有活泼氢的电子受体溶于乙醇或乙腈溶液中,混合体系加入哌啶,加热回流,反应结束后,硅胶柱层析分离纯化获取式ⅳ产物,
r1为具有分子转子特性的芳烃共轭结构单元,
r3选自与苯环通过双键共轭的吸电子单元。
制备式ⅱ化合物的方法,包括以下步骤,将硼酸化芳烃和2-(2’-羟基苯基)苯并唑,催化剂溶于有机溶剂中,加入强碱溶液,在氮气、氩气等惰性气体保护下反应,萃取有机相,合并有机相并浓缩,硅胶柱层析分离提纯后获取式ⅱ所示产物
一种方式,按摩尔比计,步骤s1中,硼酸化芳烃和2-(2’-羟基苯基)苯并唑的比例为1.0-1.5,步骤s2中加入的六甲基次胺和式ⅲ产物的比例为5-7。
一种方式,步骤s1中催化剂选自pd(pph3)4、pdcl2、pd(oac)2、pd(pph2)cl2、pd(dppf)cl2、ph2p(ch2)2pph(dppe)ph2p(ch2)3pph2(dppe)、ph2p(ch2)3pph2(dpp)中,催化剂用量以2-(2’-羟基苯基)苯并唑计算为0.1-0.3当量,具体而言是苯并唑类化合物的0.1-0.3倍当量。
一种方式,步骤s1中所述的强碱溶液包括na2co3溶液、csco3溶液、ch3cook溶液、k2co3溶液、koh溶液或naoh溶液。
制备式ⅱ化合物的方法,包括以下步骤,将硼酸化芳烃和2-(2’-羟基苯基)苯并唑,催化剂溶于有机溶剂中,加入强碱溶液,在惰性气体保护下反应,萃取有机相,合并有机相并浓缩,分离提纯后获取式ⅱ所示产物。
式ⅰ化合物在活细胞线粒体靶向成像中作为荧光染料的应用。
式ⅱ化合物在制备式ⅳ化合物中作为反应物的应用;降低了制备难度。
本发明的有益效果是:
提供一种新的化合物,发射波长更长,荧光量子产量更高,结构更加多样;同时也提供了制备具有激发态分子内质子转移和聚集诱导发光效应的2-(2’-羟基苯基)苯并唑类化合物的一种反应原料。
附图说明
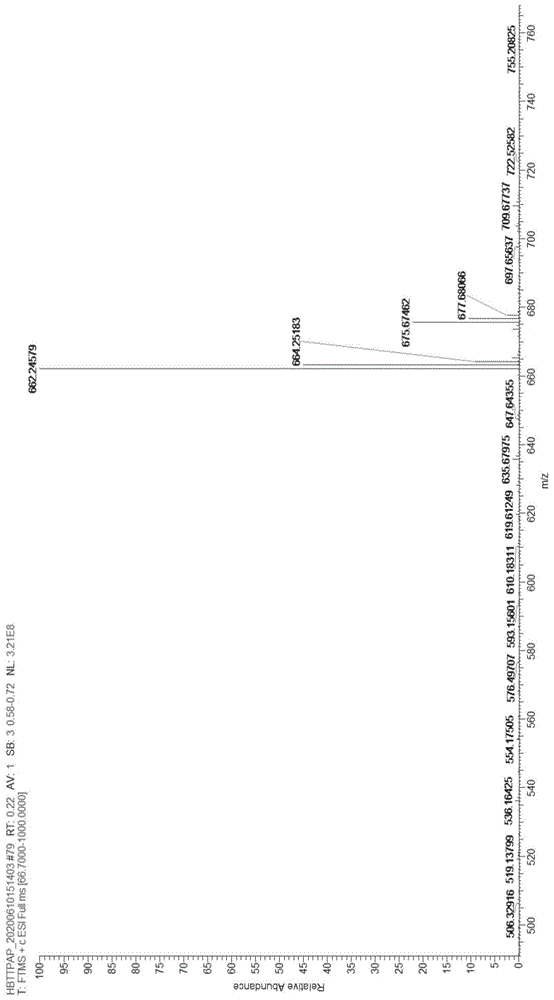
图1为化合物hbttpap高分辨质谱图,
图2为化合物hbttpip高分辨质谱图,
图3为化合物hbttpep高分辨质谱图,
图4为化合物hbttpap线粒体靶向荧光成像,
图5为化合物hbttpip线粒体靶向荧光成像,
图6为化合物hbttpep线粒体靶向荧光成像。
具体实施方式
以下实施方式旨在进一步阐释说明本发明而不是对本发明的限定。
一种具有激发态分子内质子转移和聚集诱导发光效应的2-(2’-羟基苯基)苯并唑类化合物,具有式ⅰ的结构:
式中,x独立选自-o-、-s-、-nh-或-c(o)nh-,
r1为具有分子转子特性的芳烃共轭结构单元,r2独立选自氢、醛基或与苯环通过双键共轭的吸电子单元。
2-(2’-羟基苯基)苯并唑类化合物是一类具有激发态分子内质子转移(esipt)效应的分子,该类型化合物具有大的斯托克斯位移,较高的固态发光效率,但是发光效率易受极性溶剂和质子性溶剂的干扰。然而,具有aie效应的荧光分子在形成聚集态或固态时,可以避免极性溶剂或质子性溶剂的干扰,这有利于esipt效应的发生。此外,esipt分子在形成分子内氢键时,可有效抑制分子内运动,有助于aie效应的发生。因此,兼具esipt和aie效应的荧光分子,将具有大的斯托克斯位移,高浓度时荧光不淬灭等优异的性质,可作为一种理想的发光材料应用于生物成像、化学生物传感等不同领域。
本文中所述的结构单元、电子单元一般指代基团,能够与其前述的基团相结合。
惰性气体一般采用氮气、氩气。
在制备步骤中,中间产物有多种,并不限定为一种,具体的根据反应物和反应条件确定,根据反应式所得。
实施例1(hbttpa)
本发明的具有激发态分子内质子转移和聚集诱导发光效应的2-(2’-羟基苯基)苯并唑类化合物3-(苯并[d]噻唑-2-基)-4'-(双(4-甲氧基苯基)氨基)-[1,1'-联苯]-4-醇(hbttpa)(实例中x=s、r1=
化合物hbtbr的合成:分别称取5-溴水杨醛(301.5mg,1.5mmol)和邻氨基苯硫酚(187.8mg,1.5mmol)溶解在5ml乙醇溶液中,室温搅拌下加入1ml浓盐酸,随后加入40μl30%双氧水溶液,室温下搅拌反应30min。反应结束后,过滤,乙醇重结晶得到化合物hbtbr,产率83.7%。
1hnmr(400mhz,cdcl3),δ(ppm):12.55(s,1h),7.99-8.01(d,1h),7.92-7.94(d,1h),7.79-7.80(d,1h),7.51-7.55(m,1h),7.43-7.47(m,2h);13cnmr(100mhz,cdcl3),δ(ppm):167.77,157.01,151.63,135.31,132.61,130.48,126.93,125.95,122.37,121.63,119.81,111.02。
化合物hbttpa的合成:称取化合物hbtbr(100mg,0.33mmol)和化合物(4-(双(4-甲氧基苯基)氨基)苯基)硼酸(114mg,0.33mmol)溶解在5mldmf中,室温充分搅拌,随后向反应体系中加入1ml含有200mgk2co3的水溶液,并加入20mg催化剂pd(pph3)4。反应体系在氮气保护下在75℃充分回流反应12小时,tlc板监测反应完全后,减压蒸馏除去溶剂,硅胶柱层析分离得到产物hbttpa。产率为24.3%。
1hnmr(400mhz,cdcl3),δ(ppm):12.41(s,1h),8.02-8.04(d,2h),7.93-7.95(d,2h),7.85-7.86(d,2h),7.59-7.61(dd,2h),7.52-7.66(m,1h),7.42-7.47(m,3h),7.11-7.18(m,5h),7.02-7.06(d,2h),6.86-6.90(m,4h),3.84(s,6h);13cnmr(100mhz,cdcl3),δ(ppm):169.43,156.89,155.89,151.89,148.01,140.91,132.70,132.64,132.05,131.18,127.13,126.72,126.54,126.05,125.56,122.21,121.55,120.95,118.23,116.87,114.73,55.52。
实施例2(hbttpaq)
本发明的具有激发态分子内质子转移和聚集诱导发光效应的2-(2’-羟基苯基)苯并唑类化合物5-(苯并[d]噻唑-2-基)-4'-(双(4-甲氧基苯基)氨基)-4-羟基-[1,1'-联苯]-3-甲醛(hbttpaq)(实例中x=s、r1=
化合物hbtbr的合成:分别称取5-溴水杨醛(301.5mg,1.5mmol)和邻氨基苯硫酚(187.8mg,1.5mmol)溶解在5ml乙醇溶液中,室温搅拌下加入1ml浓盐酸,随后加入40μl30%双氧水溶液,室温下搅拌反应30min。反应结束后,过滤,乙醇重结晶得到化合物hbtbr,产率83.7%。
1hnmr(400mhz,cdcl3),δ(ppm):12.55(s,1h),7.99-8.01(d,1h),7.92-7.94(d,1h),7.79-7.80(d,1h),7.51-7.55(m,1h),7.43-7.47(m,2h);13cnmr(100mhz,cdcl3),δ(ppm):167.77,157.01,151.63,135.31,132.61,130.48,126.93,125.95,122.37,121.63,119.81,111.02。
化合物hbtbrq的合成:称取化合物hbtbr(100mg,0.33mmol)溶于8ml三氟乙酸中,向体系中加入六甲基次胺(300mg,2.14mmol),混合体系充分搅拌后,120℃充分回流反应12小时。反应完成后,将反应体系倒入200ml水溶液中,用naoh溶液调体系ph为6左右,抽滤,得滤饼,干燥后柱层析纯化得到化合物hbtbrq,产率63.7%。
1hnmr(400mhz,cdcl3),δ(ppm):10.48(s,1h),8.13(s,1h),7.95-8.06(m,4h),7.55-7.59(t,1h),7.55-7.59(t,1h);13cnmr(100mhz,cdcl3),δ(ppm):159.38,151.25,136.39,127.20,126.38,122.62,121.73,111.64。
化合物hbttpaq的合成:称取化合物hbtbrq(62mg,0.19mmol)和化合物(4-(双(4-甲氧基苯基)氨基)苯基)硼酸(66mg,0.19mmol)溶解在4mldmf中,室温充分搅拌,随后向反应体系中加入1ml含有200mgk2co3的水溶液,并加入20mg催化剂pd(pph3)4。反应体系在氮气保护下在75℃充分回流反应12小时,tlc板监测反应完全后,减压蒸馏除去溶剂,硅胶柱层析分离得到产物hbttpaq。产率为32.4%。
1hnmr(400mhz,cdcl3),δ(ppm):10.58(s,1h),8.26(s,1h),8.08-8.10(m,2h),7.95-7.97(d,1h),7.54-7.58(t,1h),7.44-7.49(m,3h),7.01-7.12(m,6h),6.85-6.88(m,6h)。
实施例3(hbttpi)
本发明的具有激发态分子内质子转移和聚集诱导发光效应的2-(2’-羟基苯基)苯并唑类化合物3-(苯并[d]噻唑-2-基)-4'-(4,5-双(4-甲氧基苯基)-1-苯基-1h-咪唑-2-基)-[1,1'-联苯]-4-醇(hbttpi)(实例中x=s、r1=
化合物hbtbr的合成:分别称取5-溴水杨醛(301.5mg,1.5mmol)和邻氨基苯硫酚(187.8mg,1.5mmol)溶解在5ml乙醇溶液中,室温搅拌下加入1ml浓盐酸,随后加入40μl30%双氧水溶液,室温下搅拌反应30min。反应结束后,过滤,乙醇重结晶得到化合物hbtbr,产率83.7%。
1hnmr(400mhz,cdcl3),δ(ppm):12.55(s,1h),7.99-8.01(d,1h),7.92-7.94(d,1h),7.79-7.80(d,1h),7.51-7.55(m,1h),7.43-7.47(m,2h);13cnmr(100mhz,cdcl3),δ(ppm):167.77,157.01,151.63,135.31,132.61,130.48,126.93,125.95,122.37,121.63,119.81,111.02.
化合物hbttpi的合成:称取化合物hbtbr(40mg,0.13mmol)和化合物(4-(4,5-双(4-甲氧基苯基)-1-苯基-1h-咪唑-2-基)苯基)硼酸(63mg,0.13mmol)溶解在5mldmf中,室温充分搅拌,随后向反应体系中加入1ml含有100mgk2co3的水溶液,并加入15mg催化剂pd(pph3)4。反应体系在氮气保护下在75℃充分回流反应12小时,tlc板监测反应完全后,减压蒸馏除去溶剂,硅胶柱层析分离得到产物hbttpi。产率为25.6%。
1hnmr(400mhz,cdcl3),δ(ppm):12.62(s,1h),8.02-8.04(d,1h),7.88-7.95(m,2h),7.34-7.63(m,12h),7.07-7.19(m,5h),6.78-6.86(dd,4h),3.81-3.82(d6h);13cnmr(100mhz,cdcl3),δ(ppm):169.21,159.18,158.44,157.61,151.83,146.05,139.48,138.00,137.34,132.62,132.38,132.07,131.47,129.30,129.19,128.54,128.28,126.78,126.54,126.21,125.66,122.84,122.24,121.58,118.38,116.96,113.86,113.65,55.21,55.14。
实施例4(hbttpiq)
本发明的具有激发态分子内质子转移和聚集诱导发光效应的2-(2’-羟基苯基)苯并唑类化合物5-(苯并[d]噻唑-2-基)-4'-(4,5-双(4-甲氧基苯基)-1-苯基-1h-咪唑-2-基)-4-羟基-[1,1'-联苯]-3-甲醛(hbttpiq)(实例中x=s、r1
化合物hbtbr的合成:分别称取5-溴水杨醛(301.5mg,1.5mmol)和邻氨基苯硫酚(187.8mg,1.5mmol)溶解在5ml乙醇溶液中,室温搅拌下加入1ml浓盐酸,随后加入40μl30%双氧水溶液,室温下搅拌反应30min。反应结束后,过滤,乙醇重结晶得到化合物hbtbr,产率83.7%。
1hnmr(400mhz,cdcl3),δ(ppm):12.55(s,1h),7.99-8.01(d,1h),7.92-7.94(d,1h),7.79-7.80(d,1h),7.51-7.55(m,1h),7.43-7.47(m,2h);13cnmr(100mhz,cdcl3),δ(ppm):167.77,157.01,151.63,135.31,132.61,130.48,126.93,125.95,122.37,121.63,119.81,111.02.
化合物hbtbrq的合成:称取化合物hbtbr(100mg,0.33mmol)溶于8ml三氟乙酸中,向体系中加入六甲基次胺(300mg,2.14mmol),混合体系充分搅拌后,120℃充分回流反应12小时。反应完成后,将反应体系倒入200ml水溶液中,用naoh溶液调体系ph为6左右,抽滤,得滤饼,干燥后柱层析纯化得到化合物hbtbrq,产率63.7%。
1hnmr(400mhz,cdcl3),δ(ppm):10.48(s,1h),8.13(s,1h),7.95-8.06(m,4h),7.55-7.59(t,1h),7.55-7.59(t,1h);13cnmr(100mhz,cdcl3),δ(ppm):159.38,151.25,136.39,127.20,126.38,122.62,121.73,111.64.
化合物hbttpiq的合成:称取化合物hbtbrq(40mg,0.19mmol)和化合物(4-(双(4-甲氧基苯基)氨基)苯基)硼酸(66mg,0.19mmol)溶解在4mldmf中,室温充分搅拌,随后向反应体系中加入1ml含有200mgk2co3的水溶液,并加入20mg催化剂pd(pph3)4。反应体系在氮气保护下在75℃充分回流反应12小时,tlc板监测反应完全后,减压蒸馏除去溶剂,硅胶柱层析分离得到产物hbttpaq。产率为32.4%。
核磁共振分析结果为:1hnmr(400mhz,cdcl3),δ(ppm):10.57(s,1h),8.23(s,1h),8.10(s,1h),8.04-8.05(d,1h),7.94-7.96(d,1h),7.51-7.57(m,8h),7.45-7.48(t,1h),7.30-7.35(m,3h),7.09-7.11(m,2h),7.05-7.06(d,2h),6.82-6.84(d,2h),6.76-6.78(d,2h),3.78-3.80(d6h);13cnmr(150mhz,cdcl3),δ(ppm):159.98,159.22,158.48,151.49,145.85,138.22,137.29,132.39,129.42,129.25,128.55,128.52,128.39,126.27,122.79,122.50,121.69,113.88,113.67,55.22,55.15。
实施例5(hbttpeq)
本发明的具有激发态分子内质子转移和聚集诱导发光效应的2-(2’-羟基苯基)苯并唑类化合物5-(苯并[d]噻唑-2-基)-4-羟基-4'-(1,2,2-三苯基甲苯)-[1,1'-联苯]-3-甲醛(hbttpeq)(实例中x=s、r1=
化合物hbtbr的合成:分别称取5-溴水杨醛(301.5mg,1.5mmol)和邻氨基苯硫酚(187.8mg,1.5mmol)溶解在5ml乙醇溶液中,室温搅拌下加入1ml浓盐酸,随后加入40μl30%双氧水溶液,室温下搅拌反应30min。反应结束后,过滤,乙醇重结晶得到化合物hbtbr,产率83.7%。
1hnmr(400mhz,cdcl3),δ(ppm):12.55(s,1h),7.99-8.01(d,1h),7.92-7.94(d,1h),7.79-7.80(d,1h),7.51-7.55(m,1h),7.43-7.47(m,2h);13cnmr(100mhz,cdcl3),δ(ppm):167.77,157.01,151.63,135.31,132.61,130.48,126.93,125.95,122.37,121.63,119.81,111.02.
化合物hbtbrq的合成:称取化合物hbtbr(100mg,0.33mmol)溶于8ml三氟乙酸中,向体系中加入六甲基次胺(300mg,2.14mmol),混合体系充分搅拌后,120℃充分回流反应12小时。反应完成后,将反应体系倒入200ml水溶液中,用naoh溶液调体系ph为6左右,抽滤,得滤饼,干燥后柱层析纯化得到化合物hbtbrq,产率63.7%。
1hnmr(400mhz,cdcl3),δ(ppm):10.48(s,1h),8.13(s,1h),7.95-8.06(m,4h),7.55-7.59(t,1h),7.55-7.59(t,1h);13cnmr(100mhz,cdcl3),δ(ppm):159.38,151.25,136.39,127.20,126.38,122.62,121.73,111.64.
化合物hbttpeq的合成:称取化合物hbtbrq(108.8mg,0.33mmol)和4,4,5,5-四甲基-2-(4-(1,2,2-三苯基乙烯基)苯基)-1,3,2-二氧杂硼烷(149.8mg,0.33mmol)溶解在5mldmf中,室温充分搅拌,随后向反应体系中加入600μl含有250mgk2co3的水溶液,并加入33mg催化剂pd(pph3)4。反应体系在氮气保护下在75℃充分回流反应12小时,tlc板监测反应完全后,减压蒸馏除去溶剂,硅胶柱层析分离得到产物hbttpeq。产率为33.6%。
核磁共振分析结果为:1hnmr(400mhz,cdcl3),δ(ppm):10.56(s,1h),8.25(s,1h),8.09(s,1h),8.05-8.06(d,1h),7.94-7.95(d,1h),7.54-7.57(t,1h),7.45-7.48(t,1h),7.39-7.40(d,2h),7.08-7.13(m,15h),6.88-6.90(d,2h),6.56-6.58(d,2h);13cnmr(150mhz,cdcl3),δ(ppm):159.78,154.10,151.37,144.01,143.92,143.90,143.66,143.63,143.35,141.47,140.46,140.25,140.18,136.49,136.33,132.74,132.54,132.08,131.41,131.38,131.35,131.34,127.89,127.79,127.72,127.69,127.62,127.04,126.68,126.60,126.53,126.39,126.27,126.06,125.86,122.46,121.69,114.61。
实施例6(hbttpap)
本发明的具有激发态分子内质子转移和聚集诱导发光效应的2-(2’-羟基苯基)苯并唑类化合物hbttpap)(实例中x=s、r1=
化合物hbtbr的合成:分别称取5-溴水杨醛(301.5mg,1.5mmol)和邻氨基苯硫酚(187.8mg,1.5mmol)溶解在5ml乙醇溶液中,室温搅拌下加入1ml浓盐酸,随后加入40μl30%双氧水溶液,室温下搅拌反应30min。反应结束后,过滤,乙醇重结晶得到化合物hbtbr,产率83.7%。
1hnmr(400mhz,cdcl3),δ(ppm):12.55(s,1h),7.99-8.01(d,1h),7.92-7.94(d,1h),7.79-7.80(d,1h),7.51-7.55(m,1h),7.43-7.47(m,2h);13cnmr(100mhz,cdcl3),δ(ppm):167.77,157.01,151.63,135.31,132.61,130.48,126.93,125.95,122.37,121.63,119.81,111.02.
化合物hbtbrq的合成:称取化合物hbtbr(100mg,0.33mmol)溶于8ml三氟乙酸中,向体系中加入六甲基次胺(300mg,2.14mmol),混合体系充分搅拌后,120℃充分回流反应12小时。反应完成后,将反应体系倒入200ml水溶液中,用naoh溶液调体系ph为6左右,抽滤,得滤饼,干燥后柱层析纯化得到化合物hbtbrq,产率63.7%。
1hnmr(400mhz,cdcl3),δ(ppm):10.48(s,1h),8.13(s,1h),7.95-8.06(m,4h),7.55-7.59(t,1h),7.55-7.59(t,1h);13cnmr(100mhz,cdcl3),δ(ppm):159.38,151.25,136.39,127.20,126.38,122.62,121.73,111.64.
化合物hbttpaq的合成:称取化合物hbtbrq(62mg,0.19mmol)和化合物(4-(双(4-甲氧基苯基)氨基)苯基)硼酸(66mg,0.19mmol)溶解在4mldmf中,室温充分搅拌,随后向反应体系中加入1ml含有200mgk2co3的水溶液,并加入20mg催化剂pd(pph3)4。反应体系在氮气保护下在75℃充分回流反应12小时,tlc板监测反应完全后,减压蒸馏除去溶剂,硅胶柱层析分离得到产物hbttpaq。产率为32.4%。
1hnmr(400mhz,cdcl3),δ(ppm):10.58(s,1h),8.26(s,1h),8.08-8.10(m,2h),7.95-7.97(d,1h),7.54-7.58(t,1h),7.44-7.49(m,3h),7.01-7.12(m,6h),6.85-6.88(m,6h).
化合物hbttpap的合成:称取化合物hbttpaq(31.3mg,0.056mmol)和化合物1-乙基-4-甲基吡啶-1-碘化物(36mg,0.14mmol)溶解在6ml无水乙醇中,室温充分搅拌,随后向反应体系中加入10μl哌啶。反应体系在95℃充分回流反应8小时,tlc板监测反应完全后,减压蒸馏除去溶剂,硅胶柱层析分离得到产物hbttpap。产率为57.4%。
hrms(esi):m/z662.2457[(m-i)+,calcdfor689.2472]。
实施例7(hbttpip)
本发明的具有激发态分子内质子转移和聚集诱导发光效应的2-(2’-羟基苯基)苯并唑类化合物hbttpip(实例中x=s、r1=
化合物hbtbr的合成:分别称取5-溴水杨醛(301.5mg,1.5mmol)和邻氨基苯硫酚(187.8mg,1.5mmol)溶解在5ml乙醇溶液中,室温搅拌下加入1ml浓盐酸,随后加入40μl30%双氧水溶液,室温下搅拌反应30min。反应结束后,过滤,乙醇重结晶得到化合物hbtbr,产率83.7%。
1hnmr(400mhz,cdcl3),δ(ppm):12.55(s,1h),7.99-8.01(d,1h),7.92-7.94(d,1h),7.79-7.80(d,1h),7.51-7.55(m,1h),7.43-7.47(m,2h);13cnmr(100mhz,cdcl3),δ(ppm):167.77,157.01,151.63,135.31,132.61,130.48,126.93,125.95,122.37,121.63,119.81,111.02。
化合物hbtbrq的合成:称取化合物hbtbr(100mg,0.33mmol)溶于8ml三氟乙酸中,向体系中加入六甲基次胺(300mg,2.14mmol),混合体系充分搅拌后,120℃充分回流反应12小时。反应完成后,将反应体系倒入200ml水溶液中,用naoh溶液调体系ph为6左右,抽滤,得滤饼,干燥后柱层析纯化得到化合物hbtbrq,产率63.7%。
1hnmr(400mhz,cdcl3),δ(ppm):10.48(s,1h),8.13(s,1h),7.95-8.06(m,4h),7.55-7.59(t,1h),7.55-7.59(t,1h);13cnmr(100mhz,cdcl3),δ(ppm):159.38,151.25,136.39,127.20,126.38,122.62,121.73,111.64。
化合物hbttpiq的合成:称取化合物hbtbrq(40mg,0.19mmol)和化合物(4-(双(4-甲氧基苯基)氨基)苯基)硼酸(66mg,0.19mmol)溶解在4mldmf中,室温充分搅拌,随后向反应体系中加入1ml含有200mgk2co3的水溶液,并加入20mg催化剂pd(pph3)4。反应体系在氮气保护下在75℃充分回流反应12小时,tlc板监测反应完全后,减压蒸馏除去溶剂,硅胶柱层析分离得到产物hbttpiq。产率为32.4%。
核磁共振分析结果为:1hnmr(400mhz,cdcl3),δ(ppm):10.57(s,1h),8.23(s,1h),8.10(s,1h),8.04-8.05(d,1h),7.94-7.96(d,1h),7.51-7.57(m,8h),7.45-7.48(t,1h),7.30-7.35(m,3h),7.09-7.11(m,2h),7.05-7.06(d,2h),6.82-6.84(d,2h),6.76-6.78(d,2h),3.78-3.80(d6h);13cnmr(150mhz,cdcl3),δ(ppm):159.98,159.22,158.48,151.49,145.85,138.22,137.29,132.39,129.42,129.25,128.55,128.52,128.39,126.27,122.79,122.50,121.69,113.88,113.67,55.22,55.15.
化合物hbttpip的合成:称取化合物hbttpiq(21mg,0.031mmol)和化合物1-乙基-4-甲基吡啶-1-碘化物(11.4mg,0.046mmol)溶解在6ml无水乙醇中,室温充分搅拌,随后向反应体系中加入10μl哌啶。反应体系在95℃充分回流反应8小时,tlc板监测反应完全后,减压蒸馏除去溶剂,硅胶柱层析分离得到产物hbttpap。产率为60.3%。
hrms(esi):m/2z395.1478[(m-i)+,calcdfor789.2894]。
实施例8(hbttpap线粒体靶向成像)
本发明的具有激发态分子内质子转移和聚集诱导发光效应的2-(2’-羟基苯基)苯并唑类化合物hbttpap)(实例中x=s、r1=
选用结肠癌细胞系ct-26,将2×105个ct-26细胞接种于含1ml培养基的共聚焦皿,置于5%co2,37℃恒温培养箱中培养12h,加入10μmhbttpap孵育1h,pbs清洗3遍,每次3-5min,随后加入100nm线粒体染料(mitotrackertmgreenfm)孵育20min,pbs清洗3遍,每次3-5min,加入1ml的培养基后,置于激光共聚焦下进行线粒体共定位分析。
实施例9(hbttpip线粒体靶向成像)
本发明的具有激发态分子内质子转移和聚集诱导发光效应的2-(2’-羟基苯基)苯并唑类化合物hbttpip(实例中x=s、r1=
选用结肠癌细胞系ct-26,将2×105个ct-26细胞接种于含1ml培养基的共聚焦皿,置于5%co2,37℃恒温培养箱中培养12h,加入10μmhbttpip孵育1h,pbs清洗3遍,每次3-5min,随后加入100nm线粒体染料(mitotrackertmgreenfm)孵育20min,pbs清洗3遍,每次3-5min,加入1ml的培养基后,置于激光共聚焦下进行线粒体共定位分析。
实施例10(hbttpep靶向线粒体成像)
本发明的具有激发态分子内质子转移和聚集诱导发光效应的2-(2’-羟基苯基)苯并唑类化合物hbttpep(实例中x=s、r1=
选用结肠癌细胞系ct-26,将2×105个ct-26细胞接种于含1ml培养基的共聚焦皿,置于5%co2,37℃恒温培养箱中培养12h,加入10μmhbttpep孵育1h,pbs清洗3遍,每次3-5min,随后加入100nm线粒体染料(mitotrackertmgreenfm)孵育20min,pbs清洗3遍,每次3-5min,加入1ml的培养基后,置于激光共聚焦下进行线粒体共定位分析。
实施例11
本发明的具有激发态分子内质子转移和聚集诱导发光效应的2-(2’-羟基苯基)苯并唑类化合物(实例中x=s、r1=
化合物hbtbr的合成:分别称取5-溴水杨醛(301.5mg,1.5mmol)和邻氨基苯硫酚(187.8mg,1.5mmol)溶解在5ml乙醇溶液中,室温搅拌下加入1ml浓盐酸,随后加入40μl30%双氧水溶液,室温下搅拌反应30min。反应结束后,过滤,乙醇重结晶得到化合物hbtbr。
化合物hbtbrq的合成:称取化合物hbtbr(100mg,0.33mmol)溶于8ml三氟乙酸中,向体系中加入六甲基次胺(300mg,2.14mmol),混合体系充分搅拌后,120℃充分回流反应12小时。反应完成后,将反应体系倒入200ml水溶液中,用naoh溶液调体系ph为6左右,抽滤,得滤饼,干燥后柱层析纯化得到化合物。
称取化合物hbtbrq(40mg,0.19mmol)和化合物(4-(双(4-甲氧基苯基)氨基)苯基)硼酸(66mg,0.19mmol)溶解在4mldmf中,室温充分搅拌,随后向反应体系中加入1ml含有200mgk2co3的水溶液,并加入20mg催化剂pd(pph3)4。反应体系在氮气保护下在75℃充分回流反应12小时,tlc板监测反应完全后,减压蒸馏除去溶剂,硅胶柱层析分离得到产物hbttpiq。
化合物的合成:称取化合物hbttpiq(21mg,0.031mmol)和化合物1-乙基-4-甲基吡啶-1-高氯酸化物(0.046mmol)溶解在6ml无水乙醇中,室温充分搅拌,随后向反应体系中加入10μl哌啶。反应体系在95℃充分回流反应8小时,tlc板监测反应完全后,减压蒸馏除去溶剂,硅胶柱层析分离得到产物。
本领域的技术人员可以明确,在不脱离本发明的总体精神以及构思的情形下,可以做出对于以上实施例的各种变型。其均落入本发明的保护范围之内。本发明的保护方案以本发明所附的权利要求书为准。
- 还没有人留言评论。精彩留言会获得点赞!