一种植物组织DNA快速提取方法、提取试剂盒及提取装置与流程
【
技术领域:
】本发明属于生物工程
技术领域:
,具体地涉及一种植物组织dna快速提取方法、提取试剂盒及提取装置。
背景技术:
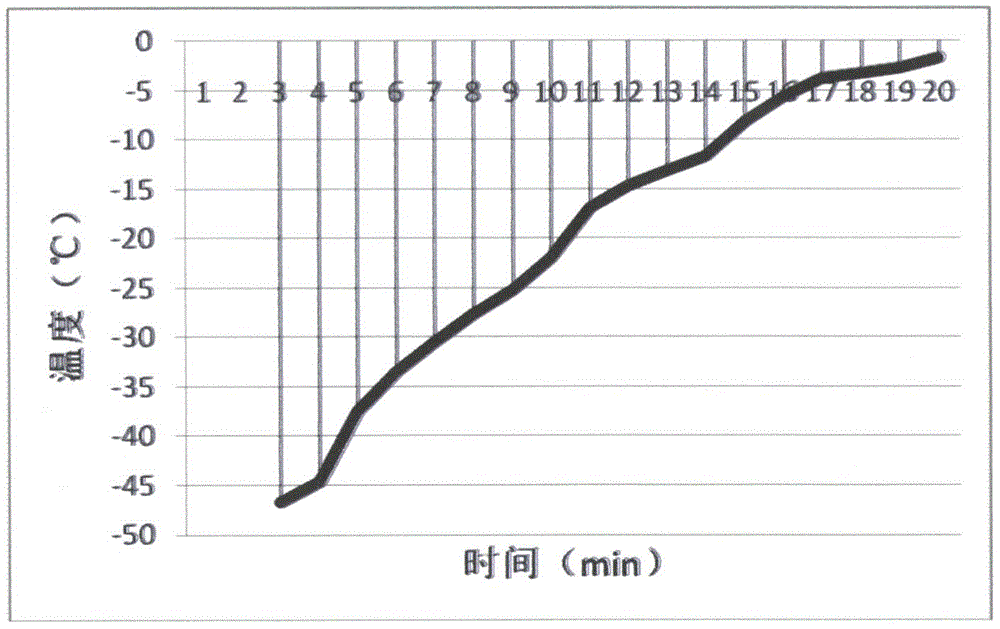
:随着基因组测序技术的发展,植物基因组的序列、结构和功能研究飞速发展,而获得高纯度、高含量和高完整度的植物基因组dna是基因组测序技术得以应用的首要前提。由于植物组织中含有大量的多糖、多酚类物质以及其它结构复杂的次级代谢产物,使得植物基因组dna的提取较微生物、动物组织或血液样品基因组提取面临更大的难度。传统的植物基因组dna提取方法主要有ctab和sds法,提取步骤主要包括植物组织在液氮保护下研磨,以及之后的细胞裂解、去除杂质、dna沉淀、漂洗和洗脱等过程。其主要是以ctab或sds等去污剂对细胞进行裂解后,释放出细胞中的基因组dna;再通过氯仿苯酚抽提或高盐沉淀的方法,去除蛋白质、多酚和多糖等杂质;然后在提取的上清液中加入适量体积的无水乙醇、异丙醇或peg等有机溶剂将dna沉淀或吸附在硅胶柱、离子交换柱等介质上;最后用漂洗液进行漂洗后,用低浓度盐溶液溶解或从介质上洗脱下来。专利文献cn110592072a公开了一种植物基因组dna的提取方法及其应用,包括在液氮保护下进行植物组织的研磨,并将植物组织粉末加入含有sds的裂解液种中,在65℃温育30~50分钟。还要在-20℃放置5~10分钟,之后进行dna抽提,全部操作时间大约2小时,并且需要用到β-巯基乙醇的有毒物质。专利文献cn106754889a公开了从一种中药植物组织提取高质量基因组dna的方法,包括在低温下对植物组织细胞核反复抽提。然后,加入蛋白酶k和sds裂解液并37℃消化过夜,耗时太长。而且使用了酚和氯仿有毒物质。专利文献cn109554362a公开了一种提取植物组织、真菌和细菌基因组dna的方法,包括将上述物质放入离心管内加入提取试剂,在90-95℃下水浴加热10min,冷却至室温,再加入其它提取试剂获得dna。耗时比较长,而且提取的dna量低。专利文献cn109439652a公开了一种富含多糖类的植物基因组dna的提取方法,包括在液氮保护下研磨植物组织,采用sds裂解植物细胞,并进一步采用酚氯仿和异丙醇进行dna沉淀提取,全部操作时间不少于1小时,并且需要β-巯基乙醇、苯酚、氯仿等有毒物质。专利文献cn107475248a公开了一种提取植物组织dna的方法,包括将植物叶片在液氮中研磨成粉末,在70℃的sds裂解液中水浴10-30分钟,并通过异丙醇进行dna提取,全部操作时间大约1小时。从a260/a280值看,有rna污染,从凝胶电泳图看,提取的dna量低,有dna降解,而且也比较耗时。通过上述专利文献可见,现有的植物组织dna提取方法普遍存在操作时间长(普遍超过1小时甚至2小时)、使用有毒物质(酚氯仿、β-巯基乙醇)等问题,操作时间长会引起dna的降解且浪费实验人员的宝贵时间、降低实验效率;使用有毒物质则会对操作者身心健康造成伤害,且废物排放对环境有不利影响,后期处理成本大,不符合可持续发展的需要。技术实现要素:本发明的目的在于克服上述现有技术中存在的不足,提供一种能够快速提取植物组织dna的方法,以及用于实施该方法的试剂盒和提取装置。为实现上述目的,本发明在第一方面提供一种植物组织dna提取方法,包括以下步骤:(a)将植物组织加入研磨装置或研磨仪;(b)对所述植物组织和研磨装置进行预冷,其中所述植物组织的水分在预冷后凝结,所述研磨装置在预冷后达到能够使当所述植物组织在其中研磨时水分保持凝结状态的温度;(c)在没有液体制冷剂保护的条件下,用预冷后的研磨装置对所述植物组织进行研磨,得到植物组织粉末;(d)对所述植物组织粉末进行dna提取。所述植物包括但不限于水生植物、陆生植物,其中水生植物包括浮水植物和沉水植物,其中陆生植物包括绿萝、月季、山茶、小叶黄杨、红叶石楠、紫荆矮樱、山莴苣、大叶黄杨、柳树、莴笋、润楠、日本珊瑚树、大豆等;所述植物组织包括植物的根、茎、叶、花、果实之一或其任意组合。所述研磨装置选自本领域常用的植物组织破碎装置,典型地选自研钵或智能样品研磨仪,但也可以采用其他能够实现相同目的的装置。在研磨时,遇到难以研磨的多酚多糖老化的植物组织情况下,为了使植物组织充分破碎,优选地加入50目的石英砂,石英砂可以在后续的离心步骤被去除。作为一种优选方案,步骤(b)中所述预冷,是指向载有植物组织的研磨装置加入液体制冷剂;所述液体制冷剂的加入量能够使所述植物组织的水分在预冷后凝结、使所述研磨装置在预冷后达到能够使当所述植物组织在其中研磨时水分保持凝结状态的温度,且所述液体制冷剂在使植物组织和研磨装置预冷后挥发成气态而耗散。所述液体制冷剂典型地选自液氮,这也是本领域现有技术通常教导的“在液氮保护下进行研磨”所需的。事实上,任何能够达到相似目的的液体制冷剂都可采用,例如液氦。但从试剂的获取难易度和价格来看,液氮更为优选。作为一种优选方案,步骤(c)的研磨在10分钟内,优选地在5分钟内完成。作为一种优选方案,步骤(d)进一步包括:i.将植物组织粉末转移到含有第一溶液的容器(典型地为ep管)中并混匀(优选地,涡旋震荡混匀10~30秒);ii.加入第二溶液并混匀,放置3分钟后,离心(优选地,转速12000rpm,约13400g,离心1~2分钟)并保留上清液(优选地,将上清液转入新的离心管中);iii.加入第三溶液并混匀,转入吸附柱中,离心(优选地,转速12000rpm,约13400g,离心20~40秒)弃滤液;iv.向所述吸附柱加入第四溶液,离心(优选地,转速12000rpm,约13400g,离心20~40秒)弃滤液;v.将所述吸附柱充分干燥(优选地,室温放置1~3分钟),并转移至新的容器;vi.向吸附柱中心滴加第五溶液,室温放置(优选地,放置1~3分钟)后离心(优选地,转速12000rpm,约13400g,离心30秒~2分钟),收集滤液,即得植物组织dna。所述吸附柱选自本领域常用于核酸提取的dna吸附柱,典型地是二氧化硅膜吸附柱,其在酸性条件下对dna具有较强的吸附作用,而在碱性条件下对dna的吸附作用明显减弱,因而常用于dna提取。作为一种优选方案,步骤i~vi均在室温环境下完成;为了提高dna纯度,步骤v可重复若干次,典型地1次、2次或3次;为了增加dna得率,步骤vi可重复1次,即将滤液再次加入同一个吸附柱中并离心收取。作为一种优选方案,所述第一溶液为提取液,其包含tris-hcl、edta、甘油、10mg/mlrnase(提取dna时加入)、sds和nacl;所述tris-hcl的浓度为50~200mm,所述edta的浓度为10~20mm,所述甘油的浓度为1%~4%,所述rnase(提取dna时加入)为4~20ul,所述sds为0.2%~4%,所述nacl的浓度为0.3~1.0m。作为一种优选方案,所述第二溶液为3.0~6.0mkac;所述第三溶液为异丙醇,所述异丙醇的加入量与步骤ii所得上清液体积的比例为0.4~0.8∶1;所述第四溶液为漂洗液,其含有65%~80%的乙醇;所述第五溶液一般为te洗脱液,其ph值在7.0-8.5范围内,如果制水机得到的去离子水ph在此范围内,则可直接采用纯水洗脱。通过上述操作,植物组织dna可在20分钟内,甚至15分钟内提取完成。本发明在另一方面提供一种用于实施前述植物组织dna方法的试剂盒,所述试剂盒包含:第一溶液,其含有浓度为50~200mm的tris-hcl(或其他缓冲液)、10~200mm的edta、1%~4%的甘油4~20ul10mg/mlrnase(提取dna时加入)0.2%~4%sds和0.3~1.0m的nacl(或其他盐);以及记载前述植物组织dna方法的载体。所述记载前述植物组织dna方法的载体,典型地为纸质说明书,也可以是记载所述方法的电子版说明书的任意载体(包括但不限于可移动磁盘、光盘、电子墨水屏幕、网络资源及其地址等),只要能通过读取该载体而获知该方法,则均在本概念范围内。本发明在另一方面提供一种计算机可读载体,其记载包含用于实施前述植物组织dna方法的计算机程序。所述计算机作广义理解,包括但不限于单片机、plc、单板机、工控机、pc机等形式。所述计算机可读载体包括但不限于flash、eeprom、磁盘(软盘或硬盘)、光盘等任何形式。所述计算机程序可以是任意语言编写的,例如汇编、java、vb、vc、c++、python,只要能够控制相关系统实施所述方法即可。本发明在另一方面提供一种自动化核酸提取装置,所述装置包含:液体加注/吸移组件、离心组件、研磨组件以及与上述组件电连接的控制器;所述控制器包含前述的计算机可读载体。其中液体加注/吸移组件用于控制前述方法中各种液体的加注和移除,离心组件和研磨组件分别用于执行相应的离心及研磨操作,所述控制器用于控制上述组件以自动化地执行前述植物组织dna提取方法。自动化的核酸提取装置广泛见于现有技术中,例如参见专利文献cn106754889a、cn109554362a、cn109439652a等,因而在此不予赘述。发明人在对植物组织dna提取方法的研究中惊讶地发现,在植物组织低温研磨时,去除液氮保护可以在更短时间内获得破碎更为充分的植物组织粉末,这对于后续的提取操作更为有利,例如可以省略sds温育的步骤,大大缩短了实验流程,保证了dna提取的质量(在具体实施方式中进一步证明)。区别于现有技术通常教导的液氮保护下研磨,发明人先将植物组织和研磨装置在少量液氮下预冷,在相当短的时间内,植物组织就被冻结而表现出脆性,同时研磨装置被预冷到保持在较低温度(例如低于零度)一段时间的状态,液氮则挥发到大气中;藉此,脆性的植物组织不会因液氮的存在而在研钵中到处漂浮,因而能够在更短的时间内获得更细的植物组织粉末。而当植物组织粉末与常规操作相比更为细腻时,其与裂解液的接触面积就更大(例如超过1个数量级的差异),因此能够在更短的时间内完成细胞裂解并释放dna。由于研磨装置和植物组织在研磨中始终处于低于零度(或更低)的状态,植物组织中的dna并不会在这一期间降解,这保证了提取的质量。本发明提出的植物组织dna提取方法、提取试剂盒和提取装置至少能产生如下有益效果:1.瞬间冷却后的植物在没有液氮保护的干燥条件下研磨,大大缩短操作时间,简化操作步骤,提高实验效率;2.不使用有毒试剂,有利于操作者健康,且减少对环境的破坏;3.采用常规试剂、仪器,可操作性更强、成本更低。4.提取的dna量更大而且纯度高。【附图说明】图1是研磨体系预冷后的温升曲线图;图2是本发明所述方法中不同浓度sds提取dna结果凝胶电泳图;图3是本发明所述方法提取7种植物组织dna的凝胶电泳图;图4是智能样品研磨仪研磨方法提取7种植物组织dna的凝胶电泳图;图5是本发明所述方法提取5种植物组织,根、茎、老叶、种子和肉质果实dna的凝胶电泳图。图6是本发明所述方法用ph4.0naac代替ph8.0tris-hcl绿萝叶片提取dna结果电泳图。图7是本发明方法用5mph7.0naac代替5mnacl和5mph7.2kac以及用5mph7.0kac代替5mnacl绿萝叶片提取dna结果电泳图。【具体实施方式】下面结合附图和具体实施例对本发明作进一步描述,这些描述仅用于帮助理解本发明。实施例1——研磨温度和时间的可行性如前所述,本发明的特殊性主要在于无液氮保护的研磨方式。为了确保在这种研磨方式下,植物组织dna不会在研磨中降解,发明人考察了采用本领域常见研钵在液氮预冷后研磨时的温升曲线(图1)。在少量液氮预冷并挥发后,研钵立即达到了低于-50℃的温度(该范围的温度无法被发明人使用的测温仪器测出)。之后,随着环境与研钵热交换的进行,研磨体系的温度不断升高,但在5分钟内低于-35℃,在10分钟内仍低于-20℃。-20℃是本领域常用的dna存储温度,在这一温度下dna不易发生降解,即在10分钟内对植物组织研磨,即使没有液氮保护,也不会引起dna降解。而在没有液氮的情况下,植物组织不会因液氮的沸腾而在研钵中无规则运动和研钵棒研磨时带动液氮和植物组织的流动,研磨的效率大大提高,在2分钟内就可以达到相当于液氮保护下研磨10分钟的细度,在5分钟内即达到提取高质量dna要求的颗粒细度。实施例2——裂解液中最佳成分浓度的确定根据前述方法对绿萝叶片进行dna提取,研磨5分钟,以单因素分析法确定sds的最佳浓度范围。称取的绿萝叶片约556.9mg。其中第一溶液(缓冲裂解液)包含tris-hcl100mm、edta20mm、甘油3%、nacl0.6m、8ul10mg/mlrnase(提取dna时加入),以及质量体积浓度分别为0.2%、0.5%、1%、2%、3%和4%的sds。将结果在biosharp上测定(表1),并通过凝胶电泳检测(图2),可见0.2%~4%的sds的结果较好,1%最佳,且植物基因组dna片段均较完整、降解的小片段较少。以单因素分析法确定nacl的最佳浓度范围,研磨5分钟。其中第一溶液包含tris-hcl100mm、edta20mm、甘油3%、sds1%、8ul10mg/mlrnase(提取dna时加入),以及浓度分别为0.5、0.6、0.7、08m的nacl,称取绿萝叶片约401mg。将结果在biosharp上测定(表2),可见0.5~0.8m的nacl结果较好,0.6m最佳。表1:不同sds浓度提取得到植物组织dna浓度(100ul洗脱)sds浓度0.2%0.5%1%2%3%4%dna浓度45.34ng/ul57.34ng/ul66.46ng/ul55.03ng/ul65.76ng/ul53.99ng/ula260/a2801.7891.7731.8231.8321.8391.800表2:不同nacl浓度提取得到的植物组织dna浓度(100ul洗脱)nacl浓度0.5m0.6m0.7m0.8mdna浓度56.74ng/ul59.18ng/ul53.32ng/ul52.86ng/ula260/a2801.8481.8211.8301.831以单因素分析法确定甘油的最佳浓度范围,研磨5分钟。其中第一溶液包含tris-hcl100mm、edta20mm、nacl0.6m、sds1%、8ul10mg/mlrnase(提取dna时加入);第二溶液:5mph7.2kac。以及体积浓度分别为1%、2%、3%、4%的甘油,称取绿萝叶片约363mg。将结果在biosharp上测定(表3),可见1%~4%的甘油结果均较好,3%最佳。表3:不同甘油浓度提取得到的植物组织dna浓度(100ul洗脱)甘油浓度1%2%3%4%dna浓度62.21ng/ul54.17ng/ul85.11ng/ul79.14ng/ula260/a2801.8091.8161.8321.829以单因素分析法确定edta的最佳浓度范围,研磨5分钟。其中第一溶液包含tris-hcl100mm、nacl0.6m、甘油3%、sds1%、8ul10mg/mlrnase(提取dna时加入);第二溶液:5mph7.2kac。以及浓度分别为10、20、30、40mm的edta,称取绿萝叶片约372mg。将结果在biosharp上测定(表4),可见10~20mm的edta结果较好,20mm最佳。表4:不同edta浓度提取得到的植物组织dna浓度(100ul洗脱)edta浓度10mm20mm30mm40mmdna浓度60.14ng/ul70.05ng/ul53.68ng/ul33.68ng/ula260/a2801.8011.8171.8051.807以单因素分析法确定tris-hcl的最佳浓度范围,研磨5分钟。其中第一溶液包含edta20mm、nacl0.6m、甘油3%、sds1%、8ul10mg/mlrnase(提取dna时加入);第二溶液:5mph7.2kac。以及浓度分别为50、100、150、200mm的edta,称取绿萝叶片约399mg。将结果在biosharp上测定(表5),可见50~100mm的tris-hcl结果较好,100mm最佳。表5:不同tris-hcl浓度提取得到的植物组织dna浓度(100ul洗脱)tris-hcl梯度50mm100mm150mm200mm浓度44.88ng/ul59.33ng/ul36.6435.73a260/a2801.8041.8351.7751.811实施例3——异丙醇的最优体积比根据前述方法对绿萝叶片进行dna提取,研磨5分钟,以单因素分析法确定步骤iii中异丙醇与离心上清液的最佳体积比例。称取的绿萝叶片约371mg。将结果在biosharp上测定(表6),可见0.6~0.8倍体积的异丙醇结果较好,0.7倍体积最佳。表6:不同异丙醇体积比提取得到的植物组织dna浓度(100ul洗脱)异丙醇体积0.5v0.6v0.7v0.8vdna浓度74.73ng/ul87.14ng/ul93.41ng/ul91.72ng/ula260/a2801.8071.8131.8221.819实施例4——不同种类植物组织的dna提取按照上文确定的最佳实验条件,对常见的多种植物组织,分别按照如下方法进行提取。(1)称取100mg左右的植物组织加入研磨装置;(2)向研磨装置加入少量液氮进行预冷;(3)待液氮挥发后对植物组织持续研磨5分钟,得到植物组织粉末;(4)将植物组织粉末转移到含有裂解液和rna酶的ep管中,涡旋震荡混匀20秒;(5)加入60μl的10%sds溶液并轻柔快速混匀20秒,然后再加入160μl5mph7.2kac溶液并轻柔混匀并室温放置3分钟,转速12000rpm(约13400g)离心1分钟,将上清液转入新的ep管中;(6)加入0.5-0.7倍体积的异丙醇并轻柔混匀,转入二氧化硅膜吸附柱中,转速12000rpm(约13400g)离心30秒,吸弃滤液;(7)向所述吸附柱加入含70%乙醇的漂洗液,转速12000rpm(约13400g)离心30秒,弃滤液,并重复漂洗一次;(8)将吸附柱室温放置2分钟以充分干燥,并转移至新的ep管;(9)向吸附柱中心滴加100ulte洗脱液,室温放置2分钟后,转速12000rpm(约13400g)离心1分钟,收集滤液,即得到植物组织dna,分别对其进行biosharp和凝胶电泳分析,得到表7、表8和图3、图4。表7:提取7种植物组织的dna浓度(100ul洗脱)表8:提取5种植物组织的dna浓度(100ul洗脱)植物组织名称老绿萝叶片马铃薯老茎小麦种子红薯肉马铃薯老根质量98.1mg100.1mg142.7mg100.0mg99.8mgdna浓度45.15ng/ul33.32ng/ul77.81ng/ul26.70ng/ul50.32ng/ula260/a2801.8351.7951.8311.8161.793实施例5——智能样品研磨仪提取7种植物组织的dna与实施例4除了研磨方式不同外——智能样品研磨仪,试剂的组成和提取操作过程都相同。所得结果见表9和图5。可见,智能样品研磨仪也可以用本方法达到提取植物组织dna的目的。表9:用智能样品研磨仪提取植物组织dna浓度(100ul洗脱)实施例6——用ph4.0的naac缓冲液代替ph8.0的tris-hcl提取植物组织的dna以ph4.0的naac代替ph8.0的tris-hcl提取绿萝叶片dna,研磨5分钟。其中第一溶液包含edta20mm、nacl0.6m、甘油3%,100mmnaac、60ul10%sds、8ul10mg/mlrnase(提取dna时加入)。第二溶液:160ul5mph7.2kac。称取绿萝叶片约100mg。将结果在biosharp上测定(表10)和图6。可见,用naac缓冲液可以替代tris-hcl的。表10:用naac代替tris-hcl提取植物组织dna浓度(100ul洗脱)植物组织名称绿萝叶片质量100.1mgdna浓度57.92ng/ula260/a2801.823实施例7——用ph7.0的naac或ph7.0的kac缓冲液代替nacl和ph7.2的kac提取植物组织的dna以5mph7.0的naac或5mph7.0kac代替5mnacl和5mph7.2的kac提取绿萝叶片dna,研磨5分钟。其中第一溶液包含edta20mm、naac或kac0.6m、甘油3%,tris-hcl100mm、60ul10%sds、8ul10mg/mlrnase(提取dna时加入)。第二溶液:160ul5mph7.0的naac或5mph7.0的kac。称取绿萝叶片约200mg。将结果在biosharp上测定(表11)和图7。所以,可以用naac或kac代替nacl和ph7.2的kac提取植物组织dna的。表11:用naac或kac代替nacl和ph7.2的kac提取植物组织dna浓度(100ul洗脱)替代物kacnaac绿萝叶片质量96.5mg96.5mgdna浓度20.24ng/ul96.31ng/ula260/a2801.8161.813由结果可见,本发明提供的提取方法在植物组织dna提取方面具有较好的普适性,采用属本领域常见的试剂/仪器,适用于多种植物组织的dna提取,结果显示dna浓度、纯度均比较高,可用于后续的分子克隆和测序等操作。更为突出的是,本方法操作时间非常短,为缩短整体实验时间、提高实验效率提供了更多可能性,而且dna提取过程有利于保护环境和不损害实验者的健康。本发明所用试剂的来源:edta国药试剂cas号:6381-92-6tris-hcl国药试剂cas号:77-86-1nacl国药试剂cas号:7647-14-5naac国药试剂cas号:127-09-3kac国药试剂cas号:127-08-2sds合肥博美生物科技有限公司试剂cas号:151-21-3异丙醇国药试剂cas号:67-63-0无水乙醇国药试剂cas号:64-17-5rnasea汉远化生医国际科技(北京)有限公司尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和结构的情况下可以对这些实施例进行多种变化、修改、组合、替换和变型,本发明的保护由所附权利要求及其等同范围限定。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1