可实现细胞三维共培养与多指标检测的生物分析芯片
1.本发明涉及微流控芯片、生物分析及应用领域,特别涉及一种可实现细胞三维共培养与多指标检测的生物分析芯片。
背景技术:
2.单细胞分析的一个关键局限性是分析的细胞脱离了原有的微环境,分析结果不能完全反映细胞的真实状态。将细胞微环境构建在单细胞分析中,可扩展单细胞分析在生物学、免疫学研究及临床诊断、评估中的应用。细胞微环境包括物理微环境和生理微环境。物理微环境中基底形貌影响细胞形貌及功能。与二维基底对比,三维基底上培养的细胞状态和功能更能体现体内真实情况。因此,三维培养为理解细胞生理及病理机制提供更好培养模式。而现有的单细胞分析技术都是基于二维培养模式,由于技术上的瓶颈,三维基底单细胞分析的开展受到限制。
3.细胞生理微环境是影响细胞功能的另一个重要因素。体外模拟生理微环境主要采用一种或多种细胞共培养模式,以构建细胞间通讯及基质微环境。将细胞生理微环境集成于单细胞分析,不仅可以更深入理解细胞间相互作用及其机制,而且对单细胞分析技术发展及应用是一个重要补充,但目前这方面鲜有报道。
技术实现要素:
4.为解决现有技术存在的问题,本发明的目的是提供一种可实现细胞三维共培养的多指标生物分析芯片,可实现在三维基底上细胞共培养模式的单细胞及多细胞分析,为体外深入理解细胞机制、功能及细胞间相互作用,拓展单细胞分析及应用提供新技术。
5.为实现上述发明目的,本发明采用以下技术方案:
6.本发明第一方面提供了一种三维微柱基底的微孔阵列芯片,包括基底和微孔阵列穿孔膜,所述基底为微柱阵列基底。
7.上述技术方案中,进一步地,所述微柱的横截面为圆形、正多边形或矩形,所述微柱的横截面的面积为70
×
10-6
μm
2-70μm2,所述微柱高度为100nm~1cm,相邻两个微柱边界之间的距离为100nm-1cm。
8.上述技术方案中,进一步地,所述微孔阵列穿孔膜由1个或多个微孔阵列组成,每个微孔阵列的形状为正多边形、矩形或圆形,所述微孔的形状包括圆形、正多边形或矩形,所述微孔的横截面的面积为0.5μm
2-2
×
105μm2,相邻两个微孔边界之间的距离为100μm-1mm;所述微孔阵列穿孔膜厚度为1μm-1mm。
9.上述技术方案中,进一步地,所述基底和微孔阵列穿孔膜的材料为pdms、pmma、pc、ps、poe、eva、epdm中的一种或多种复合材料,或亲水改性后的pdms、pmma、pc、ps、poe、eva、epdm中的一种或多种复合材料。
10.本发明第二方面提供了一种可实现细胞三维共培养的生物分析芯片,所述芯片包括生物分析基底和前述微孔阵列芯片,所述生物分析基底与所述微孔阵列穿孔膜相连。
11.上述技术方案中,进一步地,所述生物分析基底的材质为多聚赖氨酸、环氧树脂、氨基、醛基修饰的玻璃或环氧树脂玻片。
12.上述技术方案中,进一步地,所述玻璃或环氧树脂玻片包括包被抗体、蛋白或dna、或者包被蛋白阵列、抗体阵列、dna阵列。
13.本发明第三方面提供了三维微柱基底的微孔阵列芯片的应用,所述芯片应用于一种或多种单细胞的三维培养或共培养;所述芯片应用于一种或多种多细胞的三维共培养。
14.本发明第四方面提供了三维微柱基底的微孔阵列芯片的应用,所述应用为多种细胞的单细胞和多细胞三维共培养分析、多种细胞的多细胞三维共培养分析、多种细胞的单细胞多重生物分子分析、多种细胞的多重生物分子分析。
15.上述技术方案中,进一步地,所述多重生物分子分析包括分泌蛋白、细胞因子、生长因子、细胞表面蛋白、细胞表面受体、多肽、核酸、激素、抗原或外泌体的分析,所述多重分析包括1到100个指标的分析。
16.与现有技术相比,本发明的有益效果:
17.本发明构建了细胞三维共培养多指标生物分析平台,以三维微柱阵列为基底,微孔阵列穿孔膜集成于三维微柱阵列基底上,形成三维微柱基底的微孔阵列芯片,该芯片是可拆卸、可重复利用芯片;其基底为细胞培养提供三维基底物理微环境,穿孔膜为孔内细胞三维培养提供微室空间,同时作为连接层连接上层生物微柱阵列分析基底。
18.本发明三维微柱基底的微孔阵列芯片可应用于多种细胞的单细胞和多细胞三维共培养、多种细胞不同比例的三维共培养,为细胞三维共培养提供若干种生理微环境。
19.本发明的细胞三维共培养的多指标生物分子分析,可拓宽单细胞分析在生物学、医学中的研究,并为疾病诊断和治疗监测及评估应用提供重要技术支持。
附图说明
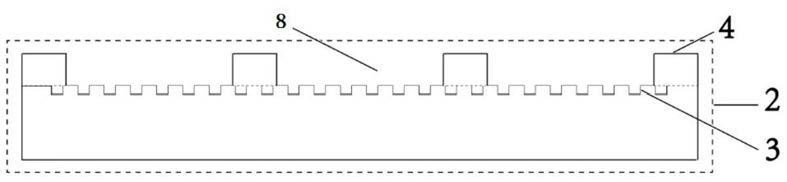
20.图1为本发明所述三维微柱阵列基底的微孔阵列芯片结构示意图;
21.图2为本发明所述三维微柱阵列基底的微孔阵列芯片俯视示意图;
22.图3为本发明所述芯片应用于多指标分泌蛋白检测时的芯片结构示意图;
23.图4为本发明所述三维微柱阵列基底的微孔阵列芯片的制备方法示意图;
24.图5为本发明所述三维微柱阵列的显微实物图;a为10倍明场图,b为40倍明场图,标尺表示50μm;
25.图6为本发明所述三维微柱阵列基底的微孔阵列芯片扫描电镜图;a为以三维微柱阵列为基底的微孔阵列芯片电镜图,b为图a中标记框内的芯片电镜放大图,c为图b中标记框内的芯片电镜放大图;
26.图7为实施例2应用于细胞培养形态分析图;a为mcf-7细胞在无微柱结构的pdms基底(p-pdms)上的形态,b为mcf-7细胞在本发明微柱阵列基底(m-pillar)上的形态;c为mcf-7在无微柱基底和本发明微柱基底上的细胞铺展面积统计结果散点图,d为mcf-7在无微柱基底和本发明微柱基底上的圆度统计结果散点图;标尺表示100μm;
27.图8为实施例3应用于u937巨噬细胞和肿瘤细胞三维共培养的大图扫描及放大显微明场和荧光图;a为共培养的大图扫描明场图,b为图a标记框内的明场放大图,c为微孔内单个u937巨噬细胞荧光图,d为微孔内多个mcf-7细胞荧光图,标尺表示100μm;
28.图9为实施例3应用于细胞三维共培养的细胞分布统计结果;a为u937巨噬细胞在微孔内分布,b为单个u937巨噬细胞的微孔中mcf-7肿瘤细胞数目分布;
29.图10为实施例3应用于细胞三维共培养的细胞活性统计结果;
30.图11为实施例4应用于细胞多指标分泌蛋白检测及其统计结果;a为本发明三维微柱阵列基底和无微柱基底的微孔阵列pdms芯片上有mcf-7肿瘤或无mcf-7肿瘤共培养的tnf-a分泌率变化图,b为本发明三维微柱阵列基底和无微柱基底的微孔阵列pdms芯片上有mcf-7肿瘤或无mcf-7肿瘤共培养的il-6分泌率变化图;
31.图12为实施例4应用于细胞三维共培养中,肿瘤不同微环境对u937巨噬细胞的蛋白分泌影响;a为随mcf-7细胞比例增加单个u937巨噬细胞的tnf-a分泌率变化图,b为随mcf-7细胞比例增加单个u937巨噬细胞的il-6分泌率变化图;
32.图13为本发明生物分析芯片立体结构图;
33.图中,1.生物分析基底,2.三维微柱阵列基底的微孔阵列芯片,3.基底,4.微孔阵列穿孔膜,5.夹具,6.三维微柱阵列硅模板,7.微孔阵列穿孔膜硅模板,8微孔阵列穿孔膜的微孔。
具体实施方式
34.以下结合具体实施例对本发明作进一步说明,但不以任何方式限制本发明。
35.实施例1
36.一种三维基底上细胞共培养的多指标生物分析芯片,如图1-4所示。该芯片分为三层,包括从上往下的生物分析基底1,三维微柱阵列基底3和微孔阵列穿孔膜4。其中,微孔阵列穿孔膜4与三维微柱阵列基底3构成了三维微柱基底的微孔阵列芯片2,将微孔阵列穿孔膜4与三维微柱阵列基底3对齐、平铺,得到以三维微柱阵列为基底的三维微孔阵列芯片2。微孔阵列穿孔膜的微孔8与基底3形成的空腔为细胞三维培养提供微室空间,微孔阵列穿孔膜连接上层生物分析基底。
37.优选地,所述三维微柱基底的微孔阵列芯片2为pdms三维微柱基底的微孔阵列芯片。
38.三维微柱阵列基底的微孔阵列芯片通过mems技术和软光刻方法制作,如图4所示,具体包括以下步骤:
39.步骤一,将pdms前驱体a胶和交联剂b胶按质量比10:1混合,搅拌均匀,放于真空干燥器,利用负压真空泵抽气至无气泡;
40.步骤二,将pdms胶倒在微柱阵列硅模板6上,待pdms胶均匀铺满整个模板时,放于烘箱中,75℃,固化1h,得到pdms三维微柱阵列基底3;微柱阵列硅模板6上突起的微池为圆形,直径5μm,高度约为500nm,微池与微池的中心的距离为10μm;
41.步骤三,将pdms胶倒在微孔阵列穿孔膜硅模板7上,1400rpm 60s匀胶,75℃,固化1h,得到pdms微孔阵列穿孔膜4。所述硅模板7包含7
×
13个正方形单元,每个正方形单元由10
×
10的正方形微柱组成,微柱边长为100μm,高度约为150μm,每两个相邻的微柱中心的距离为200μm,每相邻的正方形单元中心距离为3.0mm;
42.步骤四,将三维微柱阵列pdms基底和微孔阵列穿孔膜,分别从模板上剥离,微孔阵列穿孔膜与三维微柱阵列pdms基底沿边对齐,平铺。得到三维微柱阵列为基底的微孔阵列
pdms芯片2。
43.制备得到的芯片如图5-6所示,图5a为pdms微柱阵列的10倍明场显微图,b为图a标注区域的40倍明场放大图。标尺:50μm。图5证明制作的微柱呈均一的阵列分布,图6说明得到了以三维微柱阵列为基底的微孔阵列pdms芯片,微孔阵列穿孔膜为细胞培养提供了充足的微室空间。
44.实施例2
45.本实施例中的芯片应用于三维微柱阵列基底上细胞培养,利用人乳腺肿瘤细胞(mcf-7)培养在三维微柱阵列pdms基底(m-pillar)与二维无微柱的pdms基底(p-pdms)上。具体包括以下步骤:
46.步骤一:分别准备一块三维微柱阵列基底pdms和无微柱的pdms芯片,三维微柱阵列基底pdms制作过程如实施例1,芯片用plasma亲水处理1min;
47.步骤二:将以上两种细胞以5
×
104cells/ml,200μl/well分别接种在三维微柱阵列基底pdms芯片和无微柱的pdms芯片上;
48.步骤三:37℃,5%co2培养箱中培养24h;细胞用钙黄绿素(calcein-am)染色30min,弃去染色剂,用pbs洗3次;
49.步骤四:显微镜明场、荧光拍照,记录细胞形态。
50.本实例结果见图7,结果表明与无微柱阵列的pdms基底相比,三维微柱阵列基底上mcf-7细胞的铺展面积较小,且细胞形态趋于圆形。
51.实施例3
52.本实施例中的芯片应用于细胞三维共培养,该芯片结构如图1-4所示,该芯片包括三层结构,从上往下依次为生物分析基底1,三维微柱基底的微孔阵列芯片2包括中层微孔阵列穿孔膜3和下层三维微柱阵列基底4,微孔阵列芯片通过将微孔穿孔膜平铺于微柱阵列基底上完成的。
53.所述生物分析芯片2为三维微柱基底的微孔阵列pdms芯片。
54.本实施例中三维微柱基底的微孔阵列pdms芯片,采用mems技术和软光刻方法制作完成,制作步骤和实物图如图4-图6所示,具体步骤如实例1:
55.本实施例中的芯片用于pma分化的u937巨噬细胞与mcf-7细胞三维共培养,包括以下步骤:
56.步骤一:三维微柱基底的微孔阵列pdms芯片plasma亲水处理2min;
57.步骤二:将钙黄绿素标记的u937巨噬细胞(1
×
104cells/ml)和mcf-7肿瘤细胞(1
×
105cells/ml)按1:1体积比接种于芯片中;
58.步骤三:37℃,5%co2培养箱中培养16h;
59.步骤四:显微镜明场、荧光大图扫描拍照,记录细胞在孔内分布。
60.本实施例结果如图8-图10所示,结果表明此芯片中实现了细胞三维共培养,孔内u937巨噬细胞及mcf-7肿瘤细胞呈高斯分布。孔内具有单个u937巨噬细胞孔内的mcf-7数目不同,为提供了不同肿瘤微环境,且培养16h后细胞保持良好活性,可用于后续的多指标检测和分析。
61.实施例4
62.本实施例中的芯片应用于细胞三维共培养下的多指标生物分子分析,这里用于检
测两种分泌蛋白。该芯片结构如实施例1所述,细胞接种具体步骤如实施例3所述。
63.所述生物分析基底是修饰了抗体的多聚赖氨酸玻片。
64.本实施例中三维微柱为基底的pdms微孔阵列芯片,采用mems技术和软光刻方法制作完成,如图1-4所示,具体步骤如实例1:
65.本实施例中的芯片应用于u937巨噬细胞单个细胞与mcf-7三维共培养的多种分泌蛋白分析,具体包括以下步骤:
66.步骤一:多聚赖氨酸玻片(生物分析基底)包被tnf-a、il-6抗体;
67.步骤二:三维微柱阵列基底和无微柱阵列基底的微孔阵列芯片plasma亲水处理2min;
68.步骤三:将钙黄绿素标记的u937巨噬细胞(1
×
104cells/ml)和mcf-7(1
×
105cells/ml)按1:1体积比接种于芯片上;
69.步骤四:37℃,5%co2培养箱中培养3h;
70.步骤五:加盖步骤一获得的生物分析基底,夹具固定,培养箱培养12h;
71.步骤六:显微镜明场、荧光大图扫描拍照;
72.步骤七:卸下夹具,玻片进行后续elisa检测,扫描仪扫描玻片,记录分泌蛋白信号。本实施例结果如图11-图12所示,结果表明三维基底抑制了u937巨噬细胞单个细胞tnf-a分泌,而il-6分泌稍有增加。此外,mcf-7肿瘤微环境对tnf-a和il-6分泌调节不同,即mcf-7肿瘤微环境抑制了tnf-a分泌,而il-6分泌率无明显变化。
73.对于任何熟悉本领域的技术人员而言,在不脱离本发明技术方案范围情况下,都可利用上述揭示的技术内容对本发明技术方案作出许多可能的变动和修饰,或修改为等同变化的等效实施例。因此,凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所做的任何简单修改、等同变化及修饰,均应仍属于本发明技术方案保护的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1