用于评估肝细胞癌早期复发风险的lncRNA、评估方法及装置
文档序号:26141165发布日期:2021-08-03 14:25阅读:150来源:国知局
导航: X技术> 最新专利>有机化合物处理,合成应用技术
本发明涉及医学领域,具体涉及用于评估肝细胞癌早期复发风险的lncrna、评估方法及装置。
背景技术:
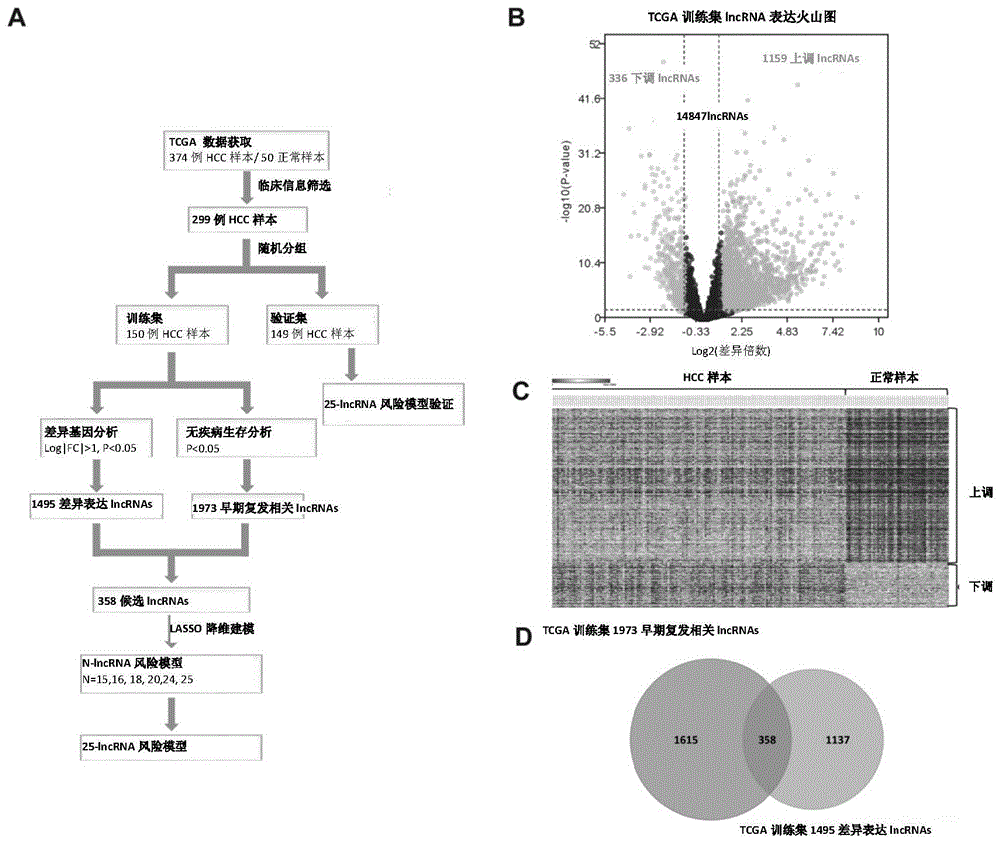
:最新癌症流行病学数据显示,世界范围内肝癌发病率在所有癌症中处于第六位,致死率则处于第四位。我国作为肝病大国,承担了全球一半的肝癌新生及死亡病例。原发性肝癌中,肝细胞癌(hepatocellularcarcinoma,hcc)占比高达75-85%,临床上hcc的治愈手段主要包括三种:肝移植、消融及肝切,肝切仍是目前肝癌治疗的主要手段。目前肝切后五年生存率可达50%,但有高达70%的hcc患者在肝切后发生复发。临床上将hcc术后2年内复发定义为早期复发,术后2年后复发定义为晚期复发。有研究表明,我国hcc患者术后1年及2年复发率分别高达38.7%及57.9%。此外,hcc早期复发患者的1、3、5年生存率分别为63.7%、25.7%、4.5%,显著低于晚期复发患者的81.5%、61.9%、27.1%。由此可见,hcc患者术后早期复发率极高且对患者的长期生存影响极大。目前,临床上普遍采用的肿瘤患者评估系统包括美国癌症联合委员会(ajcc,americanjointcommitteeoncancer)提出的tnm分期系统,巴塞罗那分期(barcelonacliniclivercancer)和意大利肝癌(clip,canceroftheliveritalianprogram)分期系统。这些分期系统多关注于hcc患者的临床特征,而忽略了hcc样本中复杂和重要的分子病原机制,因此对于hcc早期复发的预判效果不佳。此外,临床上多采用检测肝癌血清学分子标记物血清甲胎蛋白(alpha-fetoprotein,afp)结合影像学手段,对术后hcc患者进行定期监测,以期做到对可能的术后复发实现早期检出。但鉴于现有的血清afp水平对hcc诊断的特异性和准确性不高,而影像学手段对早期hcc诊断的敏感性偏低,导致目前对hcc术后复发的早期检出率差强人意。迄今为止,仍未有成熟的hcc早期复发风险模型应用于临床。如能够建立新的有效的针对hcc术后早期复发的方法,或能对hcc患者术后早期复发做出预判,指导hcc患者术后治疗及随访,进而提高hcc患者的生存率。因此,本领域迫切需要能够对hcc患者早期复发风险进行更为准确评估的标志物、评估方法和装置。技术实现要素:本发明的目的是提供一种对hcc患者早期复发风险进行更为准确评估的标志物、评估方法和装置。本发明第一方面,提供了一种lncrna、其cdna、或其检测试剂的用途,用于制备一诊断试剂或试剂盒,所述诊断试剂或试剂盒用于评估某一对象hcc早期复发风险;其中,所述的lncrna选自下组:(a’)复发风险增加型标志物,其选自下组的任一lncrna、或其组合:(a1)ensg00000253406;(a5)ensg00000268201;(a7)ensg00000234129;(a8)ensg00000272205;(a11)ensg00000255980;(a12)ensg00000269894;(a13)ensg00000275437;(a15)ensg00000254333;(a16)ensg00000176912;(a17)ensg00000267905;(a18)ensg00000275223;(a19)ensg00000269974;(b’)复发风险下降型标志物,其选自下组的任一lncrna、或其组合:(b2)ensg00000259834;(b3)ensg00000234283;(b5)ensg00000231246;(b6)ensg00000273837;(c’)选自上述(a’)组中的一个或多个lncrna与选自上述(b’)组中的一个或多个lncrna所构成的组合。在另一优选例中,所述的lncrna包括:(a’)选自a1、a5、a7、a8、a11、a12和a13的任一lncrna、或其组合;(b’)选自b2和b3任一lncrna、或其组合;(c’)a1、a5、a7、a8、a11、a12和a13中一个或多个lncrna与b2和b3一个或多个lncrna所构成的组合。在另一优选例中,所述lncrna还包括选自下组的lncrna:(a”)复发风险增加型标志物,其选自下组的任一lncrna、或其组合:(a2)ensg00000247675;(a3)ensg00000231918;(a4)ensg00000248596;(a6)ensg00000223392;(a9)ensg00000236366;(a10)ensg00000232079;(a14);ensg00000253417;(b”)复发风险下降型标志物,其选自下组的任一lncrna、或其组合:(b1)ensg00000254887;(b4)ensg00000259974;(c”)选自上述(a”)组中的一个或多个lncrna与选自上述(b”)组中的一个或多个lncrna所构成的组合。在另一优选例中,所述lncrna选自下组:a1、b2、b3、a5、b5、a7、a8、a11,或其组合。在另一优选例中,所述lncrna还包括选自下组:b1、a2、a3、a4、b6、a6,或其组合。在另一优选例中,所述检测试剂包括:特异性扩增所述lncrna或cdna的引物或引物对、探针或芯片(如核酸芯片)。在另一优选例中,所述的诊断包括早期诊断、辅助性诊断、或其组合。在另一优选例中,所述的对象为人。在另一优选例中,所述的对象为经治疗或未经治疗的hcc患者;较佳地,为经治疗的hcc患者。在另一优选例中,所述检测是针对离体样本的检测。在另一优选例中,所述的离体样本包括:血液样本、血清样本、组织样本、体液样本或其组合。在另一优选例中,所述的检测试剂偶联有或带有可检测标记。在另一优选例中,所述可检测标记选自下组:生色团、化学发光基团、荧光团、同位素或酶。在另一优选例中,所述的样本为分离自外周血的单个核细胞样本。在另一优选例中,所述检测是检测外周血的单个核细胞中表a和/或表b中所示的任一lncrna的表达量。在另一优选例中,所述诊断试剂包括引物、探针、测序文库或核酸芯片(如rna芯片)。在另一优选例中,所述的核酸芯片包括基片和点样在基片上的特异性寡核苷酸探针,所述的特异性寡核苷酸探针包括与任一所述的lncrna的多核苷酸特异性结合的探针。在另一优选例中,当满足以下条件时,则提示所述对象为hcc早期复发风险高者:(i)当所述的lncrna属于a组(a’组或a”组),且所述lncrna的表达水平高于参考值或标准值时;和/或(ii)当所述的lncrna属于b组(b’组或b”组),且所述lncrna的表达水平低于参考值或标准值时。在另一优选例中,所述lncrna包括了a1。在另一优选例中,所述lncrna包括了a1、a5和a7。在另一优选例中,所述的lncrna包括了a’组中n个lncrna所构成的组合,其中,n为2-12的任一正整数(即2、3、4、5、6、7、8、9、10、11、12)。在另一优选例中,所述的lncrna还包括a”组中n个lncrna所构成的组合,其中,n为2-7的任一正整数(即2、3、4、5、6、7)。在另一优选例中,所述lncrna还包括了a2、a3和a4。在另一优选例中,所述的lncrna包括了b’组中n个lncrna所构成的组合,其中,n为2-4的任一正整数(即2、3、4)。在另一优选例中,所述的lncrna包括了b1和b2。在另一优选例中,所述的lncrna包括了b2、b3。在另一优选例中,所述的lncrna包括了b2、b3和b5中任一lncrna或其组合。在另一优选例中,所述的lncrna还包括了b1和b4中任一lncrna或其组合。在另一优选例中,所述的试剂为pcr引物对。本发明第二方面,提供了一种试剂盒,所述试剂盒含有一检测试剂,所述检测试剂用于检测选自下组的lncrna和/或其cdna:(a)选自a’组的任一lncrna、或其组合;(b)选自b’组的任一lncrna、或其组合;(c)a’组中一个或多个lncrna与b’组中一个或多个lncrna所构成的组合。在另一优选例中,所述lncrna还包括选自下组的lncrna:选自a”组的任一lncrna、或其组合;选自b”组的任一lncrna、或其组合;a”组中一个或多个lncrna与b”组中一个或多个lncrna所构成的组合。在另一优选例中,所述的试剂盒含有所述lncrna和/或其cdna作为对照品或质控品。在另一优选例中,所述的试剂盒还包括标签或说明书,所述标签或说明书注明所述试剂盒用于评估某一对象hcc早期复发风险。在另一优选例中,所述的试剂为pcr引物对。在另一优选例中,所述的标签或说明书中注明以下内容:如果检测对象的所述的lncrna检测结果满足以下条件时,则提示所述对象hcc早期复发风险高:(i)当所述的lncrna属于a组,且所述lncrna的表达水平高于参考值或标准值时;和/或(ii)当所述的lncrna属于b组,且所述lncrna的表达水平低于参考值或标准值时。本发明第三方面,提供了一种检测方法,包括步骤:(a)提供一检测样本,所述检测样本为血液样本或组织样本(如手术中切下的肝癌组织);(b)检测所述检测样本中lncrna的表达量,记为c1;和(c)将所述lncrna的浓度c1与参考值c0进行比较,其中,所述的lncrna选自下组:(a)选自a’组的任一lncrna、或其组合;(b)选自b’组的任一lncrna、或其组合;(c)a’组中一个或多个lncrna与b’组中一个或多个lncrna所构成的组合;如果检测对象的lncrna的检测结果满足以下条件时,则提示所述对象hcc早期复发风险高:(i)当所述的lncrna属于a组,且所述lncrna的表达水平高于参考值或标准值c0时;和/或(ii)当所述的lncrna属于b组,且所述lncrna的表达水平低于参考值或标准值c0时。在另一优选例中,所述lncrna还包括选自下组的lncrna:选自a”组的任一lncrna、或其组合;选自b”组的任一lncrna、或其组合;a”组中一个或多个lncrna与b”组中一个或多个lncrna所构成的组合。在另一优选例中,所述的参考值c0为经治疗的hcc患者且早期(治愈后1年内或两年内)无复发人群中相同样本中的所述lncrna的浓度。在另一优选例中,所述的参考值c0为正常人群中相同样本中的所述lncrna的浓度。本发明第四方面,提供了一种对经治疗的hcc患者进行分型的方法,包括步骤:(a)提供一来自待测对象的检测样本,所述检测样本为血液样本或组织样本(如手术中切下的肝癌组织);(b)检测所述检测样本中lncrna的表达量,记为c1;和(c)将所述lncrna的浓度c1与参考值c0进行比较,如果检测对象的lncrna的检测结果满足以下条件时,则提示所述对象为hcc早期复发风险高的对象:(i)当所述的lncrna属于a组,且所述lncrna的表达水平高于参考值或标准值c0时;和/或(ii)当所述的lncrna属于b组,且所述lncrna的表达水平低于参考值或标准值c0时;其中,所述的lncrna选自下组:(a)选自a’组的任一lncrna、或其组合;(b)选自b’组的任一lncrna、或其组合;(c)a’组中一个或多个lncrna与b’组中一个或多个lncrna所构成的组合。在另一优选例中,所述lncrna还包括选自下组的lncrna:选自a”组的任一lncrna、或其组合;选自b”组的任一lncrna、或其组合;a”组中一个或多个lncrna与b”组中一个或多个lncrna所构成的组合。在另一优选例中,所述方法还包括与选自下组的方法组合使用:血清甲胎蛋白(afp)检测、血管侵袭性评价、tnm分期系统,或其组合。在另一优选例中,所述方法还包括与血清甲胎蛋白(afp)检测、血管侵袭性评价和tnm分期系统组合使用。本发明第五方面,提供了一种lncrna的用途,用于评估某一对象hcc早期复发风险;其中,所述的lncrna选自下组:(a)选自a’组的任一lncrna、或其组合;(b)选自b’组的任一lncrna、或其组合;(c)a’组中一个或多个lncrna与b’组中一个或多个lncrna所构成的组合。在另一优选例中,所述lncrna还包括选自下组的lncrna:选自a”组的任一lncrna、或其组合;选自b”组的任一lncrna、或其组合;a”组中一个或多个lncrna与b”组中一个或多个lncrna所构成的组合。在本发明的第六方面,提供了一种用于对经治疗的hcc患者进行分型的标志物集合(set),所述的标志物集合包括选自下组的lncrna:(a)选自a’组的任一lncrna、或其组合;(b)选自b’组的任一lncrna、或其组合;(c)a’组中一个或多个lncrna与b’组中一个或多个lncrna所构成的组合。在另一优选例中,所述标志物集合还包括选自下组的lncrna:选自a”组的任一lncrna、或其组合;选自b”组的任一lncrna、或其组合;a”组中一个或多个lncrna与b”组中一个或多个lncrna所构成的组合。在另一优选例中,所述标志物集合包括选自下组的lncrna:a1、b1、b2、a2、b3、a3、a4、a5、a6、a7、a8、a9、b4,或其组合。在另一优选例中,所述标志物集合包括选自下组的lncrna:a1、b1、b2、a2、b3、a3,或其组合。在另一优选例中,所述标志物集合包括了a1。在另一优选例中,所述标志物集合包括了a1、a5和a7。在另一优选例中,所述的标志物集合包括了a’组中n个lncrna所构成的组合,其中,n为2-12的任一正整数(即2、3、4、5、6、7、8、9、10、11、12)。在另一优选例中,所述的标志物集合还包括a”组中n个lncrna所构成的组合,其中,n为2-7的任一正整数(即2、3、4、5、6、7)。在另一优选例中,所述标志物集合还包括了a2、a3和a4。在另一优选例中,所述的标志物集合包括了b’组中n个lncrna所构成的组合,其中,n为2-4的任一正整数(即2、3、4)。在另一优选例中,所述的标志物集合包括了b1和b2。在另一优选例中,所述的标志物集合包括了b2、b3。在另一优选例中,所述的标志物集合包括了b2、b3和b5中任一lncrna或其组合。在另一优选例中,所述的标志物集合还包括了b1和b4中任一lncrna或其组合。本发明第七方面,提供了一种用于对hcc患者进行分型的装置,包括:(p1)输入单元,所述输入单元用于输入某一对象的hcc复发特异性lncrna标志物表达水平的数据(即输入hcc复发特异性lncrna标志物),其中所述的hcc复发特异性lncrna标志物包括选自表a和/或表b的n个lncrna,其中n为正整数;(p2)数据处理单元,所述数据处理单元对输入的lncrna表达水平的数据进行处理,从而获得该对象的hcc复发风险评分s1;(p3)分型单元,所述的分型单元被配置为将所述对象的hcc复发风险评分s1,与复发风险评分阈值s0进行比较,从而对所述对象进行分型并获得分型结果;其中,如果s1≥s0时,则所述分型单元将所述对象定为hcc复发高风险者;如果s1<s0时,则所述分型单元将所述对象定为hcc复发低风险者;和(p4)输出单元,所述的输出设备用于输出所述的分型结果。在另一优选例中,所述的n≥2。在另一优选例中,所述的hcc复发风险评分s按公式q1进行计算:其中,w为lncrna权重系数;e为lncrna表达水平;n为lncrna的数量,且n为≥1正整数。在另一优选例中,所述的权重系数为表a或表b中对应于各lncrna的权重系数。在另一优选例中,所述的e为相对表达水平(如0、1;或-1,0,1;或按10分或5分进行打分的相对表达水平)或绝对表达水平。应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。附图说明图1显示了建模过程及候选lncrnas的筛选;其中,a)lncrna风险模型构建流程;b)训练集中lncrnas表达的火山图,差异表达基因中1159挑lncrnas在hcc中表达上调,336条lncrna在hcc中表达下调;c)1495条差异表达lncrnas在150例hcc样本和50例健康样本中的表达热图;d)差异表达的lncrnas和肝细胞癌早期复发相关lncrnas的韦恩图,共获得358在肝细胞癌中差异表达且有预后价值的lncrnas。图2显示了训练集中25-lncrna风险模型与hcc早期复发的相关性;其中,a)按照风险得分中位数为临界值将训练集150例患者分为低风险组(150例)和高风险组(150例),并按照他们的风险得分从大到小排列;b)训练集150例患者的25条lncrnas表达谱热图,19条危险lncrnas在高风险组中富集,6条保护lncrnas在低风险组中富集;c)训练集中,1年内复发和2年内复发的患者中分别有81.25%和76.06%的患者属于高风险组,18.72%和23.94%的患者属于低风险组。图3显示了验证集和全集中25-lncrna风险模型与hcc早期复发的相关性;其中,a)采用相同的风险得分阈值,将验证集患者也分为高风险组(80例)和低风险组(69例);b)验证集149例患者的25条lncrnas表达谱热图,19条危险lncrnas在高风险组中富集,6条保护lncrnas在低风险组中富集;c)验证集中,1年内复发和2年内复发的患者中分别有63.01%和69.09%的患者属于高风险组,36.99%和30.91%的患者属于低风险组;d)采用相同的风险得分阈值,将验证集患者也分为高风险组(155例)和低风险组(144例);e)全集299例患者的25条lncrnas表达谱热图,19条危险lncrnas在高风险组中富集,6条保护lncrnas在低风险组中富集;f)全集中,1年内复发和2年内复发的患者中分别有74.46%和69.44%的患者属于高风险组,25,24%和30.56%的患者属于低风险组;g)和h)全集高风险组患者的风险得分和g)1年无瘤生存期或h)的相关性分析,均呈负相关。图4显示了25-lncrna风险模型的hcc早期复发生存曲线分析;其中,a-c)25-lncrna风险模型与2年无瘤生存期的生存分析,其中(a)训练集(150例,p<0.0001),(b)验证集(149例,p<0.0001),(c)全集(299例,p<0.0001);高风险组的hcc患者具有更短的2年无疾病生存期;d)全集中2年复发和2年无复发患者的风险得分比较,2年内复发患者的风险得分显著高于2年内无复发患者(299例,p<0.0001)。图5显示了25-lncrna风险模型与afp、tnm分期和血管侵袭对hcc早期复发的预测效果的roc分析;其中,a-b)在全集中采用roc分析比较25-lncrna风险模型、tnm分期、血管侵袭和afp在1年无瘤生存期(a)和2年无瘤生存期(b)的预测效果;c-d)在全集中采用roc分析比较25-lncrna风险模型与tnm分期、血管侵袭和afp联用与25-lncrna风险模型单独使用在1年无瘤生存期(c)和2年无瘤生存期(d)的预测效果。rs:25-lncrna风险模型的风险得分,vi:血管侵袭。具体实施方式本发明人经过广泛而深入的研究,通过大量筛选和测试,提供了用于预测肝细胞癌早期复发风险的lncrna及基于其的预测方法和装置。具体地,本发明提供了将hcc患者分为早期复发高风险者和早期复发低风险者,从而为早期复发高风险者的术后病情监测策略制定提供依据,以及早采取措施,延长其生存期。在此基础上完成了本发明。术语除非另有定义,否则本文中所用的全部技术术语和科学术语均具有如本发明所属领域普通技术人员通常理解的相同含义。如本文所用,术语“含有”或“包括(包含)”可以是开放式、半封闭式和封闭式的。换言之,所述术语也包括“基本上由…构成”、或“由…构成”。本文中使用的术语“样品”或“样本”是指与受试者特异地相关联的材料,从其中可以确定、计算或推断出与受试者有关的特定信息。样本可以全部或部分由来自受试者的生物材料构成。如本文所用,术语“a’”、“(a’)”、“(a’)组”、“a’组”可互换使用;术语“b’”、“(b’)”、“(b’)组”、“b’组”可互换使用。如本文所用,术语“表达”包括lncrna从基因或基因部分的产生。如本文所用,术语“表达量”、“表达水平”、“表达值”可互换使用,指某一物质(如lncrna)在单位体积或单位质量生物组织内的表达量,可用如体积浓度、质量浓度等表示。如本发明所以,术语“经治疗的hcc患者”指曾患有肝细胞癌但经治疗后实现无瘤生存(freesurvivor)的对象。其中,所述“经治疗”可以是(包括但并不限于)通过手术、化疗、放疗、免疫疗法等任意治疗方法治疗。如本文所用,术语“参比值”或“参考值”、“标准值”是指当与分析结果相比时与特定结果统计学相关的值。在优选的实施方案中,参比值是根据对比较对本发明的lncrna的表达,并进行统计学分析来确定的。在本文的实施例部分中显示了一些这样的研究。但是,来自文献的研究和本文公开的方法的用户经验也可用于生产或调整参比值。参比值也可以通过考虑与患者的医疗史、遗传学、年龄和其它因素特别相关的情况和结果来确定。hcc早期复发风险预测标志物如本文所用,术语“本发明的hcc早期复发风险预测标志物”指hcc早期复发相关的lncrna,优选地,包括复发风险增加型标志物和复发风险下降型标志物。在本发明中,所述复发风险增加型标志物选自a1~a19(表a)中的一种或多种。在本发明中,所述复发风险下降型标志物选自b1~b6(表b)中的一种或多种。表a.a1~a19的hcc早期复发风险预测标志物序号lncrna权重系数a1ensg000002534061.878a2ensg000002476750.567a3ensg000002319180.339a4ensg000002485960.335a5ensg000002682010.330a6ensg000002233920.278a7ensg000002341290.272a8ensg000002722050.233a9ensg000002363660.232a10ensg000002320790.142a11ensg000002559800.125a12ensg000002698940.092a13ensg000002754370.083a14ensg000002534170.069a15ensg000002543330.044a16ensg000001769120.038a17ensg000002679050.032a18ensg000002752230.024a19ensg000002699740.007表b.b1-b6的hcc早期复发风险预测标志物检测方法基于本发明的hcc早期复发风险预测标志物在组织样本或血液样本中差异表达,本发明还提供了相应的评估某一对象hcc早期复发风险的方法。本发明涉及定量和定位检测人lncrna水平的诊断试验方法。这些试验是本领域所熟知的。试验中所检测的上述人lncrna水平,可以用于评估(包括辅助评估)检测对象hcc早期复发风险高或低。一种优选的方法是对lncrna或cdna,进行pcr进行定量检测。一种优选的方法是对lncrna或cdna,测序进行定量检测。lncrna的多核苷酸可用于hcc早期复发风险的诊断。本发明的多核苷酸的一部分或全部可作为探针固定在微阵列或芯片上,用于分析lncrna的差异表达分析和诊断。检测试剂盒基于本发明的hcc早期复发风险预测标志物与hcc早期复发风险的相关性,因此本发明的hcc早期复发风险预测标志物可以作为hcc早期复发风险的评估标志物。本发明还提供了一种评估hcc早期复发风险的试剂盒,所述的试剂盒含有一检测试剂,所述检测试剂用于检测本发明的hcc早期复发风险的lncrna和cdna或其组合。优选地,所述试剂盒含有本发明的hcc早期复发风险预测标志物(lncrna)或其cdna的引物或引物对、探针或芯片。在另一优选例中,所述的试剂盒还包括标签或说明书。典型地,可用于肝细胞癌数据的获取来源(包括但不限于):癌症基因组图谱(thecancergenomeatlas,tcga)数据库、geo数据库、临床样本测序数据。可用于进行基因差异表达分析的工具(包括但不限于):r语言中的“edger”包、deseq2、voom、rots。可用于进行风险模型构建的方法(包括但不限于):lasso回归分析、cox比例风险模型,支持向量方法(svm)。可用于进行受试者工作特征曲线分析(roc)的软件(包括但不限于):medcalc、spss、graphpadprism。可用于进行单因素和多因素分析的其它软件(包括但不限于):spss。进行生存分析的其它软件:spss,graphpadprism。如本文所用,术语“tcga数据库”中tcga(thecancergenomeatlasprogram)即癌症基因组图谱计划。目前收录了来自20000个病人,33个癌症的数据。包括了基因组,转录组,表观遗传,蛋白组等各个组学数据,以及临床样本信息。如本文所用,术语“lncrna”指长链非编码rna(longnon-codingrnas,lncrnas),是一类长度在200个核苷酸以上,且不编码蛋白的rna。研究表明,lncrnas可广泛参与细胞的增殖、存活、凋亡和运动等重要生命活动,在个体发育和疾病等过程中发挥重要生理及病理作用。已有研究表明,lncrnas主要通过与细胞内大分子间的相互作用发挥病生理作用。lasso回归分析:lasso(leastabsoluteshrinkageandselectionoperator),是一种回归方法。与常规回归方法不同的是,lasso可以对通过参数缩减对参数进行选择,从而达到降维的目的。lasso回归复杂度调整的程度由参数λ来控制,λ越大对变量较多的线性模型的惩罚力度就越大,从而最终获得一个变量较少的模型。roc分析和auc:受试者工作特征曲线(receiveroperatorcharacteristiccurve,roc曲线),又称为接收者操作特性曲线。roc曲线是以真阳性率(灵敏度)为纵坐标,假阳性率(1-特异度)为横坐标绘制的曲线。其自变量(检验项目)一般为连续性变量,因变量(金标准)一般为二分类变量。roc分析,应用曲线下面积(areaundercurve,auc)这一综合统计量作定量分析,auc介于1.0和0.5之间,auc越接近于1,说明诊断效果越好:auc介于0.5~0.7时有较低准确性;auc介于0.7~0.9时有一定准确性;auc在0.9以上时有较高准确性;auc=0.5时,说明诊断方法完全不起作用,无诊断价值。生存分析:生存分析指的是一系列用来探究所感兴趣的事件的发生的时间的统计方法。常用于癌症患者生存时间分析或工程中的失败时间分析等。生存概率也叫作生存方程s(t)=pr(t>t),生存方程指的是实例出现感兴趣的事件的时间t不小于给定的时间t的概率。在本发明中,本发明人通过使用hcc患者的基因组数据,筛选出了25个与hcc早期复发具有相关性的长链非编码rna和基于上述长链非编码rna的hcc早期复发风险预测模型,并识别出hcc患者术后早期复发的高风险者和低风险者,为hcc患者术后病情监测策略制定提供依据,从而使患者受益。本发明的主要优点包括:1)本发明提供了一组与hcc早期复发具有相关性的长链非编码rna,可用于肝细胞癌早期复发预测的长链非编码rna。2)本发明的基于长链非编码rna建立的肝细胞癌早期复发预测的方法(风险模型),其对预测肝细胞癌早期复发效果优于现有的afp、血管侵袭和tnm分期等临床特征(auc=86.7%,具有很好的预测效果);对训练集150例hcc患者进行风险得分计算,1年内复发和2年内复发的患者中分别有81.25%和76.06%的患者落入高风险组,这提示本发明的风险模型能很好的预测患者的hcc早期复发。3)使用本发明复发预测试剂盒和预测方法和装置能独立应用于hcc患者的早期复发预测,筛选出高风险患者,为此类患者的术后病情监测策略制定提供有价值的信息。4)本发明的基于长链非编码rna建立的肝细胞癌早期复发预测的方法(风险模型)和现有afp、血管侵袭和tnm分期等临床特征,对肝细胞癌早期复发预测的效果得到进一步提升。下面结合具体实施,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。实施例1实验方法1.1数据前处理从癌症基因组图谱(thecancergenomeatlas,tcga)数据库中下载得到肝细胞癌(liverhepatocellularcarcinoma,lihc)患者临床信息和转录组信息。去除缺少总生存信息和无瘤生存信息的数据后一共得到299例hcc患者。将这299例患者随机分为测试集和验证集。用gencodev30对转录组信息进行注释,得到这些患者肝癌组织的长链非编码rna(lncrna,longnon-codingrna)表达谱。1.2生物信息学分析用r语言中的“edger”包对训练集中150例hcc患者和tcga数据库中50例正常肝组织的lncrna表达谱进行差异基因表达分析。用r语言中的“survival”包对训练集中150例hcc患者的lncrna表达谱结合2年无瘤生存进行批量生存分析。用funrich软件对上述分析得到的两组lncrnas作韦恩图,得到与hcc早期复发相关的候选lncrnas列表。用r语言的“glmnet”包对对候选lncrnas进行lasso(leastabsoluteshrinkageandselectionoperator)降维分析,并用r语言的“proc”包进行受试者工作特征曲线(rocreceiveroperatingcharacteristiccurve)分析,选取曲线下方面积(auc,areaundercurve)最大的一组lncrnas构建风险模型。基于所构建的风险模型,对训练集中150例hcc患者进行风险得分计算,并以中位数为临界值,将150例患者分为低风险组和高风险组。在训练集、验证集和总集的hcc患者中用r语言的“survival”包对这种分组方式进行生存分析。并在总集中用r语言的“survival”包对风险得分和其他hcc危险因素结果无瘤生存期进行单因素和多因素分析,来验证风险模型的独立预测效果。1.3统计学分析用delong's检验比较两条roc曲线的敏感性和特异性,用斯皮尔曼秩相关系数分析两个因素之间的相关性,用log-rank检验比较生存分析中两条曲线是否有差异,用cox比例风险回归模型进行单因素和多因素分析。针对所有分析结果,当p<0.05时认为具有显著差异。1.4实验结果1.4.1数据前处理及候选lncrnas的筛选经过数据清洗和注释,共从tcga获得299例患者的lncrna表达谱及临床信息,以及50例正常肝组织的lncrnas表达谱。随机分为训练集(150例)和验证集(149例)。对训练集150例hcc和50例正常肝组织进行差异表达基因分析一共得到1495个差异表达lncrnas(deglncrnas)。对训练集150例hcc患者的lncrnas表达谱结合2年无瘤生存期进行批量生存分析,共得到1973个与hcc早期复发相关的lncrnas(erlncrnas)。对差异表达lncrnas和早期复发相关lncrnas作韦恩图,获得358个具有早期复发预判价值的候选lncrnas。1.4.2风险模型的构建经过1000次lasso降维分析后,一共得到7个lncrna风险模型,通过受试者特征曲线比较曲线面积大小,选取了面积最大的含有25个lncrnas的组合进行最终的风险模型构建(auc=86.7%,具有很好的预测效果),其中所得的25个lncrnas结果如表1。表1lasso降维分析结果基于上述结果,得到风险得分计算公式:p=w1e1+w2e2+……+w25e25其中,所述e代表lncrna的表达量,w代表lncrna的权重系数,其中,所述incrnas和权重如下表2所示。表2序号lncrna权重系数a1ensg000002534061.878a2ensg000002476750.567a3ensg000002319180.339a4ensg000002485960.335a5ensg000002682010.330a6ensg000002233920.278a7ensg000002341290.272a8ensg000002722050.233a9ensg000002363660.232a10ensg000002320790.142a11ensg000002559800.125a12ensg000002698940.092a13ensg000002754370.083a14ensg000002534170.069a15ensg000002543330.044a16ensg000001769120.038a17ensg000002679050.032a18ensg000002752230.024a19ensg000002699740.007b1ensg00000254887-0.735b2ensg00000259834-0.721b3ensg00000234283-0.459b4ensg00000259974-0.187b5ensg00000231246-0.041b6ensg00000273837-0.025风险模型的25个lncrnas中,有19个(a1~a19)和无瘤生存期负相关,为危险lncrnas;6个lncrnas(b1-b6)和无瘤生存期正相关,为保护lncrnas。1.4.325-lncrna风险模型与hcc早期复发的相关性如图2所示,基于风险模型,对训练集150例hcc患者进行风险得分计算,并取风险得分中位数为临界值将其分为高风险组(75例)和低风险组(75例),19条危险lncrnas在高风险组中富集,6条保护lncrnas在低风险组中富集。1年内复发和2年内复发的患者中分别有81.25%和76.06%的患者属于高风险组,这提示本发明的风险模型能有效的预测患者的hcc早期复发。实施例2验证2.125-lncrna风险模型的验证采用相同的风险得分阈值,将验证集患者也分为高风险组(80例)和低风险组(69例)。如图3所示,19条危险lncrnas在高风险组中富集,6条保护lncrnas在低风险组中富集。1年内复发和2年内复发的患者中分别有63.01%和69.09%的患者属于高风险组。而在所有纳入分析的患者中(299例),19条危险lncrnas在高风险组(155例)中富集,6条保护lncrnas在低风险组(144例)中富集。1年内复发和2年内复发的患者中分别有74.76%和69.44%的患者属于高风险组。在全集的高风险中分析风险得分和无瘤生存期的相关性,发现风险得分和1年及2年无瘤生存期均呈负相关。2.225-lncrna风险模型可以准确预测hcc早期复发如图4所示,生存分析的结果表明,无论在训练集,验证集还是总集中,基于25-lncrna风险模型的风险得分将hcc患者分为高风险组和低风险组,两组患者的生存曲线呈现出显著差异,即高风险组的hcc患者具有更短的2年无疾病生存期。且2年内复发患者的风险得分显著高于2年内无复发患者。实施例325-lncrna是hcc早期复发的独立影响因素在全集hcc患者中,纳入25-lncrna风险模型、性别、年龄、种族、肝硬化、血管侵袭,血清afp和tnm分期,结合无瘤生存期进行单因素和多因素分析。表3全集的hcc早期复发影响因素的单因素和多因素分析(299例)结果如表3,发现本发明的风险模型、血管侵袭、afp和tnm分期是2年无瘤生存期的独立影响因素,风险模型、血管侵袭、afp是1年无瘤生存期的独立影响因素,这提示本发明的25-lncrna能够作为一个独立的模型很好地对hcc的早期复发作出预判。实施例525-lncrna风险模型和afp、tnm分期及血管侵袭联用能够提高预测效果在全集299例hcc患者中比较25-lncrna风险模型与afp、tnm分期和血管侵袭对hcc早期复发的预测效果。如图5所示,25-lncrna的受试者特征曲线的面积高于其他三者。而将上述四个hcc早期复发独立影响因素联合使用,与25-lncrna单独使用相比,风险模型对早期复发的预测得到进一步提高,受试者特征曲线的面积均超过75%。讨论综上所述,使用本发明筛选的lncrnas,构建的lncrnas的风险模型,可用于hcc早期复发的准确预测。基于风险模型的风险得分计算公式,计算每例hcc患者的风险得分,可将hcc患者分为高风险组和低风险组。经过验证,高风险组的1年和2年复发显著高于低风险组,在高风险患者中,风险得分和无瘤生存期呈负相关。本发明的lncrna风险模型是hcc早期复发的独立影响因素,能够很好预测hcc患者的早期复发,且效果优于afp、血管侵袭和tnm分期,本发明lncrna构建的风险模型具有良好的hcc早期复发预测效果,能独立应用于hcc患者的早期复发预测,筛选出高风险患者,为此类患者的术后病情监测策略制定提供有价值的信息。进一步地,将本发明的风险模型与afp、血管侵袭和tnm分期进行四者联用,对hcc患者早期复发的预测效果得到进一步提高。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页12
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:邬海龙;傅怡;韩秋琴;乐佳美
- 技术所有人:上海健康医学院
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、薛老师:1.CRISPR-Cas系统 2.基因编辑 3.基因修复 4.天然产物合成 5.单分子技术开发与应用
- 2、张老师:1.探索新型氧化还原酶结构-功能关系,电催化反应机制 2.酶电催化导向的酶分子改造 3.纳米材料、生物功能多肽对酶-电极体系的影响4. 生物电化学传感和生物电合成体系的设计与应用。
- 3、豆老师:1.环境纳米材料及挥发性有机化合物(VOCs) 2.CO污染物的催化氧化 3.低温等离子体 4.吸脱附等控制技术
- 4、赵老师:1.高分子材料改性及加工技术 2.微孔及过滤材料 3.环境友好高分子材料
- 5、邬老师:1.高分子材料的共混与复合 2.涉及材料功能化及结构与性能的研究; 高分子热稳定剂的研发
- 如您是高校老师,可以点此联系我们加入专家库。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
精彩留言,会给你点赞!
专利分类正在加载中....