一种牛源抗金黄色葡萄球菌的单链抗体及其制备和应用的制作方法
本发明涉及牛源抗体药物领域,尤其涉及一种牛源抗金黄色葡萄球菌(简称金葡菌)的单链抗体及其制备和应用。
背景技术:
单链抗体是一种基因工程抗体,通过dna重组技术将抗体轻链可变区vl和重链可变区vh通过一段连接短肽linker首尾连接而成,是保留完整抗原结合部位的最小功能片段。单链抗体的表达形式主要有融合表达,胞内表达和分泌表达三种形式。和完整抗体相比,单链抗体具有以下优点:1)分子量小,大小仅为完整抗体的六分之一,免疫原性较低;2)组织穿透力强,容易进入实体瘤周围的微循环;3)血液清除快,肾脏蓄积很少;4)无fc段,非特异结合低;5)易于通过基因工程大量生产;6)易于基因操作,更易构建重组免疫毒素。
奶牛乳腺炎是影响奶牛业发展,给乳品生产造成巨大损失的一种常见多发病。引起奶牛乳腺炎的致病菌很多,其中金黄色葡萄球菌是最重要的致病菌之一,发病率达到了50%以上,导致严重的经济损失。因为金黄色葡萄球菌具有传染性,且治疗用的抗生素易产生耐药性,所以很难彻底治愈。目前针对金黄色葡萄球菌全菌和多种毒力因子的疫苗也用于奶牛乳腺炎的预防,但是效果均不理想。单链抗体等基因工程抗体,以其独特的抗病毒和抗细菌作用及其能够大规模工程化制备的优势,显示了巨大的研发抗细菌药物的潜力,受到该领域高度重视。
因此,本领域的技术人员致力于开发一种抗金葡菌奶牛乳腺炎的单链抗体,该单链抗体能够与金葡菌毒力因子特异性结合,能够抑制金葡菌致病活性,用于治疗金黄色葡萄球菌奶牛乳腺炎。
技术实现要素:
有鉴于现有技术的上述缺陷,本发明所要解决的技术问题是开发一种抗金黄色葡萄球菌奶牛乳腺炎的单链抗体,该单链抗体能够与金黄色葡萄球菌毒力因子特异性结合,能够抑制金黄色葡萄球菌致病活性,用于治疗金黄色葡萄球菌奶牛乳腺炎。
为实现上述目的,本发明提供一种抗金黄色葡萄球菌奶牛乳腺炎的基因工程原核表达单链抗体,该单链抗体能够与金葡菌双组分杀白细胞素luked的s组分(luke)特异性结合,且具有一定的抑制金葡菌致病活性,能够用于金黄色葡萄球菌奶牛乳腺炎的研究。
本发明提供一种牛源抗金黄色葡萄球菌的单链抗体,至少包括牛抗体轻链可变区(vl)、牛抗体重链可变区(vh)和中间连接肽(linker),其中,牛抗体轻链可变区(vl)的氨基酸序列如seqidno.1所示,牛抗体重链可变区(vh)的氨基酸序列如seqidno.2;中间连接肽(linker)的氨基酸序列如seqidno.3所示;单链抗体连接顺序是vl-linker-vh,具有如seqidno.4所示的氨基酸序列。
进一步地,单链抗体的编码基因为牛源性单链抗体基因,牛源性单链抗体基因含有酶切位点sfi/和酶切位点not/,其中,酶切位点sfi/的核苷酸序列如seqidno.5所示,酶切位点not/的核苷酸序列如seqidno.6所示。
进一步地,一种牛源抗金黄色葡萄球菌的单链抗体,其牛源性单链抗体基因含有酶切位点bamhi和酶切位点xhoi,其中,酶切位点bamhi的核苷酸序列为ggatcc,酶切位点xhoi的核苷酸序列为ctcgag。
进一步地,一种牛源抗金黄色葡萄球菌的单链抗体的纯化蛋白的分子量为50~54kda。
本发明还提供一种牛源抗金黄色葡萄球菌的单链抗体的制备方法,包括以下步骤:
(1)采用rt-pcr直接从奶牛的外周血单个核细胞rna中扩增出牛抗体编码基因的重链可变区基因(vh)和轻链可变区基因(vl);奶牛患乳腺炎;
(2)利用soe-pcr法将linker与步骤(1)得到的vh基因和vl基因相连,构建牛源性单链抗体基因,牛源性单链抗体基因的重组连接顺序是vl-linker-vh;
(3)将步骤(2)得到的牛源性单链抗体基因克隆到噬菌粒载体pcantab5e中,构建重组质粒(vl-linker-vh);
(4)将步骤(3)得到的重组质粒(vl-linker-vh)转化入大肠杆菌,培养并用辅助噬菌体扩增建立初级单链抗体文库;
(5)用金黄色葡萄球菌双组分杀白细胞素luked的s组分(luke)作为包被抗原,将步骤(3)得到的初级单链抗体文库富集淘选3~5轮,得到克隆;
(6)采用phageelisa,用金黄色葡萄球菌双组分杀白细胞素luked的s组分(luke)作为包被抗原,从步骤(5)得到的述克隆里筛选阳性克隆;
(7)将步骤(6)筛选得到的阳性克隆酶切,回收单链抗体编码基因scfv,与同步酶切的原核表达载体pgex-4t-1混匀后,14~16℃连接过夜;连接产物转化dh5α感受态细胞后,挑取第一单克隆,对第一单克隆的菌落pcr扩增和提取第一质粒;第一单克隆的菌落pcr扩增产物和第一质粒分别经双酶切验证,对于经验证连接正确的第一单克隆进行测序,得到测序正确的第一单克隆;
(8)将步骤(7)得到的测序正确的第一单克隆的重组质粒进行提取,获得第一重组质粒,将第一重组质粒转化到bl21感受态细胞后,挑取第二单克隆,对第二单克隆的菌落pcr扩增和提取第二质粒;第二单克隆的菌落pcr扩增产物和第二质粒分别经双酶切验证,对于经验证正确的第二单克隆进行测序,得到测序正确的第二单克隆;测序正确的第二单克隆中提取的质粒为构建成的单链抗体原核表达质粒pgex-4t-1-scfv,保存备用;
(9)将步骤(8)构建成的单链抗体原核表达质粒pgex-4t-1-scfv进行表达,纯化其表达的单链抗体蛋白。
进一步地,一种牛源抗金黄色葡萄球菌的单链抗体的制备方法,单链抗体至少包括牛抗体轻链可变区(vl)、牛抗体重链可变区(vh)和中间连接肽(linker),其中,牛抗体轻链可变区(vl)的氨基酸序列如seqidno.1所示,牛抗体重链可变区(vh)的氨基酸序列如seqidno.2,中间连接肽(linker)的氨基酸序列如seqidno.3;单链抗体连接顺序是vl-linker-vh,具有如seqidno.4所示的氨基酸序列。
进一步地,一种牛源抗金黄色葡萄球菌的单链抗体的制备方法,步骤(2)中牛源性单链抗体基因含有酶切位点sfi/和酶切位点not/,其中,酶切位点sfi/的核苷酸序列如seqidno.5所示,酶切位点sfi/的核苷酸序列如seqidno.6所示。
进一步地,一种牛源抗金黄色葡萄球菌的单链抗体的制备方法,步骤(2)中单链抗体的基因含有酶切位点bamhi和酶切位点xhoi,其中,酶切位点bamhi的核苷酸序列为ggatcc,酶切位点xhoi的核苷酸序列为ctcgag。
进一步地,一种牛源抗金黄色葡萄球菌的单链抗体的制备方法,步骤(7)和(8)中双酶切为使用限制性内切酶bamhi和xhoi进行酶切。
进一步地,一种牛源抗金黄色葡萄球菌的单链抗体的制备方法,步骤(9)中单链抗体原核表达质粒pgex-4t-1-scfv的表达和纯化过程为:将测序正确的第二单克隆菌落传代纯化,得到单链抗体原核表达质粒的菌株pgex-4t-1-scfv-bl21,将单链抗体原核表达质粒的菌株pgex-4t-1-scfv-bl21,在37℃培养,当细菌od值为0.4~0.6时,加入0.6mm蛋白质诱导剂iptg,在28℃进行诱导表达16h,之后对单链抗体蛋白进行纯化。
本发明还提供一种牛源抗金黄色葡萄球菌的单链抗体的应用,该单链抗体应用于治疗金黄色葡萄球菌引起的牛乳腺炎及相关研究。
在本发明的较佳实施方式中,实施例1详细说明牛源噬菌体单链抗体库的构建过程;
在本发明的另一较佳实施方式中,实施例2详细说明牛源抗金葡菌毒力因子luke单链抗体的筛选过程;
在本发明的另一较佳实施方式中,实施例3详细说明单链抗体pgex-4t-1-scfv的原核表达及纯化过程;
在本发明的另一较佳实施方式中,实施例4详细说明重组scfv序列分析;
在本发明的另一较佳实施方式中,实施例5详细说明检测单链抗体scfv对金葡菌的粘附阻断效果的过程。
本发明的有益效果是:
1、抗金葡菌的基因工程原核表达单链抗体(scfv)与金葡菌混合孵育后,能与金葡菌双组分杀白细胞素luked的s组分(luke)特异性结合,作用于牛乳腺上皮细胞,表现为具有一定的抑制金葡菌致病的功能,可抑制金葡菌对牛乳腺上皮细胞的粘附和损伤,治疗牛乳腺炎,进而能够用于奶牛乳腺炎的防控的进一步研究。
2、在金黄色葡萄球菌牛乳腺上皮细胞模型保护试验中获得了理想的保护效果,该单链抗体用于金黄色葡萄球菌奶牛乳腺炎的相关研究,具有良好的应用前景。
以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
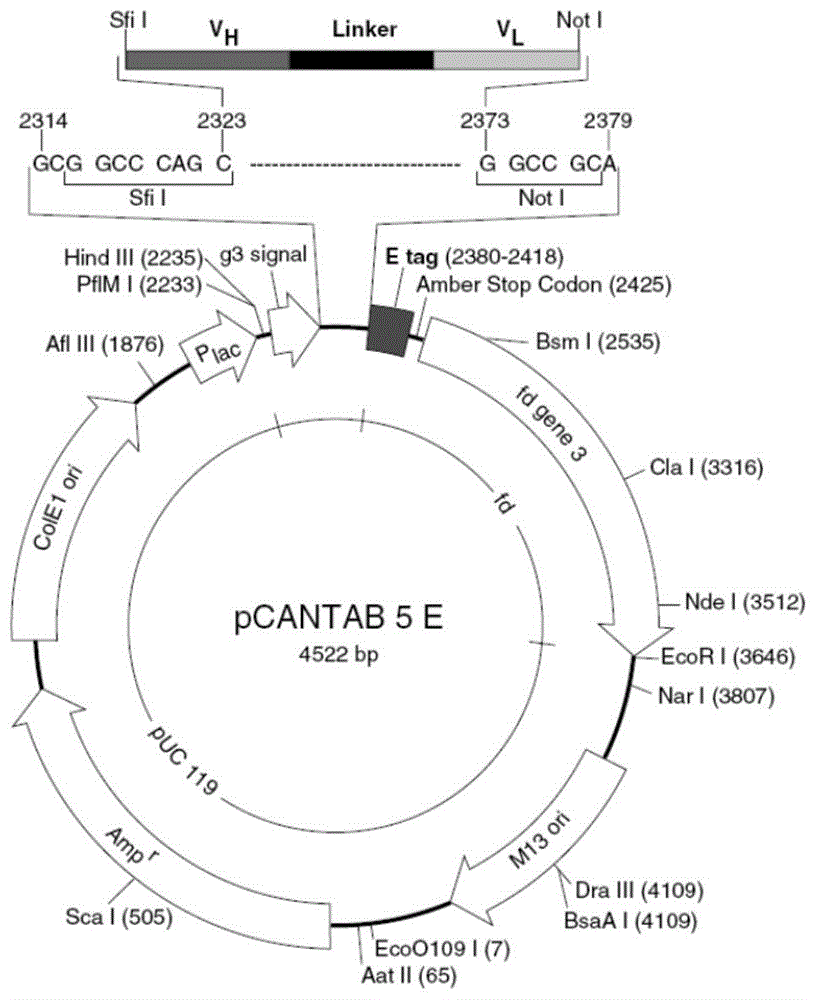
图1是本发明的一个较佳实施例1的噬菌粒载体pcantab5e的结构图;
图2是本发明的一个较佳实施例2的phageelisa筛选到的其中一个scfv阳性克隆;
图3是本发明的一个较佳实施例3的原核表达筛选到的scfv阳性克隆基因的扩增片段;
图4是本发明的一个较佳实施例3的scfv基因表达的蛋白sds-page检测图;
图5是本发明的一个较佳实施例3的scfv基因表达的蛋白westernbloting检测图;
图6是本发明的一个较佳实施例5的特异性抗luke毒力因子的单链抗体scfv对金葡菌粘附牛乳腺上皮细胞的阻断效果。
具体实施方式
以下参考说明书附图介绍本发明的多个优选实施例,使其技术内容更加清楚和便于理解。本发明可以通过许多不同形式的实施例来得以体现,本发明的保护范围并非仅限于文中提到的实施例。
实施例1牛源噬菌体单链抗体初级文库的构建
牛源噬菌体单链抗体初级文库的构建包括如下五个步骤,分别为:
1)采集患乳腺炎的奶牛血液,elisa法检测血清抗体效价大于1:20000时,继续后续实验。用抗凝血提取牛外周血白细胞,用trizol法(trizolreagent购自takara公司)提取总rna。以提取的总rna为模版,采用oligoprimer,根据反转录试剂盒(cdna第1链合成试剂盒购自takara公司)的产品说明操作步骤,合成第1链cdna。
2)分析已发表文献中的牛抗体编码基因可变区序列,根据其fr区设计扩增抗体轻、重链的引物,如表1所示,其中第一引物vhf和第一引物vhr用于扩增基因vh区;第一引物vlf和第一引物vlr用于扩增基因vl区。其中,第一引物vlf、第一引物vhr分别含有sfi/和not/酶切位点,酶切位点sfi/的核苷酸序列如seqidno.5所示,酶切位点sfi/的核苷酸序列如seqidno.6所示;第一引物vhf、第一引物vlr含互补的linker序列;第一引物vhf的核苷酸序列如seqidno.7所示,第一引物vhr的核苷酸序列如seqidno.8所示,第一引物vlf的核苷酸序列如seqidno.9所示,第一引物vlr的核苷酸序列如seqidno.10,linker的核苷酸序列如seqidno.11所示。引物由上海生工生物工程技术服务有限公司合成。
表1扩增抗体可变区的引物扩增片段大小
3)vh和vl基因的扩增
以cdna为模版,以第一引物vhf、第一引物vhr为引物扩增vh基因;第一引物vlf、第一引物vlr为引物扩增vl基因。pcr反应体系为25μl:2×pcrmix12.5μl,模版cdna2μl,上下游引物(25μm)各1μl,ddh2o8.5μl。扩增程序如下:95℃预变性3min;94℃变性40s,64℃退火40s,72℃延伸1min,30个循环;最后72℃延伸10min。1.5%琼脂糖凝胶电泳鉴定产物并回收目的基因(根据axygen公司提供的胶回收说明书操作)。
4)scfv基因的获得
通过重组链延伸反应(soe-pcr)将含有linker序列的vl和vh基因连接为scfv基因(vl-linker-vh),并加入sfi/和not/酶切位点。
5)根据常规分子克隆方法(参照j.萨姆布鲁克等主编的《分子克隆实验指南》)构建初级文库
如图1噬菌粒载体pcantab5e的结构图所示,scfv基因和pcantab5e载体分别经sfi/和not/双酶切后,将scfv基因插入pcantab5e载体,构建重组表达质粒;并将其电转化tg1感受态细胞,转化50次,合并所有电转化培养液,取一小部分系列稀释后涂布于yt-ag固体培养板,30℃过夜培养计算库容量(挑取克隆进行菌落pcr和质粒双酶切验证,测序验证库的多样性);通过菌落pcr计算阳性率,得到实际的库容量。将剩余的细菌培养液通过辅助噬菌体m13ko7拯救后建立初级文库。
实施例2牛源抗金葡菌毒力因子luke单链抗体的筛选
牛源抗金黄色葡萄球菌毒力因子luke单链抗体的筛选包括如下两个步骤,分别为:
6)富集淘选
制备金黄色葡萄球菌(atcc25923)双组分杀白细胞素luked的s组分(luke),将其作为抗原,4℃包被过夜;用含4%脱脂奶粉的pbst封闭96孔板,37℃孵育2h;向96孔板中加入上述步骤中制备好的单链抗体噬菌体抗体初级文库,37℃孵育2h,用pbst和pbs各洗10次,洗掉未结合的游离噬菌体;每孔加入100ul0.2mol/lgly-hcl缓冲液(ph=2.2)洗脱特异性结合的噬菌体,加入50ul1mol/ltris-hcl(ph=9.1)中和洗脱液;将剩余部分洗脱液感染大肠杆菌tg1后,重复上述步骤。如此重复3-5轮,在第一轮过后,要增加洗涤的严谨性:洗脱前用pbst洗脱20次后用pbs洗涤20次。
7)phageelisa筛选从第四轮中随机挑取96个克隆,用m13k07拯救后制备重组噬菌体。
将纯化后的金葡菌双组分杀白细胞素luked的s组分(luke)蛋白用50mmol/l碳酸氢钠盐溶液(ph9.6)于4℃包被过夜,4%脱脂奶粉溶液封闭1h,用pbst(0.1%tween20,以下同)洗涤3次;加入上述制备好的噬菌体单链抗体,37℃反应2h,pbst和pbs各洗涤6次;加入hrp-antim13抗体100μl(1:4000),37℃反应1h,pbst和pbs各洗涤6次;tmb显色,2mol/l硫酸终止反应,酶标仪读取od450值,同时设辅助噬菌体m13k07为阴性对照。elisa结果的判定以p/n(p为阳性孔的od450值,n为阴性孔的od450值)表示,p/n≥2.1为阳性;1.5≤p/n<2.1为可疑;p/n<1.5为阴性;phageelisa筛选到的scfv阳性克隆结果图2所示,其中blankcontrol为空白对照,negativecontrol为阴性对照,scfv为阳性克隆,阳性克隆的od450值很高,接近3;而阴性对照的od450值小于0.5,两者比值大于2.1。
实施例3单链抗体pgex-4t-1-scfv的原核表达及纯化
单链抗体pgex-4t-1-scfv的原核表达及纯化包括如下两个步骤,分别为:
8)重组质粒pgex-4t-1-scfv的构建
以8号阳性克隆菌株为模板,如表2所示,用特异性引物为第二引物vl-f和第二引物vh-r扩增scfv目的基因,其中,第二引物vl-f的核苷酸序列如seqidno.12所示,第二引物vh-r的核苷酸序列如seqidno.13所示;第二引物vl-f第和二引物vh-r分别包含酶切位点bamhi和酶切位点xhoi,其中酶切位点bamhi的核苷酸序列为:ggatcc,酶切位点xhoi的核苷酸序列为:ctcgag;选择限制性内切酶bamhi和xhoi对目的基因和原核表达载体pgex-4t-1进行双酶切,酶切后连接scfv基因,将其转化到dh5α感受态,挑取第一单克隆,将菌落pcr扩增,获得第一重组质粒;将第一重组质粒经限制性内切酶bamhi和xhoi双酶切,来验证是否是正确的克隆,并将经双酶切验证正确的克隆送至上海铂尚生物技术有限公司测序;
表2扩增抗体可变区的引物扩增片段大小
测序正确的克隆进行第一重组质粒的提取,再将第一重组质粒转化到bl21感受态细胞后,挑取第二单克隆,将第二单克隆的菌落pcr扩增,得到第二重组质粒;将第二重组质粒使用限制性内切酶bamhi和xhoi双酶切来验证,得到验证正确的第二重组质粒;将经双酶切验证正确的第二重组质粒测序送至上海铂尚生物技术有限公司测序,得到测序正确第二重组质粒;测序正确的第二重组质粒为构建成的单链抗体原核表达质粒pgex-4t-1-scfv,如图3pgex-4t-1-scfv检测图所示,保存备用。
9)单链抗体scfv蛋白的纯化重组表达的融合蛋白含有gst-tag,采用gst预装重力柱(采购自上海生工生物工程股份有限公司)对蛋白进行纯化,具体步骤如说明书所示,纯化后再进行蛋白超滤,对收集的洗脱液进行sds-page以及westernbloting分析,蛋白大小为54kd。如图4sds-page检测图和图5westernbloting检测图所示,其中m为marker,1孔道为蛋白诱导剂iptg诱导前scfv表达量、2孔道为蛋白诱导剂iptg诱导后scfv表达量、3孔道为上清scfv表达量,4孔道为超滤scfv表达量。采用bradford法对蛋白浓度进行测定,根据标准品绘制的标准曲线和样品所测得的od值,得到单链抗体scfv蛋白的浓度约为300μg/ml。
实施例4重组scfv序列分析
对获得的单链抗体编码基因进行测序,证明其按照正确的阅读框顺序插入到原核表达质粒pgex-4t-1载体中,氨基酸序列如seqidno.4所示,其序列顺序是vl-linker-vh。
实施例5检测单链抗体scfv对金葡菌的粘附阻断效果
检测单链抗体scfv对金葡菌的粘附阻断效果包括如下两个步骤,分别为:
10)实验方法和步骤
将牛乳腺上皮细胞培养至呈梭形且状态良好时,以1×105(cell/孔)传代至12孔板上,于37℃5%co2培养箱中培养过夜,长至单层后用于黏附抑制试验。用rpmi-1640培养液稀释实验所用的两种金黄色葡萄糖菌usa-300和atcc25923,菌株均为实验室保存。实验组,两种金黄色葡萄糖与单链抗体pgex-4t-1-scfv提前孵育30min;对照组一,两种金黄色葡萄糖与空载体pgex-4t-1(带有gst标签蛋白)提前孵育30min(usa-300+gst和25923+gst);对照组二,只加入金黄色葡萄糖(usa-300和25923);对照组三,只加入无菌rpmi-1640培养液;以复合感染比(moi)10,即1×金黄色葡萄糖106(cfu/孔)的细菌悬液感染牛乳腺上皮细胞,接种后室温下离心15min(800×g),使细菌与细胞充分接触。12孔板置37℃,5%co2培养1h,吸去培养液,pbs洗涤6次去除未黏附的细菌。每孔加入1ml包含0.1%tritonx-100的pbs,反复吹打细胞至完全裂解。梯度(10倍比)稀释后进行细菌的tsa平板计数,所得结果为黏附的细菌数。细菌黏附率=黏附的细菌数/起始的细菌数。本试验重复3次,每次3个重复孔。证实单链抗体具有一定的抗金葡菌粘附的活性,可以用于阻断金葡菌对牛乳腺上皮细胞的感染和粘附。
10)数据统计和实验结果
用graghpadprism6和excel2016软件对试验数据进行统计分析,结果以平均数±标准误(mean±se)表示。p<0.05(*)为差异显著,p>0.05为差异不显著。
如附图6特异性抗luke毒力因子的单链抗体scfv对金葡菌粘附牛乳腺上皮细胞的阻断效果所示,对于金黄色葡萄糖菌usa-300,与对照组一(usa-300+gst)和对照组二(usa-300)和相比,当加入针对金葡菌杀白细胞素luke毒力因子的单链抗体scfv(usa-300+scfv)时,细菌的粘附率下降,并具有显著性差异(p<0.05)。同样的,针对标准菌株atcc25923也具有相同的效果,对于金黄色葡萄糖菌atcc25923,与对照组一(25923+gst)和对照组二(25923)和相比,当加入针对金葡菌杀白细胞素luke毒力因子的单链抗体scfv(25923+scfv)时,细菌的粘附率下降,并具有显著性差异(p<0.05),说明该特异性单链抗体具有减弱金葡菌粘附牛乳腺上皮细胞的功能。
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
序列表
<110>上海交通大学
<120>一种牛源抗金黄色葡萄球菌的单链抗体及其制备和应用
<130>20200731
<160>13
<170>siposequencelisting1.0
<210>1
<211>112
<212>prt
<213>人工序列(artificialsequence)
<400>1
metalaglnalavalleuthrglnproserthrvalserglyserleu
151015
glyglnargvalserilethrcysserglyasnseraspasnilegly
202530
argtyrglyvalglytrptyrglnglnvalproglyserglyleuarg
354045
thrileiletyrglyasplystyrargproserglyvalproasparg
505560
pheserglyserlysserglyasnthralathrleuthrileserser
65707580
leuglnalagluaspglualaasptyrphecysalaalaglyaspser
859095
serargaspthrglyvalpheglyserglythrthrleuthrvalleu
100105110
<210>2
<211>136
<212>prt
<213>人工序列(artificialsequence)
<400>2
glnvalglnleuarggluserglyproserleuvallysprosergln
151015
thrleuserleuthrcysthrvalserglypheserleusersertyr
202530
valvalsertrpvalargglnalaproglylysalaleuglutrpval
354045
glyglyileserserglyglyargthrtyrtyrasnproalaleulys
505560
serargleuserilethrlysaspasnserlysserglnvalserleu
65707580
servalserservalthrprogluaspthralathrtyrtyrcysala
859095
argaspglnasnthrglyglyvalasnvalglyglytyrvalcystrp
100105110
ileaspthrtyraspcysthrcysseraspthrtrpglyglnglyleu
115120125
leuvalthrvalserserthrser
130135
<210>3
<211>10
<212>prt
<213>人工序列(artificialsequence)
<400>3
glyglyglyglyserglyglyglyglyser
1510
<210>4
<211>258
<212>prt
<213>人工序列(artificialsequence)
<400>4
metalaglnalavalleuthrglnproserthrvalserglyserleu
151015
glyglnargvalserilethrcysserglyasnseraspasnilegly
202530
argtyrglyvalglytrptyrglnglnvalproglyserglyleuarg
354045
thrileiletyrglyasplystyrargproserglyvalproasparg
505560
pheserglyserlysserglyasnthralathrleuthrileserser
65707580
leuglnalagluaspglualaasptyrphecysalaalaglyaspser
859095
serargaspthrglyvalpheglyserglythrthrleuthrvalleu
100105110
glyglyglyglyserglyglyglyglyserglnvalglnleuargglu
115120125
serglyproserleuvallysproserglnthrleuserleuthrcys
130135140
thrvalserglypheserleusersertyrvalvalsertrpvalarg
145150155160
glnalaproglylysalaleuglutrpvalglyglyilesersergly
165170175
glyargthrtyrtyrasnproalaleulysserargleuserilethr
180185190
lysaspasnserlysserglnvalserleuservalserservalthr
195200205
progluaspthralathrtyrtyrcysalaargaspglnasnthrgly
210215220
glyvalasnvalglyglytyrvalcystrpileaspthrtyraspcys
225230235240
thrcysseraspthrtrpglyglnglyleuleuvalthrvalserser
245250255
thrser
<210>5
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>5
ggcccagccggccggcccagccggcc26
<210>6
<211>8
<212>dna
<213>人工序列(artificialsequence)
<400>6
gcggccgc8
<210>7
<211>44
<212>dna
<213>人工序列(artificialsequence)
<400>7
ggcggtggtggatccggtggcggcggatctcaggtgcagctgcg44
<210>8
<211>34
<212>dna
<213>人工序列(artificialsequence)
<400>8
ttgcggccgcactagtggaggagacggtgaccag34
<210>9
<211>39
<212>dna
<213>人工序列(artificialsequence)
<400>9
gtggcccagccggccatggcccaggctgtgctgactcag39
<210>10
<211>63
<212>dna
<213>人工序列(artificialsequence)
<400>10
agatccgccgccaccggatccaccaccgcccgagccaccgccacctaggacggtcagtgt60
ggt63
<210>11
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>11
ggcggtggtggatccggtggcggcggatct30
<210>12
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>12
cgcggatccatggcagtaaaagtag25
<210>13
<211>28
<212>dna
<213>人工序列(artificialsequence)
<400>13
ccgctcgagtttagaaagttcagctaag28
- 还没有人留言评论。精彩留言会获得点赞!