一种具核梭杆菌中性粒细胞激活蛋白的制备方法与流程
[0001]
本发明涉及生物医学技术领域,具体为一种具核梭杆菌中性粒细胞激活蛋白的制备方法。
背景技术:
[0002]
具核梭杆菌(fusobacteriumnucleatum,fn)是一种常见的革兰氏阴性厌氧菌,是口腔炎疾病患者口腔中最丰富的微生物之一,中性粒细胞激活蛋白a (neutrophil-activatingproteina,napa)最初是在h.pylori的水提取物中发现的可溶性蛋白,由于这种可溶性蛋白可以诱导中性白细胞产生活性氧自由基(roi),所以命名为中性粒细胞激活蛋白,napa存在于hp和fn大多数菌株中,是一种保守的,抗原性强的蛋白,近年来,重组napa主要作为对抗hp感染的候选疫苗,在大多数hp感染患者体中,含有高水平的napa抗体,rossi等采用hp-napa与hp另外两个致病因子cag、vaca联合免疫比格犬可以减少hp 的定植感染,satin等发现用hp-napa免疫小鼠可减少幽门螺旋杆菌的感染,保护率高达80%,有研究发现口服hp-napa疫苗和免疫调节剂,可以控制hp感染, dong等发现霍乱毒素b(ctb)与napa联合口服可以抑制小鼠过敏性炎症,目前仍缺少fn-napa基因作为抗原的应用。
技术实现要素:
[0003]
本部分的目的在于概述本发明的实施方式的一些方面以及简要介绍一些较佳实施方式。在本部分以及本申请的说明书摘要和发明名称中可能会做些简化或省略以避免使本部分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
[0004]
鉴于上述和/或现有保护抗原中存在的问题,提出了本发明。
[0005]
因此,本发明的目的是提供一种具核梭杆菌中性粒细胞激活蛋白的制备方法,能够制备fn-napa蛋白,fn-napa蛋白拥有多个高抗原性肽段,具有较好的抗原性,并且与人体肠道共生菌之间有较小的交叉免疫反应,fn疫苗候选抗原具有良好的发展前景。
[0006]
为解决上述技术问题,根据本发明的一个方面,本发明提供了如下技术方案:
[0007]
一种具核梭杆菌中性粒细胞激活蛋白的制备方法,包括如下制备步骤:
[0008]
步骤一:具核梭杆菌的细菌培养,取出细菌冻存管,放置冰上,待其溶解,将fn菌种接种于血平板上,在极度厌氧的条件下于37℃培养48-72h;
[0009]
步骤二:细菌dna的提取,刮取适量生长状态良好的fn菌落,置于1
×
pbs 缓冲液中,提取细菌基因组dna;
[0010]
步骤三:napa基因的扩增,以fn细菌dna为模板,根据以下条件进行扩增,反应体系为50μl,参数如下:预变性94℃1min,变性98℃10sec,退火68℃ 30sec,延伸72℃45sec,共进行30个循环,最后一个循环结束后再延伸72℃ 10min,pcr产物用1.2%琼脂糖凝胶电泳进行分析;
[0011]
步骤四:napa基因与pgm-t载体连接,切胶回收的napa基因6.0μl,pgm-t 载体1.0μ
l,t4连接酶1.0μl,dna连接缓冲液1.0μl,去离子水1.0μl,总体积10.0μl,混匀后16℃反应过夜;
[0012]
步骤五:dh5α感受态细胞转化;
[0013]
步骤六:重组克隆的筛选与鉴定,挑取多个白色菌落分别接种于含有amp 的lb液体培养基中,250rpm,37℃震荡培养过夜,提取质粒,双酶切鉴定:取白色菌落质粒,进行双酶切,反应体系:ncoi1.0μl,xhoi1.0μl,10
×ꢀ
kbuffer2.0μl,dna10.0μl,ddh2o6.0μl,反应体积20.0μl,37℃酶切3h, 1.2%琼脂糖凝胶电泳分析。
[0014]
作为本发明所述的一种具核梭杆菌中性粒细胞激活蛋白的制备方法的一种优选方案,其中:所述步骤六中主要溶液、培养基的配制方法包括:
[0015]
lb液体培养基:胰蛋白胨2.0g,酵母提取物1.0g,nacl2.0g加入去离子水200ml,搅拌均匀,120℃高压灭菌20min;
[0016]
lb固体含amp培养基:胰蛋白胨2.0g,酵母提取物1.0g,nacl2.0g,琼脂粉3.0g加入去离子水200.0ml,搅拌均匀,120℃高压灭菌20min,待lb固体培养基冷却约60℃时,加入amp至终浓度100.0μg/ml,倒平板。
[0017]
作为本发明所述的一种具核梭杆菌中性粒细胞激活蛋白的制备方法的一种优选方案,其中:所述步骤一中梭杆菌的菌种、引物、载体为fn标准株;pgm-t 载体;fn-napa的上游引物:5
′-
ccatggggaaaaacaaagaaaatt-3
′
;fn-napa的下游引物:5
′-
ctcgagttttagccatagctgagat-3
′
。
[0018]
作为本发明所述的一种具核梭杆菌中性粒细胞激活蛋白的制备方法的一种优选方案,其中:所述步骤六完成之后对重组质粒pgm-fn-napa进行sanger测序。
[0019]
作为本发明所述的一种具核梭杆菌中性粒细胞激活蛋白的制备方法的一种优选方案,其中:所述步骤六完成之后对fn-napa进行3d结构模拟和预测 fn-napa蛋白的二级结构。
[0020]
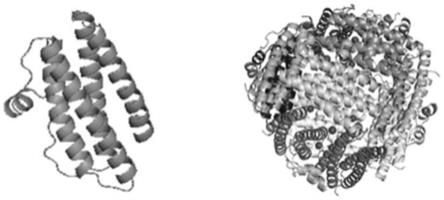
与现有技术相比:本发明中能够对fn-napa蛋白进行制备,fn-napa蛋白拥有多个高抗原性肽段,具有较好的抗原性,并且与人体肠道共生菌之间有较小的交叉免疫反应,fn疫苗候选抗原具有良好的发展前景。
附图说明
[0021]
为了更清楚地说明本发明实施方式的技术方案,下面将结合附图和详细实施方式对本发明进行详细说明,显而易见地,下面描述中的附图仅仅是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中:
[0022]
图1为本发明fn-napa基因核酸序列比对图;
[0023]
图2为本发明napa蛋白3d结构模拟图;
[0024]
图3为本发明fn-napa蛋白二级结构预测图;
[0025]
图4为本发明fn-napa蛋白亲水性分析图;
[0026]
图5为本发明fn-napa蛋白预测高抗原性肽段图;
[0027]
图6为本发明fn-napa蛋白抗原指数图;
[0028]
图7为本发明fn-napa蛋白进化树分析图;
[0029]
图8为本发明具核梭杆菌napa蛋白质谱鉴定图;
[0030]
图9为本发明crc患者和健康人血清中fn-napa重组蛋白抗体水平的检测图。
具体实施方式
[0031]
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图对本发明的具体实施方式做详细的说明。
[0032]
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施方式的限制。
[0033]
其次,本发明结合示意图进行详细描述,在详述本发明实施方式时,为便于说明,表示器件结构的剖面图会不依一般比例作局部放大,而且所述示意图只是示例,其在此不应限制本发明保护的范围。此外,在实际制作中应包含长度、宽度及深度的三维空间尺寸。
[0034]
为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明的实施方式作进一步地详细描述。
[0035]
本发明提供一种具核梭杆菌中性粒细胞激活蛋白的制备方法,fn-napa蛋白拥有多个高抗原性肽段,具有较好的抗原性,并且与人体肠道共生菌之间有较小的交叉免疫反应,fn疫苗候选抗原具有良好的发展前景,请参阅图1-图9,包括:包括如下制备步骤:
[0036]
步骤一:具核梭杆菌的细菌培养,取出细菌冻存管,放置冰上,待其溶解,将fn菌种接种于血平板上,在极度厌氧的条件下于37℃培养48-72h;
[0037]
步骤二:细菌dna的提取,刮取适量生长状态良好的fn菌落,置于1
×
pbs 缓冲液中,提取细菌基因组dna;
[0038]
步骤三:napa基因的扩增,以fn细菌dna为模板,根据以下条件进行扩增,反应体系为50μl,参数如下:预变性94℃1min,变性98℃10sec,退火68℃ 30sec,延伸72℃45sec,共进行30个循环,最后一个循环结束后再延伸72℃ 10min,pcr产物用1.2%琼脂糖凝胶电泳进行分析;
[0039]
步骤四:napa基因与pgm-t载体连接,切胶回收的napa基因6.0μl,pgm-t 载体1.0μl,t4连接酶1.0μl,dna连接缓冲液1.0μl,去离子水1.0μl,总体积10.0μl,混匀后16℃反应过夜;
[0040]
步骤五:dh5α感受态细胞转化;
[0041]
步骤六:重组克隆的筛选与鉴定,挑取多个白色菌落分别接种于含有amp 的lb液体培养基中,250rpm,37℃震荡培养过夜,提取质粒,双酶切鉴定:取白色菌落质粒,进行双酶切,反应体系:ncoi1.0μl,xhoi1.0μl,10
×ꢀ
kbuffer2.0μl,dna10.0μl,ddh2o6.0μl,反应体积20.0μl,37℃酶切3h, 1.2%琼脂糖凝胶电泳分析。
[0042]
所述步骤六中主要溶液、培养基的配制方法包括:
[0043]
lb液体培养基:胰蛋白胨2.0g,酵母提取物1.0g,nacl2.0g加入去离子水200ml,搅拌均匀,120℃高压灭菌20min;
[0044]
lb固体含amp培养基:胰蛋白胨2.0g,酵母提取物1.0g,nacl2.0g,琼脂粉3.0g加入去离子水200.0ml,搅拌均匀,120℃高压灭菌20min,待lb固体培养基冷却约60℃时,加入amp至终浓度100.0μg/ml,倒平板;
[0045]
步骤一中梭杆菌的菌种、引物、载体为fn标准株;pgm-t载体;fn-napa 的上游引物:5
′-
ccatggggaaaaacaaagaaaatt-3
′
;fn-napa的下游引物:5
′ꢀ-
ctcgagttttagccatagctgagat-3
′
。
[0046]
步骤六完成之后对重组质粒pgm-fn-napa进行sanger测序。
[0047]
步骤六完成之后对fn-napa进行3d结构模拟和预测fn-napa蛋白的二级结构。
[0048]
fn-napa基因的扩增:
[0049]
以fnatcc25586基因组模板中,扩增出大小为435bp的目的条带,与nbci 数据库中公布的fn-napa基因(nc_003454.1)大小相符。
[0050]
fn-napa基因t-a克隆的鉴定:
[0051]
挑取白色菌落,过夜培养提取质粒,进行ncoi和xhoi双酶切鉴定,琼脂糖凝胶电泳分析显示有2个条带,其中一条大小约为435bp,与fn-napa基因 (nc_003454.1)大小相符,另一条的大小约3000bp,大小与pgm-t载体相符。
[0052]
fn-napa基因序列的测定:
[0053]
对ncoi和xhoi双酶切鉴定成功的重组质粒pgm-fn-napa进行测序,fn-napa 基因全长为435bp,与ncbi上公布的fnatcc25586菌株napa基因的序列 (nc_003454.1)相比对,一致性为100%,说明重组质粒pgm-fn-napa构建成功。
[0054]
fn-napa蛋白结构预测:
[0055]
得到模拟fn-napa3d结构蛋白模型,fn-napa蛋白单体是由5个α螺旋和4 个β转角构成的,其多聚体是由12个单体组成,还包括了12个铁离子结合位点,再通过对fn-napa蛋白二级结构的预测,fn-napa蛋白具有5个α螺旋、4 个β转角和1个β折叠,结果与3d结构模拟预测相符。
[0056]
fn-napa蛋白亲水性分析:
[0057]
利用dnaman软件对napa氨基酸序列进行亲水性分析,fn-napa的氨基酸残基具有较强的亲水性,猜测这些应该是形成抗原表位的重要部位;
[0058]
fn-napa蛋白抗原性指数分析及抗原簇决定预测:
[0059]
fn-napa有6个肽段展现出高抗原性,fn-napa平均抗原指数为1.021,其中63-80长18个氨基酸残基的肽段,此肽段抗原指数为1.17,结合亲水性分析,该肽段亲水性较强,再结合二级结构预测该肽段含有一个β转角,综上所述,该肽段可能含有良好的抗原表位,同理,87-94长8个氨基酸残基的肽段可能也含有良好的抗原表位。
[0060]
fn-napa蛋白进化树分析:
[0061]
构建基于napa氨基酸序列对比的物种进化树,显示fn和其它物种之间napa 蛋白的进化关系,通过blastp分析,发现fn-napa在其他fusobacterium菌株中有高度同源性(58%-93%),在fn其他菌株中也具有高度同源性(80%),但是与人和小鼠基因组dna同源性很低,fn的napa蛋白与其他菌属的napa有较低的同源性,与博氏疏螺旋体(borreliaburgdorferi)的同源性为29%,肺支原体(mycoplasmapulmonis)的同源性为30%,黑腹弧菌(vibrionigripulchritudo) 的同源性为29%,幽门螺旋杆菌(helicobacterpylori)的同源性为30%,而且 fn-napa蛋白与极少数肠道共生细菌具有较低的同源性,比如胃乳酸杆菌(lactobacillusruminis)的同源性为50%,坏死梭杆菌 (fusobacteriumnecrophorum)的同源性为58%,极小韦永氏球菌 (veillonellaparvula)
的同源性为50%,并且,这些菌的napa蛋白中潜在的抗原决定簇存在较大的差异,表明fn的napa蛋白与这些肠道共生细菌产生的交叉免疫反应较少。
[0062]
患者均病理及临床确诊结果如下:
[0063]
(1)结直肠癌组(crc):2013年6月至2013年12月在中山大学肿瘤防治中心诊治的124例crc首诊患者治疗前血清样本,该组由65名男性和59名女性患者组成,患者年龄12-79岁(平均:55.3岁);
[0064]
(2)健康组(hs):广州市第一人名医院体检样本,包括144名hs(75名男性,69名女性)的血清样本,年龄范围从18至79岁(平均:55.1岁),健康人入组标准:体检人群,血常规、肝肾功、心电图、b超和体格检查均正常,无肠道疾病、无炎症疾病及其他恶性疾病;
[0065]
(3)血清样本收集:所有样本来源个体检测前一个月内均无服用抗生素、益生菌制剂等,采血管采集静脉血液,室温静置,待血液凝固后,4000rpm离心 10min,吸出上层血清,样本-80℃保存。
[0066]
虽然在上文中已经参考实施方式对本发明进行了描述,然而在不脱离本发明的范围的情况下,可以对其进行各种改进并且可以用等效物替换其中的部件。尤其是,只要不存在结构冲突,本发明所披露的实施方式中的各项特征均可通过任意方式相互结合起来使用,在本说明书中未对这些组合的情况进行穷举性的描述仅仅是出于省略篇幅和节约资源的考虑。因此,本发明并不局限于文中公开的特定实施方式,而是包括落入权利要求的范围内的所有技术方案。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1