一种基于高通量测序技术检测目的微生物基因组RNA的方法与流程
一种基于高通量测序技术检测目的微生物基因组rna的方法
技术领域
1.本发明属于高通量测序和微生物检测技术领域,具体涉及一种基于高通量测序技术检测目的微生物基因组rna的方法。
背景技术:
2.高通量测序技术在微生物检测领域的广泛应用使得微生物检测变得越来越方便、快捷。该技术对于传统检测方法无法准确鉴定的微生物(包括新发现的微生物物种)也能精准鉴别,但目前对于微生物基因组rna的检测仍然存在较大困难。一方面,环境中存在着大量高活性的rnase,会随时随地降解rna,而且一些微生物基因组rna是单链核糖核酸,本身易降解,稳定性较差,从而导致微生物基因组rna含量普遍偏低,不利于精准检测。另一方面,不同类型的检测样本中都会含有不同程度的背景/宿主dna水平,使得检测结果中大部分数据占比为背景序列,从而导致微生物基因组rna的检测灵敏度偏低。因此,在检测微生物基因组rna时通常需要对微生物基因组rna进行富集,以提高其rna含量,通常采用的富集方法包括宿主rrna去除、目的rna靶向富集等。
3.宿主rrna去除方法通过探针(dna)捕获方式结合样品中rrna,进而通过酶消化或磁珠吸附等方式去除被捕获的rrna。rrna去除方法的一种流程包括总rna提取、探针结合rrna、dna/rrna杂合片段中rrna消化、dna探针消化、样本纯化,其缺点是操作复杂,耗时较长;另一种流程包括总rna提取、生物素标记探针结合rrna、链霉亲和素磁珠结合探针、分离rrna、样本纯化,其虽然操作相对简便,但缺点是试剂成本较高。
4.目的rna靶向富集是目前检测效果最佳的方法,通过针对性的探针设计对特定目的微生物的cdna进行定向捕获,往往可以获得微生物的全基因组。主要流程包括总rna提取、反转录、二链合成、文库构建、探针捕获、目的片段洗脱、扩增。目的rna靶向富集的缺点是需要针对性的设计探针,探针设计比较复杂,且不能进行盲测或检测新发现的微生物的rna,因此应用范围有限,而且捕获流程操作复杂,耗时较长,全部流程往往需要几天时间,并且试剂成本较高。
技术实现要素:
5.本发明的目的在于解决现有的微生物基因组rna高通量测序中,rna易降解并且背景dna含量高,微生物基因组rna含量少从而检测灵敏度偏低的技术问题,而提出一种新的微生物基因组rna富集方法,提高微生物基因组rna含量,从而提高检测灵敏度。
6.为了解决上述技术问题,本发明采取以下技术方案:
7.一种基于高通量测序技术检测目的微生物基因组rna的方法,该方法包括以下步骤:
8.提供包含目的微生物的待测样本;
9.对待测样本进行核酸提取,得到核酸样本;
10.用dna酶对核酸样本进行dna消化,得到包含rna分子的核酸消化液;
11.对核酸消化液进行纯化,得到分离的rna分子;
12.对分离的rna分子进行片段化,得到片段化的rna分子;
13.将片段化的rna分子进行反转录,得到cdna分子;
14.用cdna分子进行文库构建,得到cdna文库;
15.对cdna文库进行高通量测序,得到高通量测序数据;
16.对高通量测序数据进行数据分析,检测出目的微生物基因组rna;
17.其中用dna酶对核酸样本进行dna消化是通过将核酸样本与dna酶在37℃至42℃下孵育10至30分钟来进行。
18.本发明方法的dna消化温度较低,反应时间较短,消化条件温和,可以有效降低了dna消化对rna的损伤。
19.进一步地,对核酸样本进行dna消化是通过在37℃下孵育10分钟来进行。
20.进一步地,对核酸消化液进行纯化是通过磁珠来进行。
21.进一步地,对分离的rna分子进行片段化是通过将分离的rna分子热打断来进行。优选地,热打断是通过将分离的rna分子在打断缓冲液存在下在85℃-94℃下震荡孵育3-10分钟来进行。本发明方法在rna反转录中采用热打断的方式进行rna片段化,减少了机械打断带来的rna损失,成本也比采用打断酶要低。
22.进一步地,将片段化的rna分子进行反转录包括合成cdna第一链和cdna第二链,其中在合成cdna第一链中使用bst 3.0dna polymerase。
23.进一步地,在用cdna分子进行文库构建后,还对构建的cdna文库进行质量检测。
24.进一步地,对cdna文库进行高通量测序是通过mgiseq测序平台来进行。
25.进一步地,目的微生物为病毒、细菌、酵母菌、霉菌或者它们的组合,特别是病毒。
26.本发明的有益效果:
27.包含目的微生物的待测样本经核酸提取后,会有大量dna残留影响rna检测灵敏度。本发明方法通过在37℃至42℃下的较低温度下对核酸样本进行10至30分钟的较短时间的孵育,对核酸样本进行温和的dna酶消化,去除样品核酸中的dna。较低的dnase消化温度在降解dna的同时将对rna的影响降到最低,较短的反应时间更适合快速检测,同时也可减少rna暴露在环境中的时间,降低rna降解的风险,有助于提高微生物基因组rna占比。
28.同时,由于样本核酸中dna的大量去除使得样本核酸含量显著降低,对于后续高通量测序文库的成功构建产生了挑战,因此本发明方法使用热打断的方式进行rna片段化,可减少机械打断带来的rna损失,成本也比采用打断酶要低。并且,本发明方法对反转录反应体系进行优化,添加bst 3.0 dna polymerase以提高rna反转录效率,进而提升后续高通量测序文库构建的成功率。
29.本发明方法由于采用了温和的消化手段和热打断手段,可以高效、快速、低成本地富集微生物基因组rna,提高微生物基因组rna的含量,提高rna高通量测序文库构建的成功率,从而提高微生物基因组rna的检测灵敏度。
30.与目的rna靶向富集方法相比,本发明方法不需要探针捕获、酶消化等多步操作,不需要特殊修饰的磁珠,也不需要针对性设计探针,不需要长时间的杂交捕获流程,只需要一步酶反应、一步纯化操作,具有操作简单、耗时短、成本低、适用范围广泛且rna富集效果显著的优点。
附图说明
31.图1示出了本发明实施例中文库质量检测合格的cdna文库的agilent 2100结果图。
具体实施方式
32.为了使本发明所解决的技术问题、所采用的技术方案及所获得的有益效果更加清楚明白,以下结合附图及具体实施例对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
33.本发明提供一种基于高通量测序技术检测目的微生物基因组rna的方法,该方法包括以下步骤:
34.提供包含目的微生物的待测样本;
35.对待测样本进行核酸提取,得到核酸样本;
36.用dna酶对核酸样本进行dna消化,得到包含rna分子的核酸消化液;
37.对核酸消化液进行纯化,得到分离的rna分子;
38.对分离的rna分子进行片段化,得到片段化的rna分子;
39.将片段化的rna分子进行反转录,得到cdna分子;
40.用cdna分子进行文库构建,得到cdna文库;
41.对cdna文库进行高通量测序,得到高通量测序数据;
42.对高通量测序数据进行数据分析,检测出目的微生物基因组rna;
43.其中用dna酶对核酸样本进行dna消化是通过将核酸样本与dna酶在37℃至42℃下孵育10至30分钟来进行。
44.以下对各步骤作进一步的说明。
45.1.提供包含目的微生物的待测样本
46.本文所用的术语“包含目的微生物的待测样本”是指需要检测其中的微生物组rna的样本。通常,此类样本包括动物样本,优选人体样本,包括但不限于胃液、肠液、唾液、痰液、组织提取液、组织切片等。此类样本也包括植物样本,例如植物的根、茎、叶、花等。此类样本还可包括环境样本,例如污水样本、淤泥样本等,或者其他包含目的微生物的样本。此类样本通常包含各种微生物核酸,还包括宿主生物,例如动物核酸(如人类核酸)、植物核酸、其他宿主生物核酸。如本领域所理解,核酸包括dna和rna。
47.本文所用的术语“微生物”是指生物学上通常理解的微生物,包括但不限于病毒、细菌、酵母菌和霉菌。本领域公知,微生物是无所不在的,因此,各种样本,例如动物样本、植物样本和环境样本中都会存在各种微生物。本文所用的术语“目的微生物”是指待测样本中的一种或者多种人们感兴趣的微生物,需要对其中的微生物组rna进行检测。
48.通常,待测样本中还存在宿主生物或者是其他生物的核酸,尤其是dna,以及微生物本身的dna,这些非微生物组rna的存在降低了微生物组rna在核酸中的占比。而且,一些微生物基因组rna是单链核糖核酸,本身易降解,稳定性较差,并且样本微环境中存在的rnase也造成rna降解,进一步降低微生物基因组rna的含量,不利于微生物基因组rna的精准检测。
49.本文所用的术语“提供”是指获取包含目的微生物的待测样本以供检测。获取生物
样本的方法、手段或装置是本领域公知的,在此不作赘述。
50.2.对待测样本进行核酸提取
51.对待测样本进行核酸提取旨在从获取的包含目的微生物的待测样本中分离和富集核酸物质,使得核酸物质从样本中的其余物质中纯化出来。从生物样本中提取核酸的方法、手段和装置是本领域公知的,在此不作赘述。通常,可以使用核酸提取试剂盒按厂商说明书进行核酸提取。例如提取病毒时,可以使用viral rna mini kit按照说明书进行核酸提取。提取后,可以用nuclease-free water回溶核酸,得到核酸样本。
52.3.用dna酶对核酸样本进行dna消化
53.本发明方法通过消化样品核酸中的dna达到对样品中微生物基因组rna富集的效果。本发明方法通过将核酸样本与dna酶在37℃至42℃下孵育10至30分钟,来对核酸样本进行dna消化。该消化温度和时间条件是一种温和的dna酶消化条件。本发明方法通过对包含微生物基因组rna的核酸样本进行温和的dna酶消化,在降解dna的同时不会对rna产生显著影响,起到降解dna并富集rna的效果。消化之后,得到包含rna分子的核酸消化液,其中的rna分子包括微生物组rna分子及其他生物(包括宿主生物)的rna分子,但微生物组rna得到了富集。
54.4.对核酸消化液进行纯化
55.对核酸消化液进行纯化旨在将核酸消化液中的rna分子与其他物质分离,起到进一步富集rna的作用。rna纯化和富集的方法、手段和装置是本领域公知的,在此不作赘述。作为一个实例,可以采用磁珠进行rna纯化。磁珠的一个非限制性例子为ampure xp beads。磁珠纯化后,可以用nuclease-free water回溶核酸,得到分离的rna分子。
56.5.对分离的rna分子进行片段化
57.通常,可以采用机械打断、片段化酶处理、热打断的方式对分离的rna分子进行片段化,得到片段化的rna分子。在本发明方法中,通过将分离的rna分子在缓冲液存在下在85℃-94℃孵育3-10min来进行片段化。本发明方法优选地采用了热打断的方式进行rna片段化,可以减少机械打断带来的rna损失,与片段化酶处理相比成本也较低。
58.6.将片段化的rna分子进行反转录
59.将片段化的rna分子进行反转录通常涉及cdna第一链和cdna第二链的合成。cdna第一链的合成涉及将片段化的rna分子在第一链缓冲液中,在引物(例如随机引物)、dntps、反转录酶等组分存在下进行孵育,形成rna/dna杂交体;cdna第二链的合成涉及将rna/dna杂交体在第二链缓冲液中,在dntps、dnapolymerase i、rnase h等组分存在下进行孵育,形成cdna第二链。
60.合成了cdna第二链后,可通使用磁珠进行纯化,例如可以采用ampure xp beads进行纯化,得到cdna分子,用nuclease-free water回溶。
61.7.用cdna分子进行文库构建
62.用cdna分子进行文库构建通常涉及末端补平、加a、加接头、pcr扩增,制备得到cdna文库。可以按照测序平台的文库构建说明书来构建cdna文库,例如mgiseq测序平台文库构建说明书。
63.在构建了cdna文库后,通常需要检测文库质量。例如,可以采用agilent 2100 bioanalyzer检测仪按照说明书进行文库质量检测。
64.8.对cdna文库进行高通量测序
65.在构建了cdna文库并优选进行文库质量检测后,在高通量测序平台上机进行高通量测序,得到高通量测序数据。mgiseq测序平台是一种优选的高通量测序平台,其可提供多种测序通量、多种测序读长类型的个性化测序方案,测序周期可缩短至4-5h,可满足快速检测的需求,同时测序成本也显著低于其他高通量测序平台。然而,应当理解,本发明方法也可以在其他测序平台上实现。
66.9.对高通量测序数据进行数据分析
67.将下机的高通量测序数据与目的微生物的参考基因组进行比对,将仅能比对上参考基因组的读长(reads)进行计数,检测出待测样本中目的微生物组rna状况。本领域有专门的算法和软件进行高通量测序数据分析,在此不作赘述。
68.应当说明的是,以上按顺序对本发明方法的各步骤进行说明,并不表明本发明方法严格按照所述的步骤顺序和步骤数目来进行。尤其是,本发明方法中的某些步骤可能可以合并在一起进行。例如用dna酶对核酸样本进行dna消化和使dna酶失活可以合并在一起进行。
69.以下通过实施例详细说明本发明的技术方案,应当理解,实施例仅仅是示例性的,不能理解为对本发明保护范围的限制。
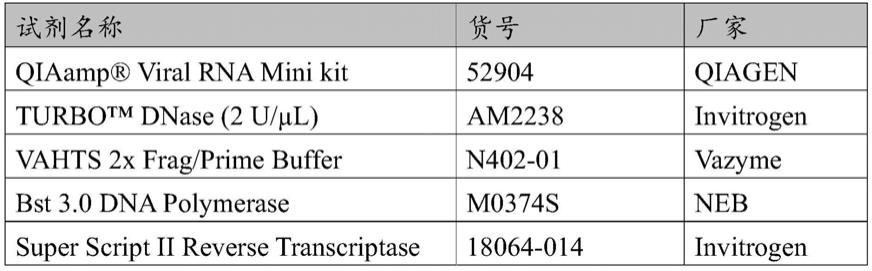
70.以下实施例用到的试剂如下表1所示。
71.表1
[0072][0073][0074]
实施例1
[0075]
柯萨奇病毒是一种肠病毒,核酸为单股rna。本实施例以检测样品中柯萨奇病毒a16型为例,对本发明的基于高通量测序技术检测目的微生物基因组rna的方法进行举例说明。该柯萨奇病毒a16型来源于本技术人的合作医院提供的临床剩余样本。以下说明本发明方法的示例性检测步骤。
transcriptase,25℃孵育5min,42℃孵育30min,85℃孵育2min,4℃保持。
[0092]
4.cdna第二链合成:与实施例1相同。
[0093]
5.核酸片段化:使用bioruptor pico打断仪进行打断,打断程序为30个cycle(time on:30s;time off:30s),期间每4个cycle停一次,对样品进行震荡离心。
[0094]
6.cdna文库构建、高通量测序及数据分析与实施例1相同。
[0095]
比较实施例1和对比例1的检测步骤可见,对比例1的柯萨奇病毒a16型模拟样本配制、核酸提取、cdna第二链合成以及cdna文库构建、高通量测序及数据分析步骤与实施例1相同;对比例1在提取核酸后,不经dna消化、rna纯化和rna片段化步骤直接进行cdna第一链合成,因此cdna第一链合成步骤与实施例1的操作稍有不同,n6 primer在此步骤中加入,并且此步骤没有加入bst 3.0dna polymerase;对比例1的核酸片段化步骤在cdna第二链合成步骤后进行,并且采用打断仪进行机械打断。
[0096]
实施例1所代表的本发明方法和对比例1所代表的常规方法的病毒检测结果如下表2所示,其中各柯萨奇病毒a16型浓度下的数据表示比对上柯萨奇病毒a16型基因组的读长(reads)数。
[0097]
表2:
[0098][0099]
由表2可见,在hela细胞含量为105cell/ml的样本中,本发明方法最低可检测到100cp/ml的柯萨奇病毒a16型,而常规方法即使有1000cp/ml的柯萨奇病毒a16型也无法检测到。
[0100]
本发明方法使用条件反应温度较低(例如37℃)、反应时间较短(例如10min)的温和dnase消化法,有效降低了dna消化流程对rna的损伤。进一步地,本发明方法在rna反转录中采用热打断的方式进行rna片段化,减少了机械打断带来的rna损失,成本也比采用打断酶要低。应该指出的是,rna片段在高盐、高温条件下易断裂,而dna片段则不易断裂,热打断适用于rna片段而不适用于dna片段,因此如果样本中存在较高含量的dna,会与打断buffer中的盐离子结合影响rna片段化效果。因此,本发明方法采用温和的dna消化,还有助于热打断效果。另外,本发明方法还对反转录反应体系进行优化,在cdna第一链合成中添加了bst 3.0dna polymerase以提高rna反转录效率,有助于cdna文库的构建。因此,本发明方法可以高效、快速、低成本地富集微生物基因组rna,提高微生物基因组rna的含量,提高rna高通量测序文库构建的成功率,从而提高微生物基因组rna的检测灵敏度。
[0101]
以上应用了具体实例对本发明进行了阐述,只是用于帮助理解本发明,并不用以限制本发明。本发明所属技术领域的技术人员依据本发明的构思,还可以做出若干简单推演、变形或替换。这些推演、变形或替换方案也落入本发明的权利要求范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1