NCre/CCre系统及Cre-GFP融合蛋白的构建方法与应用与流程
ncre/ccre系统及cre-gfp融合蛋白的构建方法与应用
技术领域
1.本发明涉及生物技术领域中,ncre/ccre系统及cre-gfp融合蛋白的构建方法与应用。
背景技术:
2.cre-loxp重组酶系统被广泛应用于特定基因启动下的编辑动物基因组。然而,目前来看单个基因或者启动子并不能很好的再定义一种细胞类型,往往需要两个甚至更多基因一起才能更准确的定义某一类细胞类型。如果想要在这样的细胞中敲除某个基因或者标记这群细胞就需要用到split-cre系统(ncre/ccre系统)或者多种重组酶一起联用。split-cre系统是利用两个特异性基因启动子分别启动n端cre和c端cre表达,只有在同一个细胞中同时表达两个特异性基因才能有cre重组酶的活性,进而敲除目的基因或者启动报告基因的表达。基因敲除的效率和重组之后cre活性密切相关,重组之后cre的活性又严格依赖于将ncre和ccre聚在一起的二聚体分子亲和力和稳定性。目前,使用较多的自发形成二聚体的分子有gcn4-coiled coil domain、split-intein等等。但是,这些split-cre系统重组之后均未能达到接近全长cre的活性值,进一步提高split-cre系统的活性具有重要的意义。
技术实现要素:
3.本发明的目的是提供高重组酶活性的ncre/ccre系统及新的cre-gfp融合蛋白。
4.本发明提供了一种ncre/ccre系统,其名称为split-spy-gcre系统,所述split-spy-gcre系统由名称分别为spy-gncre
aa59
和spy-gccre
aa60
的蛋白质组成;
5.所述spy-gncre
aa59
为如下a1)、a2)、a3)或a4):
6.a1)氨基酸序列是序列15的第21-246位的蛋白质;
7.a2)氨基酸序列是序列15的第13-246位的蛋白质;
8.a3)将序列表中序列15的第21-246位或第13-246位所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质;
9.a4)在a1)或a2)或a3)的n端或/和c端连接标签得到的融合蛋白质;
10.所述spy-gccre
aa60
为如下b1)、b2)、b3)或b4):
11.b1)氨基酸序列是序列17的第23-511位的蛋白质;
12.b2)氨基酸序列是序列17的第15-511位的蛋白质;
13.b3)将序列表中序列17的第23-511位或第15-511位所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质;
14.b4)在b1)或b2)或b3)的n端或/和c端连接标签得到的融合蛋白质。
15.为了使a1)或a2)或a3)或b1)或b2)或b3)蛋白质便于纯化,可在其氨基末端或羧基末端连接上如下表1所示的标签。
16.表1:标签的序列
17.标签残基序列poly-arg5-6(通常为5个)rrrrrpoly-his2-10(通常为6个)hhhhhhflag8dykddddkstrep-tag ii8wshpqfekc-myc10eqkliseedl
18.上述a3)经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的蛋白质,为与a1)或a2)的蛋白质的氨基酸序列具有75%或75%以上同一性且具有相同功能的蛋白质。上述b3)经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的蛋白质,为与b1)或b2)的蛋白质的氨基酸序列具有75%或75%以上同一性且具有相同功能的蛋白质。所述具有75%或75%以上同一性为具有75%、具有80%、具有85%、具有90%、具有95%、具有96%、具有97%、具有98%或具有99%的同一性。
19.上述a3)或b3)中的蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
20.上述a3)中的蛋白质的编码基因可通过将编码a1)或a2)的蛋白质的dna序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5
′
端和/或3
′
端连上上表所示的标签的编码序列得到。上述b3)中的蛋白质的编码基因可通过将编码b1)或b2)的蛋白质的dna序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5
′
端和/或3
′
端连上上表所示的标签的编码序列得到。
21.a4)所述融合蛋白质可为序列表中序列15所示的蛋白质。
22.b4)所述融合蛋白质可为序列表中序列17所示的蛋白质。
23.本发明还提供了另一种ncre/ccre系统,由与所述spy-gncre
aa59
相关的生物材料和与所述spy-gccre
aa60
相关的生物材料组成;
24.与所述spy-gncre
aa59
相关的生物材料为下述c1)至c5)中的任一种:
25.c1)编码所述spy-gncre
aa59
的核酸分子;
26.c2)含有c1)所述核酸分子的表达盒;
27.c3)含有c1)所述核酸分子的重组载体、或含有c2)所述表达盒的重组载体;
28.c4)含有c1)所述核酸分子的重组微生物、或含有c2)所述表达盒的重组微生物、或含有c3)所述重组载体的重组微生物;
29.c5)含有c1)所述核酸分子的转基因细胞系、或含有c2)所述表达盒的转基因细胞系;
30.与所述spy-gccre
aa60
相关的生物材料为下述d1)至d5)中的任一种:
31.d1)编码所述spy-gccre
aa60
的核酸分子;
32.d2)含有d1)所述核酸分子的表达盒;
33.d3)含有d1)所述核酸分子的重组载体、或含有d2)所述表达盒的重组载体;
34.d4)含有d1)所述核酸分子的重组微生物、或含有d2)所述表达盒的重组微生物、或含有d3)所述重组载体的重组微生物;
35.d5)含有d1)所述核酸分子的转基因细胞系、或含有d2)所述表达盒的转基因细胞
系。
36.上述系统中,c1)所述核酸分子可为如下c11)或c12)或c13)或c14)或c15):
37.c11)序列表中序列16的第61-741位所示的cdna分子或dna分子;
38.c12)序列表中序列16的第37-741位所示的cdna分子或dna分子;
39.c13)序列表中序列16所示的cdna分子或dna分子;
40.c14)与c11)或c12)或c13)限定的核苷酸序列具有75%或75%以上同一性,且编码所述spy-gncre
aa59
的cdna分子或dna分子;
41.c15)在严格条件下与c11)或c12)或c13)或c14)限定的核苷酸序列杂交,且编码所述spy-gncre
aa59
的cdna分子或dna分子;
42.d1)所述核酸分子可为如下d11)或d12)或d13)或d14)或d15):
43.d11)序列表中序列18的第67-1536位所示的cdna分子或dna分子;
44.d12)序列表中序列18的第43-1536位所示的cdna分子或dna分子;
45.d13)序列表中序列18所示的cdna分子或dna分子;
46.d14)与d11)或d12)或d13)限定的核苷酸序列具有75%或75%以上同一性,且编码所述spy-gccre
aa60
的cdna分子或dna分子;
47.d15)在严格条件下与d11)或d12)或d13)或d14)限定的核苷酸序列杂交,且编码所述spy-gccre
aa60
的cdna分子或dna分子。
48.本发明中,所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna或hnrna等。
49.本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的核苷酸序列进行突变。那些经过人工修饰的,具有与本发明的核苷酸序列75%或者更高同一性的核苷酸,只要编码本发明的蛋白质且具有相同蛋白质功能,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
50.这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的核苷酸序列具有75%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
51.上文中,所述严格条件可为如下:50℃,在7%十二烷基硫酸钠(sds)、0.5m napo4和1mm edta的混合溶液中杂交,在50℃,2
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m napo4和1mm edta的混合溶液中杂交,在50℃,1
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m napo4和1mm edta的混合溶液中杂交,在50℃,0.5
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m napo4和1mm edta的混合溶液中杂交,在50℃,0.1
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m napo4和1mm edta的混合溶液中杂交,在65℃,0.1
×
ssc,0.1%sds中漂洗;也可为:在6
×
ssc,0.5%sds的溶液中,在65℃下杂交,然后用2
×
ssc,0.1%sds和1
×
ssc,0.1%sds各洗膜一次;也可为:2
×
ssc,0.1%sds的溶液中,在68℃下杂交并洗膜2次,每次5min,又于0.5
×
ssc,0.1%sds的溶液中,在68℃下杂交并洗膜2次,每次15min;也可为:0.1
×
sspe(或0.1
×
ssc)、0.1%sds的溶液中,65℃条件下杂交并洗膜。
52.上述75%或75%以上同一性,可为80%、85%、90%或95%以上的同一性。
53.本发明中的表达盒,是指能够在宿主细胞中表达目的蛋白质的dna,该dna不但可包括启动目的蛋白编码基因转录的启动子,还可包括终止目的蛋白编码基因转录的终止子。进一步,所述表达盒还可包括增强子序列。
54.可用现有的表达载体构建含有所述目的蛋白编码基因表达盒的重组载体。
55.本发明中,所述载体可为质粒、黏粒、噬菌体或病毒载体。所述质粒具体可为pcmv-tag2b载体(flag标签)、pcmv-tag3b载体(myc标签)、mscv-thy1.1载体、mscv-ngfr载体或pegfp-n1载体。
56.c3)所述重组载体可为具体实施方式中的mscv-thy1.1-spy-gncre
aa59
。
57.d3)所述重组载体可为具体实施方式中的mscv-ngfr-spy-gccre
aa60
。
58.本发明中,所述微生物可为酵母、细菌、藻或真菌。所述细胞系可为植物细胞系或动物细胞系(如293t细胞)。
59.本发明所述细胞系不包括繁殖材料。
60.本发明还提供了另一种ncre/ccre系统,其名称为split-gfp-cre系统,所述split-gfp-cre系统由名称分别为gfp-ncre
aa59
和gfp-ccre
aa60
的蛋白质组成;
61.所述gfp-ncre
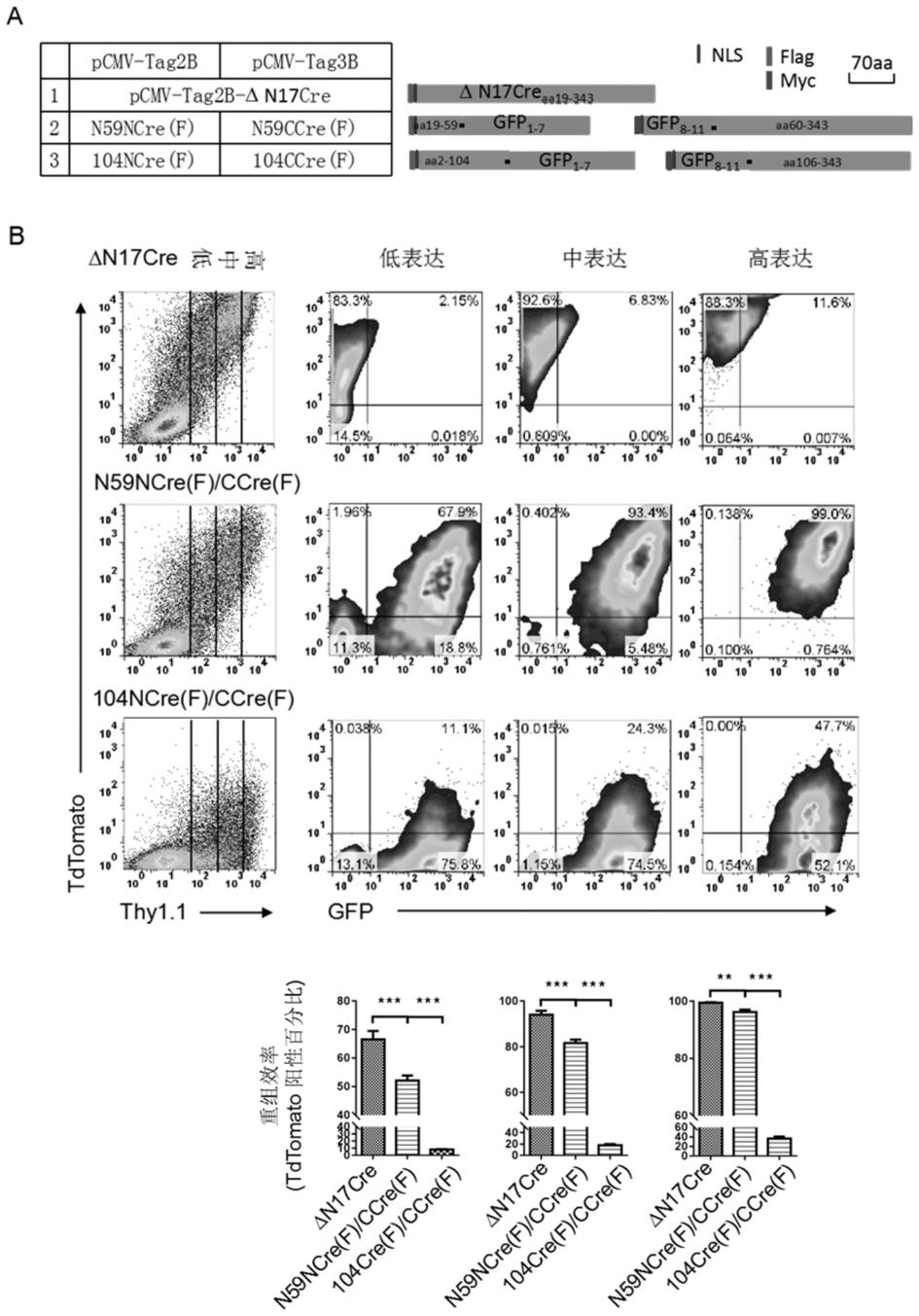
aa59
为如下e1)、e2)、e3)或e4):
62.e1)氨基酸序列是序列3的第25-226位的蛋白质;
63.e2)氨基酸序列是序列3的第17-226位的蛋白质;
64.e3)将序列表中序列3的第25-226位或第17-226位所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质;
65.e4)在e1)或e2)或e3)的n端或/和c端连接标签得到的融合蛋白质;
66.所述gfp-ccre
aa60
为如下f1)、f2)、f3)或f4):
67.f1)氨基酸序列是序列5的第27-389位的蛋白质;
68.f2)氨基酸序列是序列5的第19-389位的蛋白质;
69.f3)将序列表中序列5的第27-389位或第19-389位所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质;
70.f4)在f1)或f2)或f3)的n端或/和c端连接标签得到的融合蛋白质。
71.为了使e1)或e2)或e3)或f1)或f2)或f3)蛋白质便于纯化,可在其氨基末端或羧基末端连接上如上表1所示的标签。
72.上述e3)经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的蛋白质,为与e1)或e2)的蛋白质的氨基酸序列具有75%或75%以上同一性且具有相同功能的蛋白质。上述f3)经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的蛋白质,为与f1)或f2)的蛋白质的氨基酸序列具有75%或75%以上同一性且具有相同功能的蛋白质。
73.上述e3)或f3)中的蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
74.上述e3)中的蛋白质的编码基因可通过将编码e1)或e2)的蛋白质的dna序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5
′
端和/或3
′
端连上上表所示的标签的编码序列得到。上述f3)中的蛋白质的编码基因可通过将编码f1)或f2)的蛋白质的dna序列中缺失一个或几个氨基酸残基的密码子,和/或进行
一个或几个碱基对的错义突变,和/或在其5
′
端和/或3
′
端连上上表所示的标签的编码序列得到。
75.e4)所述融合蛋白质可为序列表中序列3所示的蛋白质。
76.f4)所述融合蛋白质可为序列表中序列5所示的蛋白质。
77.本发明还提供了另一种ncre/ccre系统,由与所述gfp-ncre
aa59
相关的生物材料和与所述gfp-ccre
aa60
相关的生物材料组成;
78.与所述gfp-ncre
aa59
相关的生物材料为下述g1)至g5)中的任一种:
79.g1)编码所述gfp-ncre
aa59
的核酸分子;
80.g2)含有g1)所述核酸分子的表达盒;
81.g3)含有g1)所述核酸分子的重组载体、或含有g2)所述表达盒的重组载体;
82.g4)含有g1)所述核酸分子的重组微生物、或含有g2)所述表达盒的重组微生物、或含有g3)所述重组载体的重组微生物;
83.g5)含有g1)所述核酸分子的转基因细胞系、或含有g2)所述表达盒的转基因细胞系;
84.与所述gfp-ccre
aa60
相关的生物材料为下述h1)至h5)中的任一种:
85.h1)编码所述gfp-ccre
aa60
的核酸分子;
86.h2)含有h1)所述核酸分子的表达盒;
87.h3)含有h1)所述核酸分子的重组载体、或含有h2)所述表达盒的重组载体;
88.h4)含有h1)所述核酸分子的重组微生物、或含有h2)所述表达盒的重组微生物、或含有h3)所述重组载体的重组微生物;
89.h5)含有h1)所述核酸分子的转基因细胞系、或含有h2)所述表达盒的转基因细胞系。
90.上述系统中,g1)所述核酸分子可为如下g11)或g12)或g13)或g14)或g15):
91.g11)序列表中序列4的第73-681位所示的cdna分子或dna分子;
92.g12)序列表中序列4的第49-681位所示的cdna分子或dna分子;
93.g13)序列表中序列4所示的cdna分子或dna分子;
94.g14)与g11)或g12)或g13)限定的核苷酸序列具有75%或75%以上同一性,且编码所述gfp-ncre
aa59
的cdna分子或dna分子;
95.g15)在严格条件下与g11)或g12)或g13)或g14)限定的核苷酸序列杂交,且编码所述gfp-ncre
aa59
的cdna分子或dna分子;
96.h1)所述核酸分子可为如下h11)或h12)或h13)或h14)或h15):
97.h11)序列表中序列6的第79-1170位所示的cdna分子或dna分子;
98.h12)序列表中序列6的第55-1170位所示的cdna分子或dna分子;
99.h13)序列表中序列6所示的cdna分子或dna分子;
100.h14)与h11)或h12)或h13)限定的核苷酸序列具有75%或75%以上同一性,且编码所述gfp-ccre
aa60
的cdna分子或dna分子;
101.h15)在严格条件下与h11)或h12)或h13)或h14)限定的核苷酸序列杂交,且编码所述gfp-ccre
aa60
的cdna分子或dna分子。
102.g3)所述重组载体可为具体实施方式中的pcmv-tag2b-gfp-ncre
aa59
。
103.h3)所述重组载体可为具体实施方式中的pcmv-tag3b-gfp-ccre
aa60
。
104.本发明还提供了一种蛋白质,其名称是
△
n17cre
59-gfp,为如下i1)、i2)、i3)、i4)或i5):
105.i1)氨基酸序列是序列21的第10-574位的蛋白质;
106.i2)氨基酸序列是序列21的第2-574位的蛋白质;
107.i3)氨基酸序列是序列21的蛋白质;
108.i4)将序列表中序列21或其第10-574位或其第2-574位的所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质;
109.i5)在i1)或i2)或i3)或i4)的n端或/和c端连接标签得到的融合蛋白质。
110.为了使i1)或i2)或i3)或i4)蛋白质便于纯化,可在其氨基末端或羧基末端连接上如上表1所示的标签。
111.上述i4)经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的蛋白质,为与i1)或i2)或i3)的蛋白质的氨基酸序列具有75%或75%以上同一性且具有相同功能的蛋白质。
112.上述i4)中的蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
113.上述i4)中的蛋白质的编码基因可通过将编码i1)或i2)或i3)的蛋白质的dna序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5
′
端和/或3
′
端连上上表所示的标签的编码序列得到。
114.本发明还提供了与
△
n17cre
59-gfp相关的生物材料,为下述j1)至j5)中的任一种:
115.j1)编码
△
n17cre
59-gfp的核酸分子;
116.j2)含有j1)所述核酸分子的表达盒;
117.j3)含有j1)所述核酸分子的重组载体、或含有j2)所述表达盒的重组载体;
118.j4)含有j1)所述核酸分子的重组微生物、或含有j2)所述表达盒的重组微生物、或含有j3)所述重组载体的重组微生物;
119.j5)含有j1)所述核酸分子的转基因细胞系、或含有j2)所述表达盒的转基因细胞系。
120.上述生物材料中,j1)所述核酸分子可为如下j11)或j12)或j13)或j14)或j15):
121.j11)序列表中序列22的第28-1725位所示的cdna分子或dna分子;
122.j12)序列表中序列22的第4-1725位所示的cdna分子或dna分子;
123.j13)序列表中序列22所示的cdna分子或dna分子;
124.j14)与j11)或j12)或j13)限定的核苷酸序列具有75%或75%以上同一性,且编码
△
n17cre
59-gfp的cdna分子或dna分子;
125.j15)在严格条件下与j11)或j12)或j13)或j14)限定的核苷酸序列杂交,且编码
△
n17cre
59-gfp的cdna分子或dna分子。
126.j3)所述重组载体可为具体实施方式中的pegfp-n1
-△
n17cre
59-gfp。
127.上文任一所述系统,或所述
△
n17cre
59-gfp,或所述生物材料的下述任一应用,也均属于本发明的保护范围:
128.x1、基因编辑;
129.x2、敲除目的基因;
130.x3、向基因组中导入目的基因;
131.x4、制备基因编辑产品;
132.x5、制备敲除目的基因产品;
133.x6、制备向基因组中导入目的基因产品。
134.本发明提供的ncre/ccre系统将其cre重组酶活性提高到了非常接近cre全长时的活性,可以最大程度的降低因cre重组酶活性带来的ncre/ccre系统双基因特异性敲除或标记效率低的问题。另外,本发明也首次把gfp实时标记方法引入ncre/ccre系统,可以通过检测gfp的表达与否指示两个特异性基因(分别启动ncre/ccre的基因)的同步表达情况,能够在活细胞或动物体内执行定量(cre模式)和可见(gfp模式)cre-loxp基因编辑测定,拓展了ncre/ccre系统的应用范围和有效检测指标,具有很好的应用前景。
附图说明
135.图1为不同断裂位置对cre重组酶的活性的影响。a为两种断裂位置的ncre/ccre系统的载体构建示意图;b为不同断裂位置对cre重组酶的活性的影响,上图为表达水平的检测结果,下图为各系统低中高(左、中、右)蛋白表达水平下的重组效率(%)统计图。
136.图2为不同ncre/ccre系统的cre重组酶活性比较。gcn4-cre、intein-cre、gfp-cre分别表示split-gcn4-cre、split-intein-cre、split-gfp-cre系统。
137.图3为spytag/spycatcher连接后可以提高gfp的荧光信号。gfp-cre和spy-gcre分别表示split-gfp-cre和split-spy-gcre系统。
138.图4为spytag/spycatcher连接后可以提高cre重组酶活性。n17cre表示
△
n17cre,gfp-cre和spy-gcre分别表示split-gfp-cre和split-spy-gcre系统。
139.图5为
△
n17cre
59-gfp融合蛋白cre重组酶活性的检测。a为
△
n17cre
59-gfp融合蛋白构建示意图;b为cre重组酶活性的检测。
140.图1-5中,*表示差异达到显著性水平,p<0.05;**表示差异达到极显著性水平,p<0.01;***表示差异达到极显著性水平,p<0.001;n.s表示无显著差异。
具体实施方式
141.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。以下实施例中的定量试验,均设置二到三次独立重复实验,每次实验均设置至少两个重复,结果取平均值。下述实施例中,如无特殊说明,序列表中各核苷酸序列的第1位均为相应dna/rna的5
′
末端核苷酸,末位均为相应dna/rna的3
′
末端核苷酸。
142.下述实施例中的pcmv-tag2b载体(flag标签)为将addgene公司的pcmv-tag2b-ncre(plasmid#106368)(http://www.addgene.org/106368/)的bamhi和hindiii的识别序列间的dna片段(包括bamhi和hindiii的识别序列)替换为bamhi、ecor i、sma i、pst i、spe i和hind iii的识别序列(5
′-
ggatccgaattccccgggctgcagactagtaagctt-3
′
)得到的重组载体。
143.下述实施例中的pcmv-tag3b载体(myc标签)为将addgene公司的pcmv-tag3b-ccre
(plasmid#106369)(http://www.addgene.org/106369/)的bamhi和hindiii的识别序列间的dna片段(包括bamhi和hindiii的识别序列)替换为bamhi、ecor i、sma i、pst i、spe i和hind iii的识别序列(5
′-
ggatccgaattccccgggctgcagactagtaagctt-3
′
)得到的重组载体。
144.下述实施例中的rosa26-loxp-stop-loxp-tdtomato检测载体为addgene公司的pcalnl-tdtomato(plasmid#125573)(http://www.addgene.org/125573/)。
145.下述实施例中的mscv-thy1.1载体为文献“jitao guo,jianhua zhang,et al.constitutive activation of mek1 promotes treg cell instability in vivo.j biol chem.2014dec 19;289(51):35139
–
35148.doi:10.1074/jbc.m114.589192”中的pmscv-ires-thy1.1,公众可从申请人处获得。
146.下述实施例中的mscv-ngfr载体为addgene公司的ngfr(plasmid#27489)(http://www.addgene.org/27489/)。
147.下述实施例中的pegfp-n1载体为addgene公司的pegfp-n1-ro1gfp(plasmid#82369)(http://www.addgene.org/82369/)。
148.实施例1、不同断裂位置对cre重组酶的活性的影响
149.一、不同断裂位置对cre重组酶的活性的影响
150.通过选择在n端缺失17个氨基酸(第2-18位)的cre重组酶(记为
△
n17cre)的不同位置(aa59和aa104)进行断裂,然后将得到的n端多肽和c端多肽分别与n端gfp和c端gfp通过一个gggs连接肽相连接,获得不同的ncre/ccre系统,并对其cre重组酶的活性进行检测。步骤如下:
151.1、重组载体的构建
152.合成序列表中序列2的第49-1050位所示的dna片段,将pcmv-tag2b载体(flag标签)的ecor i和pst i识别序列间的小dna片段替换为序列表中序列2的第49-1050位所示的dna片段,将得到的序列正确的重组载体记为pcmv-tag2b
-△
n17cre。pcmv-tag2b
-△
n17cre含有序列表中序列2所示的dna片段,能表达序列表中序列1所示的
△
n17cre与flag、核定位序列(nls)的融合蛋白质(记为
△
n17cre融合蛋白)。
153.其中,序列2所示的dna片段(记为
△
n17cre融合基因)编码序列1所示的
△
n17cre融合蛋白,序列2的第73-1050位为
△
n17cre基因,序列1的第2-9位为flag,第17-24位为nls,第25-349位为
△
n17cre。
154.合成序列表中序列4的第49-681位所示的dna片段,将pcmv-tag2b载体(flag标签)的ecor i和pst i识别序列间的小dna片段替换为序列表中序列4的第49-681位所示的dna片段,将得到的序列正确的重组载体记为pcmv-tag2b-gfp-ncre
aa59
。pcmv-tag2b-gfp-ncre
aa59
含有序列表中序列4所示的dna片段,能表达序列表中序列3所示的gfp-ncre
aa59
与flag、nls的融合蛋白质(记为n59ncre(f))。
155.其中,序列4所示的dna片段(记为n59ncre(f)基因)编码序列3所示的融合蛋白质n59ncre(f),序列4的第73-681位为gfp-ncre
aa59
基因,序列3的第2-9位为flag,第17-24位为nls,第25-226位为gfp-ncre
aa59
,gfp-ncre
aa59
为cre重组酶的第19-59位氨基酸与gfp的第1-7β折叠片形成的融合蛋白质,由gfp-ncre
aa59
基因(序列4的第73-681位)编码。
156.合成序列表中序列6的第55-1170位所示的dna片段,将pcmv-tag3b载体(myc标签)的ecor i和pst i识别序列间的小dna片段替换为序列表中序列6的第55-1170位所示的dna
片段,将得到的序列正确的重组载体记为pcmv-tag3b-gfp-ccre
aa60
。pcmv-tag3b-gfp-ccre
aa60
含有序列表中序列6所示的dna片段,能表达序列表中序列5所示的gfp-ccre
aa60
与myc、nls的融合蛋白质(记为n59ccre(f))。
157.其中,序列6所示的dna片段(记为n59ccre(f)基因)编码序列5所示的融合蛋白质n59ccre(f),序列6的第79-1170位为gfp-ccre
aa60
基因,序列5的第2-11位为myc,第19-26位为nls,第27-389位为gfp-ccre
aa60
,gfp-ccre
aa60
为cre重组酶的第60-343位与gfp的第8-11β折叠片形成的融合蛋白质。
158.合成序列表中序列8的第49-867位所示的dna片段,将pcmv-tag2b载体(flag标签)的ecor i和pst i识别序列间的小dna片段替换为序列表中序列8的第49-867位所示的dna片段,将得到的序列正确的重组载体记为pcmv-tag2b-gfp-ncre
aa104
。pcmv-tag2b-gfp-ncre
aa104
含有序列表中序列8所示的dna片段,能表达序列表中序列7所示的gfp-ncre
aa104
与flag、nls的融合蛋白质(记为104ncre(f))。
159.其中,序列8所示的dna片段(记为104ncre(f)基因)编码序列7所示的融合蛋白质104ncre(f),序列7的第2-9位为flag,第17-24位为nls,第25-288位为gfp-ncre
aa104
,gfp-ncre
aa104
为cre重组酶的第2-104位氨基酸与gfp的第1-7β折叠片形成的融合蛋白质。
160.合成序列表中序列10的第55-1032位所示的dna片段,将pcmv-tag3b载体(myc标签)的ecor i和pst i识别序列间的小dna片段替换为序列表中序列10的第55-1032位所示的dna片段,将得到的序列正确的重组载体记为pcmv-tag3b-gfp-ccre
aa106
。pcmv-tag3b-gfp-ccre
aa106
含有序列表中序列10所示的dna片段,能表达序列表中序列9所示的gfp-ccre
aa106
与myc、nls的融合蛋白质(记为104ccre(f))。
161.其中,序列10所示的dna片段(记为104ccre(f)基因)编码序列9所示的融合蛋白质104ccre(f),序列9的第2-11位为myc,第19-26位为nls,第27-343位为gfp-ccre
aa106
,gfp-ccre
aa106
为cre重组酶的第106-343位氨基酸与gfp的第8-11β折叠片形成的融合蛋白质。
162.各重组载体的构建如图1中a所示。
163.2、ncre/ccre系统的cre重组酶活性的检测
164.将步骤1的pcmv-tag2b
-△
n17cre、pcmv-tag2b-gfp-ncre
aa59
与pcmv-tag3b-gfp-ccre
aa60
、pcmv-tag2b-gfp-ncre
aa104
与pcmv-tag3b-gfp-ccre
aa106
作为待测载体转染293t细胞,检测cre重组酶切割前后的活性变化,pcmv-tag2b
-△
n17cre单独转染,转染量为200ng,即
△
n17cre系统;pcmv-tag2b-gfp-ncre
aa59
与pcmv-tag3b-gfp-ccre
aa60
组合转染,转染量各为200ng,即n59ncre(f)/ccre(f)系统;pcmv-tag2b-gfp-ncre
aa104
与pcmv-tag3b-gfp-ccre
aa106
组合转染,转染量各为200ng,即104ncre(f)/ccre(f)系统。步骤如下:
165.将待测载体和rosa26-loxp-stop-loxp-tdtomato检测载体(400ng)和mscv-thy1.1载体(100ng)一起共转染293t细胞(转染方法参考lip2000说明书),转染20小时之后,收集293t细胞,利用thy1.1抗体(his51,ebioscience
tm
,货号17-0900-82)染色,bdfacscalibur流式细胞仪检测,根据转染效率报告载体的thy1.1表达的强弱,将ncre/ccre系统蛋白表达水平分为高中低三个档次,分别统计各系统不同蛋白表达水平下tdtomato阳性的细胞比例,也即各系统的重组效率。
166.结果(图1中b)显示,
△
n17cre在低、中、高表达水平下tdtomato阳性的细胞比例分别为66.61
±
2.9、94.08
±
1.65和99.45
±
0.26%,在aa59处(即cre重组酶的第59与60位氨
基酸间)切割时,所得名称为n59ncre(f)/ccre(f)系统的ncre/ccre系统在低、中、高表达水平下tdtomato阳性的细胞比例分别为52.16
±
1.73、81.65
±
1.5和96.2
±
0.85%,在aa104处(即cre重组酶的第104与106位氨基酸间)切割时,所得名称为104ncre(f)/ccre(f)系统的ncre/ccre系统在低、中、高表达水平下tdtomato阳性的细胞比例分别为8.18
±
0.89、17.8
±
2.2和36.22
±
4.35%。说明,aa59处是一个较好的断裂点,在该位点切割后的ncre/ccre系统cre重组酶活性可以达到
△
n17cre的cre活性的78%,即n59ncre(f)与n59ccre(f)所形成的n59ncre(f)/ccre(f)系统的cre重组酶的活性可达到
△
n17cre的cre活性的78%,将该系统命名为split-gfp-cre。
167.二、split-gfp-cre系统cre重组酶的活性与其他系统的比较
168.目前报道的以aa59为断裂点且重组酶活性较好的split-cre系统有split-gcn4-cre系统和split-intein-cre系统,通过基因合成的方法,将步骤一构建的split-gfp-cre的gfp-ncre
aa59
和gfp-ccre
aa60
以及上述两种split-cre的n端cre和c端cre分别连接到mscv-thy1.1载体上,比较不同split-cre系统的cre重组酶的活性,步骤如下:
169.1、重组载体的构建
170.合成序列表中序列2所示的dna片段,将mscv-thy1.1载体的not i和sali识别序列间的小dna片段替换为序列表中序列2所示的dna片段,将得到的序列正确的重组载体记为mscv-thy1.1
-△
n17cre,mscv-thy1.1
-△
n17cre能表达序列表中序列1所示的
△
n17cre融合蛋白。
171.split-gfp-cre系统重组载体:
172.合成序列表中序列4所示的dna片段,将mscv-thy1.1载体的not i和sali识别序列间的小dna片段替换为序列表中序列4所示的dna片段,将得到的序列正确的重组载体记为mscv-thy1.1-gfp-ncre
aa59
,mscv-thy1.1-gfp-ncre
aa59
能表达序列表中序列3所示的n59ncre(f)。
173.合成序列表中序列6所示的dna片段,将mscv-thy1.1载体的not i和sali识别序列间的小dna片段替换为序列表中序列6所示的dna片段,将得到的序列正确的重组载体记为mscv-thy1.1-gfp-ccre
aa60
,mscv-thy1.1-gfp-ccre
aa60
能表达序列表中序列5所示的n59ccre(f)。
174.split-gcn4-cre系统的重组载体:
175.合成序列表中序列11所示的dna片段,将mscv-thy1.1载体的not i和sali识别序列间的小dna片段替换为序列表中序列11所示的dna片段,将得到的序列正确的重组载体记为mscv-thy1.1-gcn4-ncre。
176.合成序列表中序列12所示的dna片段,将mscv-thy1.1载体的not i和sali识别序列间的小dna片段替换为序列表中序列12所示的dna片段,将得到的序列正确的重组载体记为mscv-thy1.1-gcn4-ccre。
177.split-intein-cre系统的重组载体:
178.合成序列表中序列13所示的dna片段,将mscv-thy1.1载体的not i和sali识别序列间的小dna片段替换为序列表中序列13所示的dna片段,将得到的序列正确的重组载体记为mscv-thy1.1-intein-ncre。
179.合成序列表中序列14所示的dna片段,将mscv-thy1.1载体的not i和sali识别序
列间的小dna片段替换为序列表中序列14所示的dna片段,将得到的序列正确的重组载体记为mscv-thy1.1-intein-ccre。
180.2、ncre/ccre系统的cre重组酶活性的检测
181.将步骤1得到的各系统的载体作为待测载体转染293t细胞,检测cre重组酶活性,mscv-thy1.1
-△
n17cre单独转染,mscv-thy1.1-gfp-ncre
aa59
与mscv-thy1.1-gfp-ccre
aa60
组合转染,mscv-thy1.1-gcn4-ncre与mscv-thy1.1-gcn4-ccre组合转染,mscv-thy1.1-intein-ncre与mscv-thy1.1-intein-ccre组合转染,每种载体的转染量均为200ng。步骤如下:
182.把mscv-thy1.1
-△
n17cre或相配对的同一系统的两种载体和rosa26-loxp-stop-loxp-tdtomato检测载体(400ng)一起共转染293t细胞(转染方法参考lip2000说明书),转染20小时之后,收集293t细胞,thy1.1抗体(his51,ebioscience
tm
,货号17-0900-82)染色,bdfacscalibur流式细胞仪检测,同样根据thy1.1表达的强弱,将split-cre表达水平分为高中低三个档次,分别统计各系统不同表达水平下tdtomato阳性的细胞比例。
183.结果(图2)表明,
△
n17cre在低、中、高表达水平下tdtomato阳性的细胞比例分别为58.41
±
6.40、89.98
±
2.29和98.77
±
0.38%,split-gfp-cre系统在低、中、高表达水平下tdtomato阳性的细胞比例分别为29.19
±
4.31、69.92
±
4.35和94.92
±
1.08%,split-gcn4-cre系统在低、中、高表达水平下tdtomato阳性的细胞比例分别为3.58
±
0.56、21.95
±
2.03和70.84
±
2.43%,split-intein-cre系统在低、中、高表达水平下tdtomato阳性的细胞比例分别为18.91
±
2.63、59.27
±
3.70和92.64
±
1.10%。说明在同样表达水平的情况下,split-gfp-cre具有更好的重组酶活性。另外,由于本发明使用的是两段断裂的gfp(split-gfp)作为二聚体分子,因此可以通过检测gfp的荧光信号指示两个启动子启动的基因是否正在同时表达。
184.实施例2、spytag/spycatcher可以提高split-gfp-cre系统的cre重组酶活性
185.本实施例通过spytag/spycatcher连接实施例1的split-gfp-cre系统的两个蛋白,构建split-spy-gcre系统,并检测其cre重组酶活性,步骤如下:
186.1、重组载体的构建
187.split-spy-gcre系统:
188.合成序列表中序列16所示的dna片段,将mscv-thy1.1载体的bgl ii和sal i识别序列间的小dna片段替换为序列表中序列16所示的dna片段,将得到的序列正确的重组载体记为mscv-thy1.1-spy-gncre
aa59
。mscv-thy1.1-spy-gncre
aa59
能表达序列表中序列15所示的融合蛋白质。
189.其中,序列16所示的dna片段编码序列15所示的蛋白质,序列15中,第2-9位为flag,第13-20位为nls,第21-222位为gfp-ncre
aa59
,第223-232位为连接肽(ggggs)x2,第233-246位为spytag。
190.合成序列表中序列18所示的dna片段,将mscv-ngfr载体的bgl ii和ecor i识别序列间的小dna片段替换为序列表中序列18所示的dna片段,将得到的序列正确的重组载体记为mscv-ngfr-spy-gccre
aa60
。mscv-ngfr-spy-gccre
aa60
能表达序列表中序列17所示的融合蛋白质。
191.其中,序列18所示的dna片段编码序列17所示的蛋白质,序列17中,第2-11位为
myc,第15-22位为nls,第23-138位为spycatcher,第139-148位为连接肽(ggggs)x2,第149-511位为gfp-ccre
aa60
。
192.2、ncre/ccre系统的gfp荧光信号强弱的检测
193.将实施例1的mscv-thy1.1-gfp-ncre
aa59
与mscv-thy1.1-gfp-ccre
aa60
以及步骤1的mscv-thy1.1-spy-gncre
aa59
与mscv-ngfr-spy-gccre
aa60
组合,分别检测不同系统的gfp荧光信号强弱:
194.将成对的两个重组载体(200ng+200ng)转染293t细胞(转染方法参考lip2000说明书),转染20小时之后,收集293t细胞,thy1.1抗体(his51,ebioscience
tm
,货号17-0900-82)染色,bd lsr fortessa流式细胞仪检测。根据载体自带的标签基因thy1.1的表达,将cre表达量分为高中低三个档次,分别比较gfp荧光信号强弱。
195.结果显示,split-gfp-cre系统在低中高表达水平下gfp荧光信号值分别为1264
±
48、4080
±
71和12730
±
107,split-spy-gcre系统在低中高表达水平下gfp荧光信号值分别为2080
±
114、5012
±
110和12460
±
102,表明利用spytag/spycatcher连接后在低中表达下可以显著提高gfp的荧光信号,意味着连接之后的gfp具有了更好的稳定性(图3)。
196.3、ncre/ccre系统的cre重组酶活性的检测
197.将实施例1的mscv-thy1.1
-△
n17cre、mscv-thy1.1-gfp-ncre
aa59
与mscv-thy1.1-gfp-ccre
aa60
组合以及步骤1的mscv-thy1.1-spy-gncre
aa59
与mscv-ngfr-spy-gccre
aa60
组合,分别检测不同系统的cre重组酶活性:
198.将mscv-thy1.1
-△
n17cre(200ng)或成对的两个重组载体(200ng+200ng)与cre活性检测报告载体rosa26-loxp-stop-loxp-tdtomato(400ng)转染293t细胞(转染方法参考lip2000说明书),转染20小时之后,收集293t细胞,thy1.1抗体(his51,ebioscience
tm
,货号17-0900-82)染色,bd lsr fortessa流式细胞仪检测。根据载体自带的标签基因thy1.1的表达,将cre表达量分为高中低三个档次(即根据thy1.1荧光强弱将thy1.1阳性细胞分成三等份),分别统计各系统不同表达水平下tdtomato阳性的细胞比例与tdtomato荧光信号值,比较不同系统的cre重组酶活性。
199.结果显示,
△
n17cre在低、中、高表达水平下tdtomato阳性的细胞比例分别为32.83
±
1.68%、89.69
±
0.65%和99.68
±
0.05%,split-gfp-cre系统在低、中、高表达水平下tdtomato阳性的细胞比例分别为27
±
1.39、74.66
±
1.03和98.27
±
0.09%,split-spy-gcre系统在低、中、高表达水平下tdtomato阳性的细胞比例分别为37.02
±
1.15%、79.24
±
0.48%和98.62
±
0.08%。在中和低表达量时和split-gfp-cre相比,spytag/spycatcher连接后都可以显著提升系统的cre重组酶活性,特别是在低表达量时,可以将其cre重组酶活性提高到和
△
n17cre相当的水平,图4。
200.不同cre表达量时tdtomato的荧光值结果显示,
△
n17cre在低、中、高表达水平下tdtomato的荧光值分别为1138
±
82、12330
±
878和93660
±
4286,split-gfp-cre系统在低、中、高表达水平下tdtomato的荧光值分别为1157
±
71、9207
±
447和73780
±
3303,split-spy-gcre系统在低、中、高表达水平下tdtomato的荧光值分别为1818
±
96、13110
±
676和83510
±
1748。结果表明,在中和低表达量时,spytag/spycatcher连接后都可以显著提升split-cre重组酶活性接近
△
n17cre相当的活性水平(图4)。
201.实施例3、cre-gfp融合蛋白的cre重组酶活性检测
202.本实施例根据实施例1和2的结果,将完整的gfp插入在cre重组酶的第59-60位间构建
△
n17cre
59-gfp融合蛋白,并检测其cre重组酶活性,步骤如下:
203.1、重组载体的构建
204.合成序列表中序列20所示的dna片段,将pegfp-n1载体的hind iii和not i识别序列间的小dna片段替换为序列表中序列20所示的dna片段,将得到的序列正确的重组载体记为pegfp-n1
-△
n17cre。pegfp-n1
-△
n17cre能表达序列表中序列19所示的蛋白质。
205.序列20所示的dna片段编码序列19所示的蛋白质,序列19中,第2-9位为nls,第10-334位为
△
n17cre。
206.合成序列表中序列22所示的dna片段,将pegfp-n1载体的hind iii和not i识别序列间的小dna片段替换为序列表中序列22所示的dna片段,将得到的序列正确的重组载体记为pegfp-n1
-△
n17cre
59-gfp。pegfp-n1
-△
n17cre
59-gfp能表达序列表中序列21所示的融合蛋白质,记为
△
n17cre
59-gfp。
207.序列22所示的dna片段编码序列21所示的蛋白质,序列21中,第2-9位为nls,第10-50位为cre重组酶的第19-59位,第53-288位为gfp,第291-574位为cre重组酶的第60-343位。
208.2、cre重组酶活性的检测
209.将步骤1的pegfp-n1
-△
n17cre和pegfp-n1
-△
n17cre
59-gfp分别作为待测载体,检测各自表达的蛋白质的cre重组酶活性:
210.将待测载体(200ng)、rosa26-loxp-stop-loxp-tdtomato检测载体(400ng)和mscv-thy1.1载体(100ng)一起共转染293t细胞(转染方法参考lip2000说明书)。转染20小时之后,收集293t细胞,thy1.1抗体(his51,ebioscience
tm
,货号17-0900-82)染色,bdfacscalibur流式细胞仪检测。根据thy1.1表达的强弱,将cre表达水平分为高中低三个档次(即根据thy1.1荧光强弱将thy1.1阳性细胞分成三等份),分别统计tdtomato阳性的细胞比例。
211.结果(图5)显示,
△
n17cre在低、中、高表达水平下tdtomato阳性的细胞比例分别为77.01
±
2.02、99.26
±
0.06和99
±
0%,
△
n17cre
59-gfp在低、中、高表达水平下tdtomato阳性的细胞比例分别为68.77
±
2.02、96.87
±
0.44和99.7
±
0.07%。表明在cre重组酶的第59-60位间插入gfp后所得融合蛋白
△
n17cre
59-gfp具有和全长cre相当的重组酶活性,也进一步表明该融合蛋白是一种不错的实时标记cre表达情况的融合方式。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1