微藻固碳强化剂的应用及包含该强化剂的培养基的制作方法
本发明涉及环境保护与微藻培养领域,更特别的,涉及微藻固碳强化剂在提高微藻固碳效率中的应用、可提高微藻固碳效率的培养基,以及使用上述培养基培养微藻以提高微藻固碳效率的方法
背景技术:
微藻生物法减排co2对于缓解温室效应和发展低碳经济具有重要意义。但是目前微藻固碳产业尚处于起步阶段,存在一些技术瓶颈,如类似烟气这种低浓度co2气体在水中的溶解度较低,以及微藻生物转化碳源的速率较慢等需要解决。
目前,微藻的培养多以鼓泡的方式向培养液中通入含co2的气体作为碳源,鉴于低浓度co2的溶解度较低且气泡在液相中的停留时间较短,微藻的生长往往受到碳源供给不足的限制。专利cn200510126465.2、cn201210138598.1和cn201210138845.8从延长气液接触时间和增加气液接触面积的角度出发,发明了在微藻培养池中原位补充co2的阱式补碳技术和水平浸没罩式补碳技术,该技术强化了传质过程,大幅度提高了补碳位点co2的吸收率。但是受限于培养液的理化性质,co2溶解于液相形成的总无机碳浓度依然不高,尤其是在近中性ph环境下,从补碳位点流出的培养液中,部分碳源逸失到空气中,部分碳源转化为碳酸根的形式,从而造成微藻生长的碳源限制。
因此,需要一种方案提高微藻培养过程中对co2的吸收和转化效率。
技术实现要素:
为解决以上问题,本团队仔细研究了提高液相中co2溶解度的方法,筛选了一些可能具有co2吸收能力的并对比了不同吸收剂的亨利系数(根据亨利定律,亨利系数越小,co2溶解度越高),发现甲醇、碳酸丙烯酯、n-甲基吡咯烷酮和聚乙二醇二甲醚等吸收容量大,且毒性小、成本低,如果能将其应用到微藻培养中,可使用的浓度范围较宽,则培养液中的总无机碳浓度可以显著提高,而不对微藻细胞产生毒害,从而提高微藻生物固碳的效率。我们将这类物质称为微藻固碳强化剂。
基于以上研究,本发明提供了微藻固碳强化剂在提高微藻固碳效率中的应用。
本发明还提供了一种可提高微藻固碳效率的培养基,包含微藻固碳强化剂,所述微藻固碳强化剂为甲醇、聚乙二醇二甲醚、碳酸丙烯酯或n-甲基吡咯烷酮中的一种或多种组合。
在一个具体实施方案中,所述培养基中包含浓度为0.05-1.0%体积分数的甲醇,或者浓度为0.5-10mmol/l的聚乙二醇二甲醚、碳酸丙烯酯或n-甲基吡咯烷酮,或其组合。优选地,碳酸丙烯酯的浓度为4-6mmol/l。
在一个优选实施方案中,所述培养基的ph为6-8。
在一个具体实施方案中,包括基础培养基成分,所述基础培养基为用于培养光合微藻的培养基。
在一个具体实施方案中,所述基础培养基为bg11培养基、se培养或f/2培养基。
本发明通过在培养基中加入微藻固碳强化剂,改变了培养基的理化性质,提高了培养基对co2的吸收容量,增加了培养环境中的无机碳浓度,并促使微藻提高co2的转化效率。
本发明还提供了一种提高微藻固碳效率的方法,包括使用上述培养基培养所述微藻的步骤。
在一个具体实施方案中,培养所述微藻时,向培养液中通入含有co2的气体。
在一个具体实施方案中,所述含有co2的气体为烟道气、工业co2气体、或混合有co2的空气,或其组合。
本发明的方法适用于各种微藻培养方式,例如,可用于封闭式培养,包括光生物反应器,例如管式、柱状、板式光生物反应器;也可用于开放式培养,例如开放式跑道池或圆形培养池。
本发明的培养基和方法可用于各种光合藻类,例如微藻为绿藻、硅藻、蓝藻、金藻等,优选为小球藻、栅藻、三角褐指藻、球等鞭金藻。
在一个具体实施方案中,所述方法还包括收获所培养的微藻的步骤。微藻的采收可在稳定期或对数期。根据实际培养经验,微藻采收的优选时期,在封闭式培养方式下为批次培养的第8天,在开放式培养方式下为批次培养的第6天。
本发明提供的微藻固碳强化剂和包含所述微藻固碳强化剂的培养基不仅能够提高微藻的固碳效率,同时对微藻没有毒害作用,并且不会被微藻吸收消耗。通过使用本发明的培养基和方法,培养的藻细胞具有高固碳效率、高碳酸酐酶活性和高光合放氧速率。有利于使用微藻处理含co2的尾气,从而达到减排的效果
附图说明
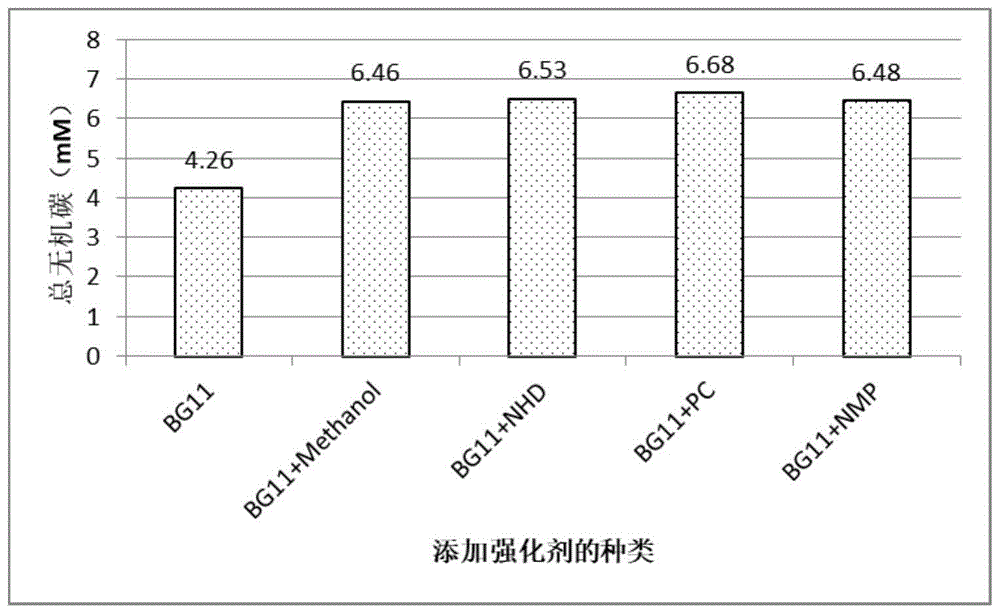
图1为在bg11培养基中添加不同种类强化剂培养小球藻的培养液中总无机碳源浓度统计图。
图2为在bg11培养基中添加不同种类强化剂培养小球藻时的固碳效率统计图。
图3为在bg11培养基中添加不同种类强化剂培养小球藻前后培养液中总有机碳浓度的变化统计图。
图4为在bg11培养基中添加不同种类强化剂培养小球藻的细胞光合放氧速率统计图。
图5为在bg11培养基中添加不同种类强化剂培养小球藻的胞外碳酸酐酶活性统计图。
具体实施方式
以下结合附图对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
实施例1
在室内采用柱状玻璃光反应器(高50cm,内径6cm)进行微藻培养,使用本领域常用的曝气石(孔径为30-60μm)通气,由8支日光灯管提供光强为100μmol/m2/s的12h:12h(光:暗)的光照。
所培养的藻种为普通小球藻,来自中国科学院水生生物研究所淡水藻种库,编号为fachb-8。对照组以bg11为培养基培养小球藻,培养体积为1l。甲醇实验组的培养基中加入体积比0.5%的甲醇;nhd实验组的培养基中加入聚乙二醇二甲醚,终浓度5mmol/l;pc实验组的培养基中加入碳酸丙烯酯,终浓度5mmol/l;nmp实验组的培养基中加入n-甲基吡咯烷酮,终浓度5mmol/l。控制培养温度为25℃,24h连续通入空气驱动培养液的混合,空气流量为180ml/min,期间在光照的12h内,每隔4h在通入的空气中加入纯co2气体一次,每次持续10min,纯co2的流量为20ml/min(此时纯co2与通入的空气组成co2体积比为10%的混合气体)。
微藻初始接种浓度为0.1g/l,培养过程中每天取样测定藻细胞的生长情况,并计算固碳速率,培养第4天取样测定培养液中总无机碳源浓度、藻细胞的光合放氧速率、胞外碳酸酐酶的活性,培养8天后离心收获微藻,测定培养前后培养液中总有机碳浓度的变化。
如图1所示,培养期间,对照组培养液的平均总无机碳源浓度为4.26mmol/l。甲醇实验组培养液中的平均总无机碳源浓度为6.46mmol/l,与对照组相比提高了51.6%;nhd实验组培养液中的平均总无机碳源浓度为6.53mmol/l,与对照组相比提高了53.3%;pc实验组培养液中的平均总无机碳源浓度为6.68mmol/l,与对照组相比提高了56.8%;nmp实验组培养液中的平均总无机碳源浓度为6.48mmol/l,与对照组相比提高了52.1%。
如图2所示,对照组批次培养8天的平均生物固碳效率为100.65mg/l/d,甲醇实验组批次培养8天的平均生物固碳效率为146.4mg/l/d,与对照组相比相对提高了45.4%;nhd实验组批次培养8天的平均生物固碳效率为137.25mg/l/d,与对照组相比相对提高了36.4%;pc实验组批次培养8天的平均生物固碳效率为173.85mg/l/d,与对照组相比相对提高了72.7%;nmp实验组批次培养8天的平均生物固碳效率为155.55mg/l/d,与对照组相比相对提高了54.5%。
如图3所示,在批次培养8天后,甲醇实验组培养液中总有机碳源浓度由393.48mg/l减少为319.62mg/l,说明在培养过程中强化剂损失了18.7%;nhd实验组培养液中总有机碳源浓度由770.81mg/l变为773.29mg/l,处于误差范围内,没有损失;pc实验组培养液中总有机碳源浓度由392.67mg/l减少为351.09mg/l,说明在培养过程中pc损失了10.5%;nmp实验组培养液中总有机碳源浓度由412.7mg/l减少为427.45mg/l,说明在培养过程中nmp没有损失。
如图4和5所示,甲醇实验组培养的藻细胞的净光合放氧速率为68.1μmolo2(mgchlah)-1,胞外碳酸酐酶的活性为8.6eu/μg,与对照组相比,分别提高了10.3%和135.6%;nhd实验组培养的藻细胞的净光合放氧速率为93.55μmolo2(mgchlah)-1,胞外碳酸酐酶的活性为7.3eu/μg,与对照组相比,分别提高了51.5%和100.0%;pc实验组培养的藻细胞的净光合放氧速率为94.5μmolo2(mgchlah)-1,胞外碳酸酐酶的活性为9.0eu/μg,与对照组相比,分别提高了53.0%和146.6%;nmp实验组培养的藻细胞的净光合放氧速率为92.9μmolo2(mgchlah)-1,胞外碳酸酐酶的活性为9.1eu/μg,与对照组相比,分别提高了50.5%和149.3%。
将甲醇浓度调节为0.05-1.0%,nhd、pc和nmp的浓度调节为0.5-10mmol/l,均能得到类似效果。
以上实验说明,甲醇、nhd、pc和nmp都可作为强化剂促进了微藻生物固碳的效率。
实施例2
在室内采用柱状玻璃光生物反应器进行海生微拟球藻的培养,藻种来自中国科学院水生生物所淡水藻种库,编号为926。对照组使用f/2培养基培养,实验组使用添加了pc的f/2培养基培养,pc的终浓度为5mmol/l。其他同实施例1,微藻细胞的接种浓度为0.05g/l。
培养期间,对照组培养液的平均总无机碳源浓度为4.95mmol/l。甲醇实验组培养液中的平均总无机碳源浓度为6.46mmol/l,与对照组相比提高了62.2%。对照组批次培养8天的平均生物固碳效率为121.2mg/l/d,实验组批次培养8天的平均生物固碳效率为177.8mg/l/d,与对照组相比相对提高了46.7%。在批次培养8天后,实验组培养液中总有机碳源浓度由430.1mg/l减少为433.9mg/l,说明在培养过程中强化剂几乎没有损失。
实施例3
进行开放式跑道池培养实验。跑道池周长70米,宽3米。藻种为二形栅藻,来自中国科学院水生生物所淡水藻种库,编号为496。以bg11培养基培养二形栅藻,培养液的深度为20厘米;配置培养基时加入pc至终浓度5mmol/l;依靠水体自然蒸发维持培养液的温度不超过30℃;培养液的流动由搅拌叶轮驱动,补碳采用自动控制(已有相关控制装置和技术的公开文献,例如专利cn200410009360.4和cn201210138598.1)。以未添加pc的培养基进行的跑道池培养为对照组。结果显示,对照组培养液中平均总无机碳浓度为3.77mmol/l,单位面积的固碳率为8.5g/(m2·d),实验组的培养液中平均总无机碳浓度为4.83mmol/l,单位面积的固碳率为10.5g/(m2·d)。此外,检测实验组培养过程中总有机碳的浓度,发现几乎没有变化,说明强化剂在使用过程中没有损失。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!