一种分泌双特异性抗体的免疫细胞及其应用的制作方法
本发明涉及生物细胞技术领域,特别是涉及可以分泌抗体、表达car的免疫细胞,优化免疫细胞的杀伤功能,减少耗竭,减少肿瘤微环境对免疫细胞的抑制。
背景技术:
近几年来,肿瘤免疫疗法发展迅速,尤其是过继性细胞疗法(act),即指从病人体内分离出t细胞、nk细胞等免疫细胞,通过体外修饰扩增培养,随后回输入患者体内进行肿瘤治疗的方法。2013年,肿瘤的免疫疗法被science杂质评为“十大突破”之首。
car-t和tcr-t是过继性细胞疗法重要的组成部分,尤其car-t疗法,在血液肿瘤的治疗上取得了显著的成就,取得了较高的缓解率,典型的car结构由三部分组成,胞外识别肿瘤抗原的scfv、铰链和跨膜结构域、胞内共刺激信号和激活结构域。第一代的car并不包含胞内共刺激信号,car-t细胞的杀伤活性较低且生存时间较短。因此,第二代car开始加入共刺激信号如cd28和4-1bb,采用不同的共刺激信号的car-t细胞的特性也不尽相同,cd28增强了car-t细胞的杀伤活性而4-1bb则增强car-t细胞杀伤活性的同时延长了car-t细胞的生存时间。随后,出现了共同表达两个共刺激信号域的三代car,然而其抗肿瘤效果并不如二代car-t。因此,现在临床应的主要为二代car-t细胞。
car-t疗法不仅在血液肿瘤的治疗上成果显著,而且商业化进展顺利,美国fda于2017年正式批准了两种car-t药品上市。尽管car-t细胞疗法在血液肿瘤的治疗上大放异彩,而对于实体瘤却并没有较好的治疗效果,缓解率低且容易发生脱靶等毒副作用。实体瘤微环境是car-t细胞不能有效发挥作用的重要因素之一,pd-1和ctla-4是两个重要的免疫负调控分子,在肿瘤微环境中,肿瘤细胞,免疫抑制细胞等通过这两条途径抑制免疫细胞功能,导致免疫细胞耗竭。
技术实现要素:
基于此,有必要针对上述问题,提供了一种可以分泌双特异性抗体的表达car的免疫细胞,通过分泌的双特异性抗体,阻断pd-1、ctla-4两条负反馈途径,从而减弱肿瘤微环境对免疫细胞的负调控,减少免疫细胞的耗竭,增强其杀瘤功能,减少肿瘤微环境对免疫细胞抑制。
一种分泌双特异性抗体的免疫细胞,免疫细胞表达嵌合抗原受体,并且表达分泌型的双特异性抗体。
在其中一个实施例中,免疫细胞为t细胞、nk细胞、nkt细胞、巨噬细胞、gamma-deltat细胞、til细胞、tcr-t细胞或其它肿瘤杀伤细胞。
在其中一个实施例中,将表达嵌合抗原受体和分泌型的双特异性抗体的基因转入免疫细胞,基因放于表达框中。
在其中一个实施例中,表达框为包含嵌合抗原受体的核酸序列或表达anti-pd-1&anti-ctla-4双特异性抗体。
在其中一个实施例中,表达嵌合抗原受体和分泌型的双特异性抗体的基因的转入方式为通过慢病毒、逆转录病毒、普通质粒载体、附加体载体、纳米递送系统、电转导、转座子或其它递送系统转入。
在其中一个实施例中,分泌型的双特异性抗体为靶向pd-1的scfv和/或靶向ctla-4的scfv,所述分泌型的双特异性抗体的中间由fc链接。
在其中一个实施例中,嵌合抗原受体包括细胞外结构域、跨膜结构域和细胞内结构域,所述胞外结构域包括抗原结合结构域,所述细胞内结构域包括共刺激信号传导区和cd3ζ链部分,所述共刺激信号传导区指包括共刺激分子的细胞内结构域的一部分,所述共刺激分子为淋巴细胞对抗原的有效应答所需要的细胞表面分子。
在其中一个实施例中,嵌合抗原受体包含egfr、gpc3、claundin18.2的scfv、cd28的铰链区和跨膜结构域、cd8的铰链区和跨膜结构域、cd28或cd137(4-1bb)或者icos的共刺激结构域,以及胞内激活信号cd3ζ。
在其中一个实施例中,scfv选自单克隆抗体、嵌合单克隆抗体、人源化单克隆抗体、人抗体、纳米抗体和合成抗体中的一种或几种。
在其中一个实施例中,同时结合pd-1抗原和ctla-4抗原。
本发明还提供了上述任一项所述的分泌双特异性抗体的免疫细胞在制备预防和/或治疗癌症或肿瘤的药物中的应用,可制成药学上可接受的载体、稀释剂或赋形剂,均具有较好的成形效果,同时保持良好的药效。
本发明分泌双特异性抗体的免疫细胞的主要优点包括:
1、分泌双特异性抗体的免疫细胞表达car,特异性识别肿瘤细胞;
2、分泌双特异性抗体的免疫细胞表达靶向pd-1&ctla-4的双特异性抗体,减弱或阻断免疫检查点对t细胞的抑制,减少肿瘤微环境,增强car-t细胞的杀瘤活性并减少耗竭;
3、本发明的分泌双特异性抗体的免疫细胞同时分泌靶向两个抑制途径的靶点,增强其免疫疗法的疗效;
4、本发明的双特异性抗体的结构简单,分子量小,易于慢病毒的制备;
5、本发明的双特异性抗体不同于传统的双特异性抗体的结构,增强了抗体的稳定性,延长其半衰期,利于其在体内长时间发挥药效;
6、本发明分泌型的双特异性抗体的分泌随着car-t细胞的移动而移动,具有靶向性,减少对正常组织的损害,降低全身毒性,避免抗体过量引起的自身免疫疾病等问题;
7、分泌型的抗体不同于pd-1&ctla-4抗体的联合治疗,对抗体要的用量低,降低成本。
附图说明
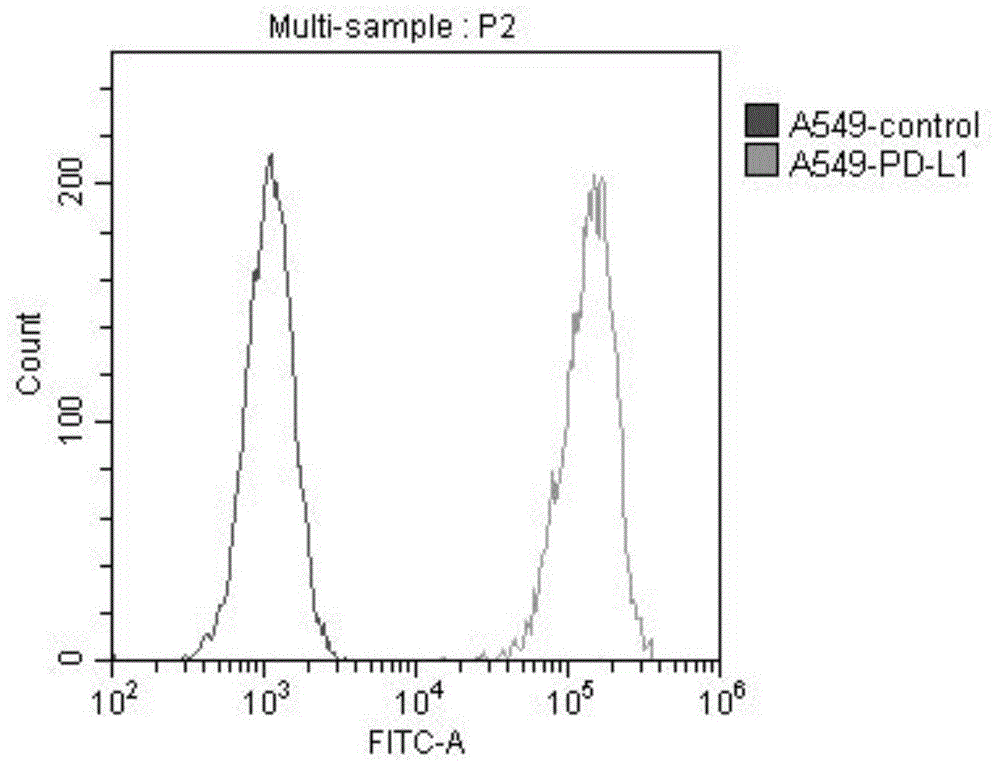
图1为实施例1的a549-pd-l1表达pd-l1的情况;
图2为实施例1的huh7-pd-l1表达pd-l1的情况;
图3为实施例1的分泌双特异性抗体的car结构及car的结构;
图4为实施例1的分泌双特异性抗体的免疫细胞的扩增曲线;
图5为实施例1三种t细胞的car的表达情况(day6);
图6为实施例1三种t细胞的car的表达情况(day13);
图7为实施例1三种t细胞的pd-1的表达情况(day6);
图8为实施例1三种t细胞的pd-1的表达情况(day8);
图9为实施例1三种t细胞的体外杀伤实验;
图10为实施例1分泌双特异性抗体的免疫细胞的il-2分泌情况;
图11为实施例1分泌双特异性抗体的免疫细胞的细胞因子分泌情况;
图12为实施例1中car-t细胞与a540-pd-l1共孵育的扩增曲线;
图13为实施例1car-t细胞与huh7-pd-l1共孵育的扩增曲线。
具体实施方式
为了便于理解本发明,下面将对本发明进行更全面的描述。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
本发明提供了一种分泌双特异性抗体的免疫细胞,免疫细胞表达嵌合抗原受体,并且表达分泌型的双特异性抗体。
一个实施例中,免疫细胞为t细胞、nk细胞、nkt细胞、巨噬细胞、gamma-deltat细胞、til细胞、tcr-t细胞或其它肿瘤杀伤细胞。
将表达嵌合抗原受体和分泌型的双特异性抗体的基因转入免疫细胞,使其表达嵌合抗原受体和分泌型的双特异性抗体,上述基因可以放在同一个表达框中,也可以分别放在两个表达框进行表达,第一表达框包含嵌合抗原受体的核酸序列,第二表达框表达anti-pd-1&anti-ctla-4双特异性抗体。甚至可以有第三表达框,第四表达框等,来表达其他趋化因子、car等其他功能原件。
表达嵌合抗原受体和分泌型的双特异性抗体的基因转入方式为通过慢病毒、逆转录病毒、普通质粒载体、附加体载体、纳米递送系统、电转导、转座子或其它递送系统转入。
分泌型的双特异性抗体为靶向pd-1的scfv和/或靶向ctla-4的scfv,所述分泌型的双特异性抗体的中间由fc链接,fc是经过改造的,对nk细胞识别位点进行了突变,使其不能引起adcc反应。
嵌合抗原受体包括细胞外结构域、跨膜结构域和细胞内结构域,所述胞外结构域包括抗原结合结构域,所述细胞内结构域包括共刺激信号传导区和cd3ζ链部分,所述共刺激信号传导区指包括共刺激分子的细胞内结构域的一部分,所述共刺激分子为淋巴细胞对抗原的有效应答所需要的细胞表面分子。
嵌合抗原受体包含egfr、gpc3、claundin18.2的scfv、cd28的铰链区和跨膜结构域、cd8的铰链区和跨膜结构域、cd28或cd137(4-1bb)或者icos的共刺激结构域,以及胞内激活信号cd3ζ。
scfv选自单克隆抗体、嵌合单克隆抗体、人源化单克隆抗体、人抗体、纳米抗体和合成抗体中的一种或几种。
同时结合pd-1抗原和ctla-4抗原。
本发明以car-t细胞为例,代表性地对本发明的免疫细胞进行详细说明。本发明的免疫细胞不限于上下文所述的car-t细胞,本发明的免疫细胞具有与上下文所述的car-t细胞相同或类似的技术特征和有益效果。具体地,当免疫细胞表达嵌合抗原受体car时,nk细胞、nkt细胞、til、gamma-deltat细胞等同于t细胞(或t细胞可替换nk细胞)。
术语
为了可以更容易地理解本公开,首先定义某些术语。如本申请中所使用的,除非本文另有明确规定,否则以下术语中的每一个应具有下面给出的含义。在整个申请中阐述了其它定义。
术语car:嵌合抗原受体cars的设计经历了以下过程:第一代car只有一个胞内信号组份cd3ζ或者fcγri分子,由于胞内只有一个活化结构域,因此它只能引起短暂的t细胞增殖和较少的细胞因子分泌,而并不能提供长时间的t细胞增殖信号和持续的体内抗肿瘤效应,所以并没有取得很好地临床疗效。第二代cars在原有结构基础上引入一个共刺激分子,如cd28、4-1bb、ox40、icos,与一代cars相比功能有很大提高,进一步加强car-t细胞的持续性和对肿瘤细胞的杀伤能力。在第二代cars基础上串联一些新的免疫共刺激分子如cd27、cd134,发展成为第三代cars和第四代cars,并且还有在同一个细胞上表达靶向2个靶点或者多个靶点的的双car或者多car等
本发明的嵌合抗原受体(car)包括细胞外结构域、跨膜结构域、和细胞内结构域,胞外结构域包括抗原结合结构域,细胞内结构域包括共刺激信号传导区和cd3ζ链部分,共刺激信号传导区指包括共刺激分子的细胞内结构域的一部分,共刺激分子为淋巴细胞对抗原的有效应答所需要的细胞表面分子。
在一个较佳的实施方案中,本发明提供的car的胞外结构域包括靶向gpc3的抗原结合结构域。本发明的car在t细胞中表达时,能够基于抗原结合特异性或者蛋白受体结合进行抗原识别。当其结合其关联抗原时,car-t细胞会靶向性裂解肿瘤细胞,导致患者的肿瘤负荷缩小或消除。抗原结合结构域优选与来自共刺激分子和cd3ζ链中的一个或多个的细胞内结构域融合。优选地,抗原结合结构域与cd28/4-1bb/icos信号传导结构域、和cd3ζ信号结构域组合的细胞内结构域融合。
对于铰链区和跨膜区(跨膜结构域),在其跨膜结构域前或者后加入起调控作用的氨基酸序列,使car的表达随靶抗原的浓度而变化。在一些例子中,可选择跨膜结构域,或通过氨基酸置换进行修饰。
本发明的car中的胞内结构域包括cd28/4-1bb/icos的信号传导结构域和cd3ζ的信号传导结构域。
术语“表达框”:在其中一个实施方案中,表达框包括第一表达框和第二表达框,第一表达框包含编码所述car的核酸序列,第二表达框表达anti-pd-1&anti-ctla-4双特异性抗体。在其中一个实施方案中,表达框还包括第三表达框,表达另一个car,即为有两个跨膜区的双car,或者多car。在一个实施方案中,第一表达框、第二表达框和第三表达框分别包括启动子,第一表达框、第二表达框可以位于相同或不同的载体上。优选地,所述的第一表达框、第二表达框和第三表达框位于同一载体。
术语“载体”,表达框的载体选自下组:dna、rna、质粒、慢病毒载体、腺病毒载体、逆转录病毒载体、转座子、其他基因转移系统、或其组合。优选地,载体为病毒载体。
载体编码期望分子的核酸序列可利用在本领域中已知的重组方法获得,诸如例如通过从表达基因的细胞中筛选文库,通过从已知包括该基因的载体中得到该基因,或通过利用标准的技术,从包含该基因的细胞和组织中直接分离。可选地,感兴趣的基因可被合成生产。
本发明也提供了其中插入本发明的表达框的载体。源于逆转录病毒诸如慢病毒的载体,其特点是长期、稳定的整合目的基因至细胞中;可转导非增殖的细胞,诸如肝细胞;低免疫原性;安全性高。典型的克隆载体包含可用于调节期望核酸序列表达的转录和翻译终止子、初始序列和启动子。
表达载体可以以病毒载体形式提供给细胞。可用作载体的病毒包括但不限于逆转录病毒、腺病毒、腺伴随病毒、疱疹病毒和慢病毒。通常,合适的载体包含在至少一种有机体中起作用的复制起点、启动子序列、方便的限制酶位点和一个或多个可选择的标记。例如,逆转录病毒提供了用于基因传递系统的方便的平台。可利用在本领域中已知的技术将选择的基因插入载体并包装入逆转录病毒颗粒。该重组病毒可随后被分离和传递至体内或离体的对象细胞。在一个实施方案中,使用慢病毒载体。
额外的启动子元件,例如增强子,可以调节转录开始的频率。通常地,这些位于起始位点上游的30-110bp区域中,尽管最近已经显示许多启动子也包含起始位点下游的功能元件。启动子元件之间的间隔经常是柔性的,以便当元件相对于另一个被倒置或移动时,保持启动子功能。合适的启动子的一个例子为即时早期巨细胞病毒(cmv)启动子序列,另一个例子为延伸生长因子-1α(ef-1α)。然而,也可使用其他组成型启动子序列,包括但不限于类人猿病毒40(sv40)早期启动子、小鼠乳癌病毒(mmtv)、人免疫缺陷病毒(hiv)长末端重复(ltr)启动子、momulv启动子、鸟类白血病病毒启动子、艾伯斯坦-巴尔(epstein-barr)病毒即时早期启动子、鲁斯氏肉瘤病毒启动子、以及人基因启动子,诸如但不限于肌动蛋白启动子、肌球蛋白启动子、血红素启动子和肌酸激酶启动子。进一步地,本发明不应被限于组成型启动子的应用。诱导型启动子也被考虑为本发明的一部分。诱导型启动子的使用提供了分子开关,其能够当这样的表达是期望的时,打开可操作地连接诱导型启动子的多核苷酸序列的表达,或当表达是不期望的时关闭表达。诱导型启动子的例子包括但不限于金属硫蛋白启动子、糖皮质激素启动子、孕酮启动子和四环素启动子。
为了评估car多肽或其部分的表达,被引入细胞的表达载体也可包含可选择的标记基因或报道基因中的任一个或两者,以便于从通过病毒载体寻求被转染或感染的细胞群中鉴定和选择表达细胞。在其他方面,可选择的标记可被携带在单独一段dna上并用于共转染程序。可选择的标记和报道基因两者的侧翼都可具有适当的调节序列,以便能够在宿主细胞中表达。有用的可选择标记包括例如抗生素抗性基因,诸如neo等等。
将多核苷酸引入宿主细胞的物理方法包括磷酸钙沉淀、脂质体转染法、粒子轰击、微注射、电穿孔等等。生产包括载体和/或外源核酸的细胞的方法在本领域中是公知的。将多核苷酸引入宿主细胞的优选方法为脂质体转染法。核酸可与脂质相关联,与脂质相关联的核酸可被封装入脂质体的水性内部中,散布在脂质体的脂双层内,经与脂质体和寡核苷酸两者都相关联的连接分子附接至脂质体,陷入脂质体,与脂质体复合,分散在包含脂质的溶液中,脂质为脂肪物质,其可为天然发生或合成的脂质。例如,脂质包括脂肪小滴,其天然发生在细胞质以及包含长链脂肪族烃和它们的衍生物诸如脂肪酸、醇类、胺类、氨基醇类和醛类的该类化合物中。
本发明提供了含有如上所述的免疫细胞以及药学上可接受的载体、稀释剂或赋形剂。在一个实施方案中,所述制剂为液态制剂。优选地,所述制剂为注射剂。优选地,所述制剂中所述car-t细胞的浓度为1×103-1×108个细胞/ml,更优地1×104~1×107个细胞/ml。在一个实施方案中,所述制剂可包括缓冲液诸如中性缓冲盐水、硫酸盐缓冲盐水等等;碳水化合物诸如葡萄糖、甘露糖、蔗糖或葡聚糖、甘露醇;蛋白质;多肽或氨基酸诸如甘氨酸;抗氧化剂;螯合剂诸如edta或谷胱甘肽;佐剂(例如,氢氧化铝);和防腐剂。本发明的制剂优选配制用于静脉内施用。
本发明包括用编码本发明核酸构建物的慢病毒载体转导的细胞(例如,t细胞)进行的治疗性应用。转导的t细胞可引起car-介导的t-细胞应答。注入的细胞能够杀死接受者的肿瘤细胞,且car-t细胞能够体内复制,产生可导致持续肿瘤控制的长期持久性。且本发明的car-t可以分泌anti-pd-1&ctla-4双特异性抗体,提高car-t细胞的活力持久性,不易耗竭,长时间维持抗肿瘤活性
在一个实施方案中,本发明的免疫细胞可经历稳固的体内t细胞扩展并可持续延长的时间量。另外,car介导的免疫应答可为过继免疫疗法步骤的一部分,其中car-修饰t细胞诱导对car中的抗原结合结构域特异性的免疫应答。例如,gpc3car-t细胞引起抗表达gpc3的细胞的特异性免疫应答。
可治疗的癌症包括没有被血管化或基本上还没有被血管化的肿瘤,以及血管化的肿瘤。癌症可包括非实体瘤(诸如血液学肿瘤,例如白血病和淋巴瘤)或可包括实体瘤。用本发明的car治疗的癌症类型包括但不限于癌、胚细胞瘤和肉瘤,和某些白血病或淋巴恶性肿瘤、良性和恶性肿瘤、和恶性瘤,例如肉瘤、癌和黑素瘤。也包括成人肿瘤/癌症和儿童肿瘤/癌症。
血液学癌症为血液或骨髓的癌症。血液学(或血原性)癌症的例子包括白血病,包括急性白血病(诸如急性淋巴细胞白血病、急性髓细胞白血病、急性骨髓性白血病和成髓细胞性、前髓细胞性、粒-单核细胞型、单核细胞性和红白血病)、慢性白血病(诸如慢性髓细胞(粒细胞性)白血病、慢性骨髓性白血病和慢性淋巴细胞白血病)、真性红细胞增多症、淋巴瘤、霍奇金氏疾病、非霍奇金氏淋巴瘤(无痛和高等级形式)、多发性骨髓瘤、瓦尔登斯特伦氏巨球蛋白血症、重链疾病、骨髓增生异常综合征、多毛细胞白血病和脊髓发育不良。
实体瘤为通常不包含囊肿或液体区的组织的异常肿块。实体瘤可为良性或恶性的。不同类型的实体瘤以形成它们的细胞类型命名(诸如肉瘤、癌和淋巴瘤)。实体瘤诸如肉瘤和癌的例子包括纤维肉瘤、粘液肉瘤、脂肪肉瘤间皮瘤、淋巴恶性肿瘤、胰腺癌卵巢癌、。
本发明免疫细胞,修饰t细胞的离体程序,以下中的至少一项在将细胞施用进入人体前在体外发生:i)扩增细胞,ii)将编码car的核酸和编码双特异性抗体的核算引入细胞,和/或iii)冷冻保存细胞。离体程序在本领域中是公知的,并在以下更完全地进行讨论。简单地说,人外周血中分离的细胞用于表达本文公开的car和双特异性抗体。修饰的细胞可被施用给接受者,以提供治疗益处。次免疫细胞可相对于接受者为自体的。可选地,细胞可相对于接受者为同种异基因的、同基因的(syngeneic)或异种的。
本发明免疫细胞的修饰的t细胞可被单独施用或与其他药物、药物组合物、稀释剂和/或与其他组分诸如il-2、il-17或其他细胞因子或细胞群结合施用。简单地说,本发明的药物组合物可包括如本文所述的靶细胞群,与一种或多种药学或生理学上可接受载体、稀释剂或赋形剂结合。这样的组合物可包括缓冲液诸如中性缓冲盐水、硫酸盐缓冲盐水等等;碳水化合物诸如葡萄糖、甘露糖、蔗糖或葡聚糖、甘露醇;蛋白质;多肽或氨基酸诸如甘氨酸;抗氧化剂;螯合剂诸如edta或谷胱甘肽;佐剂(例如,氢氧化铝);和防腐剂。本发明的组合物优选配制用于静脉内施用。
采用本发明免疫细胞制成的药物组合物可以以适于待治疗(或预防)的疾病的方式施用。施用的数量和频率将由这样的因素确定,如患者的病症、和患者疾病的类型和严重度,并由临床方案确定。当指出“免疫学上有效量”、“抗肿瘤有效量”、“肿瘤-抑制有效量”或“治疗量”时,待施用的本发明组合物的精确量可由医师确定,其考虑患者(对象)的年龄、重量、肿瘤大小、感染或转移程度和病症的个体差异。可通常指出:包括本文描述的t细胞的药物组合物可以以1×104~1×109个细胞/kg体重的剂量,优选1×105~1×106个细胞/kg体重的剂量施用。t细胞组合物也可以以这些剂量多次施用。对于具体患者的最佳剂量和治疗方案可通过监测患者的疾病迹象并因此调节治疗由医学领域技术人员确定。
本发明的制剂的施用可以以任何方便的方式进行,包括通过喷雾法、注射、吞咽、输液、植入或移植。本文描述的组合物可被皮下、皮内、瘤内、结内、脊髓内、肌肉内、通过静脉内(i.v.)注射或腹膜内施用给患者。在一个实施方案中,本发明的t细胞组合物通过皮内或皮下注射被施用给患者。在另一个实施方案中,本发明的t细胞组合物优选通过i.v.注射施用。t细胞的组合物可被直接注入肿瘤,淋巴结或感染位置。
在本发明的某些实施方案中,利用本文描述的方法或本领域已知的其他将t细胞扩展至治疗性水平的方法活化和扩展的细胞,与任何数量的有关治疗形式结合(例如,之前、同时或之后)施用给患者,所述治疗形式包括但不限于用以下试剂进行治疗:所述试剂诸如抗病毒疗法、西多福韦和白细胞介素-2、阿糖胞苷(也已知为ara-c)或对ms患者的那他珠单抗治疗或对牛皮癣患者的厄法珠单抗治疗或对pml患者的其他治疗。在进一步的实施方案中,本发明的t细胞可与以下结合使用:化疗、辐射、免疫抑制剂,诸如,环孢菌素、硫唑嘌呤、甲氨喋呤、麦考酚酯和fk506,抗体或其他免疫治疗剂。在进一步的实施方案中,本发明的细胞组合物与骨髓移植、利用化疗剂诸如氟达拉滨、外部光束放射疗法(xrt)、环磷酰胺结合(例如,之前、同时或之后)而施用给患者。例如,在一个实施方案中,对象可经历高剂量化疗的标准治疗,之后进行外周血干细胞移植。在一些实施方案中,在移植后,对象接受本发明的扩展的免疫细胞的注入。在一个额外的实施方案中,扩展的细胞在外科手术前或外科手术后施用。施用给患者的以上治疗的剂量将随着治疗病症的精确属性和治疗的接受者而变化。人施用的剂量比例可根据本领域接受的实践实施。通常,每次治疗或每个疗程,可将1×106个至1×1010个细胞,通过例如静脉回输的方式,施用于患者。
本发明免疫细胞的主要优点包括:1、免疫细胞表达car,特异性识别肿瘤细胞;2、免疫细胞表达靶向pd-1&ctla-4的双特异性抗体,减弱或阻断免疫检查点对t细胞的抑制,减少肿瘤微环境,增强car-t细胞的杀瘤活性并减少耗竭;3、本发明的免疫细胞同时分泌靶向两个抑制途径的靶点,增强其免疫疗法的疗效;4、本发明的双特异性抗体的结构简单,分子量小,易于慢病毒的制备;5、本发明的双特异性抗体不同于传统的双特异性抗体的结构,增强了抗体的稳定性,延长其半衰期,利于其在体内长时间发挥药效;6、本发明分泌型的双特异性抗体,其分泌随着car-t细胞的移动而移动,具有靶向性,减少对正常组织的损害,降低全身毒性,避免抗体过量引起的自身免疫疾病等问题;7、分泌型的抗体不同于pd-1&ctla-4抗体的联合治疗,对抗体要的用量低,降低成本。
实施例1
本实施例免疫细胞的制备方法及功能验证包括以下步骤:
步骤一:外周血pbmc的分离和t细胞的培养
从供体外周血中分离单核细胞,使用ficol进行密度梯度离心,并用t细胞分选试剂盒富集t细胞(cd3microbeads,human-lyophilized,130-097-043),使用偶联anti-cd3/anti-cd28的磁珠激活培养和扩增t细胞;培养基使用texmacsgmpmedium(miltenyibiotec,170-076-309),含10%fbs,2mml-glutamine,100iu/mlrhil2,所有细胞均置于37℃,5%co2恒温培养箱中培养,获得t细胞。
步骤二:细胞系培养
表达gpc3的细胞系:huh-7(人肝癌细胞),购自atcc。
不表达gpc3的细胞系:a549(人非小细胞肺癌细胞),购自atcc。
包装用细胞:293t(人胚肾细胞系),购自atcc。
过表达pd-l1的肿瘤细胞系的建立:将表达pd-l1的碱基序列克隆至phblv慢病毒载体骨架中,置于ef1α(ef-1α)的启动子下,形成phblv-ef1α-pd-l1,将phblv-ef1α-pd-l1、慢病毒包膜质粒pmd2.g(addgene,plasmid#12259)和慢病毒包装质粒pspax2(addgeneplasmid#12260)三个质粒使用lipofectamine3000转入293t中制备慢病毒完整表达载体;在48h和72h收集病毒上清,超离进行浓缩(merckmillipore);浓缩后的病毒即可用于感染huh-7、a549,最终得到过表达pd-l1的huh-7、a549细胞系,命名为huh-7-pd-l1、a549-pd-l1。如图1和图2为huh-7-pd-l1、a549-pd-l1细胞表达pd-l1的检测图。
培养基培养:huh-7、a549、293t使用dmem培养基培养。所有培养基均添加10%(v/v)胎牛血清。
步骤三:car结构设计与慢病毒包装
gpc3-car结构,即靶向gpc3(磷脂酰肌醇蛋白聚糖3)的car结构:
本发明方法将双特异性抗体和第二代car构建在一个表达框上,用p2a连接。car的核心结构包括分泌信号肽序列;来自anti-gpc3的抗体的scfv(专利号:us2007/0190599a1);cd8跨膜区;胞内段刺激信号4-1bb-cd3ζ,命名为pcgpc3car,以只有car的表达框作为对照,命名为gpc3car,如图2。
将表达框克隆至phblv慢病毒载体骨架中,置于ef1α(ef-1α)的启动子下,形成phblv-ef1α-gpc3-car和phblv-ef1α-pcgpc3-car,将phblv-ef1α-gpc3-car或者phblv-ef1α-pcgpc3-car、慢病毒包膜质粒pmd2.g(addgene,plasmid#12259)和慢病毒包装质粒pspax2(addgeneplasmid#12260)三个质粒使用lipofectamine3000转入293t中制备慢病毒完整表达载体;在48h和72h收集病毒上清,超离进行浓缩(merckmillipore);浓缩后的病毒即可用于感染t细胞。
步骤四:car-t细胞制备
4.1慢病毒感染
步骤1分离纯化的原代t细胞在激活1天后,利用步骤三包装的2种慢病毒,按moi(1-10)进行慢病毒载体感染,转移至细胞培养瓶,置于37℃,5%co2恒温培养箱中培养。
4.2细胞增殖及car阳性率检测
感染后第6、9、11、13天每天取样检测细胞数量,第6、9天分别检测t细胞的car阳性率,并于第6、7、8天分别检测pd-1的表达。每隔1-2天传代补加培养基。
利用2种慢病毒载体,成功构建了2种car-t细胞,分别命名为pcgpc3cart,gpc3cart,以不感染慢病毒的t细胞为对照(nt)
如图4所示:3种car-t细胞的增殖速率,插入分泌双特异性抗体的序列对于细胞的增值速率无显著影响。
如图5、6所示:分别是第6天、第9天3种t细胞car的表达情况。可见分泌双特异性抗体对car阳性率无显著影响。
如图7、8所示,分别是3种t细胞的pd-1表达。分泌双特异性抗体的car-t其表达pd-1表达降低很多。原因是分泌的双特异性抗体可以封闭pd-1和pd-l1的结合位点,而检测pd-1的荧光抗体结合pd-1的位点也是这个位点,所以检测不到。
步骤5:细胞体外杀伤实验
对步骤4获得的3种-t细胞进行体外杀伤实验。ldh法(promega:g1780)检测car-t细胞的杀伤效应,靶细胞与效应细胞共孵育6h,杀伤效率明显,且分泌双特异性抗体对car-t的杀伤活性无显著性影响。如图8。
步骤6:细胞因子释放检测
将car-t细胞(步骤4获得)与靶细胞(a549、huh-7)分别以1:1效靶比混合,置于rpmi培养基中,共培养24h,收集上清,离心后取上清检测细胞因子ifn-γ与il2的释放水平,采用elisa试剂盒(abbkine,ket6011、ket6014)进行检测。
结果如图10所示,与gpc3+靶细胞共培养后,car-t细胞会释放大量ifn-γ与il-2,与gpc3-靶细胞共培养后,car-t细胞只少量分泌ifn-γ与il-2。表明car-t能被肿瘤表面gpc3抗原有效且特异性的激活。
步骤7:长时间体外杀伤实验。
将不同的car-t细胞和靶细胞以3:1比例共培养,每隔5天进行细胞计数、流式检测car-t细胞的比例、再次补加靶细胞,使car-t细胞和靶细胞的比例为3:1,一共进行25天,如下图11、12是car-t细胞的扩增数量。图11为car-t细胞与a549-pc共孵育时t细胞的扩增曲线。图12为car-t细胞与huh7-pc共孵育时t细胞的扩增曲线。由此可知,分泌双特异性抗体可以有效的抵制pd-1的免疫抑制。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的一种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!