一种绒山羊毛乳头细胞的分离、鉴定方法与流程
本发明属于细胞培养领域,具体涉及一种绒山羊毛乳头细胞的分离、鉴定方法。
背景技术:
绒山羊毛乳头细胞(dermalpapilla,以下简称dp细胞)由中胚层来源的真皮间充质细胞分化而成,在绒山羊毛囊形态发生、周期性生长调控和维持毛囊生长发育中起重要作用。现有观点认为:dp细胞是毛囊生长发育过程中的“信号中心”,控制着由隆突区毛囊干细胞向毛母质细胞的分化过程,参与毛囊周期的调控。dp细胞的数量可能参与决定初级毛囊/次级毛囊的差异发育过程,进而决定毛囊的大小。同时,dp细胞分泌的多种细胞因子、生长因子,可通过异种移植的方法实现体外条件下诱导毛囊的重建过程,有助于分析其在毛囊发育生物学过程中的功能。
绒山羊毛囊周期调控是提高绒用山羊产能的重要课题,绒山羊dp细胞作为最具代表性的毛囊周期调控关键细胞之一,其鉴定、分离工作势在必行。随着绒山羊毛囊相关研究的深入,越来越多的研究表明,绒山羊毛囊细胞组成极为复杂,绒山羊毛囊的周期发育过程与小鼠模型存在明显差异,细胞间的互作更为繁琐。而作为最主要类型的dp细胞,其功能研究、介导的调控机制更是难以准确描述,这也阻碍了对绒山羊增绒增产的相关研究。
截止目前,在绒山羊dp细胞相关研究中,仍使用小鼠模型研究中发现的sox2+作为dp细胞的标记基因,而缺少针对绒山羊dp细胞的标记基因。但由于物种间存在差异,直接将小鼠模型研究中采用的sox2基因作为绒山羊dp细胞的标记基因,对dp细胞的鉴定效果并不理想。
因此,亟需提供一种新的绒山羊dp细胞的分离、鉴定方法,以为探究绒山羊毛囊周期调控,描绘绒山羊毛囊发育过程奠定基础。
技术实现要素:
本发明的目的是提供一种绒山羊毛乳头细胞的鉴定、分离和培养方法。
为实现上述发明目的,本发明所采用的技术方案是:一种绒山羊毛乳头细胞的鉴定方法,使用apod+和/或hhip+作为毛乳头细胞的标记基因。
优选的,使用sox2+和/或fgf7+和/或apod+和/或hhip+作为毛乳头细胞的标记基因。
优选的,将待鉴定细胞经免疫荧光染色,判断标记基因转录蛋白的表达情况,能够表达所述标记基因的为所需绒山羊毛乳头细胞。
优选的,将所述待鉴定细胞分离出来的方法包括如下步骤:
(1)无菌分离绒山羊皮肤组织;
(2)联合使用机械分离法和酶消化法,从步骤(1)的皮肤组织上分离绒山羊完整毛乳头细胞所在区域,获得相互分离的毛乳头细胞;
(3)获得相互分离的毛乳头细胞后,进行贴壁组织培养,培养所得细胞即为待鉴定细胞。
优选的,步骤(1)所述皮肤组织的获得方法为:获取绒山羊肩胛部背侧皮肤组织,去除皮肤组织上残留的血渍和杂质,用含青霉素和链霉素的dmem/f12培养基刷洗皮肤组织,随后沿毛囊的生长方向将皮肤组织切为长条状。
优选的,步骤(2)所述分离绒山羊完整毛乳头细胞所在区域的方法为:将每条皮肤组织置入胶原酶中,于37℃恒温消化15min~1h,将初步消化的皮肤组织转置于胰酶溶液中继续消化15min~1h,消化至可通过体视镜观察到明显毛囊簇结构;
随后在体视镜下,将皮肤组织中的毛囊簇分离,为单根毛囊。
优选的,胶原酶的消化时长为30min;和/或;胰酶的消化时长为30min。
优选的,获得单根毛囊后,在体视镜下,使用注射器针头切下毛囊终端膨胀部分,通过挤压将梭形毛乳头细胞团分离出来。
优选的,步骤(3)所述培养的方法为:将毛乳头细胞团置于培养基中,于5%的co2培养箱中37℃恒温培养。
优选的,所述培养基为:10%fbs+dmem/f12+bfgf+egf。
本发明具有以下有益效果:本发明首次提出了一种可准确分离、鉴定绒山羊毛乳头细胞的方法。在分离上,本发明联合使用酶消化法和机械分离法共同获得细胞,并提供了一种可专用于培养绒山羊毛乳头细胞的培养基,以快速获得所需细胞。在鉴定上,本发明首次联合使用了几种新的标记基因,可快速、准确鉴定所需细胞。
附图说明
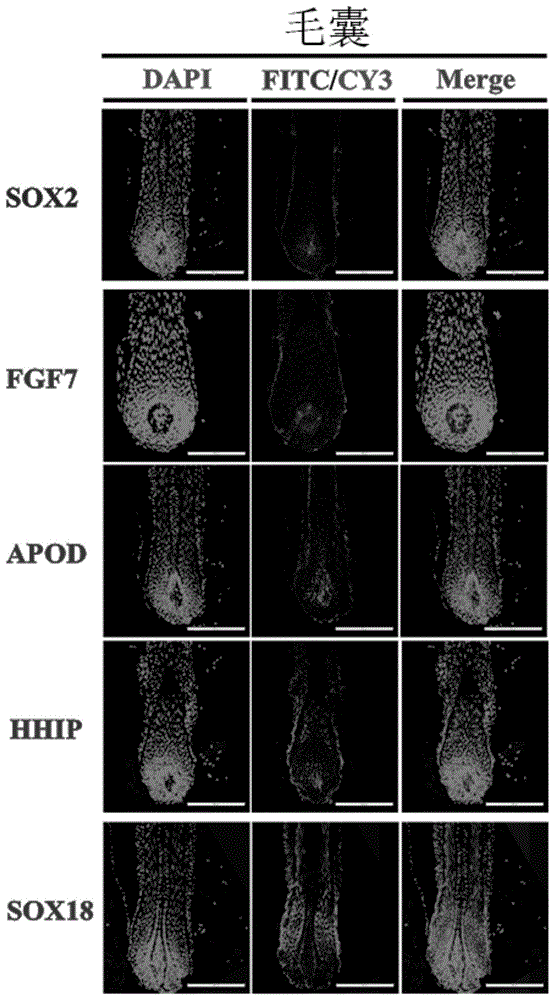
图1为标记基因(蛋白)在绒山羊毛囊中的表达情况;
图2为标记基因(蛋白)在绒山羊dp细胞中的表达情况。
具体实施方式
本发明提供了一种绒山羊dp细胞的体外分离、鉴定和培养的方法,具体包括如下步骤:
1、体外分离
(1)无菌分离绒山羊完整毛囊,分离操作方式为:获取绒山羊肩胛部背侧皮肤组织,利用眼科镊去除皮肤组织上残留的血渍和杂质,用含1%(v/v)青霉素和链霉素(质量比1:1)的dmem/f12培养基刷洗组织样品,以避免细胞污染。将刷洗后的皮肤组织用于分离毛囊,在分离毛囊过程中,使用手术刀沿着毛囊的生长方向切为厚度约为2~3mm长条,以提高后续皮肤组织与消化酶的接触面积,缩短消化时间。
(2)通过机械分离和酶消化相结合的方法,从步骤(1)处理后的皮肤组织上分离绒山羊完整毛乳头内部dp区域。
使用机械分离和酶消化法结合进行,有效降低了细胞分离难度,提高了获得的细胞纯度。具体分离的操作方案为:每条皮肤组织置入1ml胶原酶(mg/ml)中,于37℃恒温培养箱中消化15min~1h,优选消化时间为30min。随后移弃胶原酶,将初步消化的皮肤组织转置于0.25%(w/v)的胰酶溶液中继续消化15min~1h,优选的消化时间为30min。
经上两步消化后,可通过体视镜观察到明显毛囊(簇)结构。在体视镜下,使用眼科镊逐步将皮肤组织中的毛囊簇分离,并进一步分离为单根毛囊。由于真皮结构复杂,这样操作可提高分离毛囊的效率,同时减少不必要的细胞引入。
体视镜下,使用注射器针头切下毛囊终端膨胀部分即毛乳头区域,通过挤压便可将梭形毛乳头细胞团分离出来。再使用吸口管将毛乳头细胞团置于培养基中培养;培养基组分为:dmem/f12+10%(v/v)fbs++bfgf(20ng/ml)+egf(10ng/ml)。置于5%的co2培养箱中37℃恒温培养。在培养过程中,毛乳头细胞能较快从组织中分离,且生长状态较好。培养5~7d后,即可观测到毛乳头细胞逐渐从细胞团中分离。
(3)获得相互分离的毛乳头细胞后,再使用完全培养基进行贴壁组织培养。根据细胞差异贴壁性和不同的酶消化对其消化时间的差异性,分离纯化细胞。
所述完全培养基为:在dmem/f12培养基中加入10%(v/v)胎牛血清,10ng/ml表皮生长因子(epidermalgrowthfactor,全文简称egf)、20ng/ml碱性成纤维细胞生长因子(basicfibroblastgrowthfactor,全文简称bfgf)、1%(v/v)的青链霉素。
2、选择sox2+、fgf7+、apod+、hhip+共同作为标记基因。对获得的细胞分别进行鉴定,通过细胞免疫荧光选取sox2+/fgf7+/apod+/hhip+的细胞,即为所需的绒山羊dp细胞。
具体方法为:将步骤1分离出的细胞经过免疫荧光染色,判断标记基因转录蛋白的表达情况,能够表达sox2+/fgf7+/apod+/hhip+的细胞即确认为绒山羊dp细胞类型,该细胞呈纤维状,具有聚集生长的特性。
下面将结合实施例,对本发明的技术方案进行清楚、完整地描述。显然,所描述的实施例仅是本发明的一部分实施例,而不是全部的实施例。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
实施例
1、绒山羊dp细胞的分离:剪取绒山羊肩胛部背侧皮肤组织,使用含有1%(w/v)双抗(青霉素、链霉素)的pbs溶液反复冲洗皮肤组织,以去除表面污渍。之后置于含1%(w/v)青霉素和链霉素的dmem/f12培养基中,于冰上运输至超净工作环境。转入超净工作台后,用眼科镊去除皮肤组织上残留的血渍和杂质,并用含1%青霉素和链霉素的dmem/f12培养基刷洗组织样品。随后用手术刀将皮肤组织沿着毛囊的生长方向切为长条形,厚度约为2~3mm,再次用含1%(w/v)青霉素和链霉素的dmem/f12培养基冲洗组织。
将皮肤组织转入2mg/ml的胶原酶溶液中,于37℃恒温培养箱中消化消化,时间由15min至1h。通过观察,15min后,皮肤组织开始松软,但皮肤整体结构没有较大变化;30min时,皮肤下层结缔组织消化明显,质地粘稠,表皮真皮结构显现,可观察到单根毛囊;继续消化至1h时,毛囊结构不再明显,明显消化过度,无法区分毛囊结构。因此,本次实例中,选用30min作为胶原酶的消化时间。至皮肤组织变得松软后,再将组织转置于0.25%(w/v)的胰酶溶液中继续消化15min至1h。经观察,15min后皮肤组织没有明显变化;30min后,毛囊表皮与真皮层能够较好的区分出来,毛囊结构清晰可辨;而当消化时间延长至1h后,已经无法区分毛囊结构;故最终选取的胰蛋白酶消化时长为30min。取出组织块,用dmem/f12培养基清洗三次,将组织块转移到体视镜下,用钟表镊或眼科镊从皮肤组织分离完整毛囊(簇)。将分离得到的单个毛囊转移到1.5ml离心管中,用dmem/f12培养基吹洗3遍,低速离心,弃掉上清后将毛囊移置于含有10%(v/v)胎牛血清(fbs)的dmem/f12培养基中。
用注射器针头切下毛囊终端膨胀部分即毛乳头区域,在体式镜下用眼科镊挤压毛乳头区域,梭形毛乳头细胞团逐步从毛乳头区域分离。使用吸口管将毛乳头细胞团置入新培养皿中,分别置于不同的培养基中,设置为3组:组1、dmem/f12+10%fbs培养基;组2、dmem/f12+10%fbs+egf(10ng/ml)培养基;组3、dmem/f12+10%fbs+egf(10ng/ml)+bfgf(20ng/ml)培养基。各组培养条件均为37℃,5%co2。
经过观察,与组1相比,组2中egf的添加有助于毛乳头细胞从组织中迁移出来,细胞迁移时间与组1相比能够提高1天以上;且细胞结构更为清晰,细胞碎片较少。与组1、2相比,组3中的bfgf添加则能够明显的促进细胞的增殖,迁移出的细胞更为饱满。因此,选择组3的培养基为细胞培养培养基,细胞迁移时间在3天左右。待细胞生长至密度70%以上后,用胰蛋白酶消化细胞后加入等比例含有10%fbs的dmem/f12终止消化,吸取混合液,移液器吹打至细胞完全悬浮,获得单细胞悬液,并在显微镜下检查。
2、免疫荧光验证标记蛋白在分离细胞中的表达:将获得的单细胞悬液离心弃上清,然后加入4%的多聚甲醛于4℃固定30min。随后将细胞悬液用移液器滴到apes(3-aminopropyl-triethoxysilane)处理过的载玻片上,42℃烘干。用pbs漂洗3遍,再用含0.5%tritonx-100的pbs溶液(pbst)在室温下透化10min。用封闭液(10%,v/v即用型正常山羊血清的pbst溶液)进行封闭,室温封闭40min。封闭结束后,在片子上加入50μl一抗(既兔抗sox2/fgf7/apod/hhip多克隆抗体,根据一抗说明书,用含10%山羊血清的pbst将一抗稀释100倍后使用),然后转入水平的湿盒中,4℃孵育过夜。次日,待片子恢复到室温,先将片子用含1%(v/v)牛血清白蛋白(bovineserumalbumin,bsa)的pbs溶液漂洗3遍,加入50μl带有荧光标记(cy3,红色荧光标记;fitc,绿色荧光标记的)的兔免疫球蛋白抗体(根据说明书,用含1%bsapbs溶液稀释150倍后使用),转入37℃孵育1h。孵育结束后,将片子取出,用pbs洗3遍,加入50μl核染料(dapi)染核3min,再加上10μl抗荧光衰减封片剂封片,避光保存于4℃。
荧光显微镜检测观察细胞荧光情况,蓝色标记(dapi染色)为细胞核位置,cy3为与目标蛋白fgf7+/apod/hhip免疫反应所带红色荧光,fitc标记的为与sox2发生免疫反应所带绿色荧光;同时表达了sox2+/fgf7+/apod+/hhip+的细胞即为所需的dp细胞。
标记基因(蛋白)在绒山羊毛囊中的表达情况如图1所示,图中所示结构为完整毛乳头区域,蓝色标记为细胞核位置,图1的第1列均为蓝色标记,标记形状如图中阴影形状所示,形成蓝色水滴状图案,水滴中心形成“蓝色核心”;红色或绿色荧光位置即为发生免疫反应的阳性区域,图1第2列第1排位绿色荧光,第2列其余排为红色荧光,标记形状如图中阴影形状所示;merge为蓝色标记与红色标记组合图。如图所示,sox2+/fgf7+/apod+/hhip+在毛乳头区域表达量较高,具有明显特异性,染色位置正确,清楚明显。而部分早期发现于小鼠上的dp细胞标记蛋白如sox18则并非在毛乳头区域特异性表达,佐证dp细胞的标记基因在物种间存在差异。图2所示的是免疫荧光显示为sox2+/fgf7+/apod+/hhip+在分离细胞中的表达情况,均呈现阳性表达,而sox18表达未检测到,再次证明了本专利中所选用的标记基因更为准确,所使用的sox2+/fgf7+/apod+/hhip+等标记试用于绒山羊的dp细胞的分离与鉴定。
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形、变型、修改、替换,均应落入本发明权利要求书确定的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!