一种高产苯乳酸地衣芽孢杆菌基因工程菌、生产苯乳酸的方法和应用与流程
本发明属于基因技术领域,尤其是一种高产苯乳酸地衣芽孢杆菌基因工程菌、生产苯乳酸的方法和应用。
背景技术:
苯乳酸(phenyllacticacid,pla),也称为2-羟基-3-苯基丙酸,分子式为c9h10o3。在天然环境中,苯乳酸多产于蜂蜜与奶酪中,制备后为浅黄色粉末,是一种具有优秀溶解度的小分子物质。现有技术合成苯乳酸主要是化学合成方法与生物合成方法,生物合成可以由多种微生物代谢获得,其中最主要的是通过乳酸菌发酵产生。苯乳酸因其具有抑菌谱广、稳定性高、亲水性强等多种优点,而被广泛应用于食品药品防腐剂中,作为饲料添加剂也可替代家畜饲料中的抗生素,具有较好的工业应用前景。
苯乳酸的化学制备方法是利用水解、开环、结晶等过程合成获得目的产物,因为其存在着合成步骤繁杂、特异性差、副产物较多、分离纯化困难、耗能大、产生的污染物较多等问题,所以近几年的研究主要围绕微生物发酵和全细胞催化等生物合成技术生产苯乳酸。微生物发酵法主要是通过接种产苯乳酸菌株至液体培养基中,经过长时间发酵获得的目标代谢产物。
目前苯乳酸生产菌株的筛选主要是通过天然菌株的筛选与诱变获得的,但是单纯的筛选产苯乳酸野生型菌株发酵时间较长,发酵液产物分离复杂,诱变率低下,发酵产率低难以满足工业生产需求。
全细胞催化技术是将合成苯乳酸相关酶基因在目标菌株中进行异源表达,通过添加前体物质来合成目标产物。此法相较于传统的酶催化法,为酶提供了更为安全稳定的细胞内环境,可简单快速获得目标产物。
目前所使用的全细胞催化宿主菌株大多数以遗传背景简单、实验操作便利的大肠杆菌为主。但是大肠杆菌存在一定生物安全性的问题,大肠杆菌数值为日常饮用水、食品安全等检测的重要指标之一,所以一旦在前期培养中操作失误污染环境,可能会造成工业上的巨大损失。
其次全细胞催化方法大多需要添加前体物质来催化目标产物的生成,而苯乳酸的前体物质苯丙氨酸、苯丙酮酸售价较高,相比目标产物价格利润值偏低,不适合工业大范围生产。
通过检索,尚未发现与本发明专利申请相关的专利公开文献。
技术实现要素:
本发明的目的在于克服现有技术的不足之处,提供一种高产苯乳酸地衣芽孢杆菌基因工程菌、生产苯乳酸的方法和应用。
本发明解决其技术问题所采用的技术方案是:
一种高产苯乳酸地衣芽孢杆菌基因工程菌,所述基因工程菌的构建方法为:通过基因工程与代谢工程技术对地衣芽孢杆菌tccc11148(2709)或/大肠杆菌rosetta(de3)进行改造,包括抑制分支酸向色氨酸途径分支、抑制预苯酸向酪氨酸途径分支、过表达苯乳酸合成酶/氨基转移酶三步分子操作。
而且,所述基因工程菌的构建方法的步骤如下:
⑴以地衣芽孢杆菌tccc11148为出发菌株,敲除色氨酸合成途径中的邻氨基苯甲酸合成酶基因trpe;
⑵对地衣芽孢杆菌tccc11148δtrpe进行敲除酪氨酸合成途径中的t-预苯酸脱氢酶基因tyra;
⑶过表达地衣芽孢杆菌tccc11148δtrpeδtyra乳酸脱氢酶基因ldh,即得高产苯乳酸地衣芽孢杆菌基因工程菌。
而且,具体步骤如下:
⑴邻氨基苯甲酸合成酶基因trpe的敲除
①以genbank编号cp033218的地衣芽孢杆菌tccc11148基因组为模板,根据其trpe基因序列,分别在基因两端设计上游同源臂引物seqno.1、seqno.2和下游同源臂引物seqno.3、seqno.4,通过primestarmaxdnapolymerase酶经过pcr扩增获得trpe的上、下游同源臂;
②将上、下游同源臂与经过线性化载体pksvt(t2)通过solutioni混合连接酶连接获得敲除载体,化转入e.coliec135中,提质粒再化转入e.coliec135pm.bam进行甲基化修饰,涂布含有卡那霉素和壮观霉素的lb平板37℃、12h,挑取转化子于5ml的lb试管中,37℃、220r/min培养至od600为0.2时,加入质量终浓度为0.2%的阿拉伯糖进行诱导,30℃、220r/min培养12h,提取质粒电转化入地衣芽孢杆菌tccc11148感受态,涂布含有卡那霉素的lb平板;
③将电转涂布的平板培养45℃、12h,筛选单交换的菌株划线至无抗性平板中培养37℃、12h,挑取生长菌株对点含有卡那霉素与不含抗生素的平板,筛选出在卡那霉素抗性平板不长、在无抗平板生长的菌株为双交换邻氨基苯甲酸合成酶基因trpe敲除菌株地衣芽孢杆菌tccc11148δtrpe,并使用验证引物trpe1、trpe2对敲除菌株进行验证;
⑵t-预苯酸脱氢酶基因tyra的敲除
①以地衣芽孢杆菌tccc11148基因组为模板,根据其tyra基因序列,分别在基因两端设计上游同源臂引物seqno.5、seqno.6和下游同源臂引物seqno.7、seqno.8,通过primestarmaxdnapolymerase酶pcr扩增获得tyra的上、下游同源臂;
②敲除载体的构建同⑴的步骤①,将获得的载体电转化至地衣芽孢杆菌tccc11148δtrpe感受态中,涂布含有卡那霉素的lb平板;
③筛选双交换菌株方法同⑴的步骤③,筛选出双交换t-预苯酸脱氢酶基因tyra的敲除菌株地衣芽孢杆菌tccc11148δtrpeδtyra,并使用验证引物tyraseqno.11、seqno.12对敲除菌株进行验证;
⑶过表达乳酸脱氢酶基因ldh
①以植物乳杆菌atcc8014基因组为模板,设计引物seqno.13、seqno.14,通过primestarmaxdnapolymerase酶pcr扩增获得ldh片段,所述ldh片段的序列为seqno.15;
②经bamhi/smai双酶切后回收ldh片段与线性化载体ply-3,使用solutionⅰ混合连接酶连接片段与载体;
③将重组载体ply-3-ldh化转入e.coliec135中,提质粒再化转入e.coliec135pm.bam进行甲基化修饰,涂布含有卡那霉素和壮观霉素的lb平板培养37℃、12h,挑取转化子37℃、220r/min培养至od600为0.2时,加入质量终浓度为0.2%的阿拉伯糖进行诱导,30℃、220r/min培养12h,提取质粒电转化入地衣芽孢杆菌tccc11148δtrpeδtyra感受态,涂布含有卡那霉素的lb平板,即得高产苯乳酸地衣芽孢杆菌基因工程菌。
而且,所述苯乳酸含量的检测方法为:
利用反相高效液相色谱法快速检测苯乳酸含量,步骤如下:
⑴配置流动相a为0.05%~0.5%三氟乙酸水溶液,流动相b为0.05%~0.5%三氟乙酸甲醇溶液,流动相过滤,脱气;上述百分数均为质量百分数;
⑵配置苯乳酸标品母液1mg/ml,按不同比例梯度稀释,用0.22μm无菌微孔滤膜过滤;
⑶待测样品10000~12000r/min离心5min,上清用0.22μm无菌微孔滤膜过滤,备用;
⑷使用inertsustainc184.6×250mm,5μm反相色谱柱;流动相流速:0.5~1ml/min;波长:210nm;柱温:25~30℃;进样量:5~10μl;
⑸梯度洗脱程序:0-20min10%-100%b;20-23min100%b;23-25min100%-10%b;
绘制苯乳酸标准曲线:利用agilentopenlab处理数据,确定苯乳酸出峰时间;以苯乳酸含量为横坐标,峰面积为纵坐标,绘制苯乳酸标准曲线。
如上所述的高产苯乳酸地衣芽孢杆菌基因工程菌在苯乳酸生产方面中的应用。
利用如上所述的高产苯乳酸地衣芽孢杆菌基因工程菌发酵生产苯乳酸的方法,步骤如下:
⑴将高产苯乳酸地衣芽孢杆菌基因工程菌接入种子培养基,培养35~37℃,12~16h;
⑵按2%的接种量将种子培养基接入发酵培养基,培养37℃,56~72h,即得苯乳酸。
而且,所述步骤⑴中种子培养基为:lb培养基:胰蛋白胨1%,酵母浸粉0.5%,nacl1%,高温灭菌121℃,20~30min;上述百分数均为质量百分数。
而且,所述步骤⑵中发酵培养基配方为:玉米粉6~6.4%,豆饼粉4~5%,高峰淀粉酶0.07%,na2hpo40.3~0.4%,kh2po40.03%,ph7.0-7.5,高温灭菌121℃,20~30min;上述百分数均为质量百分数。
本发明取得的优点和积极效果为:
1、本发明所使用菌株地衣芽孢杆菌tccc11148安全无害,遗传背景成熟,分子操作简洁,菌体内酶系丰富,对产物苯乳酸有耐受性。通过改造地衣芽孢杆菌芳香族氨基酸代谢途径,敲除苯乳酸合成前体苯丙氨酸合成途径竞争性酶基因,过表达苯乳酸合成最直接前体酶乳酸脱氢酶基因,大大提升苯乳酸产量,为获取目标产物苯乳酸提供了新的思路。最终,获得的苯乳酸生产菌株经发酵后产量达17.8g/l,在苯乳酸的工业化生产中具有一定潜力。
2、本发明以地衣芽孢杆菌tccc11148为出发菌,构建苯乳酸高产工程菌株。地衣芽孢杆菌作为非致病菌已被国际机构美国食品药品监督管理(fda)认定为公认安全(gras)的工业菌株。除此之外地衣芽孢杆菌还具有遗传操作背景成熟、抵抗极端环境能力强、酶系丰富且无毒安全等优点,已被广泛应用于工业化生产中,具有较强的发展潜力。
3、本发明从地衣芽孢杆菌的代谢途径入手,研究其芳香族氨基酸代谢途径调控机制,通过邻氨基苯甲酸合酶(trpe)以及t-预苯酸脱氢酶(tyra)编码基因的敲除,初步提高前体物苯丙氨酸的积累。其次通过前期工作筛选出酶活力较高的植物乳杆菌来源乳酸脱氢酶基因(ldh)的过表达,最终实现苯乳酸的高效生物合成。
4、本发明有效敲除地衣芽孢杆菌tccc11148邻氨基苯甲酸合酶(trpe)以及t-预苯酸脱氢酶(tyra)编码基因,过表达益生菌来源植物乳杆菌乳酸脱氢酶基因,经过发酵检测后确定地衣芽孢杆菌于48h苯乳酸产量最高,并最终获得一株苯乳酸高产工程菌株,苯乳酸产量达17.8g/l。
附图说明
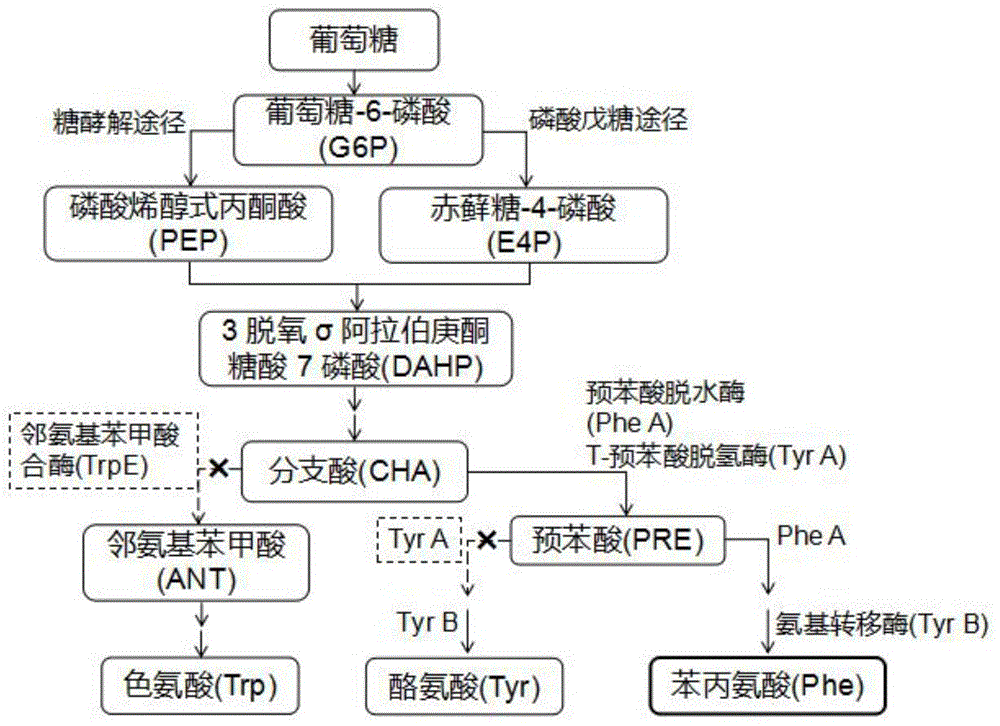
图1为本发明中苯乳酸生产菌株中芳香族氨基酸的代谢途径图;
图2为本发明中苯乳酸主要合成途径图;
图3为本发明中敲除载体的构建图;其中,a为敲除载体构建琼脂糖凝胶电泳图,其中,1:trpe左臂,2:trpe右臂,3:trpa左臂,4:trpa右臂;b为重组质粒的构建图;
图4为本发明中敲除突变体的筛选及验证图;其中,a为同源重组原理图;b为双交换菌落pcr验证图,其中,1:trpe敲除菌验证,2:trpa敲除菌验证,3:trpe未敲除阴性对照,4:trpa未敲除阴性对照;
图5为本发明中乳酸脱氢酶过表达的菌液上清sds-page图;
图6为本发明中苯乳酸hplc检测图;
图7为本发明中不同重组菌株不同时间苯乳酸发酵产量图。
具体实施方式
下面结合实施例,对本发明进一步说明,下属实施例是叙述性的,不是限定性的,不能以下述实施例来限定本发明的保护范围。
本发明中所使用的原料,如无特殊说明,均为常规市售产品,本发明中所使用的方法,如无特殊说明,均为本领域常规方法,本发明所用各物质质量均为常规使用质量。
一种高产苯乳酸地衣芽孢杆菌基因工程菌,所述基因工程菌的构建方法为:通过基因工程与代谢工程技术对地衣芽孢杆菌tccc11148(2709)或/大肠杆菌rosetta(de3)进行改造,包括抑制分支酸向色氨酸途径分支、抑制预苯酸向酪氨酸途径分支、过表达苯乳酸合成酶/氨基转移酶三步分子操作。
较优地,所述基因工程菌的构建方法的步骤如下:
⑴以地衣芽孢杆菌tccc11148为出发菌株,敲除色氨酸合成途径中的邻氨基苯甲酸合成酶基因trpe;
⑵对地衣芽孢杆菌tccc11148δtrpe进行敲除酪氨酸合成途径中的t-预苯酸脱氢酶基因tyra;
⑶过表达地衣芽孢杆菌tccc11148δtrpeδtyra乳酸脱氢酶基因ldh,即得高产苯乳酸地衣芽孢杆菌基因工程菌。
较优地,具体步骤如下:
⑴邻氨基苯甲酸合成酶基因trpe的敲除
①以genbank编号cp033218的地衣芽孢杆菌tccc11148基因组为模板,根据其trpe基因序列,分别在基因两端设计上游同源臂引物seqno.1、seqno.2和下游同源臂引物seqno.3、seqno.4,通过primestarmaxdnapolymerase酶经过pcr扩增获得trpe的上、下游同源臂;
②将上、下游同源臂与经过线性化载体pksvt(t2)通过solutioni混合连接酶连接获得敲除载体,化转入e.coliec135中,提质粒再化转入e.coliec135pm.bam进行甲基化修饰,涂布含有卡那霉素和壮观霉素的lb平板37℃、12h,挑取转化子于5ml的lb试管中,37℃、220r/min培养至od600为0.2时,加入质量终浓度为0.2%的阿拉伯糖进行诱导,30℃、220r/min培养12h,提取质粒电转化入地衣芽孢杆菌tccc11148感受态,涂布含有卡那霉素的lb平板;
③将电转涂布的平板培养45℃、12h,筛选单交换的菌株划线至无抗性平板中培养37℃、12h,挑取生长菌株对点含有卡那霉素与不含抗生素的平板,筛选出在卡那霉素抗性平板不长、在无抗平板生长的菌株为双交换邻氨基苯甲酸合成酶基因trpe敲除菌株地衣芽孢杆菌tccc11148δtrpe,并使用验证引物trpe1、trpe2对敲除菌株进行验证;
⑵t-预苯酸脱氢酶基因tyra的敲除
①以地衣芽孢杆菌tccc11148基因组为模板,根据其tyra基因序列,分别在基因两端设计上游同源臂引物seqno.5、seqno.6和下游同源臂引物seqno.7、seqno.8,通过primestarmaxdnapolymerase酶pcr扩增获得tyra的上、下游同源臂;
②敲除载体的构建同⑴的步骤①,将获得的载体电转化至地衣芽孢杆菌tccc11148δtrpe感受态中,涂布含有卡那霉素的lb平板;
③筛选双交换菌株方法同⑴的步骤③,筛选出双交换t-预苯酸脱氢酶基因tyra的敲除菌株地衣芽孢杆菌tccc11148δtrpeδtyra,并使用验证引物tyraseqno.11、seqno.12对敲除菌株进行验证;
⑶过表达乳酸脱氢酶基因ldh
①以植物乳杆菌atcc8014基因组为模板,设计引物seqno.13、seqno.14,通过primestarmaxdnapolymerase酶pcr扩增获得ldh片段,所述ldh片段的序列为seqno.15;
②经bamhi/smai双酶切后回收ldh片段与线性化载体ply-3,使用solutionⅰ混合连接酶连接片段与载体;
③将重组载体ply-3-ldh化转入e.coliec135中,提质粒再化转入e.coliec135pm.bam进行甲基化修饰,涂布含有卡那霉素和壮观霉素的lb平板培养37℃、12h,挑取转化子37℃、220r/min培养至od600为0.2时,加入质量终浓度为0.2%的阿拉伯糖进行诱导,30℃、220r/min培养12h,提取质粒电转化入地衣芽孢杆菌tccc11148δtrpeδtyra感受态,涂布含有卡那霉素的lb平板,即得高产苯乳酸地衣芽孢杆菌基因工程菌。
较优地,所述苯乳酸含量的检测方法为:
利用反相高效液相色谱法快速检测苯乳酸含量,步骤如下:
⑴配置流动相a为0.05%~0.5%三氟乙酸水溶液,流动相b为0.05%~0.5%三氟乙酸甲醇溶液,流动相过滤,脱气;上述百分数均为质量百分数;
⑵配置苯乳酸标品母液1mg/ml,按不同比例梯度稀释,用0.22μm无菌微孔滤膜过滤;
⑶待测样品10000~12000r/min离心5min,上清用0.22μm无菌微孔滤膜过滤,备用;
⑷使用inertsustainc184.6×250mm,5μm反相色谱柱;流动相流速:0.5~1ml/min;波长:210nm;柱温:25~30℃;进样量:5~10μl;
⑸梯度洗脱程序:0-20min10%-100%b;20-23min100%b;23-25min100%-10%b;
绘制苯乳酸标准曲线:利用agilentopenlab处理数据,确定苯乳酸出峰时间;以苯乳酸含量为横坐标,峰面积为纵坐标,绘制苯乳酸标准曲线。
如上所述的高产苯乳酸地衣芽孢杆菌基因工程菌在苯乳酸生产方面中的应用。
利用如上所述的高产苯乳酸地衣芽孢杆菌基因工程菌发酵生产苯乳酸的方法,步骤如下:
⑴将高产苯乳酸地衣芽孢杆菌基因工程菌接入种子培养基,培养35~37℃,12~16h;
⑵按2%的接种量将种子培养基接入发酵培养基,培养37℃,56~72h,即得苯乳酸。
较优地,所述步骤⑴中种子培养基为:lb培养基:胰蛋白胨1%,酵母浸粉0.5%,nacl1%,高温灭菌121℃,20~30min;上述百分数均为质量百分数。
较优地,所述步骤⑵中发酵培养基配方为:玉米粉6~6.4%,豆饼粉4~5%,高峰淀粉酶0.07%,na2hpo40.3~0.4%,kh2po40.03%,ph7.0-7.5,高温灭菌121℃,20~30min;上述百分数均为质量百分数。
具体地:
本发明通过基因工程与代谢工程技术对地衣芽孢杆菌tccc11148进行改造,包括抑制分支酸向色氨酸途径分支、抑制预苯酸向酪氨酸途径分支、过表达苯乳酸合成酶三步分子操作。地衣芽孢杆菌中具体芳香族氨基酸代谢途径见图1,苯乳酸主要核心合成途径见图2。
如上所述高产苯乳酸地衣芽孢杆菌基因工程菌的构建方法,步骤如下:
(1)以地衣芽孢杆菌tccc11148为出发菌株,敲除色氨酸合成途径中的邻氨基苯甲酸合成酶基因(trpe);
(2)对地衣芽孢杆菌tccc11148δtrpe进行敲除酪氨酸合成途径中的t-预苯酸脱氢酶基因(tyra);
(3)过表达地衣芽孢杆菌tccc11148δtrpeδtyra乳酸脱氢酶基因(ldh)。
利用如上所述的苯乳酸高产工程菌株发酵生产苯乳酸的方法,步骤如下:
(1)挑取经筛选后的菌株接入种子培养基,培养37℃,12h;
(2)按2%的接种量将种子培养基接入发酵培养基,培养37℃,56h。
利用反相高效液相色谱法快速检测苯乳酸含量的方法,步骤如下:
(1)配置流动相a为0.05%三氟乙酸水溶液,流动相b为0.05%三氟乙酸甲醇溶液,流动相过滤,脱气;
(2)配置苯乳酸标品母液1mg/ml,按不同比例梯度稀释,用0.22μm无菌微孔滤膜过滤;
(3)待测样品12000r/min离心5min,上清用0.22μm无菌微孔滤膜过滤,备用;
(4)使用inertsustainc18(4.6×250mm,5μm)反相色谱柱;流动相流速:1ml/min;波长:210nm;柱温:30℃;进样量:10μl;
(5)梯度洗脱程序:0-20min10%-100%b;20-23min100%b;23-25min100%-10%b;
绘制苯乳酸标准曲线:利用agilentopenlab处理数据,确定苯乳酸出峰时间。以苯乳酸含量为横坐标,峰面积为纵坐标,绘制苯乳酸标准曲线。
更为具体地,相关制备及检测可以如下:
一、高产苯乳酸地衣芽孢杆菌基因工程菌的构建方法,步骤如下:
(1)邻氨基苯甲酸合成酶基因(trpe)的敲除
①以地衣芽孢杆菌tccc11148基因组为模板,根据trpe基因序列,分别在基因两端设计上游同源臂引物(trpel-f、trpel-r)和下游同源臂引物(trper-f、trper-r),通过primestarmaxdnapolymerase酶经过pcr扩增获得trpe的上、下游同源臂,敲除载体的构建见图3;
②将上、下游同源臂与经过线性化载体pksvt(t2)通过solutioni混合连接酶连接获得敲除载体,化转入e.coliec135中,提质粒再化转入e.coliec135pm.bam进行甲基化修饰,涂布含有卡那霉素和壮观霉素的lb平板37℃、12h,挑取转化子于5ml的lb试管中,37℃、220r/min培养至od600为0.2时,加入终浓度为0.2%的阿拉伯糖进行诱导,30℃、220r/min培养12h,提取质粒电转化入地衣芽孢杆菌tccc11148感受态,涂布含有卡那霉素的lb平板;
③将电转涂布的平板培养45℃、12h,筛选单交换的菌株划线至无抗性平板中培养37℃、12h,挑取生长菌株对点含有卡那霉素与不含抗生素的平板,筛选出在卡那霉素抗性平板不长、在无抗平板生长的菌株为双交换邻氨基苯甲酸合成酶基因(trpe)敲除菌株地衣芽孢杆菌tccc11148δtrpe,并使用验证引物trpe1、trpe2对敲除菌株进行验证,具体敲除获得双交换突变体的筛选及验证见图4。
(2)t-预苯酸脱氢酶基因(tyra)的敲除
①以地衣芽孢杆菌tccc11148基因组为模板,根据tyra基因序列,分别在基因两端设计上游同源臂引物(tyral-f、tyral-r)和下游同源臂引物(tyrar-f、tyrar-r),通过primestarmaxdnapolymerase酶pcr扩增获得tyra的上、下游同源臂;
②敲除载体的构建同(1)的步骤①,将获得的载体电转化至地衣芽孢杆菌tccc11148δtrpe感受态中,涂布含有卡那霉素的lb平板;
③筛选双交换菌株方法同(1)的步骤③,筛选出双交换t-预苯酸脱氢酶基因(tyra)的敲除菌株地衣芽孢杆菌tccc11148δtrpeδtyra,并使用验证引物tyra1、tyra2对敲除菌株进行验证。
(3)过表达乳酸脱氢酶基因(ldh)
①以植物乳杆菌atcc8014基因组为模板,设计引物ldh-f、ldh-r,通过primestarmaxdnapolymerase酶pcr扩增获得ldh片段;
②经bamhi/smai双酶切后回收ldh片段与线性化载体ply-3,使用solutionⅰ混合连接酶连接片段与载体;
③将重组载体ply-3-ldh化转入e.coliec135中,提质粒再化转入e.coliec135pm.bam进行甲基化修饰,涂布含有卡那霉素和壮观霉素的lb平板培养37℃、12h,挑取转化子于5ml的lb试管中,37℃、220r/min培养至od600为0.2时,加入终浓度为0.2%的阿拉伯糖进行诱导,30℃、220r/min培养12h,提取质粒电转化入地衣芽孢杆菌tccc11148δtrpeδtyra感受态,涂布含有卡那霉素的lb平板,乳酸脱氢酶过表达菌株的菌液上清sds-page见图5。
表1引物序列
植物乳杆菌atcc8014基因组中ldh序列如下:
ttatttattttctaattcagctaaaccgtcgttaagcacttttttcaaagttgcggcggaatcttgcatcttcttgagttcgtcagctgaaagtggtgattcgatgatttgtttcaaaccagttccaccaatcacagccggagtcccgatataaatgtcgtttaagccgtattggccgtccatgtaggcacctactggtaaaacggcattttcatcacgtaaaatggctttggaaatccgcattaaagcagtcccgataccgtagaacgtggcacccttcaagttgatgatgtcgtaagctttgttacgaacaccatcttctaacttggctaaatcttcgtcagaaacgccttgttccttagcgacatcgcgaactggacgtgtcccgatggttgcagttgagtaagcagcaaattcagaatcaccgtgttcacccatgatgtaagcatcaacggaacgaggatcaacattgaattgtttgcctaacgcaacgcgtaaacgtgaagagtctaaggaagtccctgaaccaatgacacgatcctttgggaaacctgagaatttccaagtagcgtaagttaagatgtcaacagggttagcagcaactaagaagatgccgtcaaagccggagtcaacaactggtttgacaatggatgataggatatttaaattcttgttaactaagtctaaacgtgattcaccaggcttttgaggcgcaccggctgtaataacaactaagtcagcgtccttacaatctgaatattcgcctgagtaaatcttcttgggagcggtgaatgcttgggcgtcttcaagatcaagggcgtcaccctttgtccgatctttaacaacatcgacaattacaaattcttcagcaattccttgttgtgccatggcaaaagcgtaactagaaccaacagcgccgtcgccgactaacacaactttttgatgatttggcatgcttgacaa。
二、摇瓶发酵
(1)种子培养:将lb培养基平板培养菌种接种至含有50mllb培养基的250ml三角瓶中,37℃、220r/min培养12h;
(2)发酵培养:按照接种量的2%接种至含有100ml的500ml挡板瓶中,37℃、200r/min培养56h,并在不同时间点进行取样分析;
上述种子培养基配方为lb培养基:胰蛋白胨1%,酵母浸粉0.5%,nacl1%,高温灭菌121℃,20min。
发酵培养基配方为:玉米粉6.4%,豆饼粉4%,高峰淀粉酶0.07%,na2hpo40.4%,kh2po40.03%,ph7.0-7.5,高温灭菌121℃,20min。
三、发酵菌株苯乳酸产量检测
(1)利用反相高效液相色谱法绘制苯乳酸标准曲线
①配置苯乳酸标品母液1mg/ml,按不同比例稀释至浓度为0.1mg/ml,0.2mg/ml,0.4mg/ml,0.6mg/ml,0.8mg/ml,用0.22μm无菌微孔滤膜过滤,备用;
②使用inertsustainc18(4.6×250mm,5μm)反相色谱柱,设置流动相流速为1ml/min,波长为210nm,柱温30℃,进样量10μl,进行梯度洗脱,洗脱程序为0-20min10%-100%b,20-23min100%b,23-25min100%-10%b;
③绘制苯乳酸标准曲线,利用agilentopenlab处理数据,以苯乳酸含量为横坐标,峰面积为纵坐标,绘制苯乳酸标准曲线,获得标准曲线回归方程:y=19577x+732.69,r2=0.9991。
(2)利用反相高效液相色谱法检测发酵菌株苯乳酸产量
①发酵液经12000r/min离心5min,取上清经0.22μm无菌微孔滤膜过滤,备用;
②液相检测方法同方案(1)的步骤②,对比苯乳酸出峰时间,获得对应峰面积值,苯乳酸检测见图6;
③代入苯乳酸标准曲线回归方程,获得对应几株突变菌株在不同时间点的苯乳酸含量,产量检测见图7。
本发明所使用菌株地衣芽孢杆菌tccc11148对产物苯乳酸有一定耐受性,可安全快速生产目标产物。研究通过对地衣芽孢杆菌芳香族氨基酸代谢途径的连续改造及过表达,检测获得了4株苯乳酸高产菌株,经筛选并发酵48h后最高产量达17.8g/l,在苯乳酸的工业化生产中具有一定潜力。
尽管为说明目的公开了本发明的实施例,但是本领域的技术人员可以理解:在不脱离本发明及所附权利要求的精神和范围内,各种替换、变化和修改都是可能的,因此,本发明的范围不局限于实施例所公开的内容。
序列表
<110>天津科技大学
<120>一种高产苯乳酸地衣芽孢杆菌基因工程菌、生产苯乳酸的方法和应用
<160>15
<170>siposequencelisting1.0
<210>1
<211>25
<212>dna/rna
<213>引物trpel-f(unknown)
<400>1
ggatcctgtcggcgatgtgatcgac25
<210>2
<211>27
<212>dna/rna
<213>引物trpel-r(unknown)
<400>2
ggtacccggacggacactgaatgaaac27
<210>3
<211>29
<212>dna/rna
<213>引物trper-f(unknown)
<400>3
ggtaccctatctctcactccctttcaggc29
<210>4
<211>26
<212>dna/rna
<213>引物trper-r(unknown)
<400>4
ccgcgggacattacggagcggacgaa26
<210>5
<211>27
<212>dna/rna
<213>引物tyral-f(unknown)
<400>5
ggatccgctgatgaaatatcacccggc27
<210>6
<211>29
<212>dna/rna
<213>引物tyral-r(unknown)
<400>6
ggtaccggtggaacacatgaaaagaggaa29
<210>7
<211>30
<212>dna/rna
<213>引物tyrar-f(unknown)
<400>7
ggtaccaatcgtttcattcggttgagtcat30
<210>8
<211>29
<212>dna/rna
<213>引物tyrar-r(unknown)
<400>8
ccgcggcaacttgatccgtttccttgaaa29
<210>9
<211>19
<212>dna/rna
<213>引物trpe1(unknown)
<400>9
gtataaagcggctccggca19
<210>10
<211>20
<212>dna/rna
<213>引物trpe2(unknown)
<400>10
gtgcggctgcactcctttaa20
<210>11
<211>19
<212>dna/rna
<213>引物tyra1(unknown)
<400>11
attcccgtcctggtcggat19
<210>12
<211>24
<212>dna/rna
<213>引物tyra2(unknown)
<400>12
gatgaacagacgaaggttgtctgg24
<210>13
<211>29
<212>dna/rna
<213>引物ldh-f(unknown)
<400>13
ggatccgtcaagcatgccaaatcatcaaa29
<210>14
<211>35
<212>dna/rna
<213>引物ldh-r(unknown)
<400>14
cccgggtttattttctaattcagctaaaccgtcgt35
<210>15
<211>963
<212>dna/rna
<213>植物乳杆菌atcc8014基因组中ldh序列(unknown)
<400>15
ttatttattttctaattcagctaaaccgtcgttaagcacttttttcaaagttgcggcgga60
atcttgcatcttcttgagttcgtcagctgaaagtggtgattcgatgatttgtttcaaacc120
agttccaccaatcacagccggagtcccgatataaatgtcgtttaagccgtattggccgtc180
catgtaggcacctactggtaaaacggcattttcatcacgtaaaatggctttggaaatccg240
cattaaagcagtcccgataccgtagaacgtggcacccttcaagttgatgatgtcgtaagc300
tttgttacgaacaccatcttctaacttggctaaatcttcgtcagaaacgccttgttcctt360
agcgacatcgcgaactggacgtgtcccgatggttgcagttgagtaagcagcaaattcaga420
atcaccgtgttcacccatgatgtaagcatcaacggaacgaggatcaacattgaattgttt480
gcctaacgcaacgcgtaaacgtgaagagtctaaggaagtccctgaaccaatgacacgatc540
ctttgggaaacctgagaatttccaagtagcgtaagttaagatgtcaacagggttagcagc600
aactaagaagatgccgtcaaagccggagtcaacaactggtttgacaatggatgataggat660
atttaaattcttgttaactaagtctaaacgtgattcaccaggcttttgaggcgcaccggc720
tgtaataacaactaagtcagcgtccttacaatctgaatattcgcctgagtaaatcttctt780
gggagcggtgaatgcttgggcgtcttcaagatcaagggcgtcaccctttgtccgatcttt840
aacaacatcgacaattacaaattcttcagcaattccttgttgtgccatggcaaaagcgta900
actagaaccaacagcgccgtcgccgactaacacaactttttgatgatttggcatgcttga960
caa963
- 还没有人留言评论。精彩留言会获得点赞!