一种氮杂5,6-并环化合物的合成方法与流程
本发明属于有机合成技术领域,具体涉及一种氮杂5,6-并环化合物的合成方法。
背景技术:
氮杂5,6-并环作为一种极其特殊的化合物结构,广泛存在于各类天然产物,药物活性分子中。如何高效的构建氮杂5,6-并环一直以来都是合成的关键步骤,其合成方式大多数都采用亲核取代的方法。2012年,雷晓光报道(li,h.,wang,x.,lei,x.totalsynthesesoflycopodiumalkaloids(+)-fawcettimine,(+)-fawcettidine,and(-)-8-deoxyserratinine.angew.chem.int.ed.2012,51,491–495;)了分子内的sn1反应构建石松科生物碱serratinine中的氮杂5,6-并环环结构;2013年,邵志会报道(li,z.,zhang,s.,wu,s.,shen,x.,zou,l.;wang,f.,li,x.,peng,f.,zhang,h.,shao,z.enantioselectivepalladium-catalyzeddecarboxylativeallylationofcarbazolones:totalsynthesisof(-)-aspidospermidineand(+)-kopsihainaninea.angew.chem.,int.ed.2013,52,4117-4121)了分子内的sn2反应构建白坚木属生物碱kopsihainaninea的骨架结构;2017年,汤文军报道(du,k.,yang,h.,guo,p.,feng,l.,xu,g.,zhou,q.,chung,l.w.,tang,w.efficientsynthesesof(-)-crinineand(-)-aspidospermidine,andtheformalsynthesisof(-)-minfiensinebyenantioselectiveintramoleculardearomativecyclization.chem.sci.,2017,8,6247-6256.)了分子内的sn2反应构建文殊兰生物碱crinine的骨架结构。这些方法需要对官能团进行大量修饰,并且底物的限制比较大,对于其他类型的体系参考意义不高。
技术实现要素:
针对以上现有技术的缺点和不足之处,本发明的目的在于提供一种氮杂5,6-并环化合物的合成方法。
本发明目的通过以下技术方案实现:
一种氮杂5,6-并环化合物的合成方法,包括以下步骤:
在保护性氛围下,以有机溶剂为反应介质,化合物1在甲基三苯基溴化膦和碱的作用下发生反应,后续处理,获得氮杂5,6-并环化合物记为化合物2;
进一步地,以有机溶剂为反应介质,将化合物2在酸性条件下反应,后续处理,获得反应产物;将所获得的产物与对甲苯磺酰氯进行反应,获得氮杂5,6-并环化合物记为化合物3。
化合物1,化合物2,化合物3的结构式分别为:
结构式中“boc”为叔丁氧羰基。
所述碱为有机碱,优选为叔戊醇钾。
所述碱与化合物1的摩尔比为(2.5~4.5):1。
所述甲基三苯基膦与化合物1的摩尔比为(3.5~5):1。
化合物2的制备过程中,所述有机溶剂优选为甲苯。
化合物2的制备过程中,反应的温度为75℃~85℃;反应的时间为1~10h。
化合物2的制备过程中,所述后续处理是指使用饱和氯化铵溶液淬灭反应,分离提纯;所述分离提纯是指加入乙酸乙酯萃取,合并有机相后使用饱和氯化钠溶液反洗,无水硫酸钠干燥,过滤,浓缩,粗产物使用快速制备硅胶色谱柱分离(石油醚:乙酸乙酯=3:1)。
所述酸性条件中采用的酸为三氟乙酸。
反应产物的制备过程中,所述有机溶剂优选为二氯甲烷。
反应产物的制备过程中,所述酸性条件中采用的酸与有机溶剂的体积比为1:(5~10)。
反应产物的制备过程中,所述化合物2在有机溶剂中的浓度为0.05~0.15mmol/ml。
反应产物的制备过程中,反应的温度为室温,反应的时间为1~3h;
反应产物的制备过程中,所述后续处理是指使用饱和碳酸氢钠溶液淬灭反应,分离提纯;所述分离提纯是指乙酸乙酯萃取,合并有机相,饱和氯化钠溶液反洗,无水硫酸钠干燥,过滤,浓缩。
化合物3制备的过程中,所述反应在有机溶剂和碱性化合物的体系中进行,所述碱性化合物为三乙胺;所述有机溶剂优选为三氯甲烷。
化合物3制备的过程中,对甲苯磺酰氯(tscl)与化合物2的摩尔比为(1~1.5):1。
所述碱性化合物与化合物2的摩尔比为(1~3):1。
化合物3制备的过程中,反应的温度为0~4℃;反应的时间为1~3h。
化合物3制备的过程中,反应完成后使用饱和碳酸氢钠溶液淬灭反应,分离提纯;所述分离提纯是指乙酸乙酯萃取,饱和氯化钠溶液反洗,无水硫酸钠干燥有机相,过滤,浓缩,柱层析。
本发明的合成方法反应方程式:
本发明的合成方法具有如下优点及有益效果:本发明的合成方法操作安全简单,所用原料无毒,试剂廉价,产率高,适用性广等。
附图说明
图1为化合物1的氢谱图;
图2为化合物1的碳谱图;
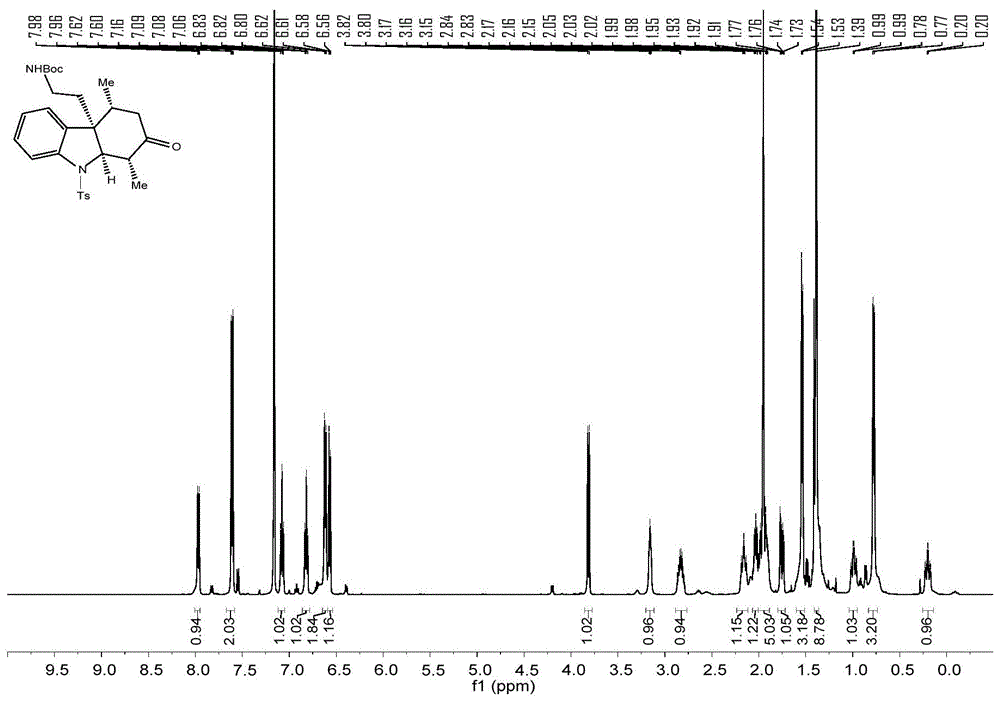
图3为实施例5制备的化合物2的氢谱图;
图4为实施例5制备的化合物3的氢谱图;
图5为实施例5制备的化合物3的碳谱图。
具体实施方式
下面结合具体实施例以及附图,对本发明作进一步的描述,但本发明的实施方式不限于此。
实施例1
反应方程式为
一种氮杂5,6-并环化合物的合成方法,包括以下步骤:
1)将化合物1(13.8mg,0.027mmol)与干燥的甲基三苯基溴化磷(48mg,0.135mmol,5当量)混合,置换氮气三次,加入无水甲苯(0.5ml),升温至80℃后,迅速加入叔戊醇钾(69μl,0.12mmol,4.5当量),反应在80℃搅拌10小时后,恢复室温,使用饱和氯化铵溶液淬灭反应,加入乙酸乙酯萃取三次,合并有机相后使用饱和氯化钠溶液反洗,无水硫酸钠干燥,过滤,浓缩,粗产物使用快速制备硅胶色谱柱分离(石油醚:乙酸乙酯=3:1),得到白色固体化合物2(10.4mg,75%);
2)将化合物2(25.5mg,0.05mmol)溶于二氯甲烷(0.5ml)中,加入三氟乙酸(50μl),室温搅拌1h后,使用饱和碳酸氢钠溶液淬灭反应,加入乙酸乙酯萃取三次,合并有机相后使用饱和氯化钠溶液反洗,无水硫酸钠干燥,过滤,浓缩,粗产物重新溶于二氯甲烷(0.5ml)中,置于0℃冰水浴,加入三乙胺(14μl,0.1mmol,2.0当量),对甲苯磺酰氯(11.4mg,0.06mmol,1.2当量),保持0℃反应1h后,使用饱和碳酸氢钠溶液淬灭反应,加入乙酸乙酯萃取三次,合并有机相后使用饱和氯化钠溶液反洗,无水硫酸钠干燥,过滤,浓缩,粗产物使用快速制备硅胶色谱柱分离(石油醚:乙酸乙酯=7:1到5:1),得到白色固体化合物3(25.8mg,91%(两步收率即经过在三氟乙酸条件下反应和与对甲苯磺酰氯反应的收率))。
实施例2
反应方程式为
一种氮杂5,6-并环化合物的合成方法,包括以下步骤:
1)将化合物1(43mg,0.084mmol)与干燥的甲基三苯基溴化磷(105mg,0.294mmol,3.5当量)混合,置换氮气三次,加入无水甲苯(1.6ml),升温至80℃后,迅速加入叔戊醇钾(0.12ml,0.21mmol,2.5当量),反应在80℃搅拌1小时后,恢复室温,使用饱和氯化铵溶液淬灭反应,加入乙酸乙酯萃取三次,合并有机相后使用饱和氯化钠溶液反洗,无水硫酸钠干燥,过滤,浓缩,粗产物使用快速制备硅胶色谱柱分离(石油醚:乙酸乙酯=3:1),得到白色固体化合物2(36.3mg,85%);
2)将化合物2(400mg,0.78mmol)溶于二氯甲烷(7.8ml)中,加入三氟乙酸(0.78ml),室温搅拌1h后,使用饱和碳酸氢钠溶液淬灭反应,加入乙酸乙酯萃取三次,合并有机相后使用饱和氯化钠溶液反洗,无水硫酸钠干燥,过滤,浓缩,粗产物重新溶于二氯甲烷(7.8ml)中,置于0℃冰水浴,加入三乙胺(0.22ml,1.56mmol,2.0当量),对甲苯磺酰氯(179mg,0.94mmol,1.2当量),保持0℃反应1h后,使用饱和碳酸氢钠溶液淬灭反应,加入乙酸乙酯萃取三次,合并有机相后使用饱和氯化钠溶液反洗,无水硫酸钠干燥,过滤,浓缩,粗产物使用快速制备硅胶色谱柱分离(石油醚:乙酸乙酯=7:1到5:1),得到白色固体化合物3(432mg,98%(两步收率))。
实施例3
反应方程式为
一种氮杂5,6-并环化合物的合成方法,包括以下步骤:
1)将化合物1(394mg,0.77mmol)与干燥的甲基三苯基溴化磷(962mg,2.70mmol,3.5当量)混合,置换氮气三次,加入无水甲苯(15ml),升温至80℃后,迅速加入叔戊醇钾(1.1ml,1.93mmol,2.5当量),反应在80℃搅拌1.5小时后,恢复室温,使用饱和氯化铵溶液淬灭反应,加入乙酸乙酯萃取三次,合并有机相后使用饱和氯化钠溶液反洗,无水硫酸钠干燥,过滤,浓缩,粗产物使用快速制备硅胶色谱柱分离(石油醚:乙酸乙酯=3:1),得到白色固体化合物2(347mg,88%)。
2)将化合物2(400mg,0.78mmol)溶于二氯甲烷(7.8ml)中,加入三氟乙酸(0.78ml),室温搅拌1h后,使用饱和碳酸氢钠溶液淬灭反应,加入乙酸乙酯萃取三次,合并有机相后使用饱和氯化钠溶液反洗,无水硫酸钠干燥,过滤,浓缩,粗产物重新溶于二氯甲烷(7.8ml)中,置于0℃冰水浴,加入三乙胺(0.22ml,1.56mmol,2.0当量),对甲苯磺酰氯(179mg,0.94mmol,1.2当量),保持0℃反应1h后,使用饱和碳酸氢钠溶液淬灭反应,加入乙酸乙酯萃取三次,合并有机相后使用饱和氯化钠溶液反洗,无水硫酸钠干燥,过滤,浓缩。粗产物使用快速制备硅胶色谱柱分离(石油醚:乙酸乙酯=7:1到5:1),得到白色固体化合物3(432mg,98%(两步收率))。
实施例4
反应方程式为
一种氮杂5,6-并环化合物的合成方法,包括以下步骤:
1)将化合物1(381mg,0.74mmol)与干燥的甲基三苯基溴化磷(1.06g,2.96mmol,4.0当量)混合,置换氮气三次,加入无水甲苯(15ml),升温至80℃后,迅速加入叔戊醇钾(1.09ml,1.83mmol,2.5当量),反应在80℃搅拌1.0小时后,恢复室温,使用饱和氯化铵溶液淬灭反应,加入乙酸乙酯萃取三次,合并有机相后使用饱和氯化钠溶液反洗,无水硫酸钠干燥,过滤,浓缩,粗产物使用快速制备硅胶色谱柱分离(石油醚:乙酸乙酯=3:1),得到白色固体化合物2(278mg,74%)。
2)将化合物2(400mg,0.78mmol)溶于二氯甲烷(7.8ml)中,加入三氟乙酸(0.78ml),室温搅拌1h后,使用饱和碳酸氢钠溶液淬灭反应,加入乙酸乙酯萃取三次,合并有机相后使用饱和氯化钠溶液反洗,无水硫酸钠干燥,过滤,浓缩,粗产物重新溶于二氯甲烷(7.8ml)中,置于0℃冰水浴,加入三乙胺(0.22ml,1.56mmol,2.0equiv),对甲苯磺酰氯(179mg,0.94mmol,1.2equiv),保持0℃反应1h后,使用饱和碳酸氢钠溶液淬灭反应,加入乙酸乙酯萃取三次,合并有机相后使用饱和氯化钠溶液反洗,无水硫酸钠干燥,过滤,浓缩,粗产物使用快速制备硅胶色谱柱分离(石油醚:乙酸乙酯=7:1到5:1),得到白色固体化合物3(432mg,98%(两步收率))。
实施例5
反应方程式为
一种氮杂5,6-并环化合物的合成方法,包括以下步骤:
1)将化合物1(1.64g,3.20mmol)与干燥的甲基三苯基溴化磷(5.20g,12.8mmol,4.0当量)混合,置换氮气三次,加入无水甲苯(64ml),升温至80℃后,迅速加入叔戊醇钾(4.60ml,8.0mmol,2.5当量),反应在80℃搅拌3.0小时后,恢复室温,使用饱和氯化铵溶液淬灭反应,加入乙酸乙酯萃取三次,合并有机相后使用饱和氯化钠溶液反洗,无水硫酸钠干燥,过滤,浓缩,粗产物使用快速制备硅胶色谱柱分离(石油醚:乙酸乙酯=3:1),得到白色固体化合物2(1.30g,82%);
2)将化合物2(400mg,0.78mmol)溶于二氯甲烷(7.8ml)中,加入三氟乙酸(0.78ml),室温搅拌1h后,使用饱和碳酸氢钠溶液淬灭反应,加入乙酸乙酯萃取三次,合并有机相后使用饱和氯化钠溶液反洗,无水硫酸钠干燥,过滤,浓缩,粗产物重新溶于二氯甲烷(7.8ml)中,置于0℃冰水浴,加入三乙胺(0.22ml,1.56mmol,2.0当量),对甲苯磺酰氯(179mg,0.94mmol,1.2当量),保持0℃反应1h后,使用饱和碳酸氢钠溶液淬灭反应,加入乙酸乙酯萃取三次,合并有机相后使用饱和氯化钠溶液反洗,无水硫酸钠干燥,过滤,浓缩,粗产物使用快速制备硅胶色谱柱分离(石油醚:乙酸乙酯=7:1到5:1)得到白色固体化合物3(432mg,98%(两步收率))。
本发明中所有结构均经过核磁共振谱图确认,数据如下:化合物1:
1hnmr(500mhz,c6d6)δ=7.97(d,j=8.0hz,1h),7.61(d,j=8.2hz,2h),7.08(t,j=7.7hz,1h),6.82(t,j=7.4hz,1h),6.62(d,j=8.0hz,2h),6.57(d,j=7.3hz,1h),3.81(d,j=8.8hz,1h),3.19–3.12(m,1h),2.88–2.78(m,1h),2.16(ddd,j=16.7,12.5,4.5hz,1h),2.07–2.01(m,1h),2.01–1.88(m,2h),1.95(s,3h),1.75(dd,j=13.9,5.7hz,1h),1.54(d,j=6.7hz,3h),1.39(s,9h),0.99(td,j=12.8,4.8hz,1h),0.78(d,j=7.0hz,3h),0.20(td,j=12.9,4.2hz,1h).
13cnmr(125mhz,c6d6)δ=207.0,155.3,143.7,140.7,138.6,137.6,129.6,128.7,127.5,124.6,123.7,118.7,78.7,76.4,50.9,48.5,44.2,37.1,35.6,31.6,28.4,21.1,16.3,12.9.
化合物2(可能存在旋转异构体,比例约为2.5:1):
1hnmr(400mhz,cdcl3,rotamers)δ=7.78(d,j=7.8hz,1h,rotamer),7.68(d,j=7.7hz,3h),7.43(d,j=8.0hz,0h,rotamer),7.31–7.24(m,3h),7.15(dt,j=18.9,8.9hz,3h),7.03(q,j=7.3,6.3hz,1h),6.59(s,1h),5.12(s,1h),5.06(s,0h,rotamer),5.02(s,1h),4.98(s,0h,rotamer),3.97(d,j=10.5hz,1h),3.59(q,j=10.1hz,1h),3.51–3.36(m,1h,rotamer),3.31(q,j=12.2,10.8hz,1h),2.40(s,6h),2.35–2.13(m,5h),1.93(dd,j=20.8,10.1hz,3h),1.20(s,9h),1.19(s,3h),1.17(s,1h,rotamer),0.54(d,j=5.6hz,1h,rotamer),0.39(d,j=4.7hz,3h).
化合物3:
1hnmr(400mhz,cdcl3)δ=7.85(d,j=8.2hz,2h),7.55(d,j=8.1hz,1h),7.33(d,j=8.1hz,2h),6.98(t,j=7.4hz,1h),6.76(d,j=8.0hz,2h),6.70–6.62(m,3h),6.47(d,j=7.7hz,1h),6.36(t,j=7.5hz,1h),5.13(s,1h),5.08(s,1h),3.94(d,j=10.2hz,1h),3.51(t,j=9.3hz,1h),2.98(q,j=9.9hz,1h),2.47–2.36(m,1h),2.34(s,3h),2.32–2.25(m,3h),2.23(s,3h),2.02–1.91(m,2h),1.44(d,j=6.6hz,3h),0.43(d,j=5.4hz,3h).
13cnmr(101mhz,cdcl3)δ=148.6,144.4,141.8,136.4,134.6,133.7,129.9,129.7,128.9,127.6,127.4,126.6,126.5,123.3,119.7,109.8,73.3,52.4,43.4,42.8,40.2,38.7,27.8,21.4,21.2,17.4,16.0.
图1为化合物1的氢谱图;图2为化合物1的碳谱图;
图3为实施例5制备的化合物2的氢谱图;
图4为实施例5制备的化合物3的氢谱图;图5为实施例5制备的化合物3的碳谱图。
- 还没有人留言评论。精彩留言会获得点赞!