一种美藤果免疫活性肽及其制备方法与流程
本发明涉及免疫活性肽技术领域,具体而言,涉及一种美藤果免疫活性肽及其制备方法。
背景技术:
免疫活性肽是指一类具有增强免疫功能、转移免疫信息及促进淋巴细胞分化成熟等生物学功能的活性多肽,具有无毒、低过敏性、高安全性等优点,在食品、保健品、生物医药等领域有很好的应用前景。目前为止,科研工作者已从乳蛋白、大豆蛋白、大米蛋白、鱼贝类蛋白、胶原蛋白等蛋白酶解物中分离出多种具有免疫活性的肽段并将其应用于临床研究,取得了显著效果。但在既有研究中,采用美藤果蛋白制备免疫活性肽还未见报道。
美藤果是一种新兴的热带地区油料品种,随着其果油及其蛋白被列为国家新资源食品,美藤果本身的加工和综合利用的问题也逐渐引起食品加工业的关注。美藤果种仁榨油后剩余的美藤果粕含有丰富的蛋白质,但目前这部分蛋白质资源的开发和利用还比较有限。因此,以美藤果粕为原料分离制备免疫活性多肽对植物蛋白来源免疫活性肽的相关研究具有重要意义,同时对提高美藤果加工副产物附加值、开发具有提高免疫力功能的产品具有一定现实意义。
技术实现要素:
本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明提出一种美藤果免疫活性肽,所述美藤果免疫活性肽能够快速穿过人体口腔和胃,直接进入小肠,更好地被人体消化吸收,具有清除自由基、提高人体免疫力等功能。
本发明还提出一种用于制备上述美藤果免疫活性肽的美藤果免疫活性肽的制备方法。
根据本发明第一方面实施例的美藤果免疫活性肽,包括:tggwsplk、wkpw、fltmepr,vvldvk、kvvl、mvvkk、ltglnkl、rllvweler、klslewwlk、fvkll、lgdlgtkl、ltgldkl、lfaemdk、eadgtlr、vvlfk、tllnpr、ayltglk、wlpdvk、vlwlpr、rwqvwedr、tvllpr、lvrfpk、tllfgdk、wselvk等24条肽段。
根据本发明实施例的美藤果免疫活性肽,免疫功能较强,通过小鼠巨噬细胞模型raw264.7对所述多肽进行体外免疫活性评价,实验表明,该免疫活性肽对raw264.7巨噬细胞吞噬能力有促进作用,在保护机体、加强机体的免疫力方面也有一定的积极作用。
根据本发明第二方面实施例的美藤果免疫活性肽的制备方法,包括:
根据本发明的一些实施例,所述提取美藤果的清蛋白包括:
对美藤果粕进行粉碎以获得美藤果粕粉;
取所述美藤果粕粉置于超临界萃取设备的24l提取釜中,在20mpa、32℃的条件下萃取120min,其中,co2的流速为60ml/min;
弃去萃取出的美藤果油,取出美藤果饼粕粉,加入一定量一级水,超声处理15min,恒温搅拌提取一定时间,以4000转每分钟的速度离心10min分离得上清液;
将所述上清液置于蒸馏水中、温度为4℃的条件下透析72小时,并于旋转蒸发器中旋转蒸发一定时间,经过真空冷冻干燥获得冻干的所述清蛋白;
对所述清蛋白进行水解以获得清蛋白水解液;
对所述清蛋白水解液进行超滤处理和分离纯化处理;
收集多肽溶液。
根据本发明实施例的美藤果免疫活性肽的制备方法,对美藤果的清蛋白水解后,利用超滤处理和分离纯化处理有针对性地对所需肽段进行分离富集,得到的免疫活性肽产品功能更强,纯度更高。
另外,根据本发明实施例的美藤果免疫活性肽的制备方法还具有如下附加的技术特征:
根据本发明的一些实施例,所述清蛋白的提取条件为:料液比为1:25(g/ml)、提取温度为40℃、提取时间为5h。
根据本发明的一些实施例,利用蛋白酶对所述清蛋白进行水解。
在本发明的一些实施例中,所述蛋白酶为中性蛋白酶、木瓜蛋白酶、碱性蛋白酶、胰蛋白酶和胃蛋白酶的一种或多种。
在本发明的一些具体实施例中,采用胰蛋白酶进行水解时的水解条件为:加酶量为7000u/g、反应ph为7.0、酶解温度为50℃、酶解时间为4h。
根据本发明的一些实施例,采用分子量为3kda的超滤膜对所述清蛋白水解液进行超滤处理;
对超滤处理后分子量小于3kda的清蛋白水解液超声处理15min后进行分离纯化处理,用流速为3ml/min的蒸馏水洗脱,收集13min-29min洗脱出来的多肽溶液;
对收集到的多肽溶液进行浓缩。
根据本发明的一些实施例,采用sephadexg-25葡聚糖凝胶柱对所述清蛋白水解液进行分离纯化处理。
根据本发明的一些实施例,在超滤处理过程中用氮气进行加压,使压力保持在0.2mpa,并将获得的多肽溶液置于冰面上以保证其活性。
根据本发明实施例的美藤果免疫活性肽,功能更强,纯度更高。
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
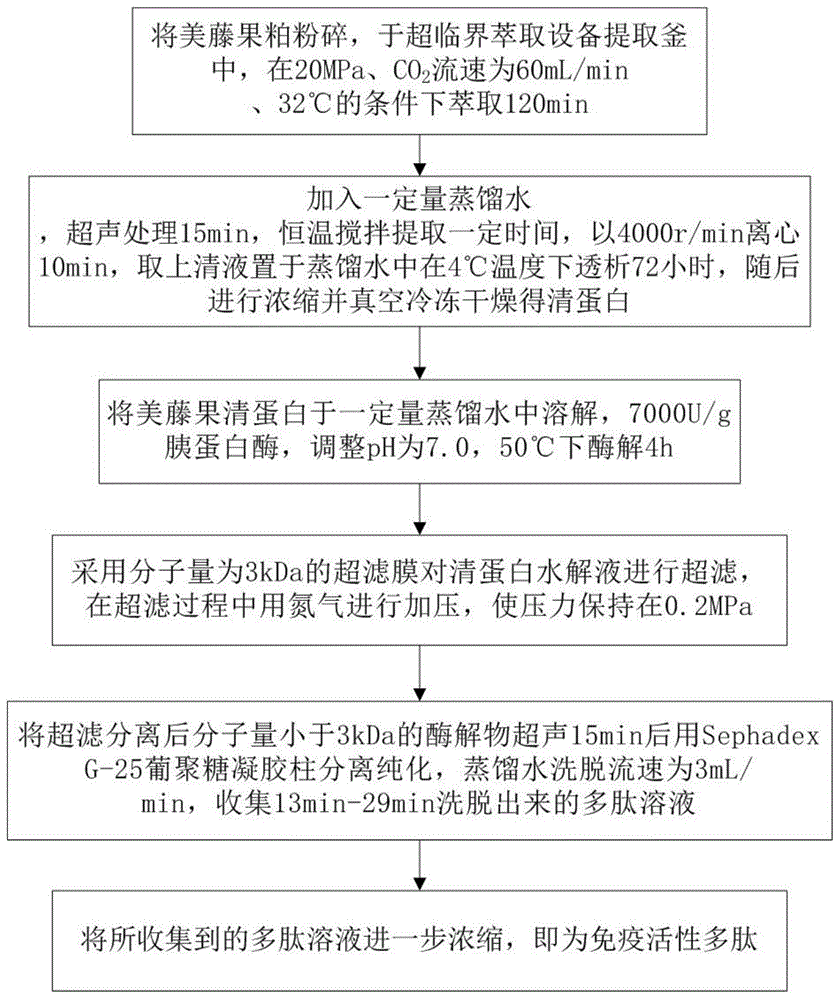
图1是根据本发明实施例的美藤果免疫活性肽的制备方法的流程图;
图2是不同蛋白酶对美藤果的清蛋白水解度的影响结果示意图;
图3是美藤果的清蛋白酶解物的hpgpc谱图;
图4是美藤果的清蛋白酶解物的分子量分布谱图;
图5是美藤果的清蛋白酶解物各超滤组分对raw264.7细胞增殖作用的影响结果示意图;
图6是美藤果的清蛋白酶解物各超滤组分对raw264.7细胞吞噬作用的影响结果示意图;
图7是美藤果的清蛋白酶解物小于3kda组分的洗脱曲线图;
图8是sephadexg-25分离组分对raw264.7细胞增殖作用的影响结果示意图;
图9是sephadexg-25分离组分对raw264.7细胞吞噬作用的影响结果示意图;
图10是sephadexg-25分离组分p1的色谱总离子流图;
图11-图34分别对应液相色谱-串联质谱联用denovo测序分析的不同免疫活性肽段二级质谱图。
具体实施方式
下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
下面参考附图描述根据本发明实施例的美藤果免疫活性肽的制备方法。
如图1所示,提取美藤果清蛋白;所得清蛋白用蛋白酶进行水解;将清蛋白水解液进行超滤;利用sephedaxg-25葡聚糖凝胶柱进一步分离纯化;收集多肽组分,即得免疫活性肽。
其中,提取美藤果粕中的清蛋白的最佳提取条件为:料液比为1:25(g/ml),提取温度为40℃,提取时间为5h。
所述蛋白酶可以是中性蛋白酶、木瓜蛋白酶、碱性蛋白酶、胰蛋白酶和胃蛋白酶的一种或一种以上,优选为胰蛋白酶。其中,采用胰蛋白酶进行水解时的最佳水解条件为:加酶量为7000u/g、反应ph为7.0、酶解温度为50℃、酶解时间为4h。
优选地,用分子量为3kda的超滤膜对清蛋白水解液进行超滤。在超滤过程中用氮气进行加压,使压力保持在0.2mpa。将获得的多肽溶液置于冰面上,以保证其活性。
优选地,用sephadexg-25葡聚糖凝胶柱将上述酶解物进一步分离纯化。sephadexg-25填料经过充分泡发后装柱。将超滤分离后分子量小于3kda的酶解物超声15min后用蒸馏水洗脱,流速为3ml/min。优选地,收集13min-29min洗脱出来的多肽溶液。
本发明实施例对美藤果清蛋白酶解后,利用超滤膜和sephadexg-25葡聚糖凝胶柱有针对性地对所需肽段进行分离富集,得到的免疫活性肽产品功能更强,纯度更高。通过小鼠巨噬细胞模型raw264.7对所述多肽进行体外免疫活性评价,实验表明,该免疫活性肽对raw264.7巨噬细胞吞噬能力有促进作用,在保护机体、加强机体的免疫力方面也有一定的积极作用。
根据本发明实施例的制备方法所得的美藤果免疫活性肽通过lc/ms-ms液质分析,对采集的高分辨质谱数据集进行denovo分析其氨基酸序列,共鉴定出tggwsplk、wkpw、fltmepr、vvldvk、kvvl、mvvkk、ltglnkl、rllvweler、klslewwlk、fvkll、lgdlgtkl、ltgldkl、lfaemdk、eadgtlr、vvlfk、tllnpr、ayltglk、wlpdvk、vlwlpr、rwqvwedr、tvllpr、lvrfpk、tllfgdk、wselvk等24条肽段。经过蛋白质数据库blast、多肽数据库piopep比对,未发现与本发明所得相同的多肽,因此,本发明所得24条肽段都是新型多肽。
下面结合具体实例进一步详细描述本发明,但这些实例旨在用于解释本发明,而不能理解为对本发明的限制。下述实施例中所使用的实验方法如无特殊说明均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明均可从商业途径获得。
以下实施例所使用的材料和试剂如下:
表1免疫活性肽制备主要材料
表2免疫活性肽制备主要试剂
实施例1美藤果清蛋白的最优工艺条件的选择
将美藤果粕粉碎,取美藤果粕粉置于超临界萃取设备的24l提取釜中,在20mpa、32℃的条件下萃取120min,co2流速为60ml/min。弃去萃取出的美藤果油,将美藤果饼粕粉取出并加入一定量一级水,超声处理15min,恒温搅拌提取一定时间,以4000转每分钟的速度离心10min分离得上清液,将上清液置于蒸馏水中在4℃温度下透析72小时后,于旋转蒸发器中旋转蒸发一定时间,然后真空冷冻干燥得冻干的清蛋白。根据模拟实验,考虑到料液比、提取温度、提取时间等因素的相互影响,拟采用正交实验来确定清蛋白的最佳提取条件,本实验通过l9(34)正交试验来完成,方案见表3。
表3清蛋白提取试验因素水平表
实验结果如表4所示,由表4极差分析可得影响美藤果清蛋白提取率的因素依次为液料比>提取时间>提取温度,均值的大小反映该条件的影响水平,均值最大即为该条件的最优化参数。从表4可以看出,三个条件中均值最大的分别为:料液比为1:25(g/ml)、提取温度为40℃、提取时间为5h。经3次验证实验,此条件下平均提取率为52.36%,与正交试验结果相当,证明优化的结果是可靠的。
表4清蛋白提取正交试验结果
实施例2美藤果清蛋白水解酶种类的筛选及最佳水解条件的选择
将美藤果清蛋白按1:15的料液比进行调配,调整最适作用温度和最适ph后按照6000u/g的酶活比加入中性蛋白酶、木瓜蛋白酶、复合蛋白酶、胰蛋白酶、胃蛋白酶和碱性蛋白酶,酶解3h,以水解度为指标对酶种类进行筛选。根据模拟实验,考虑到酶解时间、酶解温度、加酶量及ph等因素的相互影响,拟采用正交实验来确定清蛋白最佳酶解条件,本实验通过l9(34)正交试验来完成,方案见表5。
实验结果如图2所示,不同蛋白酶的美藤果清蛋白酶解液的水解度存在显著性差异(p<0.05),美藤果清蛋白的胰蛋白酶酶解产物水解度最佳,考虑工艺化生产以及经济效益,选择胰蛋白酶运用于美藤果清蛋白多肽的生产。清蛋白酶解正交试验结果如表5所示,由表5极差分析可得影响美藤果清蛋白酶解的因素依次为酶解温度>酶解ph>酶解时间>加酶量,酶解最优工艺条件为:加酶量7000u/g、ph7.0、酶解温度50℃、酶解时间4h。根据得出的最优组合做验证实验,得到的水解度为28.04%±0.07,证明优化结果较为可靠。
表5清蛋白酶解正交试验结果
实施例3美藤果免疫活性肽分离纯化鉴定及其免疫活性评价
1.超滤分离
为了纯化富集活性组分,对美藤果清蛋白酶解产物进行超滤处理,得到不同分子量大小的多肽混合溶液。将酶解液置于超滤杯中,相继用10kda和3kda的超滤膜组件进行超滤处理,封闭超滤杯后,用氮气进行加压,使压力保持在0.2mpa。将获得的多肽溶液置于冰面上,以保证其活性。随后用小鼠巨噬细胞模型raw264.7对100μg/ml浓度下各超滤组分进行体外免疫活性评价,并与空白对照组、1μg/ml脂多糖(lps)和相同浓度未经超滤的清蛋白酶解物(sip)做对比,剩余样品置于-80℃真空冷冻干燥,-20℃保存备用。
各超滤组分体外免疫活性评价如图5-图6所示,小于3kda超滤组分对raw264.7细胞增值能力及吞噬中性红能力的促进效果最佳。经超滤分离,小于3kda超滤组分对raw264.7细胞增值能力比空白组、sip组和lps组分别增长了72.34%、18.09%和85.11%;小于3kda超滤组分对raw264.7细胞吞噬中性红的能力比空白组、sip组和lps组分别增长了85.39%、30.45%和19.95%。说明小于3kda超滤组分能够显著促进raw264.7细胞增殖活化,提高免疫力。如表6所示,小于3kda超滤组分有较良好的氨基酸组成,对机体能有相对较好的免疫活性,此判定结果符合体外免疫活性实验结果。
表6美藤果清蛋白酶解物各超滤组分的氨基酸组成
2.葡聚糖凝胶柱纯化
sephadexg-25填料经过充分泡发后,装柱。将酶解物于蒸馏水溶解后超声,上样。采用蒸馏水洗脱,流速为3ml/min,每管收集3ml,检测波长为280nm。分别收集各个经洗脱分离后的峰组分,冷冻干燥后利用小鼠巨噬细胞模型raw264.7对各组分进行体外免疫活性评价。
实验结果如图7-图9所示,经sephadexg-25葡聚糖凝胶柱,小于3kda超滤组分被分离成三个主要组分,分别为组分p1、p2和p3。经sephadexg-25分离各组分均对raw264.7巨噬细胞无毒害作用,能够促进raw264.7巨噬细胞活化及细胞的吞噬活性,提高免疫力,而p1组分的效果明显优于p2、p3组分。由表7和表8可知,与lps组相比,不同浓度的p1组分对lps诱导后的raw264.7巨噬细胞分泌的tnf-α和il-6含量均有极显著地抑制作用,进而调节机理免疫功能,p1组分与p2、p3组分相比显示出更好的免疫活性。
表7sephadexg-25分离组分对raw264.7细胞细胞因子tnf-α的影响
表8sephadexg-25分离组分对raw264.7细胞因子il-6的影响
注:##.与空白组相比存在极显著差异(p<0.01);**.与lps组相比存在极显著差异(p<0.01);*.与lps组相比存在显著差异(p<0.05)。
3.免疫活性肽序列的鉴定
1)还原烷基化
于样品中加入dtt溶液使其终浓度为10mmol/l,于37℃水浴中还原4h。随后加入iaa溶液使其终浓度为50mmol/l,避光反应40min。然后使用自填脱盐柱脱盐,于45℃真空离心浓缩仪中挥干溶剂。
2)lc-ms/ms检测
毛细管液相色谱条件如下:
a.预柱:300μmi.d.×5mm,packedwithacclaimpepmaprplcc18,5μm,
b.分析柱:150μmi.d.×150mm,packedwithacclaimpepmaprplcc18,1.9μm,
c.流动相a:0.1%甲酸,2%acn;
d.流动相b:0.1%甲酸,80%acn;
e.流速:600nl/min;
f.每个组分分析时间:78min;
质谱条件如下:
a.一级质谱参数:
resolution:70,000
agctarget:3e6
maximumit:40ms
scanrange:350to1800m/z
b.二级质谱参数:
resolution:75,000
agctarget:1e5
maximumit:60ms
topn:20
nce/steppednce:27
检测结果如表9所示,p1组分共鉴定出24条新型肽段。经过蛋白质数据库blast、多肽数据库piopep比对,均未发现与本发明相同的肽段。
表9液相色谱-串联质谱联用denovo测序分析鉴定的免疫活性肽序列
在本发明的描述中,需要理解的是,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在本发明的描述中,除非另有说明,“多个”的含义是两个或两个以上。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“具体实施例”、“示例”或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
尽管已经示出和描述了本发明的实施例,本领域的普通技术人员可以理解:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。
- 还没有人留言评论。精彩留言会获得点赞!