一种促进银杏类黄酮合成的关键基因GbMYB6及其表达的蛋白、载体和应用的制作方法
本发明属于植物基因工程技术领域,具体涉及一种促进银杏类黄酮合成的关键基因gbmyb6及其表达的蛋白、载体和应用。
背景技术:
银杏(gingobilobal.),是银杏属多年生乔木,是第四纪冰川后幸存的古老树种,属于世界上著名的孑遗植物﹐其叶﹑种仁和外种皮都含药用成分﹐被称为“全身都是宝的活化石”。银杏作为药用已有600多年的历史,其功效最早记载于《神农本草经》。银杏叶提取物(ginkgobilobaextract,gbe)是多种药物的原材料,对预防和治疗早期阿尔兹海默症、心血管疾病等有一定的效果。类黄酮化合物是gbe的主要活性成分,目前已经从银杏中分离出40多种的类黄酮化合物,近年来被广泛研究的类黄酮化合物主要有黄酮醇、花青素和原花青素。类黄酮化合物种类较多,目前已知的类黄酮种类已经超过9000种,在植物的叶、根等器官中广泛存在,参与着植物的生长发育及抗逆反应调控。类黄酮化合物具有重要的药理学作用,在防治心血管硬化、抗氧化、抗衰老、抗肿瘤等方面起着重要作用,已经广泛应用在保健、医疗领域。
黄酮类化合物(flavonoids)是一类多酚化合物,是植物中最重要的次生代谢产物之一,它广泛分布于植物的花、果、叶和种子等器官中。类黄酮的分子结构主要是以两个苯环通过中央三键相连接组成的c6-c3-c6的一类化合物,主要是2-苯基色原酮为母核的化合物。大量研究表明,银杏叶中富含黄酮类化合物,目前已经分离出40多种黄酮类化合物,根据c15核心的结构和糖苷配基的差异,大致可分为黄酮醇(flavonol)、黄酮(flavone)、黄烷酮(flavanone)、二氢查尔酮(dihydrochalcone)、二氢黄烷酮(dihydroflavanone)、查尔酮(chalcone)、异黄酮(isoflavone)和花青素(anthocyanidin)等。类黄酮被人体吸收后能够改善血流量,有助于增强记忆力和保护心血管,同时也具有调节人体免疫力、抗氧化、抗衰老以及抗病毒等医疗保健功能,在抗肿瘤、预防心血管疾病等方面也起着重要作用。
由于银杏自身遗传特性和其生长条件,采用常规生物技术及遗传学方法很难鉴定和研究参与类黄酮合成调控的关键基因及其具体生物学功能。因此至今对银杏这一重要的药用经济树种的相关研究多局限于克隆相关结构基因,而对类黄酮合成通路中极为重要的调控基因myb、bhlh等重要转录因子的研究还不完善,其具体的调控机制尚不清楚,仍需要较多的实验研究。虽然目前已克隆出了很多黄酮合成相关基因,但有关基因功能更深入的研究比较少,所以进一步展开银杏黄酮合成机制研究具有重要意义。
技术实现要素:
发明目的:针对现有技术中存在的不足,本发明的目的是提供一种促进银杏类黄酮合成的关键基因gbmyb6,通过促进该基因的表达能够提高银杏类黄酮含量。
本发明还提供了所述的促进银杏类黄酮合成的关键基因gbmyb6表达的蛋白、载体及其应用。
技术方案:为了实现上述目的,本发明所述一种促进银杏类黄酮合成的关键基因gbmyb6,其核苷酸序列如seqno.1所示。
本发明所述的促进银杏类黄酮合成的关键基因gbmyb6表达的蛋白,其氨基酸序列如seqno.2所示。
本发明所述含有所述的促进银杏类黄酮合成的关键基因gbmyb6的表达载体。
其中,所述表达载体在gbmyb6基因的5’端组装了组成型强表达启动子camv35s,它能使gbmyb6基因在银杏和拟南芥体内高效表达。
其中,所述表达载体在gbmyb6基因的3’端组装了终止子ocs,可有效终止gbmyb6基因的转录。
其中,所述表达载体上组装有nptⅱ基因表达盒,作为转基因银杏和拟南芥的筛选标记,可以用卡那霉素进行转基因银杏和拟南芥的筛选。
其中,所述表达载体上组装有lb(t-borderleft)和rb(t-borderright)序列,促使组装于其间的gbmyb6基因表达框架和筛选标记基因nptⅱ整合至银杏和拟南芥受体细胞染色体中。
本发明所述含有所述的表达载体的宿主细胞。
本发明所述的关键基因gbmyb6在促进银杏类黄酮合成中的应用。
本发明所述的关键基因gbmyb6表达的蛋白在促进银杏类黄酮合成中的应用。
本发明以银杏叶片为材料,克隆了gbmyb6基因。同时,采用通过酶切连接将该基因构建到过量表达载体pcambia2300-35s-ocs,通过酶切连接技术构建获得35s::gbmyb6载体。该基因位于启动子camv35s之后,在启动子camv35s的驱动下,gbmyb6可在银杏和拟南芥体内高效表达,从而促进类黄酮的合成。
有益效果:与现有技术相比,本发明具有以下优点:
本发明通过将gbmyb6基因转入银杏和拟南芥体,过量表达gbmyb6基因的转基因银杏和拟南芥体的类黄酮含量都明显增加,说明gbmyb6是促进银杏类黄酮合成的关键基因,gbmyb6能够促进类黄酮的合成,因此调控gbmyb6的表达在提高银杏叶片药用品质等方面具有重要的应用价值。通过对gbmyb6基因进行克隆和功能研究为采用基因调控技术改良提高银杏黄酮类物质合成与积累提供理论依据,为进一步全面解析银杏myb转录因子的生物学功能提供了参考,尤其为银杏gbmyb6对类黄酮物质合成的调控机理奠定了基础。同时本发明采用基因调控技术改良提高银杏黄酮类物质合成与积累提供理论依据,以及为生物工程生产银杏次生代谢产物提供参考,同时也为其它裸子植物林木的类黄酮调控研究提供借鉴,具有极为重要的参考价值和实践意义。
附图说明
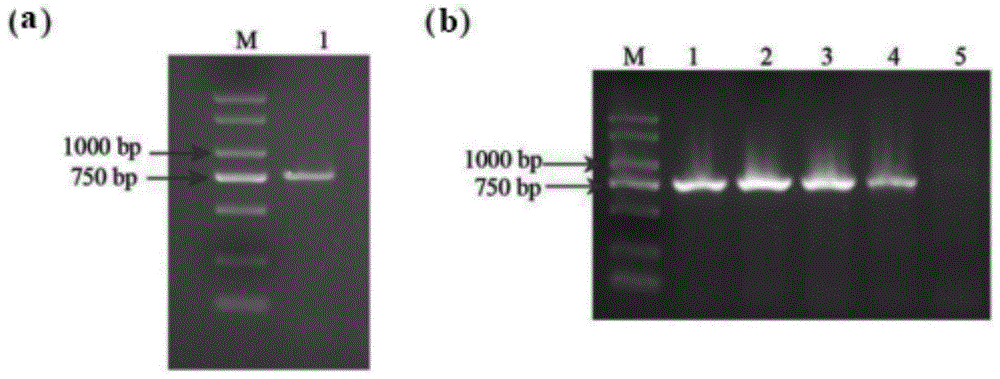
图1是gbmyb6的克隆(a)和菌液检测(b);
图2是pcambia2300-35s-ocs载体结构示意图;
图3是gbmyb6载体构建阳性检测;
图4是构建好的植物表达载体35s::gbmyb6的结构示意图;
图5是gbmyb6转基因银杏愈伤组织的表达量检测;
图6是gbmyb6转基因银杏愈伤组织的类黄酮含量检测;
图7是gbmyb6转基因拟南芥的dna检测;
图8是gbmyb6转基因银拟南芥的类黄酮含量检测。
具体实施方式
以下结合附图和实施例对本发明作进一步说明。
实施例1
克隆gbmyb6基因
(1)基于银杏基因组和银杏的转录组数据,筛选得到了一个myb基因,通过序列比对和进化分析命名为gbmyb6。使用primerpremier5.0软件进行人工设计gbmyb6的orf引物。其中,gbmyb6orf正向引物(orff引物)为seqidno.3:5’-atggggagatcaccgtgctg-3’,gbmyb6orf反向引物(orfr引物)为seqidno.4:5’-attcaaatgggggaattgtgc-3’。
(2)利用高保真酶primestarmax(takara,日本)pcr扩增,pcr体系如下:
将上述混合液轻柔混匀,瞬时低速离心后放置于普通pcr反应仪中,设置如下程序:
跑胶:取出pcr仪中的基因扩增产物,利用电泳仪将适量产物点在1%的琼脂糖凝胶上进行检测,25min左右后拿出应用成像系统进行观察,获得目的片段(图1a)。
(3)纯化片段与克隆载体的连接反应
参照peasy-bluntsimplecloningkit(全式金,中国)操作说明书将胶回收产物连接到克隆载体上,具体体系如下:
在微型管中将体系中的溶液混合,室温反应5min。反应结束后放在冰上待用。
(4)大肠杆菌转化
参照trans1-t1phageresistantchemicallycompetentcell产品说明书(全式金,中国),将已连接的产物与感受态细胞混合,经过冰浴、热激、复苏后,取适量涂布于lb平板上,倒置平板,37℃过夜培养。
(5)阳性克隆筛选及测序分析
从筛选培养板上挑选单菌落接种于lb液体培养基中,37℃、250rmp摇菌过夜;直接以培养过夜的菌液为模板进行重组转化子的pcr检测。
反应体系:
反应程序:
菌液pcr检测为阳性的克隆(图1b)送英骏生物技术公司(上海)测序鉴定,测得gbmyb6的orf序列为756bp,序列如seqidno.1所示,用于后续实验,其表达的蛋白的氨基酸序列如seqidno.2所示。
seqidno.1
atggggagatcaccgtgctgcgaaaatgctgacagaaacaaaggagcttggactaaagaagaagatgacaggcttgtggaatatattcaagttcacggagaaggctgctggcgttcgcttcccaaagctgcaggcctgttgcgctgtgggaaaagttgcaggctgagatggataaactatctgcggcctgatgtcaagcggggtaatttctgtgagaatgaagaggatatcattataaagctccacgccctcctcggaaacaggtggtctctgatagcaggcagattacccggacggacagataatgagataaagaactactggaactcacatcttaaaaggaagttgctgagcaggggtatcgatccccaaacccatcgcccaactcagcaaaaccatggccgtctgtcagccaaacgaacaggctctgaaactccctgcacatcatacgagagaacattaatgcctgtcgagatatgtgatttttttcagtgcaagtcaggaattacttcctctgagcatgtttcagacgatgcaaatgcccgtgaagaacctcccaacctcaaccttgaactgcgtatcacattgtcctcctccaccaatgcagatgcaggcaatggagtgaattccaacgaagactatagtggacgatcgtcagtaaaggacgaagctcgattcattaaacccgtatgcagtcatgtcgagttcatgcggcatgcaacgctgccgttggcacaattcccccatttgaattaa
seqidno.2
mgrspccenadrnkgawtkeeddrlveyiqvhgegcwrslpkaagllrcgkscrlrwinylrpdvkrgnfceneediiiklhallgnrwsliagrlpgrtdneiknywnshlkrkllsrgidpqthrptqqnhgrlsakrtgsetpctsyertlmpveicdffqcksgitssehvsddanareeppnlnlelritlssstnadagngvnsnedysgrssvkdearfikpvcshvefmrhatlplaqfphln
实施例2
gbmyb6基因植物表达载体构建
(1)本实验采用takaraquickcut限制酶(takara,日本)对pcambia2300-35s-ocs载体(图2)(genome-wideidentificationandanalysisofthegrowth-regulatingfactorfamilyinchinesecabbage(brassicarapal.ssp.pekinensis),wangetal.bmcgenomics2014,15:807)和gbmyb6的orf序列分别进行酶切反应实验,具体反应体系如下:
体系中各溶液混合后进行瞬时离心,在37℃水浴锅中保温30min后结束酶切反应,琼脂糖凝胶电泳观察酶切条带,随后分别将目的基因和载体片段切胶回收,用于后续的载体连接反应。
(2)参照takarat4dnaligase(takara,日本)操作说明书,将双酶切反应后回收的表达载体与目的dna片段产物相互连接,体系如下:
在微型管中将体系中的溶液混合,在金属浴中16℃反应5-6h。
通过pcr检测,确认gbmyb6的过量表达载体构建成功(图3),命名为35s::gbmyb6(图4),如图4所示,所构建的表达载体在gbmyb6基因的5’端组装了组成型强表达启动子camv35s,3’端组装了终止子ocs,表达载体上装nptⅱ基因表达盒,作为转基因银杏和拟南芥的筛选标记,同时表达载体上组装lb(t-borderleft)和rb(t-borderright)序列,促使组装于其间的基因表达框架和筛选标记基因nptⅱ整合至银杏和拟南芥受体细胞染色体中。
(3)转化农杆菌
参照gv3101/eha105chemicallycompetentcell产品(全式金,中国)操作说明书,将步骤(2)构建的35s::gbmyb6表达载体质粒与感受态细胞混合,依次经过静置5min、液氮5min、37℃水浴5min、冰浴5min后,加入培养基振荡培养。取适量涂布于lb平板上,28℃培养箱倒置培养。挑取平板上的单克隆,加入适量的lb液体培养基,28℃,220rpm,培养48h,对菌液测序,获得含有35s::gbmyb6载体的农杆菌。
实施例3
gbmyb6基因的遗传转化
1、拟南芥遗传转化
(1)于正常生长环境种植野生型拟南芥;
(2)选取土壤中培养四周左右刚开花的拟南芥植株,用剪刀剪去已经开过的花和已有角果,用于农杆菌转化;
(3)将实施例2获得含有35s::gbmyb6载体的农杆菌接种到带有kana和rif抗生素的lb液体培养基中,放入摇床28℃,过夜培养18-24h,至od600=1.0-1.5;
(4)将符合要求的菌液放入离心管中,4℃,6000rpm,10min离心后去掉上清液;
(5)向步骤(4)的沉淀中加入50ml拟南芥转化液(5%蔗糖+0.02%silwetl-77),重悬沉淀;
(6)经6000rpm,10min离心后去掉上清,加入转化液后再次重悬沉淀;
(7)将步骤(2)制备的拟南芥整个花序浸泡在转化液中30sec;
(8)侵染过的拟南芥浇水后,用塑料袋覆盖保湿,放于阴暗环境下培养24h后,去除塑料袋,将拟南芥移到光照培养箱中(16h光照/8h黑暗)正常培养生长;
(9)7d后按照上述方法再浸泡一次,正常培养至种子成熟。
2、拟南芥遗传筛选
(1)将上述采收的拟南芥成熟种子干燥后,取适量放入离心管中,加入质量分数15%的次氯酸钠溶液浸泡消毒3min,期间上下反复颠倒摇晃,然后放入体积分数70%的酒精中继续浸泡3min,然后用无菌水冲洗;
(2)将种子铺洒到含有卡那霉素的1/2ms固体培养基的平板中,封口膜封口;
(3)将培养皿放在4℃环境下春化2d,然后转移到23℃人工培养箱中培养,条件为:16h光照/8h黑暗;
(4)种子在培养基中生长10d后,将具有卡那霉素抗性的幼苗植株移入营养土中,继续用光照培养箱(16h光照/8h黑暗)里培养生长,用于后期的阳性检测和类黄酮含量测定。
3、银杏愈伤组织转化
(1)将实施例2获得含有35s::gbmyb6载体的农杆菌涂在lb平板。经过培养后挑取lb平板上的农杆菌单克隆,将其接种到lb液体培养基中,28℃培养16h至od600为0.5-0.6;
(2)菌液放入离心管中,18℃,3500rpm,15min离心后去掉上清液;
(3)向离心管加入重悬液(100mlms液体培养基含100μm乙酰丁香酮)重悬底部菌体,并在室温放置2h;
(4)将大小一致的银杏愈伤组织小块放入农杆菌重悬液中,室温静置浸泡15min,然后用镊子轻轻夹出,用无菌滤纸吸掉表面的重悬液液体;
(5)将侵染过的愈伤组织放置在愈伤培养基(ms+4.0mg·l-1naa+2.0mg·l-1kt+100μm乙酰丁香酮)上,25℃黑暗培养3d,取出放入液氮中速冻,保存在超低温冰箱中,应用于后续的类黄酮含量测定。
4、转基因材料的检测与类黄酮含量的测定
利用实时定量pcr技术,检测外源基因在rna水平的表达情况,步骤3得到的转基因银杏愈伤组织中gbmyb6的表达量显著升高(图5)。利用植物类黄酮提取试剂盒(苏州柯铭生物技术有限公司,中国)对未转基因(ck,其他培养条件相同)和转基因银杏愈伤组织的类黄酮含量进行测定,发现转基因愈伤组织中的类黄酮含量显著增高(图6)。对步骤2转基因拟南芥进行阳性检测,获得了5个阳性植株(图7)。通过类黄酮含量测定发现,转基因拟南芥中的类黄酮含量高于ck(未转基因,其他培养条件相同)(图8)。这些结果表明,gbmyb6基因促进类黄酮的合成。
序列表
<110>扬州大学
<120>一种促进银杏类黄酮合成的关键基因gbmyb6及其表达的蛋白、载体和应用
<160>4
<170>siposequencelisting1.0
<210>1
<211>756
<212>dna
<213>人工序列(artificialsequence)
<400>1
atggggagatcaccgtgctgcgaaaatgctgacagaaacaaaggagcttggactaaagaa60
gaagatgacaggcttgtggaatatattcaagttcacggagaaggctgctggcgttcgctt120
cccaaagctgcaggcctgttgcgctgtgggaaaagttgcaggctgagatggataaactat180
ctgcggcctgatgtcaagcggggtaatttctgtgagaatgaagaggatatcattataaag240
ctccacgccctcctcggaaacaggtggtctctgatagcaggcagattacccggacggaca300
gataatgagataaagaactactggaactcacatcttaaaaggaagttgctgagcaggggt360
atcgatccccaaacccatcgcccaactcagcaaaaccatggccgtctgtcagccaaacga420
acaggctctgaaactccctgcacatcatacgagagaacattaatgcctgtcgagatatgt480
gatttttttcagtgcaagtcaggaattacttcctctgagcatgtttcagacgatgcaaat540
gcccgtgaagaacctcccaacctcaaccttgaactgcgtatcacattgtcctcctccacc600
aatgcagatgcaggcaatggagtgaattccaacgaagactatagtggacgatcgtcagta660
aaggacgaagctcgattcattaaacccgtatgcagtcatgtcgagttcatgcggcatgca720
acgctgccgttggcacaattcccccatttgaattaa756
<210>2
<211>251
<212>prt
<213>人工序列(artificialsequence)
<400>2
metglyargserprocyscysgluasnalaaspargasnlysglyala
151015
trpthrlysglugluaspaspargleuvalglutyrileglnvalhis
202530
glygluglycystrpargserleuprolysalaalaglyleuleuarg
354045
cysglylyssercysargleuargtrpileasntyrleuargproasp
505560
vallysargglyasnphecysgluasnglugluaspileileilelys
65707580
leuhisalaleuleuglyasnargtrpserleuilealaglyargleu
859095
proglyargthraspasngluilelysasntyrtrpasnserhisleu
100105110
lysarglysleuleuserargglyileaspproglnthrhisargpro
115120125
thrglnglnasnhisglyargleuseralalysargthrglyserglu
130135140
thrprocysthrsertyrgluargthrleumetprovalgluilecys
145150155160
aspphepheglncyslysserglyilethrsersergluhisvalser
165170175
aspaspalaasnalaargglugluproproasnleuasnleugluleu
180185190
argilethrleuserserserthrasnalaaspalaglyasnglyval
195200205
asnserasngluasptyrserglyargserservallysaspgluala
210215220
argpheilelysprovalcysserhisvalgluphemetarghisala
225230235240
thrleuproleualaglnpheprohisleuasn
245250
<210>3
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>3
atggggagatcaccgtgctg20
<210>4
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>4
attcaaatgggggaattgtgc21
- 还没有人留言评论。精彩留言会获得点赞!