一种非人哺乳动物或其子代的制备方法及其应用与流程
1.本发明涉及生物技术领域,具体涉及一种非人哺乳动物或其子代的制备方法及其应用,该非人哺乳动物或其子代可以用于生产重链抗体。
背景技术:
2.抗体是由两条相同的重链(h链)和两条相同的轻链(l链)通过链间非共价键或二硫键连接而成的四条肽链结构。抗体重链包括重链恒定区(ch)和重链可变区(vh);其中:igd、igg、iga的重链恒定区包括4个结构域:ch1,铰链区hinge,ch2,ch3;igm和ige包括4个结构域:ch1,ch2,ch3,ch4(janeway’s immunobiology,9
th edition);重链恒定区的ch1结构域通过二硫键与轻链恒定结构域进行连接;重链可变区包括互补决定区(cdr)的高度可变区和相对保守的、称为框架区(fr)的区域中,重链可变区包括3个cdr和4个fr,从氨基端至羧基端依下述顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。
3.根据抗体重链恒定区抗原特异性的不同,抗体包括以下5类:igm、igd、igg、ige、iga。同一类抗体因其重链恒定区内抗原特异性仍有某些差异,所以又可将它们分为若干亚类,如:人igg包括igg1、igg2、igg3、igg4等;人iga包括iga1、iga2等;不同哺乳动物之间(如人、羊驼和小鼠)、不同品系的小鼠之间(如c57bl/6小鼠和balb/c小鼠)的抗体的亚类种类可能不同。
4.与抗体重链相关的基因包括l、v、d、j、c五类基因片段,其中:重链可变区由v、d、j三种基因片段编码,重链恒定区由c基因片段编码。人的抗体重链基因中包括有功能的约40个v基因、23个d基因、6个j基因以及9个c基因(来源:janeway’s immunobiology,9
th edition,page 177)。编码igm重链恒定区的基因为ighm基因(immunoglobulin heavy constant mu),编码igd重链恒定区的基因为ighd基因(immunoglobulin heavy constant delta),编码igg重链恒定区的基因为ighg(immunoglobulin heavy constant gamma),编码iga重链恒定区的基因为igha(immunoglobulin heavy constant alpha)等;相应的,编码igg1重链恒定区的基因为ighg1(immunoglobulin heavy constant gamma 1),编码igg3重链恒定区的基因为ighg3(immunoglobulin heavy constant gamma 3),编码igg2b重链恒定区的基因为ighg2b(immunoglobulin heavy constant gamma 2b)。通过重链可变区重排产生具有多样性的抗体。成熟b细胞经抗原刺激后生成分泌型抗体igm,再次抗原刺激后会发生第二次重排,膜上表达和分泌的免疫球蛋白的种类会从亲和力较低的igm转换成亲和力高的igg、iga、ige等其他类别或亚类的免疫球蛋白,这种现象称为类别转换(class switch)或同种型转换(isotype switch)。
5.重链抗体(heavy chain antibody),也叫仅有重链的抗体(heavy chain only antibody),是指仅由两条重链组成的免疫球蛋白抗体。天然存在的重链抗体存在于自然界骆驼科动物和鲨鱼体内。骆驼科动物胚系中的重链基因座包含编码重链恒定区的基因片段,在成熟期间,经重排的vdj结合区被剪接到编码igg铰链区的基因片段的5’末端,从而使得其缺乏介导与轻链结合的ch1区而不能与轻链结合,产生igg2和igg3重链抗体。利用基因
修饰动物的方法也能生成重链抗体,对生成的重链抗体分类的方式也是根据抗体重链恒定区抗原特异性的不同。
6.与传统抗体的分子量(150-160kda)相比,重链抗体要小得多,igg2c重链抗体一条重链大约40kda,其决定抗原识别特异性的重链可变区只有约15kda。重链抗体的特点是分子量小,能够结合一些隐蔽的抗原表位,特别适用于比较难得到抗体的靶点。
7.公开于该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不应当被视为承认或以任何形式暗示该信息构成已为本领域一般技术人员所公知的现有技术。
技术实现要素:
8.发明目的
9.本发明的目的在于提供一种非人哺乳动物或其子代的制备方法及其应用。
10.解决方案
11.为实现本发明目的,本发明实施例提供了以下技术方案:
12.本发明实施例的第一方面,提供了一种非人哺乳动物或其子代的制备方法,其包括以下步骤:
13.使得非人哺乳动物体内不表达或不正确表达igm重链恒定区ch1结构域的步骤;
14.以及,使得非人哺乳动物体内一个、两个、三个、四个或四个以上编码igg重链恒定区的基因在表达时不表达或不正确表达ch1结构域的步骤。
15.上述制备方法在一种可能的实现方式中,使得非人哺乳动物体内不表达或不正确表达igm重链恒定区ch1结构域的步骤为:
16.仅使得非人哺乳动物体内不表达或不正确表达igm重链恒定区ch1结构域的步骤;
17.或,使得非人哺乳动物体内不表达或不正确表达igm重链恒定区和igd重链恒定区的步骤。
18.上述制备方法在一种可能的实现方式中,使得非人哺乳动物体内一个、两个、三个、四个或四个以上编码igg重链恒定区的基因在表达时不表达或不正确表达ch1结构域的步骤为:
19.使得非人哺乳动物体内第一个编码igg重链恒定区的基因在表达时不表达或不正确表达ch1结构域的步骤;
20.或,使得非人哺乳动物体内第一个编码igg重链恒定区的基因在表达时不表达或不正确表达其所编码的igg重链恒定区、并且使得非人哺乳动物体内第二个或第三个或第四个编码igg重链恒定区的基因中的一个、两个或三个在表达时不表达或不正确表达ch1结构域的步骤;
21.或,使得非人哺乳动物体内第一个和第二个编码igg重链恒定区的基因在表达时不表达或不正确表达其所编码的igg重链恒定区、并且使得非人哺乳动物体内第三个或第四个编码igg重链恒定区的基因中的一个或两个在表达时不表达或不正确表达ch1结构域的步骤;
22.或,使得非人哺乳动物体内第一个和第二个和第三个编码igg重链恒定区的基因在表达时不表达或不正确表达其所编码的igg重链恒定区、并且使得非人哺乳动物体内第四个编码igg重链恒定区的基因在表达时不表达或不正确表达ch1结构域的步骤;
23.或,使得非人哺乳动物体内第一个编码igg重链恒定区的基因在表达时正确表达其所编码的igg重链恒定区、并且使得非人哺乳动物体内第二个或第三个或第四个编码igg重链恒定区的基因中的一个、两个或三个在表达时不表达或不正确表达ch1结构域的步骤;
24.或,使得非人哺乳动物体内第一个和第二个编码igg重链恒定区的基因在表达时正确表达其所编码的igg重链恒定区、并且使得非人哺乳动物体内第三个或第四个编码igg重链恒定区的基因中的一个或两个在表达时不表达或不正确表达ch1结构域的步骤;
25.或,使得非人哺乳动物体内第一个和第二个和第三个编码igg重链恒定区的基因在表达时正确表达其所编码的igg重链恒定区、并且使得非人哺乳动物体内第四个编码igg重链恒定区的基因在表达时不表达或不正确表达ch1结构域的步骤。本发明实施例还提供了一种非人哺乳动物,其体内不表达或不正确表达igm重链恒定区ch1结构域,其体内一个、两个、三个、四个或四个以上编码igg重链恒定区的基因不表达或不正确表达ch1结构域。
26.上述非人哺乳动物在一种可能的实现方式中,其体内不表达或不正确表达igm重链恒定区ch1结构域为:
27.仅不表达或不正确表达igm重链恒定区ch1结构域;
28.或,不表达或不正确表达igm重链恒定区和igd重链恒定区。
29.上述非人哺乳动物在一种可能的实现方式中,其体内一个、两个、三个、四个或四个以上编码igg重链恒定区的基因不表达或不正确表达ch1结构域为:
30.第一个编码igg重链恒定区的基因不表达或不正确表达ch1结构域;
31.或,第一个编码igg重链恒定区的基因不表达或不正确表达其所编码的igg重链恒定区、并且第二个或第三个或第四个编码igg重链恒定区的基因中的一个、两个或三个不表达或不正确表达ch1结构域;
32.或,第一个和第二个编码igg重链恒定区的基因不表达或不正确表达其所编码的igg重链恒定区、并且第三个或第四个编码igg重链恒定区的基因中的一个或两个不表达或不正确表达ch1结构域;
33.或,第一个和第二个和第三个编码igg重链恒定区的基因不表达或不正确表达其所编码的igg重链恒定区、并且第四个编码igg重链恒定区的基因不表达或不正确表达ch1结构域;
34.或,第一个编码igg重链恒定区的基因正确表达其所编码的igg重链恒定区、并且第二个或第三个或第四个编码igg重链恒定区的基因中的一个、两个或三个不表达或不正确表达ch1结构域;
35.或,第一个和第二个编码igg重链恒定区的基因正确表达其所编码的igg重链恒定区、并且第三个或第四个编码igg重链恒定区的基因中的一个或两个不表达或不正确表达ch1结构域;
36.或,第一个和第二个和第三个编码igg重链恒定区的基因正确表达其所编码的igg重链恒定区、并且第四个编码igg重链恒定区的基因不表达或不正确表达ch1结构域。
37.本发明实施例的第二方面,提供了一种非人哺乳动物或其子代的制备方法,包括以下步骤:
38.敲除非人哺乳动物基因组上的、包括编码igm重链恒定区ch1结构域的核苷酸序列的步骤;
39.以及,敲除以下目标基因的步骤,所述目标基因包括:一个、两个、三个、四个或四个以上编码igg重链恒定区的基因上的、编码ch1结构域的核苷酸序列。
40.本发明实施例还提供了一种非人哺乳动物,其基因组上包括编码igm重链恒定区ch1结构域的核苷酸序列以及目标基因被敲除,所述目标基因包括:
41.一个、两个、三个、四个或四个以上编码igg重链恒定区的基因上的、编码ch1结构域的核苷酸序列。
42.上述制备方法或非人哺乳动物在一种可能的实现方式中,敲除非人哺乳动物基因组上的、包括编码igm重链恒定区ch1结构域的核苷酸序列为:
43.仅敲除非人哺乳动物基因组上的、编码igm重链恒定区ch1结构域的核苷酸序列;
44.或,敲除非人哺乳动物基因组上的、编码igm重链恒定区和igd重链恒定区。
45.上述制备方法或非人哺乳动物在一种可能的实现方式中,所述目标基因为:
46.第一个编码igg重链恒定区的基因上的、编码ch1结构域的核苷酸序列;
47.或,从第一个编码igg重链恒定区的基因开始至第二个编码igg重链恒定区的基因上的、编码ch1结构域的核苷酸序列的全部核苷酸序列;
48.或,从第一个编码igg重链恒定区的基因开始至第三个编码igg重链恒定区的基因上的、编码ch1结构域的核苷酸序列的全部核苷酸序列;
49.或,从第一个编码igg重链恒定区的基因开始至第四个编码igg重链恒定区的基因上的、编码ch1结构域的核苷酸序列的全部核苷酸序列;
50.或,从第一个编码igg重链恒定区的基因开始至最后一个编码igg重链恒定区的基因上的、编码ch1结构域的核苷酸序列的全部核苷酸序列;
51.或,第二个编码igg重链恒定区的基因上的、编码ch1结构域的核苷酸序列;
52.或,从第二个编码igg重链恒定区的基因开始至第三个编码igg重链恒定区的基因上的、编码ch1结构域的核苷酸序列的全部核苷酸序列;
53.或,从第二个编码igg重链恒定区的基因开始至第四个编码igg重链恒定区的基因上的、编码ch1结构域的核苷酸序列的全部核苷酸序列;
54.或,第三个编码igg重链恒定区的基因上的、编码ch1结构域的核苷酸序列;
55.或,从第三个编码igg重链恒定区的基因开始至第四个编码igg重链恒定区的基因上的、编码ch1结构域的核苷酸序列的全部核苷酸序列;
56.或,第四个编码igg重链恒定区的基因上的、编码ch1结构域的核苷酸序列。
57.上述制备方法在一种可能的实现方式中,以下步骤在同一操作步骤中完成或在不同的操作步骤中完成:
58.敲除非人哺乳动物基因组上的、包括编码igm重链恒定区ch1结构域的核苷酸序列的步骤;
59.敲除目标基因的步骤。
60.上述制备方法或非人哺乳动物在一种可能的实现方式中,所述非人哺乳动物为啮齿类动物;可选地,所述啮齿类动物为大鼠或小鼠;进一步可选地,所述啮齿类动物为小鼠;更进一步,所述小鼠为c57bl/6小鼠或balb/c小鼠。
61.上述制备方法或非人哺乳动物在一种可能的实现方式中,第一个编码igg重链恒定区的基因为ighg3。
no.13和seq id no.14;
92.和/或,靶向小鼠编码igg3重链恒定区的基因第1号外显子上游的sgrna为seq id no.15和seq id no.16;
93.和/或,靶向小鼠编码igg2c重链恒定区的基因第1号外显子下游的sgrna为seq id no.11和seq id no.12。
94.上述制备方法或c57bl/6小鼠在一种可能的实现方式中,所述c57bl/6小鼠或其子代用于生产重链igg2c抗体。
95.本发明实施例的第五方面,提供了一种非人哺乳动物或其子代的制备方法,其包括敲除非人哺乳动物基因组上的、编码igm重链恒定区ch1结构域的核苷酸序列的步骤。
96.本发明实施例还提供了一种非人哺乳动物,其基因组上的、编码igm重链恒定区ch1结构域的核苷酸序列被敲除。
97.上述制备方法或非人哺乳动物在一种可能的实现方式中,所述非人哺乳动物为啮齿类动物;可选地,所述啮齿类动物为大鼠或小鼠;进一步可选地,所述啮齿类动物为小鼠;更进一步,所述小鼠为c57bl/6小鼠或balb/c小鼠。
98.上述制备方法或非人哺乳动物在一种可能的实现方式中,所述非人哺乳动物或其子代用于构建上述非人哺乳动物或其子代。
99.本发明实施例的第六方面,提供了一种来源于上述制备方法构建的非人哺乳动物或其子代、来源于上述制备方法构建的c57bl/6小鼠或其子代、上述非人哺乳动物、上述c57bl/6小鼠在筛选目标重链抗体中的应用。
100.上述应用在一种可能的实现方式中,筛选目标重链抗体时采用噬菌体展示的方法。
101.本发明实施例的第七方面,提供了一种非人哺乳动物细胞或细胞系或原代细胞培养物,所述非人哺乳动物细胞或细胞系或原代细胞培养物来源于上述制备方法构建的非人哺乳动物或其子代、或来源于上述的制备方法构建的c57bl/6小鼠或其子代。
102.本发明实施例的第八方面,提供了一种离体组织或离体器官或其培养物,所述离体组织或离体器官或其培养物来源于上述制备方法构建的非人哺乳动物或其子代、或来源于上述的制备方法构建的c57bl/6小鼠或其子代。
103.本发明实施例的第九方面,提供了一种sgrna组合物,所述sgrna组合物包括:靶向小鼠编码igm重链恒定区的基因的第1号外显子上游的sgrna和靶向小鼠编码igg2c重链恒定区的基因第1号外显子下游的sgrna;
104.或,靶向小鼠编码igm重链恒定区的基因的第1号外显子上游和下游的sgrna;
105.或,靶向小鼠编码igg3重链恒定区的基因第1号外显子上游的sgrna和靶向小鼠编码igg2c第1号外显子下游的sgrna。
106.上述sgrna组合物在一种可能的实现方式中,sgrna靶向的小鼠编码igm重链恒定区的基因第1号外显子上游的靶向序列包括seq id no.1和seq id no.2;
107.和/或,sgrna靶向的小鼠编码igg2c重链恒定区的基因第1号外显子下游的靶向序列包括seq id no.3和seq id no.4;
108.和/或,sgrna靶向的小鼠编码igm重链恒定区的基因第1号外显子下游的靶向序列包括seq id no.5和seq id no.6;
109.和/或,sgrna靶向的小鼠编码igg3重链恒定区的基因第1号外显子上游的靶向序列包括seq id no.7和seq id no.8。
110.上述sgrna组合物在一种可能的实现方式中,靶向小鼠编码igm重链恒定区的基因第1号外显子上游的sgrna为seq id no.9和seq id no.10;
111.和/或,靶向小鼠编码igm重链恒定区的基因第1号外显子下游的sgrna为seq id no.13和seq id no.14;
112.和/或,靶向小鼠编码igg3重链恒定区的基因第1号外显子上游的sgrna为seq id no.15和seq id no.16;
113.和/或,靶向小鼠编码igg2c重链恒定区的基因第1号外显子下游的sgrna为seq id no.11和seq id no.12。
114.本发明实施例的第十方面,提供了一种敲除载体,其包括:编码sgrna的一段或多段dna序列,所述sgrna的靶向序列选自以下的一种:
115.靶向小鼠编码igm重链恒定区的基因第1号外显子上游;
116.或,靶向小鼠编码igg2c重链恒定区的基因第1号外显子下游;
117.或,靶向小鼠编码igm重链恒定区的基因第1号外显子下游;
118.或,靶向小鼠编码igg3重链恒定区的基因第1号外显子上游。
119.上述敲除载体在一种可能的实现方式中,所述敲除载体的骨架是sgrna表达载体。
120.本发明实施例的第十一方面,提供了一种细胞,包含上述敲除载体。
121.不正确表达:与不正确表达相对的是正确表达,本发明中的正确表达和不正确表达实际上都具有本领域通常所理解的含义。如不正确表达ch1结构域是指:基因组水平的突变或缺失引起的重链恒定区ch1结构域的不正确表达,从而导致ch1结构域失去与轻链结合的能力;如:编码重链恒定区ch1结构域的外显子的上下游各10个核苷酸范围内的突变或缺失,从而导致ch1结构域失去与轻链结合的能力。又如编码igg重链恒定区的基因在表达时不正确表达其所编码的igg重链恒定区是指该基因表达所获得的免疫球蛋白抗体不具有抗体功效;与之相对的,编码igg重链恒定区的基因在表达时正确表达其所编码的igg重链恒定区是指该基因表达所获得的免疫球蛋白抗体具有抗体功效。
122.第一个编码igg重链恒定区的基因、第二个编码igg重链恒定区的基因、第三个编码igg重链恒定区的基因、第四个编码igg重链恒定区的基因:是指在编码igg重链恒定区的基因座上,编码igg重链恒定区的各基因按照从上游到下游的顺序进行排列的顺序。
123.有益效果
124.本发明实施例通过使得非人哺乳动物不表达或不正确表达igm重链恒定区ch1结构域的步骤以及使得一个或多个编码igg重链恒定区的基因在表达时不表达或不正确表达ch1结构域的步骤,制备非人哺乳动物或其子代,所得非人哺乳动物或其子代可以用于生产重链抗体。采用本发明实施例制备方法获得的非人哺乳动物不引入任何编码抗体重链可变区和恒定区的外源基因,可以直接利用其自身基因组中编码抗体重链可变区的所有vdj基因,从而通过重链可变区重排产生多样性更好的重链抗体。
125.免疫学中通常认为igm对于b细胞的发育极为重要,而b细胞的发育又对抗体的产生极为重要。本发明实施例通过实验验证了即使不表达编码igm重链恒定区ch1结构域,甚至删除编码igm重链恒定区的基因和编码igd重链恒定区的基因,也没有显著影响非人哺乳
动物的免疫成熟,所有小鼠正常存活,并仍能产生高效价的免疫反应,并且发明人还从中筛选得到了特异性强、亲和力高的重链抗体。
126.通过选择基因改造的编码igg重链恒定区的基因,可以获得特定亚类的重链igg抗体。
附图说明
127.一个或多个实施例通过与之对应的附图中的图片进行示例性说明,这些示例性说明并不构成对实施例的限定。在这里专用的词“示例性”意为“用作例子、实施例或说明性”。这里作为“示例性”所说明的任何实施例不必解释为优于或好于其它实施例。
128.图1是本发明实施例1中涉及的小鼠抗体重链可变区和恒定区的基因位点示意图。
129.图2是本发明实施例1中制备ighm-d-g小鼠的sgrna打靶策略示意图。第二行中的方框表示外显子,白色方框表示被敲除基因片段,数字是外显子序号。五角星表示sgrna的靶点位置。箭头表示基因型鉴定的引物针对的位置。
130.图3是本发明实施例1中对ighm-d-g小鼠进行基因型鉴定的pcr胶图示意图,wt:野生型;+/-:杂合子;-/-:敲除纯合子。
131.图4是本发明实施例2中用crp(人c反应蛋白)作为抗原蛋白免疫ighm-d-g纯合型小鼠后的血清效价检测结果示意图,一免后和未免疫时血清效价均很低,两条线重合。
132.图5a是本发明实施例5中ighm-d-g纯合型小鼠igg2c抗体重链基因vh段的菌落pcr图;图5b是本发明实施例5中ighm-d-g纯合型小鼠表达的igg2c抗体的重链氨基酸序列比对图。
133.图6是本发明实施例6中重链抗体噬菌体文库筛选阳性克隆测序比对。
134.图7是本发明实施例7中纯化d4-12对抗原crp的特异性识别elisa结果。
135.图8是本发明实施例8中纯化5s-12对抗原crp特异性识别的elisa结果,其中ova-d5s-12和bsa-d5s-12两条线od450值很低,线条重合。
136.图9是本发明实施例8中d5s-12重链抗体亲和力测定结果。
137.图10是本发明实施例9中制备ighm小鼠的sgrna打靶策略示意图。黑色方框表示外显子,其中的数字是外显子序号。五星符号表示sgrna的靶点位置。箭头表示基因型鉴定的引物。
138.图11是本发明实施例9中pcr鉴定ighm小鼠基因型示例。ighm野生型基因产生约600bp条带,ighm敲除基因产生约300bp条带。数字代表小鼠样品编号,+:野生型对照,-:空白对照。
139.图12是本发明实施例10中ighm纯合型小鼠表达的igm抗体重链氨基酸序列图。
140.图13是本发明实施例11中制备ighm-3g3小鼠的sgrna打靶策略示意图。黑色方框表示外显子,其中的数字是外显子序号。五星符号表示sgrna的靶点位置。箭头表示基因型鉴定的引物。
141.图14是本发明实施例11中对ighm-3g3小鼠进行基因型鉴定的pcr胶图示意图,wt:野生型;+/-:杂合子;-/-:敲除纯合子。
142.图15是本发明实施例12中用crp(人c反应蛋白)作为抗原蛋白免疫ighm-3g3纯合型小鼠后的血清效价检测结果示意图,一免后和二免后血清效价均很低,两条线重合。
143.图16a是本发明实施例13中ighm-3g3纯合型小鼠igg2c抗体重链基因vh段的菌落pcr图;图16b是本发明实施例13中ighm-3g3纯合型小鼠表达的igg2c抗体的重链氨基酸序列比对图。
具体实施方式
144.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
145.另外,为了更好的说明本发明,在下文的具体实施方式中给出了众多的具体细节。本领域技术人员应当理解,没有某些具体细节,本发明同样可以实施。在一些实施例中,对于本领域技术人员熟知的原料、元件、方法、手段等未作详细描述,以便于凸显本发明的主旨。
146.除非另有其它明确表示,否则在整个说明书和权利要求书中,术语“包括”或其变换如“包含”或“包括有”等等将被理解为包括所陈述的元件或组成部分,而并未排除其它元件或其它组成部分。
147.第一部分、ighm-d-g纯合型小鼠及其免疫结果
148.实施例1、制备ighm-d-g纯合型小鼠
149.ighm-d-g小鼠是指被敲除了ighm基因、ighd基因、ighg3基因、ighg1基因、ighg2b基因以及位于ighg2c基因上的第一个外显子的c57bl/6小鼠,该外显子负责编码igg2c重链的ch1结构域。通过以下步骤,制备ighm-d-g纯合型小鼠。
150.(1)核酸分子的获得:
151.c57bl/6小鼠抗体重链可变区和恒定区的基因位点示意图如图1所示,设计如图2所示的打靶策略以敲除小鼠ighm、ighd、ighg3、ighg1、ighg2b基因和ighg2c中的编码ch1结构域的核苷酸序列。发明人在小鼠ighm基因的第一个外显子上游选择了sgrna的靶向序列(seq id no:1、seq id no:2),在小鼠ighg2c的第1个外显子下游选择了sgrna靶向序列(seq id no:3、seq id no:4),并根据靶向序列设计了sgrna序列,具体如表1所示。
152.表1
153.[0154][0155]
(2)将核酸分子构建入骨架质粒并体外转录得到sgrna:
[0156]
将合成的编码sgrna序列的正向和反向dna oligo通过退火形成互补的双链,利用t4连接酶连接在sgrna表达载体(px330)上,连接后经专业测序公司测序验证,结果表明获得了目的质粒,进一步通过体外转录获得sgrna。
[0157]
(3)向宿主动物受精卵导入所述sgrna和cas9蛋白:
[0158]
小鼠促排卵、体外受精并培育受精卵,然后将sgrna和cas9蛋白混合、电转小鼠受精卵或者采用显微注射的方法将cas9蛋白(或cas9 mrna,可商购)与sgrna一起注射进入小鼠受精卵。
[0159]
(4)将含有上述sgrna和cas9蛋白的细胞植入宿主动物体内:
[0160]
将上述受精卵细胞植入代孕母鼠体内,可生产f0代嵌合体鼠。通过提取鼠尾基因组dna和pcr检测,检测f0代小鼠中发生了敲除的个体。对基因敲除小鼠进行测序,确认删除了靶序列。挑选基因正确敲除的f0代嵌合鼠用于后续繁殖和鉴定。
[0161]
pcr引物ighm-d-g-1f和ighm-d-g-1r能检测敲除基因(如图2中箭头所示),引物ighd-2f和ighd-2r能检测野生型基因(如图2中箭头所示),各引物的序列如表2,检测ighm-d-g小鼠中发生敲除的个体时的pcr结果示意图如图3所示。ighm-d-g纯合子敲除基因用引物ighm-d-g-1f和ighm-d-g-1r产生约700bp条带(如左图所示),用引物ighd-2f和ighd-2r不产生条带(如右图所示);ighm-d-g野生型基因用引物ighm-d-g-1f和ighm-d-g-1r不产生条带(如左图所示),用引物ighd-2f和ighd-2r产生约600bp条带(如右图所示)。
[0162]
表2
[0163][0164][0165]
(5)繁殖杂合、纯合的基因敲除小鼠:
[0166]
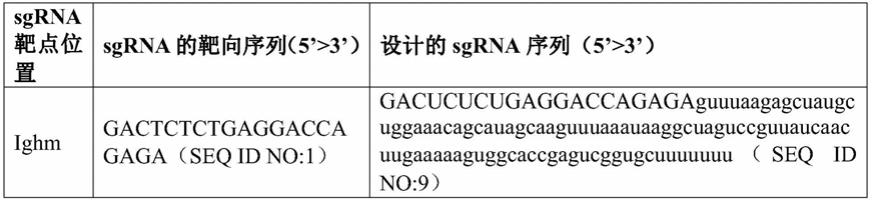
将靶基因敲除的f0代小鼠与野生型鼠交配获得f1代鼠,通过提取鼠尾基因组和
pcr检测,挑选可以稳定遗传的基因敲除阳性f1代杂合子小鼠。再将f1代杂合小鼠互相交配即可获得基因敲除阳性f2代纯合子鼠,即ighm-d-g纯合型小鼠。对获得的f1代杂合或f2代纯合鼠进行基因型的方法与步骤(4)相同。
[0167]
实施例2、抗原免疫反应和效价检测
[0168]
用人c反应蛋白(crp)免疫ighm-d-g纯合型小鼠。
[0169]
免疫方法如下:选择6-8周龄雄性鼠,抗原人c反应蛋白(crp,a-5172,百桥瑞景)加等体积弗氏完全佐剂(f5881,sigma),乳化到滴水不化,即可做小鼠初次免疫皮下多点注射用,初次免疫注射剂量为100μg/只小鼠,初次免疫后,每2周进行后续皮下免疫,crp抗原加等体积弗氏不完全佐剂(f5506,sigma)乳化后,对小鼠皮下多点注射,每次注射剂量为100μg/只小鼠。
[0170]
血清效价检测方法如下:将crp抗原稀释成2μg/ml,取100μl加入聚苯乙烯酶联检测板包板,用hrp-山羊抗小鼠igg-fc(jackson 115-035-071)检测血清中与crp抗原特异性结合的特异性igg2c抗体重链。
[0171]
如图4所示,分别在未免疫、一免一周后、二免一周后、三免一周后采血,血清用pbs稀释,从1:500稀释度开始做倍比稀释,elisa检测血清效价显示,未免疫和一免小鼠体内未出现结合抗原crp的特异性抗体,从二免后,小鼠体内出现特异性与抗原结合的igg2c抗体,三免后效价没有进一步提升,其血清效价在1:8000左右,可用于下一步的抗体基因调取实验。
[0172]
实施例3、未免疫ighm-d-g纯合型小鼠及抗原免疫后的ighm-d-g纯合型小鼠的脾脏、胸腺、淋巴节及器官检查
[0173]
小鼠经二氧化碳窒息法安乐处死。解剖观察胸腺、脾脏、肠系膜淋巴结、颌下淋巴结等及心、肝、肺、肾脏等多个器官的大小及形态,解剖显示,未免疫ighm-d-g纯合型小鼠及抗原免疫后的ighm-d-g纯合型小鼠的胸腺、肠系膜淋巴结、颌下淋巴结、主要脏器均无明显异常。
[0174]
实施例4、抗原免疫产生特异性igg2c重链抗体
[0175]
crp抗原免疫小鼠血清蛋白印迹:取免疫后小鼠血清2μl加入100μl pbs,与10μl crp抗原-sepharose填料室温反应60分钟后,6000rpm离心30秒,弃上清。用pbs清洗填料3次,用10μl pbs重悬煮沸,经12%sds-page电泳,转膜pvdf后,分别用hrp-山羊抗小鼠igg-fc(jackson 115-035-071,用于检测重链)抗体和hrp-山羊抗小鼠ig轻链(jackson,115-035-174)抗体反应并进一步显色。
[0176]
按照本技术的设计,由于小鼠igm、igd、igg1、igg2b、igg3的基因被敲除,用抗原蛋白免疫ighm-d-g纯合型小鼠只会产生igg2c亚类抗体,并且由于igg2c重链的ch1基因被敲除,用抗原蛋白免疫ighm-d-g纯合型小鼠可以产生igg2c重链抗体(不含ch1结构域),igg2c单独一条重链分子量大约在40kd左右。抗原蛋白免疫后的ighm-d-g纯合型小鼠产生的抗体,经过分离、电泳、显色等步骤后,在80kd大小条带左右出现特异性与抗原crp结合的条带,这与理论igg2c重链的二聚体分子量相符合,并且包括未与hrp-山羊抗小鼠ig轻链(jackson,115-035-174)抗体结合的二聚体。
[0177]
实施例5、igg2c重链抗体基因调取
[0178]
crp抗原免疫ighm-d-g纯和型小鼠并经血清效价检测后,安乐死处死小鼠并取脾
细胞,经trizol裂解并反转录得到cdna,使用如下igg2c亚型抗体特异性引物通过pcr扩增重链可变区及与之相连接的重链恒定区。
[0179]
mhv1:atgaaatgcagctggggcatsttcttc(seq id no:21);
[0180]
mhv2:atgggatggagctrtatcatsytctt(seq id no:22);
[0181]
mhv3:atgaagwtgtggttaaactgggttttt(seq id no:23);
[0182]
mhv4:atgractttgggytcagcttgrttt(seq id no:24);
[0183]
mhv5:atgggactccaggcttcaatttagttttcctt(seq id no:25);
[0184]
mhv6:atggcttgtcyttrgsgctrctcttctgc(seq id no:26);
[0185]
mhv7:atggratggagckggrgtctttmtctt(seq id no:27);
[0186]
mhv8:atgagagtgctgattcttttgtg(seq id no:28);
[0187]
mhv9:atggmttgggtgtggamcttgcttattcctg(seq id no:29);
[0188]
mhv10:atgggcagacttaccattctcattcctg(seq id no:30);
[0189]
mhv11:atggattttgggctgattttttttattg(seq id no:31);
[0190]
mhv12:atgatggtgttaagtccttctgtacc(seq id no:32);
[0191]
联合b6_igg2c_ch2 r1:5
’-
tggtccacccaagaggtctg-3’(seq id no:33);
[0192]
pcr反应体系如表3所示:
[0193]
表3
[0194][0195][0196]
pcr反应程序:98℃ 2min——30个循环(每个循环98℃ 10s——50℃ 20s——72℃40s)——72℃ 5min——16℃。
[0197]
将所得pcr扩增产物连接peasy-t5 zero cloning载体,转化top10菌株并涂板,随机挑取11个克隆,菌落pcr鉴定为阳性并送测序(如图5a所示,650bp大小条带为阳性条带)。
[0198]
阳性克隆的测序结果显示(如图5b所示),ighm-d-g纯和型小鼠中产生的igg2c抗体重链可变区fr4区直接与igg2c hinge区(抗体铰链区)相连,由于抗体重链的结构是vh-ch1-hinge-ch2-ch3,其中vh区域又可以详细的分为fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4,通过图5b可知,ighm-d-g纯和型小鼠中产生的igg2c抗体重链可变区fr4区直接与hinge区(抗体铰链区)相连,说明igg2c ch1外显子敲除成功。
[0199]
实施例6、crp抗原特异性igg2c重链抗体可变区噬菌体展示库构建和淘选
[0200]
i、噬菌体展示库构建
[0201]
从crp免疫的ighm-d-g纯和型小鼠的脾脏中分离总rna,使用oligo(dt)制备cdna(takar 6110a cdna合成试剂盒),采用巢式pcr进行了两轮pcr扩增出重链抗体基因。
[0202]
第一轮pcr过程与实施例5中提到的pcr过程完全相同;
[0203]
第二轮pcr所用引物、反应体系、反应程序如下所示:
[0204]
mhvf1-sfii:atgccatgactgtggcccaggcggcc gag gtg aag ctt ctc gag tct gg
(seq id no:34);
[0205]
mhvf2-sfii:catgccatgactgtggcccaggcggcc sag gts cag ctg mag gag tcw gg(seq id no:35);
[0206]
mhvf3-sfii:catgccatgactgtggcccaggcggcc gag gtc cag ctg caa caa tct gg(seq id no:36);
[0207]
mhvf4-sfii:catgccatgactgtggcccaggcggcc sag gty car ctk cag cag yct gg(seq id no:37);
[0208]
mhvf5-sfii:catgccatgactgt ggcccaggcggcc gar gtg aag ctt gwg gag tct gg(seq id no:38)。
[0209]
b6-igg2c-hin-sfi1:actcgcggccggcctggcctgttatgggcactctggg(seq id no:39)。
[0210]
反应体系如表4所示:
[0211]
表4
[0212][0213]
pcr反应程序:98℃ 2min——30个循环(每个循环98℃ 10s——65℃ 20s——72℃40s)——72℃ 5min——16℃。
[0214]
将扩增引物用sfii(fd1824,thermo)消化,凝胶纯化并克隆到sfii消化的pcomb3xss载体上。电转r2738电感受态细胞,制备igg2c重链抗体文库并进行多轮淘选。挑选多个阳性克隆送测序鉴定,结果如图6所示。
[0215]
ii、淘选
[0216]
1.淘选
[0217]
1)包被:将crp用包被液稀释到100ug/ml,加入酶标板(100μl/孔)2孔,4℃包被过夜。
[0218]
2)封闭:吸出包被液,用pbs洗板3次,用300μl,4%脱脂牛奶封闭(第二,三,四,五轮封闭液为4%bsa),37℃,孵育2h。
[0219]
3)结合:吸出封闭液,用pbs洗板3次,加入100μl噬菌体展示文库,37℃孵育1h。
[0220]
4)洗涤:吸出未结合的噬菌体,pbst洗涤(本技术中共进行了五轮淘选,第一、第二轮分别用pbst洗3遍,第三、四、五轮分别用pbst洗10遍)。
[0221]
5)洗脱:加入100μl gly-hcl(ph3.0),37℃,5min,用移液器轻柔吸打数次。
[0222]
6)中和:吸出孔中液体至离心管,预先加入15μl中和缓冲液(1m tirs-hcl,ph=8.8)并混匀。
[0223]
7)取10μl中和后的洗脱液测定滴度,其余用于扩增后用于下一轮淘选。
[0224]
2.噬菌体扩增与纯化
[0225]
1)中和后的洗脱液加入5ml er2738菌液中(商购菌株,od
600
约为0.5-0.7),混匀;
[0226]
2)37℃恒温箱静置30min,37℃,180rpm培养1h;
[0227]
3)将培养物加入20ml lb培养基中,37℃,180rpm培养2h;
[0228]
4)加入20ul辅助噬菌体m13ko7(2x109cfu)(购自neb公司,货号是n03158),混匀;
[0229]
5)37℃恒温箱静置30min,37℃,180rpm培养1h后加入氨苄;
[0230]
6)37℃,180rpm培养1h后8000rpm,离心5min;
[0231]
7)用25ml lb培养基/amp/kan重悬沉淀,30℃,180rpm过夜(约14h)。
[0232]
8)4℃,8000rpm,离心10min,取上清;
[0233]
9)加入1/5体积peg-nacl溶液,4℃静置约4-6h;
[0234]
10)4℃,12000rpm,离心20min,弃去上清;
[0235]
11)沉淀用1ml重悬,取10μl测滴度。
[0236]
3.滴度测定
[0237]
1)用pbs稀释待测噬菌体(10μl噬菌体加入到990μlpbs中为10-2
),分别取10μl稀释后的噬菌体加入200μler2738菌液中,混匀。
[0238]
2)将感染培养物在37℃静置30min;
[0239]
3)涂布于lb/amp平板;
[0240]
4)37℃倒置过夜培养;
[0241]
5)计数菌落,计算滴度;
[0242]
iii、制备igg2c重链抗体可变区文库并进行进行了5次淘选后的结果如下表:
[0243]
crp-mdg1筛选数据表:
[0244][0245]
总共进行了5次淘选,如上表可知输出噬菌体有明显富集,通过phage-elisa实验挑选阳性克隆送测序鉴定。
[0246]
实施例7、crp抗原特异性igg2c重链抗体可变区的原核表达与生物学活性鉴定
[0247]
对测序序列进行分析,选择前5轮淘选重复出现的d4-12(核苷酸序列和氨基酸序列如表5所示)转染bl21大肠杆菌,并在16
°
加入不同浓度iptg进行原核诱导表达,经超声破碎收集上清并进行镍亲和柱纯化。
[0248]
包被特异性抗原crp和无关蛋白ova(2ug/ml),用纯化d4-12进行梯度稀释,elisa检测,结果显示,纯化d4-12重链抗体可变区能特异性识别并结合抗原crp,并呈现出较好的浓度依赖性,如图7所示
[0249]
表5
[0250][0251]
实施例8、crp抗原特异性igg2c重链抗体可变区的真核表达与生物学活性鉴定
[0252]
对测序序列进行进一步分析,选择重复出现最多的序列d5s-12(核苷酸序列和氨基酸序列如表6所示)进行真核表达和生物学活性鉴定。经转染kop293细胞(珠海凯瑞),并于第6天收获上清并进行镍亲和柱纯化。
[0253]
表6
[0254]
[0255][0256]
1、包被特异性抗原crp和无关蛋白ova或bsa(2ug/ml),用纯化d5s-12进行梯度稀释,elisa检测,结果显示,纯化d5s-12重链抗体能特异性识别并结合抗原crp,并呈现出较好的浓度依赖性,结果如图8所示。
[0257]
2、d5s-12重链抗体亲和力测定:用fortebio-octet测定纯化d5s-12重链抗体对抗原crp的亲和力,抗体稀释为10μg/ml,抗原crp稀释成200,100,50,25,12.5,6.25,3.13nm,经测定,其亲和力常数kd(m)=9.87e-10,k
on
(1/ms)=8.55e+04,k
off
(1/s)=8.44e-05,重链抗体d5s-12对抗原crp有较高的亲和力,结果如图9所示。
[0258]
第二部分、制备ighm-3g3纯和型小鼠及其免疫结果
[0259]
ighm-3g3小鼠是指被敲除了ighm基因上的第一个外显子以及敲除了ighg3基因、ighg1基因、ighg2b基因以及位于ighg2c基因上的第一个外显子的c57bl/6小鼠。先制备ighm纯和型小鼠(即敲除了ighm基因上的第一个外显子的c57bl/6小鼠),再基于ighm纯和型小鼠制备ighm-3g3纯合型小鼠。
[0260]
实施例9、制备ighm纯和型小鼠
[0261]
ighm纯合型小鼠的制备,包括以下步骤:
[0262]
1、核酸分子的获得:
[0263]
c57bl/6小鼠抗体重链可变区和恒定区的基因位点示意图如图1所示,设计如图10所示的打靶策略以敲除小鼠ighm基因中编码ch1结构域的核苷酸序列。
[0264]
为了敲除小鼠ighm基因中编码ch1结构域的核苷酸序列,在小鼠ighm基因的第1个外显子上下游选取靶点,发明人在小鼠ighm基因的第一个外显子上游选择了sgrna的靶向序列(seq id no:1、seq id no:2),在小鼠ighm基因的第一个外显子下游选择了sgrna靶向序列(seq id no:5、seq id no:6),并根据靶向序列设计了sgrna序列,具体如表7所示。
[0265]
表7
[0266]
[0267][0268]
(2)将核酸分子构建入骨架质粒并体外转录得到rna:
[0269]
将合成的sgrna序列的正向和反向dnaoligo通过退火形成互补的双链,利用t4连接酶连接在sgrna表达载体(px330)上,连接后经专业测序公司测序验证,结果表明获得了目的质粒,进一步通过体外转录获得sgrna。
[0270]
(3)向宿主动物受精卵导入所述sgrna和cas9蛋白:
[0271]
小鼠促排卵、体外受精并培育受精卵,然后将sgrna和cas9蛋白混合、电转小鼠受精卵,或者采用显微注射的方法将cas9蛋白(或cas9 mrna,可商购)与sgrna一起注射进入小鼠受精卵。
[0272]
(4)将含有上述sgrna和cas9蛋白的细胞植入宿主动物体内:
[0273]
将上述受精卵细胞植入代孕母鼠体内,可生产f0代嵌合体鼠。通过提取鼠尾基因组dna和pcr检测,检测f0代小鼠中发生了敲除的个体。对基因敲除小鼠进行测序,确认删除了靶序列。挑选基因正确敲除的f0代嵌合鼠用于后续繁殖和鉴定。
[0274]
pcr引物ighm-f和ighm-r能检测敲除基因(如图10中箭头所示),引物序列见表8:
[0275]
表8
[0276][0277]
检测结果见图11。使用以上引物进行pcr检测时,ighm野生型基因会产生约600bp的条带,ighm ch1敲除基因会产生约300bp的条带。由图11可知,样品1,2,3和6含有ighm ch1敲除基因。对基因敲除小鼠进行测序,确认敲除小鼠ighm基因的第1个外显子被删除。
[0278]
(5)繁殖杂合、纯合的基因敲除小鼠:
[0279]
将靶基因敲除的f0代小鼠与野生型鼠交配获得f1代鼠,通过提取鼠尾基因组和pcr检测,挑选可以稳定遗传的基因敲除阳性f1代杂合子小鼠。再将f1代杂合小鼠互相交配即可获得基因敲除阳性f2代纯合子鼠,即ighm纯合型小鼠。对获得的f1代杂合或f2代纯合鼠进行基因型的方法与步骤4相同。
[0280]
实施例10、igm重链抗体基因调取
[0281]
crp抗原免疫后,ighm纯和型小鼠被安乐死处死并取脾细胞,经trizol裂解并反转录得到cdna,使用igm亚型抗体特异性引物通过pcr扩增重链可变区及与之相连接的重链恒定区,所用引物及其序列如下:
[0282]
mhv1、mhv2、mhv3、mhv4、mhv5、mhv6、mhv7、mhv8、mhv9、mhv10、mhv11、mhv12均见实
施例5;
[0283]
联合b6 ighm ch2 r4:gttcatctctgcgacagc(seq id no:46);
[0284]
pcr反应体系如表9所示:
[0285]
表9
[0286][0287]
pcr反应程序:98℃ 2min——30个循环(每个循环98℃ 10s——50℃20s——72℃ 40s)——72℃ 5min——16℃。
[0288]
将pcr扩增产物连接至peasy接至5min——16℃s——72℃载体,转化top10菌株并涂板(氨苄抗性),挑取克隆进行菌落pcr。将阳性克隆送测序,由测序结果可知,ighm纯合型小鼠中表达的igm抗体重链可变区fr4直接与ch2(起始氨基酸序列avaemn)相连,结果如图12所示,基因组igm ch1外显子敲除成功。。
[0289]
实施例11、制备ighm-3g3纯和型小鼠
[0290]
一种制备ighm-3g3小鼠纯合型的方法,包括以下步骤:
[0291]
(1)核酸分子的获得:
[0292]
c57bl/6小鼠抗体重链可变区和恒定区的基因位点示意图如图1所示,设计如图13所示的打靶策略,在实施例9所获得的ighm纯合型小鼠的基础上,进一步敲除ighg3基因、ighg1基因、ighg2b基因以及位于ighg2c基因上的第一个外显子。
[0293]
为了敲除小鼠ighm上编码ch1结构域的第一外显子、ighg3、ighg1、ighg2b基因和ighg2c上编码ch1结构域的第一个外显子,发明人在ighm纯合型小鼠的基础上,在小鼠ighg3基因的第一个外显子上游选择了sgrna的靶向序列(seq id no:7、seq id no:8),在小鼠ighg2c基因的第一个外显子下游选择了sgrna靶向序列(seq id no:3、seq id no:4),并根据靶向序列设计了sgrna序列,具体如表10所示。
[0294]
表10
[0295][0296]
(2)将核酸分子构建入骨架质粒并体外转录得到rna:
[0297]
将合成的sgrna序列的正向和反向dnaoligo通过退火形成互补的双链,利用t4连接酶连接在sgrna表达载体(px330)上,连接后经专业测序公司测序验证,结果表明获得了目的质粒,进一步通过体外转录获得sgrna。
[0298]
(3)向宿主动物受精卵导入所述sgrna和cas9蛋白:
[0299]
小鼠促排卵、体外受精并培育受精卵,然后将sgrna和cas9蛋白混合、电转小鼠受精卵,或者采用显微注射的方法将cas9蛋白(或cas9 mrna,可商购)与sgrna一起注射进入小鼠受精卵。
[0300]
(4)将含有上述sgrna和cas9蛋白的细胞植入宿主动物体内:
[0301]
将上述受精卵细胞植入代孕母鼠体内,可生产f0代嵌合体鼠。通过提取鼠尾基因组dna和pcr检测,检测f0代小鼠中发生了敲除的个体。对基因敲除小鼠进行测序,确认删除了靶序列。挑选基因正确敲除的f0代嵌合鼠用于后续繁殖和鉴定。
[0302]
pcr引物ighg-1f和ighg-1r能检测敲除基因,引物ighg-2r和ighg-1f能检测野生型基因(图13的箭头)。引物的序列如表11。
[0303]
表11
[0304][0305][0306]
通过pcr对ighm-3g3小鼠进行基因型鉴定(图14),ighm基因型用引物ighm-f和ighm-r鉴定:ighm野生型基因产生约600bp条带,敲除基因产生约300bp条带。ighg基因型用引物ighg-1f、ighg-1r和ighg-2r鉴定:ighg敲除基因用引物ighg-1f和ighg-2r产生约500bp条带,用引物ighg-1f和ighg-1r不产生条带;ighg野生型基因用引物ighg-1f和ighg-2r不产生条带,用引物ighg-1f和ighg-1r产生约460bp条带。+/-:杂合子;wt:野生型;-/-:
敲除纯合子。
[0307]
(5)繁殖杂合、纯合的基因敲除小鼠:
[0308]
将靶基因敲除的f0代小鼠与野生型鼠交配获得f1代鼠,通过提取鼠尾基因组和pcr检测,挑选可以稳定遗传的基因敲除阳性f1代杂合子小鼠。再将f1代杂合小鼠互相交配即可获得基因敲除阳性f2代纯合子鼠,即ighm-3g3纯合型小鼠。对获得的f1代杂合或f2代纯合鼠进行基因型鉴定的方法与步骤4相同。
[0309]
实施例12、ighm-3g3纯合型小鼠抗原免疫反应和效价检测
[0310]
用人c反应蛋白(crp)免疫ighm-3g3纯合型小鼠。
[0311]
免疫方法如下:选择6-8周龄雄性鼠,抗原人c反应蛋白(crp,a-5172,百桥瑞景)加等体积弗氏完全佐剂(f5881,sigma),乳化到滴水不化,即可做小鼠初次免疫皮下多点注射用,初次免疫注射剂量为100μg/只小鼠,初次免疫后,每2周进行后续皮下免疫,crp抗原加等体积弗氏不完全佐剂(f5506,sigma)乳化后,对小鼠皮下多点注射,每次注射剂量为100μg/只小鼠。
[0312]
血清效价检测;
[0313]
血清效价检测方法如下:将crp抗原稀释成2μg/ml,取100μl加入聚苯乙烯酶联检测板包板,用hrp-山羊抗小鼠igg-fc(jackson 115-035-071)检测血清中与crp抗原特异性结合的特异性igg抗体。
[0314]
如图15所示,分别在未免疫、一免一周后、三免一周后采血,血清用pbs稀释,从1:500稀释度开始做倍比稀释,elisa检测血清效价显示,未免疫和一免小鼠体内未出现结合抗原crp的特异性抗体,三免后其血清效价在1:32000左右。
[0315]
实施例13igg2c重链抗体基因调取
[0316]
crp抗原免疫ighm-3g3纯和型小鼠并经血清效价检测后,安乐死处死小鼠并取脾细胞,经trizol裂解并反转录得到cdna,使用如下igg2c亚型抗体特异性引物通过pcr扩增重链可变区及与之相连接的重链恒定区。
[0317]
mhv1、mhv2、mhv3、mhv4、mhv5、mhv6、mhv7、mhv8、mhv9、mhv10、mhv11、mhv12、联合b6_igg2c_ch2 r1均见实施例5;
[0318]
pcr反应体系、pcr反应程序如实施例5所示:
[0319]
将所得pcr扩增产物连接peasy-t5 zero cloning载体,转化top10菌株并涂板,随机挑取7个克隆,菌落pcr鉴定为阳性并送测序(如图16a所示,650bp大小条带为阳性条带)。
[0320]
阳性克隆的测序结果显示(如图16b所示),ighm-3g3纯和型小鼠中产生的igg2c抗体重链可变区fr4区直接与igg2c hinge区(抗体铰链区)相连,由于抗体重链的结构是vh-ch1-hinge-ch2-ch3,其中vh区域又可以详细的分为fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4,ighm-3g3纯和型小鼠中产生的igg2c抗体重链可变区fr4区直接与hinge区(抗体铰链区)相连,说明igg2c ch1外显子敲除成功。
[0321]
实施例14、crp抗原特异性igg2c重链抗体可变区噬菌体库展示构建和淘选;
[0322]
噬菌体展示库构建和抗体淘选的步骤与实施例6中完全相同,仅针对表12中的参数进行调整,进行了5次淘选后的结果如下表:
[0323]
表12:crp筛选数据表
[0324][0325]
总共进行了5次淘选,如表12可知输出噬菌体有明显富集,通过phage-elisa实验挑选阳性克隆送测序鉴定,如表13所示。
[0326]
表13:阳性克隆氨基酸序列
[0327][0328]
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1