一种盐单胞菌YFX-6及其应用的制作方法
本发明是关于盐单胞菌及其应用,具体地说,是关处理高盐度废水中含氮化合物的盐单胞菌(halomonassp)yfx-6的其相关应用。
背景技术:
根据好氧反硝化菌的反硝化作用,避免了传统工艺中好氧硝化和缺氧反硝化分离投入大等缺点,在城市污水处理应用中具有生长快速、耐有机负荷、脱氮效率高等特点。然而,印染、农药、煤化工、造纸、炼油、海水利用、粮果、制药等都是高盐废水等行业废水不同于传统的城市污水,其产生的含氮废水的盐度偏高,导致菌的生长代谢受到抑制,脱氢酶活性降低,甚至会导致细菌细胞质壁分离和破裂死亡,显著影响脱氮效率。近年来,国内外开展了大量针对特殊环境脱氮菌株的筛选研究,为耐盐菌的筛选奠定了重要基础。已有研究筛选出耐盐耐冷氨氧化细菌,能够在高盐低温发挥较好的脱氮效能,也陆续筛选出一些具有耐高氨氮和耐低温特性的菌株。然而,目前所筛选出的菌少具耐盐特性,导致其在高盐废水中的应用中难以发挥优势,因此筛选能够耐高盐的菌具有十分重要的意义。[1]
技术实现要素:
为解决上述的问题,本发明提出一种盐单胞菌yfx-6菌制剂,盐单胞菌,用于降解高盐污水处理厂出水氮化合物,优选用于降解印染、农药、煤化工、造纸、炼油、海水利用、粮果、制药废水中的氮化合物。本发明还提该菌制剂应用及筛选方法。本发明提供一种如下的技术方案:
本发明的目的之一在于提供一种盐单胞菌(halomonassp)yfx-6,分类命名:盐单胞菌(halomonassp)。
本发明的第二目的是提供上述的盐单胞菌yfx-6的应用,所述的盐单胞菌yfx-6用于降解高盐度工业废水氮化合物,优选用于降解皮革废水、养殖废水、制药废水、石化废水、化肥废水、景观水、食品废水、大豆蛋白废水中的氮化合物。
本发明提供的盐单胞菌(halomonassp)yfx-6可以以氮化合物作为唯一氮源进行生长繁殖。
优选的,所述的氮化合物为硝态氮以及亚硝态氮。
优选的,应用盐单胞菌yfx-6降解氮化合物可以是在好氧环境下进行。也可以在兼氧条件下降解硝态氮化合物。
本发明提供的盐单胞菌(halomonassp)yfx-6可以以氮化合物作为唯一氮源进行生长繁殖。
一种菌制剂,所述的菌制剂采用上述的盐单胞菌yfx-6制备而成,该菌制剂也用于降解氮化合物,同时所述的菌制剂还包括有营养培养基。营养培养基选自牛肉膏蛋白胨培养基、lb营养培养基、以及添加有碳源的无机盐培养基中的任意一种,其中,碳源优选为乙酸钠。
牛肉膏蛋白胨培养基的成分及含量为:牛肉膏3g/l、蛋白胨10g/l、氯化钠5g/l,ph=7.0-8.0,优选ph=7.2-7.6。
lb营养培养基的成分及含量为:酵母粉5.0g/l、氯化钠10.0g/l、蛋白胨10.0g/l,ph=7.2~7.6。
无机盐培养基的成分及含量为:乙酸钠8.5g/l、硝酸钾:1.0g/l、磷酸二氢钾1.0g/l、硫酸亚铁0.05g/l、氯化钙10g/l、氯化钠20g/l~100g/l,硫酸镁1.0g/l,ph=7.2-7.6。
本发明提供了所述的盐单胞菌(halomonassp)yfx-6或菌制剂在降解高盐度污水中的应用,其应用步骤如下:
a)、将所述的盐单胞菌或菌制剂与待处理高盐度污水混合;盐单胞菌添加量为添加量占废水处理体系总体积的1.5%-30%,废水处理体系中的碳氮比为4-12。优选的,添加量为废水体积的15%-30%,废水处理体系中的碳氮比为7-10。
盐单胞菌或菌制剂与待处理高盐度污水混合后,混合体系中活菌数为1×105~1×108cell/ml。
b)、混合后投加三水合乙酸钠1.12~1.92g/l作为碳源,然后放置于15-35℃,优选30℃,180rpm的水浴摇床中反应,反应一定时间后取样;
ph值为7-10,优选为7.5-8.5,更优选为8,有利于盐单胞菌(halomonassp)yfx-6在高盐度废水中生长繁殖,从而加快对高盐度废水中的硝态氮化合物的降解。
优选的,高盐度废水的硝态氮浓度为100-110mg/l。
本发明的有益效果在于,对高盐度废水中硝态氮有很好的去除效果,对环境无污染,是优选的除氮选择。
附图说明
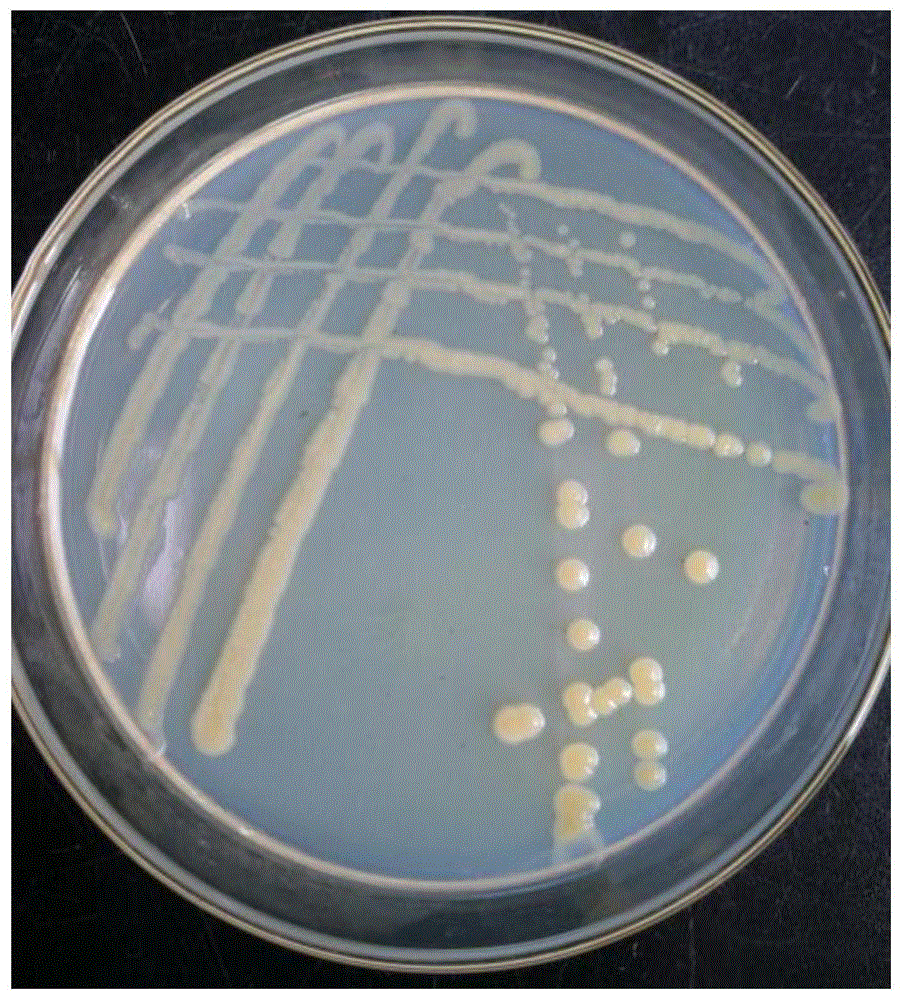
图1为本发明实施例2中盐单胞菌(halomonassp)yfx-6的菌落形态图;
图2为本发明实施例3中盐单胞菌(halomonassp)yfx-6及同时筛选得到的yfx-4、yfx-5和yfx-6分别对高盐度废水的硝态氮去除情况;
图3为本发明实施例4中盐单胞菌(halomonassp)yfx-6处理高盐度粮果废水不同反应时间的硝态氮去除情况;
图4为本发明实施例5提供yfx-6菌株的不同碳氮比处理高盐度粮果废水的硝态氮去除情况;
图5为本发明实施例6提供yfx-6菌株的不同添加量处理高盐度粮果废水的硝态氮去除情况。
图6为本发明实施例6提供yfx-6菌株的不同转速处理高盐度粮果废水的硝态氮去除情况。
具体实施方式
为使本发明的技术方案和优点更加清楚,下面将结合附图与实施例对本发明作进一步地详细描述。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的实验材料,如无特殊说明,均为常规生化试剂,均可通过商购获得。
实施例1
筛选获取盐单胞菌(halomonassp)yfx-6,其筛选过程如下:
步骤1)、从皮革废水处理厂a/a/o处理工艺a池出口取活性污泥;
步骤2)、将5g的活性污泥接种至硝态氮体积分数为0.5%以及盐度为10%的无机盐培养基中,在温度为30℃、盐度为10%、转速为180转/分钟的摇床上培养1天,得到第一菌液;
步骤3)、吸取步骤2)中的第一菌液转接至硝态氮体积分数为1.5%以及盐度为10%的无机盐培养基中,在温度为30℃、转速为180转/分钟的摇床上培养3天,得到第二菌液;
步骤4)、吸取步骤3)中的第二菌液转接至硝态氮体积分数为2%以及盐度为10%的无机盐培养基中,在温度为30℃、转速为180转/分钟的摇床上培养3天,得到第三菌液;
步骤5)、吸取步骤4)中的第三菌液涂布于硝态氮体积分数为2%以及盐度10%的无机盐固体培养基中,在温度为30℃、转速为180转/分钟的摇床上培养3天,获得单菌落;
步骤6)、挑取步骤5)中的单菌落置于离心管中,与甘油(体积分数30%)1:1体积混合,制成菌液,并于-80℃超低温冰箱中保存。
实施例2
对实施例1筛选的菌种进行鉴定。
本发明的实施例1中,筛选到三株菌,本发明中分别命名为hx-1、il-3、yfx-6。其中,经鉴定,yfx-6为盐单胞菌(halomonassp)。
盐单胞菌(halomonassp)yfx-6在琼脂平板培养基上生长良好,如图1所示,菌落呈规则形状,圆凸透明,大小统一,直径2~4mm,表面湿润,边缘平整,革兰氏染色为阴性,具有运动性,兼氧生长。菌株生长温度为20~35℃,ph6~9,最适生长条件:生长温度为30℃,ph7.5。
对实施例1中的步骤5)获得的单菌落提取dna,并对菌种进行dna测序,其16srrna基因序列如seqidno.1所示。本发明中亦称该菌为盐单胞菌(halomonassp)fx-6。
实施例3
对实施例1获得的盐单胞菌(halomonassp)yfx-6菌的氮化合物物降解能力进行测定。具体步骤如下:
步骤1)、取实施例1获得的盐单胞菌(halomonassp)hx-1及同时筛选得到的il-3、yfx-6的菌液,于3000转/分钟离心10分钟,弃上清,向沉淀中加入实际水重新悬浮,得到盐单胞菌(halomonassp)yfx-6;
步骤2)、将分别取20ml的盐单胞菌(halomonassp)yfx-6以及同时筛选到的hx-1、il-3按照步骤1离心后分别加入到编号2,3,4的测试瓶中,编号1为不加菌的对照组。并向每个测试瓶中加入硝态氮为117.42mg/l的粮果高盐(2%nacl)处理水及三水合乙酸钠(碳氮比为8)至总体积均为100ml,其中粮果废水中的盐度nacl补充到盐度10%,即再加入80g/l的nacl浓度。补充编号1(对照)、2、3、4中的盐单胞菌(halomonassp)yfx-6以及同时筛选到hx-1、il-3原菌液的菌浓在8.1×107~6.6×108cell/ml,体积分数分别为0、20%、20%、20%;
步骤3)、将步骤2)中的测量系统置于摇床中,于30℃下,180转/分钟培养16h,测得16h处理后的硝态氮,并计算处理后的粮果处理水的硝态氮的去除率。
结果详见表1和图2。
表1不同菌株处理粮果高盐(10%nacl)处理水的硝态氮浓度及去除率
如表1所示,3株脱氮菌选择添加量为20%,处理时间为16h时,fx-6菌以在好氧环境中,对粮果高盐(10%nacl)废水处理16h时的硝态氮脱除效率达到98.54%,此时硝态氮浓度为1.68mg/l。而hx-1菌与il-3菌反硝化性能显著低于yfx-6菌,硝态氮处理效率分别为75.69%和85.33%。因此,yfx-6菌的脱氮效果更优,选择yfx-6菌做后续的研究。从图2中可以看出,yfx-6菌的脱氮效果和hx-1菌与il-3菌相比,其效果远远要好于hx-1菌与il-3菌。
实施例4
对实施例1获得的盐单胞菌(halomonassp)yfx-6菌的不同反应时间的氮化合物物降解能力进行测定。具体步骤如下:
步骤1)、取实施例1获得的盐单胞菌(halomonassp)yfx-6,于3000转/分钟离心10分钟,弃上清,向沉淀中加入实际水重新悬浮,得到盐单胞菌(halomonassp)yfx-6;
步骤2)、将0ml、20.00ml的盐单胞菌(halomonassp)yfx-6分别加入编号为0、1、2、3、4、5的测试瓶中,并向每个测试瓶中加入硝态氮为108.55mg/l的粮果处理水(盐度2%)及三水合乙酸钠(碳氮比为8.0)至总体积均为100ml,其中粮果废水中的盐度nacl补充到盐度10%,即再加入80g/l的nacl浓度。编号0(对照)、1、2、3、4、5中的盐单胞菌(halomonassp)yfx-6原菌液的菌浓在8.1x107~6.4x108cell/ml,体积分数分别为0、20%、20%、20%、20%、20%;
步骤3)、将步骤2)中的测量系统置于摇床中,于30℃下,180转/分钟培养0h,5h,10h,13h,16h,19h、23h,测得每个时间点处理后的硝态氮的去除率。
结果详见表2和图3。
表2yfx-6菌株不同反应时间处理高盐度废水的硝态氮的浓度
如表2所示,在yfx-6菌株添加量为20%条件下分别对0h,5h,10h,13h,16h,19h、23h的硝态氮变化考察,结果表明随着处理时间的增加,硝态氮去除率有增加的趋势。其中,处理时间为16h时,yfx-6菌脱氮效率最高,且为98.69%。从性价比综合考虑,处理时间为16h时为最佳的反应时间。
实施例5
对实施例1获得的盐单胞菌(halomonassp)yfx-6菌的不同碳氮比条件下的氮化合物物降解能力进行测定。具体步骤如下:
步骤1)、取实施例1获得的盐单胞菌(halomonassp)yfx-6,于3000转/分钟离心10分钟,弃上清,向沉淀中加入实际水重新悬浮,得到盐单胞菌(halomonassp)yfx-6;
步骤2)、将0ml、20.00ml的盐单胞菌(halomonassp)yfx-6分别加入编号为1、2的测试瓶中,并向每个测试瓶中加入总氮为硝态氮为110.50mg/l的粮果(2%盐度)处理水和三水合乙酸钠(碳氮比为2)至总体积均为100ml,其中粮果废水中的盐度nacl补充到盐度10%,即再加入80g/l的nacl浓度。编号1(对照)、2中的盐单胞菌(halomonassp)yfx-6原菌液的菌浓在8.1×107~6.4×108cell/ml,体积分数分别为0、20%;
步骤3)、将0ml、20.00ml的盐单胞菌(halomonassp)yfx-6分别加入编号为3、4的测试瓶中,并向每个测试瓶中加入硝态氮为110.50mg/l的粮果废水(2%盐度)处理水和三水合乙酸钠(碳氮比为4)至总体积均为100ml,其中粮果废水中的盐度nacl补充到盐度10%,即再加入80g/l的nacl浓度。编号3(对照)、4中的盐单胞菌(halomonassp)yfx-6原菌液的菌浓在8.1x107~6.4x108cell/ml,体积分数分别为0、20%;
步骤4)、将0ml、20.00ml的盐单胞菌(halomonassp)yfx-6分别加入编号为5、6的测试瓶中,并向每个测试瓶中加入硝态氮为110.50mg/l的粮果废水(2%盐度)处理水和三水合乙酸钠(碳氮比为6)至总体积均为100ml,其中粮果废水中的盐度nacl补充到盐度10%,即再加入80g/l的nacl浓度。编号5(对照)、6中的盐单胞菌(halomonassp)yfx-6原菌液的菌浓在8.1x107~6.4x108cell/ml,体积分数分别为0、20%;
步骤5)、将0ml、20.00ml的盐单胞菌(halomonassp)yfx-6分别加入编号为7、8的测试瓶中,并向每个测试瓶中加入硝态氮为110.50mg/l的粮果废水(2%盐度)处理水和三水合乙酸钠(碳氮比为8)至总体积均为100ml,其中粮果废水中的盐度nacl补充到盐度10%,即再加入80g/l的nacl浓度。编号7(对照)、8中的盐单胞菌(halomonassp)yfx-6原菌液的菌浓在8.1x107~6.4x108cell/ml,体积分数分别为0、20%;
步骤6)、将0ml、20.00ml的盐单胞菌(halomonassp)yfx-6分别加入编号为9、10的测试瓶中,并向每个测试瓶中加入硝态氮为110.50mg/l的粮果废水(2%盐度)处理水和三水合乙酸钠(碳氮比为10)至总体积均为100ml,其中粮果废水中的盐度nacl补充到盐度10%,即再加入80g/l的nacl浓度。编号9(对照)、10中的盐单胞菌(halomonassp)yfx-6原菌液的菌浓在8.1×107~6.4×108cell/ml,体积分数分别为0、20%;
步骤7)、将步骤2),步骤3),步骤4),步骤5),步骤6),步骤7)中的测量系统置于摇床中,于30℃,下,180转/分钟培养16h,测得16h处理后的硝态氮,并计算处理后的粮果废水(10%盐度)处理水的硝态氮的去除率。
结果详见表3和图4。
表3yfx-6处理粮果废水(8%盐度)废水不同碳氮比硝态氮去除效果
如表3所示,在yfx-6菌株添加量为20%,反应时间为16h条件下,分别对碳氮比为2,4,6,8,10的硝态氮的去除效果进行考察,结果碳氮比越高,硝态氮浓度越低,硝态氮脱除速率越大。碳氮比为2,4,6,8,10处理后的硝态氮浓度分别为:58.52mg/l,33.08mg/l,14.23mg/l,3.87mg/l,10.40mg/l。yfx-6菌利用no2-和no3-为呼吸作用的最终电子受体,把硝酸还原成氮(n2),其脱氮作用过程为:no3-→no2-→n2↑。反硝化细菌多为异养型细菌,异养反硝化细菌可以以有机物为碳源,硝态氮为能源进行反硝化作用,其生化过程为:5ch3cooh+8no3—→6h2o+10co2↑+4n2↑+8oh—+能量。碳源浓度的高低影响着反硝化作用的进程。碳氮比为2,4和6时,碳源相对不足,硝态氮浓度相对较高,硝态氮脱除效率分别为47.04%,70.06%。碳氮比为8时,碳源浓度适宜,此时硝态氮脱除效率达到96.49%,碳氮比为10时,碳源较为充足,硝态氮脱除效率达90.58%。
实施例6
对实施例1获得的盐单胞菌(halomonassp)yfx-6的不同添加量的含氮化合物降解能力进行测定。具体步骤如下:
步骤1)、取实施例1获得的盐单胞菌(halomonassp)yfx-6菌液,分别取5ml、10ml、15ml、20ml、25ml和30ml的菌液,于3000转/分钟离心10分钟,弃上清,向沉淀中加入实际水重新悬浮,得到盐单胞菌(halomonassp)yfx-6;
步骤2)、将5ml、10ml、15ml、20ml、25ml和30ml的菌液的盐单胞菌(halomonassp)yfx-6菌体分别加入编号为1、2、3、4、5、6的测试瓶中,并向每个测试瓶中加入硝态氮为110.95mg/l粮果废水和对应的三水合乙酸钠(配成碳氮比为8:1)至总体积均为100ml,编号1(对照)、2中的盐单胞菌(halomonassp)yfx-6原菌液的菌浓在8.1x107~6.4x108cell/ml,体积分数分别为0、5%、10%、15%,20%,25%和30%;
步骤3)、将步骤2)中的测量系统置于摇床中,于30℃下,180转/分钟培养16h,测得16h处理后的硝态氮,并计算处理后的粮果废水的硝态氮的去除率。
结果详见表4和图5。
表4yfx-6处理粮果不同添加量硝态氮浓度及去除率
如表4所示,碳氮比为8,以体积比分别投加菌液0、5%、10%、15%,20%,25%和30%对粮果处理16h。结果表明,当菌株添加量为5%-15%时,菌株投加量越大,硝态氮脱除效率越高;当菌株添加量为20%时,yfx-6菌脱氮效率最高为97.09%,此时硝态氮浓度为3.23mg/l;继续增加菌体浓度为25%和30%,硝态氮去除率不再升高,为97.12%和97.33%。
实施例7
对实施例1获得的盐单胞菌(halomonassp)yfx-6菌的不同转速(溶解氧)条件下的含氮化合物降解能力进行测定。具体步骤如下:
步骤1)、取实施例1获得的盐单胞菌(halomonassp)yfx-6菌液,分别取20ml、20ml、20ml、20ml和20ml的菌液,于3000转/分钟离心10分钟,弃上清,向沉淀中加入实际水重新悬浮,得到盐单胞菌(halomonassp)yfx-6;
步骤2)、将0ml、20ml、20ml、20ml、20ml和20ml的菌液的盐单胞菌(halomonassp)yfx-6菌体1分别加入编号为1、2、3、4、5、6的测试瓶中,测试瓶用透气的封口膜封住瓶口,并向每个测试瓶中加入硝态氮为110.24mg/l的粮果处理水(2%盐度)和对应的三水合乙酸钠(配成碳氮比为8:1)至总体积均为50ml,其中粮果废水中的盐度nacl补充到盐度10%,即再加入80g/l的nacl浓度。编号1(对照)、2中的盐单胞菌(halomonassp)yfx-6原菌液的菌浓在8.8×107~6.5×108cell/ml,菌种添加体积为20%;
步骤3)、将步骤2)中的测量系统置于摇床中,于80转/分钟、120转/分钟、150转/分钟、180转/分钟和230转/分钟培养16h,测得16h处理后的硝态氮,并计算处理后粮果处理水的硝态氮的去除率。
结果详见表5和图6。
表5fx-6处理粮果处理水不同转速条件下硝态氮浓度及亚硝态氮的去除率
从评价结果来看:对比80rad/min、120rad/min、150rad/min、180rad/min及230rad/min四个处理组可以看出,随着摇床转速的增加,硝态氮的去除率逐渐提高,当转速为180rad/min,硝态氮的去除率为97.28%,处理后的硝态氮浓度为2.99mg/l,;摇床转速继续提升到230rad/min,硝态氮的去除率为97.88%,处理后的硝态氮浓度为2.33mg/l。综合考虑,性价比最高的为摇床转速为180rad/min。
上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
[1]白洁,陈琳,黄潇,etal.1株耐盐异养硝化-好氧反硝化菌zobellellasp.b307的分离及脱氮特性[j].环境科学,2018,39(10):403-411。
- 还没有人留言评论。精彩留言会获得点赞!