一种草莓果实蔗糖积累相关重要转录调控因子的基因、编码蛋白及其应用的制作方法
本发明涉及植物生物技术领域,具体涉及一种草莓果实蔗糖积累相关的重要转录调控因子的基因、编码蛋白及其应用。
背景技术:
果实成熟及品质形成是一个复杂的生物学过程,涉及多种代谢系统,并受环境及激素等多种因素调控。以温室栽培为主的草莓种植,受栽培环境限制,温室内容易造成果实着色不佳、含糖量低,降低草莓的产业价值。因此,深入研究草莓果实糖代谢的调控机理不仅具有重要的理论价值,同时为今后通过基因工程改良草莓果实品质提供技术支持。
已有的关于草莓果实糖代谢的调控机理研究较少,并且大多主要集中在结构基因,如fasus1(gene12940)、fasps1–3(gene11606/22863/31122)等,鉴定调节蛋白对糖分积累的调控具有更重要的价值和意义。myb44是r2r3-myb家族s22亚家族成员,参与调控植物生长、抗逆及激素信号转导等多种生物学过程,但其在果实成熟过程中的作用未见报道。
技术实现要素:
本发明所要解决的技术问题是如何提升草莓果实品质或如何提高草莓果实糖分累积或如何改良草莓品质。
为了解决上述技术问题,本发明首先提供了一种蛋白的下述任一种应用:
p1、所述蛋白质在调控草莓果实蔗糖、葡萄糖和/或果糖含量中的应用;
p2、所述蛋白质在制备提高草莓果实蔗糖、葡萄糖和/或果糖含量产品中应用;
p3、所述蛋白质在调控草莓果实蔗糖积累过程中的应用;
p4、所述蛋白质在制备提高草莓果实蔗糖积累产品中的应用;
p5、所述蛋白质在调控草莓果实糖分积累过程中的应用;
p6、所述蛋白质在制备提高草莓果实糖分积累产品中的应用;
p7、所述蛋白质在提升草莓果实品质中的应用;
p8、所述蛋白质在制备提升草莓果实品质产品中的应用;
p9、所述蛋白质在草莓品质改良中的应用;
p10、所述蛋白质在草莓育种中的应用;
p11、所述蛋白质在调控草莓果实香气中的应用;
p12、所述蛋白质在制备调控草莓果实香气产品中的应用;
p13、所述蛋白质在调控草莓果实有机酸含量中的应用;
p14、所述蛋白质在培育优良口感草莓品种中的应用。
所述蛋白质的名称为famyb44.2,是如下a1)、a2)或a3)的蛋白质:
a1)氨基酸序列是序列表中seqidno.1的蛋白质;
a2)将序列表中seqidno.1所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的且具有相同功能的由a1)衍生的或与a1)所示的蛋白质具有80%以上的同一性且与调控草莓糖分含量相关的蛋白质;
a3)在a1)或a2)的n末端或/和c末端连接蛋白标签得到的融合蛋白质。
上述蛋白质中,序列表中seqidno.1由326个氨基酸残基组成。
上述蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
上述蛋白质中,所述蛋白标签(protein-tag)是指利用dna体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和/或纯化。所述蛋白标签可为flag标签、his标签、mbp标签、ha标签、myc标签、gst标签和/或sumo标签等。
上述蛋白质中,同一性是指氨基酸序列的同一性。可使用国际互联网上的同源性检索站点测定氨基酸序列的同一性,如ncbi主页网站的blast网页。例如,可在高级blast2.1中,通过使用blastp作为程序,将expect值设置为10,将所有filter设置为off,使用blosum62作为matrix,将gapexistencecost,perresiduegapcost和lambdaratio分别设置为11,1和0.85(缺省值)并进行检索一对氨基酸序列的同一性进行计算,然后即可获得同一性的值(%)。
上述蛋白质中,所述80%以上的同一性可为至少81%、82%、85%、86%、88%、90%、91%、92%、95%、96%、98%、99%或100%的同一性。
为了解决上述技术问题,本发明还提供了上述应用中所述蛋白质相关的生物材料的下述任一种应用:
q1、所述生物材料在调控草莓果实蔗糖、葡萄糖和/或果糖含量中的应用;
q2、所述生物材料在制备提高草莓果实蔗糖、葡萄糖和/或果糖含量产品中应用;
q3、所述生物材料在调控草莓果实蔗糖积累过程中的应用;
q4、所述生物材料在制备提高草莓果实蔗糖积累产品中的应用;
q5、所述生物材料在调控草莓果实糖分积累过程中的应用;
q6、所述生物材料在制备提高草莓果实糖分积累产品中的应用;
q7、所述生物材料在提升草莓果实品质中的应用;
q8、所述生物材料在制备提升草莓果实品质产品中的应用;
q9、所述生物材料在草莓品质改良中的应用;
q10、所述生物材料在草莓育种中的应用;
q11、所述生物材料在调控草莓果实香气中的应用;
q12、所述生物材料在制备调控草莓果实香气产品中的应用;
q13、所述生物材料在调控草莓果实有机酸含量中的应用;
q14、所述生物材料在培育优良口感草莓品种中的应用。
上述生物材料为下述b1)至b7)和c1)至c7)的任一种:
b1)抑制或降低上述蛋白质编码基因表达的核酸分子;
b2)含有b1)所述核酸分子的表达盒;
b3)含有b1)所述核酸分子的重组载体、或含有b2)所述表达盒的重组载体;
b4)含有b1)所述核酸分子的重组微生物、或含有b2)所述表达盒的重组微生物、或含有b3)所述重组载体的重组微生物;
b5)含有b1)所述核酸分子的转基因植物细胞系、或含有b2)所述表达盒的转基因植物细胞系;
b6)含有b1)所述核酸分子的转基因植物组织、或含有b2)所述表达盒的转基因植物组织;
b7)含有b1)所述核酸分子的转基因植物器官、或含有b2)所述表达盒的转基因植物器官;
c1)上述蛋白质编码基因表达的核酸分子;
c2)含有c1)所述核酸分子的表达盒;
c3)含有c1)所述核酸分子的重组载体、或含有c2)所述表达盒的重组载体;
c4)含有c1)所述核酸分子的重组微生物、或含有c2)所述表达盒的重组微生物、或含有c3)所述重组载体的重组微生物;
c5)含有c1)所述核酸分子的转基因植物细胞系、或含有c2)所述表达盒的转基因植物细胞系;
c6)含有c1)所述核酸分子的转基因植物组织、或含有c2)所述表达盒的转基因植物组织;
c7)含有c1)所述核酸分子的转基因植物器官、或含有c2)所述表达盒的转基因植物器官;
上述生物材料中,c1)所述核酸分子可为如下c1)c2)或c3):
c1)编码链的编码序列(cds)是序列表中seqidno.2的第1-981位核苷酸的dna分子;
c2)编码链的核苷酸序列是序列表中seqidno.2的dna分子,
c3)在严格条件下与b2)限定的cdna或dna分子杂交且编码具有相同功能的蛋白质的cdna分子或dna分子。
上述生物材料中,b1)所述的核酸分子,是指能够在宿主细胞中抑制或降低上述应用中所述基因表达的dna;
上文b2)所述表达盒可为rnai载体。
为了解决上述技术问题,本发明还提供了调控基因表达的物质的下述任意一种应用:
f1、调控基因表达的物质在调控草莓果实蔗糖、葡萄糖和/或果糖含量中的应用;
f2、调控基因表达的物质在制备提高草莓果实蔗糖、葡萄糖和/或果糖含量产品中应用;
f3、调控基因表达的物质在调控草莓果实蔗糖积累过程中的应用;
f4、调控基因表达的物质在制备提高草莓果实蔗糖积累产品中的应用;
f5、调控基因表达的物质在调控草莓果实糖分积累过程中的应用;
f6、调控基因表达的物质在制备提高草莓果实糖分积累产品中的应用;
f7、调控基因表达的物质在提升草莓果实品质中的应用;
f8、调控基因表达的物质在制备提升草莓果实品质产品中的应用;
f9、调控基因表达的物质在草莓品质改良中的应用;
f10、调控基因表达的物质在草莓育种中的应用;
f11、调控基因表达的物质在调控草莓果实香气中的应用;
f12、调控基因表达的物质在制备调控草莓果实香气产品中的应用;
f13、调控基因表达的物质在调控草莓果实有机酸含量中的应用;
f14、调控基因表达的物质在培育优良口感草莓品种中的应用;
f1-f14中,所述基因编码上文中所述的蛋白质。
上述应用中,所述调控基因表达的物质可为进行如下6种调控中至少一种调控的物质:1)在所述基因转录水平上进行的调控;2)在所述基因转录后进行的调控(也就是对所述基因的初级转录物的剪接或加工进行的调控);3)对所述基因的rna转运进行的调控(也就是对所述基因的mrna由细胞核向细胞质转运进行的调控);4)对所述基因的翻译进行的调控;5)对所述基因的mrna降解进行的调控;6)对所述基因的翻译后的调控(也就是对所述基因翻译的蛋白质的活性进行调控)。
上述应用中,所述调控基因表达可为抑制或降低所述基因表达。
上述应用中,所述调控基因表达的物质可为抑制或降低所述基因表达的试剂。所述抑制或降低所述基因表达的试剂可为沉默所述基因的试剂或敲除所述基因的试剂。沉默所述基因的试剂可含有如下式i所示的dna片段:
seq正向-x-seq反向
式i。
式i中,所述seq正向可为编码链的核苷酸序列是序列表中的seqidno.3(包含5’utr区166bp和cds编码区5’端329bp,共495bp)的第1-495位核苷酸的双链dna,seq反向的序列与seq正向的序列反向互补,x是所述seq正向与所述seq反向之间的间隔序列,在序列上,所述x与所述seq正向及所述seq反向均不互补。所述x可为pfgc5941载体的swai和avrii酶切位点间的片段(小片段)。
敲除所述基因的试剂可为通过crispr-cas9敲除所述基因的试剂,也可为通过同源重组敲除所述基因的试剂。
所述抑制或降低所述基因表达的试剂可以包含下述1)、2)或3):
1)靶向所述基因的sgrna、sirna、shrna、mirna或反义rna;
2)产生靶向所述基因的sgrna的dna分子、产生靶向所述基因的sirna的dna分子、产生靶向所述基因的shrna的dna分子、产生靶向所述基因的mirna的dna分子或产生靶向所述基因的反义rna的dna分子;
3)产生靶向所述基因的sgrna的表达载体、产生靶向所述基因的sirna的表达载体、产生靶向所述基因的shrna的表达载体、产生靶向所述基因的mirna的表达载体或产生靶向所述基因的反义rna的表达载体。
上文所述应用中所述调控草莓果实蔗糖含量为提高草莓果实蔗糖含量;所述调控草莓果实蔗糖积累为提高草莓果实蔗糖积累;所述调控草莓果实糖分积累为提高果实糖分积累。
上文所述应用中所述提高草莓果实蔗糖、葡萄糖和/或果糖含量,是通过调控蔗糖、葡萄糖和/或果糖合成代谢过程中的关键基因的表达而实现的;所述关键基因可为fasps3、fasus1、fahxk2、famdh1、facs1、fasps1、fasps2、fasus2、fatps7、fagad、fabam1、faqr、fapyl、fajaz、famads和/或famyb10。
所述调控草莓果实香气,是通过调控草莓果实中香气代谢相关物质的含量而实现的;所述香气代谢相关物质可为2-己烯醛、己酸甲酯、2-己烯-1-ol、乙酸、1-戊烯、3,7-二甲基-1,6-辛二烯、丁酸甲酯、戊醛、2-戊烯、1-戊醇、2-庚烯醛。
上文所述应用中所述有机酸具体可为柠檬酸和/或琥珀酸。
为了解决上述技术问题,本发明还提供了一种提高草莓果实糖分含量或改良草莓果实品质的方法。
本发明所提供的提高草莓果实糖分含量或改良草莓果实品质的方法,包括抑制或降低草莓中上文所述蛋白质的活性或/和上文所述蛋白质的编码基因的表达量,得到草莓果实糖分含量提高或草莓果实品质提高的草莓的步骤。
上述方法中,所述抑制或降低草莓中上文所述蛋白质的活性或其编码基因的表达量,是通过将含有上文b1)中所述核酸分子的rnai载体导入草莓实现的。
上文所述蛋白质在调控草莓糖合成和代谢过程中关键基因表达中的应用也属于本发明的保护范围。
包含上文所述蛋白质或上文所述生物材料的下述任意一种产品也属于本发明的保护范围:
c1、提高草莓果实蔗糖、葡萄糖和/或果糖含量的产品;
c2、提高草莓果实蔗糖积累的产品;
c3、提高草莓果实糖分积累的产品;
c4、提升草莓果实品质的产品;
c5、调控草莓果实香气的产品;
c6、培育优良口感草莓品种的产品。
上文中所述糖分为蔗糖、葡萄糖和/或果糖。
本发明从草莓中克隆出编码famyb44.2的基因后,构建famyb44.2基因的超表达载体和rnai载体,并将含有两种载体的农杆菌菌液瞬时转化八倍体草莓果实,发现转录因子famyb44.2是一个抑制子,可通过抑制蔗糖积累过程相关基因如fasps3的表达来降低草莓果实蔗糖积累。famyb44.2可用于调控草莓果实糖分积累、提升草莓果实品质,为草莓品质改良提供策略。
附图说明
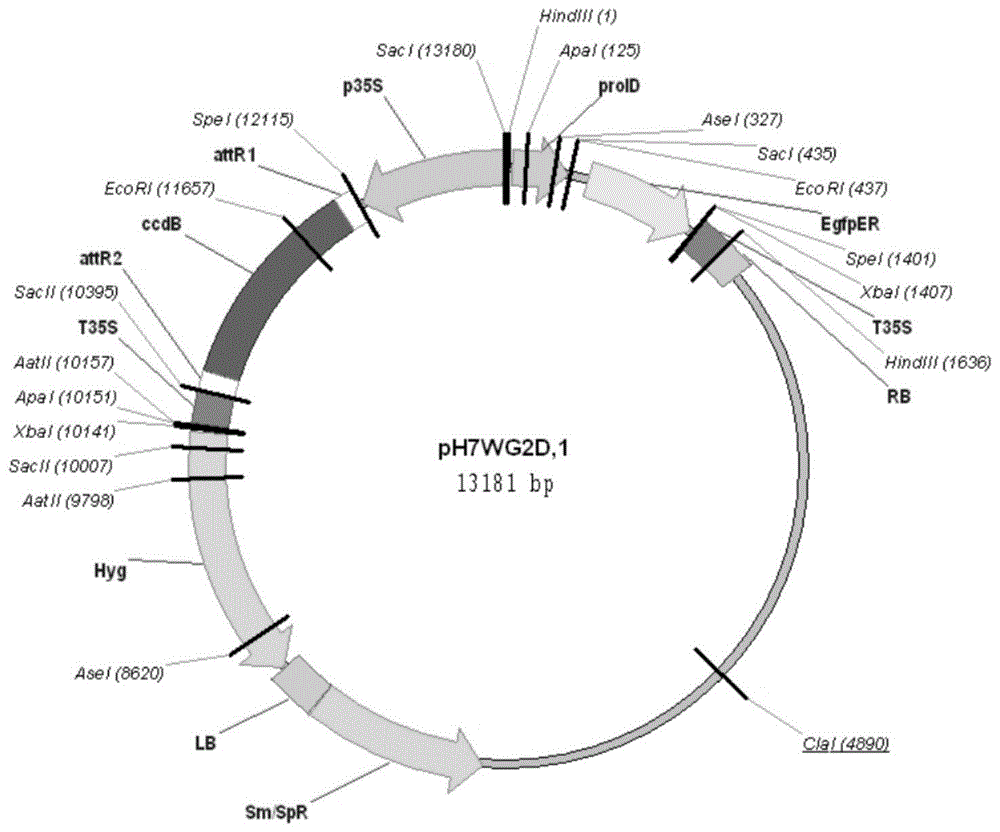
图1为ph7wg2d,1载体图。
图2为pfgc5941载体图。
图3为famyb44.2瞬时转化草莓果实。a.famyb44.2-oe和famyb44.2-rnai果实表型观察及famyb44.2基因表达分析;b.famyb44.2-oe和famyb44.2-rnai果实糖含量;c.famyb44.2-oe和famyb44.2-rnai果实有机酸含量(采用t检验分析对照和处理样品之间的显著性差异,与空载体对照果实相比,“*”p<0.05,“**”p<0.01)。
图4为fasps3-oe对草莓果实蔗糖积累的影响。
图5为qrt-pcr分析famyb44.2-oe和famyb44.2-rnai材料中果实成熟相关基因表达。a.famyb44.2-oe(44.2-oe)和famyb44.2-rnai(44.2-rnai)材料中果实成熟相关结构基因表达;b.famyb44.2-oe(44.2-oe)和famyb44.2-rnai(44.2-rnai)材料中果实成熟相关调节基因表达;c.famyb10-oe材料中果实成熟相关基因表达。(采用t检验分析对照和处理样品之间的显著性差异,“*”p<0.05,“**”p<0.01)。
图6为emsa筛选famyb44.2下游直接结合的结构基因。a.famyb44.2与fasps3启动子(pfasps3)结合;b.famyb44.2与facs1启动子(pfacs1)结合;c.famyb44.2与fasus1启动子(pfasus1)结合;d.famyb44.2与fahxk2启动子(pfahxk2)结合;e.famyb44.2与famdh1启动子(pfamdh1)结合。
图7为原核表达载体pet-30a(+)图。
图8位原核表达载体pgex-6p-1载体图。
图9为famyb44.2被磷酸化位点图。纵坐标为离子流强度(相对丰度),横坐标为离子质荷比m/z。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1、利用famyb44.2基因调控草莓果实的糖分含量
一、载体构建
1.1基因克隆
1.1.1草莓果实总rna提取:供试材料:草莓品种为八倍体草莓“红颜”fragaria×ananassa‘benihoppe’为本实验室保存(hanetal.,2015)。
对草莓果实进行取样,参照omegae.z.n.aplantrna试剂盒提取草莓总rna:
1)在预冷的研钵中加入液氮对果实样品进行研磨,研磨充分后取100mg样品装入1.5mlrnase-free离心管中;
2)加入500μl裂解液rcl,涡旋震荡混匀;
3)室温13000rpm离心10min;
4)将上清转入dna过滤柱gdnafiltercolumn,13000rpm离心1min;
5)在滤过液中加入等体积的bufferrcb,用枪头吸打混匀;
6)将上述混合液转入rna收集柱hindbindrnaspincolumn,13000rpm离心1min,弃滤过液(按体积分两次上柱);
7)加入400μlrwcwashbuffer,13000rpm离心1min;
8)将rna收集柱放入新的收集管,加入500μlrnawashbufferii,13000rpm离心1min,弃滤过液;
9)重复操作8);
10)13000rpm,空离3min去多余乙醇;
11)将hindbindrnaspincolumn放入干净的1.5mlrnase-free离心管中,加入30μl预热的depc水,室温静置2min,13000rpm离心1min,收集rna,并用nanodrop仪器进行rna浓度测定。
1.1.2rna反转为cdna
1)在rnase-freepcr管中加入1μgrna,2μloligodt,rnase-freewater补齐至15μl,70℃变性10min;
2)冰浴3min;
3)分别在管中加入以下组分:m-mlvbuffer5μl,rnase抑制剂(20u/μl)0.7μl,dntp(2.5mm)2.5μl,m-mlv反转录酶1μl,depc处理水0.8μl,混匀;
4)42℃1h,70℃5min,-20℃保存待用。
1.1.3基因克隆
使用引物f:aaaaagcaggctatggcttcttcttcaaccaaga和r:agaaagctgggtctactccaccttgctaatcccaa克隆famyb44.2基因。
pcr反应体系为:
pcr反应条件为:98℃10s,55℃15s,72℃30s/kb,33cycles,72℃2min。。
1.2.载体构建
1.2.1dna琼脂糖凝胶回收:
使用天根琼脂糖凝胶dna回收试剂盒(dp209)
1)向吸附柱中加入500μlbl,室温13000rpm离心30s,弃滤过液;
2)将含有目的条带的琼脂糖胶块切下,放入干净2.0ml离心管中,加入500μl溶胶液pn,60℃水浴溶胶;
3)待胶块完全溶解后,将其加入平衡好的吸附柱中,室温放置2min;
4)13000rpm离心1min,弃滤过液;
5)加入600μl漂洗液pw,13000rpm离心1min,弃滤过液;
6)重复操作步骤5;
7)13000rpm空离3min;
8)将吸附柱放入干净的1.5ml离心管中,向吸附膜中滴加30μl预热的洗脱缓冲液,室温放
置2min;
9)13000rpm离心1min,收集dna产物。
回收产物加a:
反应程序:72℃,45min。
dna产物纯化:
天根dna纯化试剂盒
1)向吸附柱中加入500μlbl,室温13000rpm离心30s,弃滤过液;
2)在吸附柱中加入5倍加a产物体积的结合液pb,再加入加a完成的产物,混匀静置2min,13000rpm离心1min,弃收集管中的液体。
3)加入500μlpw,13000rpm离心30s,弃滤过液,重复此步骤一次;
4)室温13000rpm空离3min,去除残留乙醇;
5)向吸附膜中滴加20μl预热洗脱液,13000rpm离心1min,收集纯化产物。
1.2.2载体构建:
表1.构建载体及其primer
分别使用表1中的相应的引物(下划线所示序列为酶识别位点)构建过表达载体famyb44.2-oe、rnai载体famyb44.2-rnai。
其中,用于构建过表达载体的原始载体为ph7wg2d,1(图1kevinfolta实验室惠赠),用于构建rnai载体的原始载体为pfgc5941(图2本实验室保存,yuhan,ruihongdang,jinxili,jinzhujiang,ningzhang,meirujia,lingzhiwei,ziqiangli,bingbingli*,andwensuojia*.(2015)sucrosenonfermenting1-relatedproteinkinase2.6,anorthologofopenstomata1,isanegativeregulatorofstrawberryfruitdevelopmentandripening,plantphysiology,167:915–930.)。
1.2.2.1纯化产物连接t载体及转化:
4.5μl纯化产物与5μlsolutioni和0.5μlpmd19-tsimple载体(宝生物工程(大连)有限公司)混和,16℃连接过夜,10μl连接产物加入50μldh5α大肠杆菌感受态中,冰上放置30min,42℃热激45s,冰上冷却2min,加入500μl无抗lb液体培养基,37℃180rpm培养40min,5000rpm离心5min,在超净工作台弃400μl上清,将菌体重悬,涂布在含amp(氨苄青霉素)抗性的lb培养板上,37℃培养10h后挑斑小摇,进行菌液pcr鉴定,送阳性克隆进行测序。
1.2.2.2酶切连接:
选择测序成功的,与目的序列完全匹配的质粒样品进行酶切,37℃2h。
连接rnai载体的目的序列包含正向序列和反向序列,其中正向序列为序列表中seqidno.3的1-495位所示的dna分子,反向序列为与正向序列即序列表中seqidno.3的1-495位所示的dna分子反向互补的序列。
酶切体系如下:
回收成功切下的目标dna片段及线性表达载体(使用相应的限制性内切酶切割的rnai载体pfgc5941),16℃连接过夜,连接体系如下:
连接产物转化大肠杆菌感受态dh5α(转化方式同常规载体构建),涂布在含目的载体抗性的lb固体培养基上,37℃培养10h后挑斑小摇,进行菌液pcr鉴定,选择阳性克隆进行大摇提取质粒。
测序结果表明,得到的rnai载体质粒famyb44.2-rnai是将pfgc5941载体的asci和swai酶切位点间的片段(小片段)替换为编码链的核苷酸序列是序列表中seqidno.3的第1-495位核苷酸的双链dna(seq正向),并将pfgc5941载体的paci和avrii酶切位点间的片段(小片段)替换为seq反向(seq反向的序列与seq正向的序列反向互补,即与序列表中seqidno.3的1-495位所示的dna分子反向互补)序列,并保持pfgc5941的其它核苷酸不变,得到的用于沉默famyb44.2基因的重组表达载体pfgc5941-famyb44.2-rnai。
1.2.2.3gateway载体构建:
使用gateway载体构建方法构建过表达载体famyb44.2-oe,相关试剂来源于newenglandbiolabs(neb)公司neb#m0491、thermofisher公司11789020,11791020。
第一轮pcr:
pcr反应条件为:98℃10s,55℃15s,72℃30s/kb,33cycles,72℃2min。引物序列见附表1。
第二轮pcr:
pcr反应条件为:98℃10s,55℃15s,72℃30s/kb,33cycles,72℃2min。引物序列见附表1。
将经过第二轮扩增的pcr产物电泳切胶回收后进行bp反应:
25℃反应1h,加入1μlproteinasek,37℃孵育10min终止反应。将交换产物转化大肠杆菌感受态dh5α(转化方式同常规载体构建),涂布在含kan(硫酸卡那霉素)抗性的lb固体培养基上,37℃培养10h后挑斑小摇,进行菌液pcr鉴定,送阳性克隆进行测序。测序结果表明,所得阳性克隆菌液含有famyb44.2-pdonr221载体,为含有核苷酸序列是seqidno.2的第1-981位的双链dna(famyb44.2基因)的重组载体。
选择公司返还的与目的序列完全匹配的质粒样品(连接ph7wg2d,1过表达载体)进行lr反应:
25℃反应1h,加入1μlproteinasek,37℃孵育10min终止反应。将交换产物转化大肠杆菌感受态dh5α(转化方式同常规载体构建),涂布在含spe抗性的lb固体培养基上,37℃培养10h后挑斑小摇,进行菌液pcr鉴定,选择阳性克隆(包括连接上述两种载体的样品)进行大摇提取质粒。
1.2.2.4保菌
提取质粒之前在超净工作台中取无菌2.0ml离心管,加入800μl无菌40%(v/v,体积比)甘油,再加入800μl大摇饱和的菌液,混匀后液氮速冻,-80℃储存。
1.2.2.5质粒提取:
使用天根质粒小提试剂盒
1)取2.0ml灭菌离心管,收集8ml大摇饱和的菌液,13000rpm,1min室温离心;
2)去上清,向菌体沉淀中加入250μlp1,250μlp2,350μl溶液p3,颠倒混合均匀;
3)13000rpm,10min离心;
4)吸取上清至吸附柱中,13000rpm,1min离心;
5)加入600μlpw,13000rpm离心1min,弃滤过液;
6)重复步骤5);
7)13000rpm离心3min空离,去除残余乙醇;
8)将吸附柱放入新的1.5ml离心管中,向柱中滴加50μlelutionbuffer,室温放置2min;
9)13000rpm离心1min,收集质粒dna。
将所得质粒进行测序,测序结果表明通过gateway的lr反应将核苷酸序列seqidno.2的第1-981位的双链dna(famyb44.2基因)克隆至ph7wg2d,1,得到了含有核苷酸序列seqidno.2的第1-981位的双链dna(famyb44.2基因)的重组载体ph7wg2d-famyb44.2-oe(famyb44.2过表达载体)。
1.3.质粒转化农杆菌
将上述1.2中所得过表达载体质粒famyb44.2-oe、rnai载体质粒famyb44.2-rnai转化农杆菌,同时将ph7wg2d,1空载体和pfgc5941空载体转化农杆菌,分别作为过表达载体的对照和rnai载体的对照用于后续分析。
1.3.1感受态制作:
1)挑取微量gv3101农杆菌菌液(北京全式金生物技术有限公司)划板(利福平rif抗性),28℃烘箱培养2天,待长出大而圆的单菌落;
2)挑单菌落至20mllb液体培养基(rif抗性)中,180rpm,28℃摇菌过夜。吸取摇至饱和的1ml菌液接种于50mllb液体培养基(rif抗性)中,摇菌6h,至od600=0.6-0.8;
3)将培养好的菌液冰浴30min;
4)4℃离心5000rpm,5min,弃上清收集菌体;
5)菌体用10ml0.15mnacl重悬,冰浴20min;
6)4℃离心4000rpm,10min,弃上清收集菌体;
7)菌体悬浮于1ml20mmcacl2中,加入250μl无菌甘油(终浓度20%),震荡混匀,分装为100μl/管,液氮速冻待用。
1.3.2质粒转化:
1)将5μg载体质粒dna,加入100μlgv3101农杆菌感受态细胞中,轻轻混匀后冰上放置30min;
2)液氮速冻1min,37℃水浴5min;
3)加入800μl不含抗性的lb液体培养基,28℃,200rpm振荡培养4h;
4)5000rpm离心8min收集菌体,取100μl涂布于含50μg/ml利福平、50μg/mlkan的平板上,28℃暗培养3d,挑取单菌落小摇并进行菌液pcr鉴定,选择阳性克隆大摇饱和并保菌。
二、草莓果实瞬时注射
将含有目的载体的农杆菌菌株进行活化,加入含有相应抗性(ph7wg2d载体抗性为spe;pfgc5941载体抗性为kan;农杆菌抗性为rif)的液体lb培养基大摇至od600=0.6-0.8时,室温5000rpm,10min离心收集菌体,用含有10mmmes(2-吗啉代乙磺酸)、100μmas(乙酰丁香酮)以及10mmmgcl2的侵染缓冲液(ph5.6)重悬菌体,28℃避光活化菌体2h。
选择生长环境相同、着生位置相近、大小发育时期一致的大绿果时期)八倍体草莓“红颜”(fragaria×ananassaducherne,cvbenihoppe)以下简称野生型(wt)果实进行瞬时注射,1ml注射器针尖从果蒂基部插入果实中,将侵染菌液缓慢注入草莓果实,至全果出现浸渍状,得到转入ph7wg2d-famyb44.2-oe的草莓,将该草莓称为famyb44.2-oe,简称44.2-oe或oe;得到转入空载体ph7wg2d的草莓,将该草莓称为ev-oe或ev;得到转入pfgc5941-famyb44.2-rnai的草莓,将该草莓称为famyb44.2-rnai,简称44.2-rnai或rnai;得到转入空载体pfgc5941的草莓,将该草莓称为ev-rnai或ev。
三、瞬时注射结果分析
步骤二中采用农杆菌介导的方式在八倍体草莓果实中瞬时操纵famyb44.2的表达4-5天后,进行草莓果实表型观察,然后采收草莓果实,使用岛津gcms-qp2010仪器(北京市农林科学院蔬菜中心检测)对果实材料的成熟相关指标进行检测;同时提取rna进行famyb44.2基因表达检测。
岛津gcms-qp2010仪器检测果实材料成熟相关指标的方法:
草莓果实→加入1%hcl的甲醇提取液→打成匀浆→4℃浸提48h→离心→重复浸提一次→过滤上清→10微升上样→液相色谱仪hp1050hplc(agilenttechnologies)→色谱柱:dikmapolyaminohilic250*4.6mm,5μm和dikmacarbopacoa-6300*8.0mm,6μm→流动相为75%乙腈流速为1ml/min→35℃shimadzu,rid-10a示差折光仪检测器和shimadzu,spd-m20a紫外检测器测定糖、酸、色素等品质指标。
表型观察显示瞬时转化famyb44.2的果实花青素积累在0-9d不同天数下与对照果实无明显差异(图3中a左侧图及表2所示),其它与果实细胞壁代谢和色素代谢相关的指标也不存在显著差异(表2)。其中,wt代表八倍体草莓野生型,ev-oe代表瞬时转化ph7w2gd,1空载体的对照植株,44.2-oe代表瞬时转化ph7wg2d-famyb44.2-oe载体的植株,ev-rnai代表转化pfgc5941空载体的植株,44.2-rnai代表转化pfgc5941-famyb44.2-rnai载体的植株。
3.1果实材料的成熟相关指标检测
结果如表2所示,采用t检验分析对照和处理样品之间的显著性差异,其中ev-oe代表瞬时转化ph7wg2d,1空载体的对照植株,oe代表瞬时转化ph7wg2d-famyb44.2-oe载体的植株,ev-rnai代表转化pfgc5941空载体的植株,rnai代表转化pfgc5941-famyb44.2-rnai载体的植株。结果表明与ev-oe果实相比,oe果实的香气代谢相关指标物质占总挥发性物质的百分比发生变化,有的香气代谢指标物质的百分比显著提高,包括2-己烯醛、己酸甲酯、1-戊烯、3,7-二甲基-1,6-辛二烯;有的香气代谢指标物质的的百分比显著降低,如2-己烯-1-ol,乙酸。与ev-rnai果实相比,rnai果实的香气代谢相关指标物质占总挥发性物质的百分比也发生变化,有的香气代谢指标物质的百分比显著降低,包括己酸甲酯、1-戊烯、1-正己醇、丁酸甲酯、戊醛;有的香气代谢指标物质的百分比显著提高,如2-己烯醛、2-己烯-1-ol,乙酸、2-戊烯、1-戊醇、2-庚烯醛(表2)。上述结果说明famyb44.2基因超表达后显著调控草莓果实香气代谢相关指标物质的含量发生显著变化,草莓果实香气发生改变;抑制或降低famyb44.2基因的表达,也显著调控了草莓果实香气代谢相关指标物质的含量发生显著变化,草莓果实香气也发生改变。因此famyb44.2可能参与调控草莓果实香气合成。
表2famyb44.2-oe和famyb44.2-rnai对草莓果实成熟相关指标的影响
注:*为p<0.05,**为p<0.01,(e)和(z)代表有机分子的顺反构型。
3.2基因表达检测
4-5天后,采收草莓果实,提取rna进行famyb44.2基因表达检测。
其中,famyb44.2基因表达检测方法如下:分别提取草莓wt、44.2-oe、ev-oe、ev-rnai和44.2-rnai的果实的总rna,根据天根生化公司第一链cdna合成试剂盒的程序,反转录成cdna。利用组成性表达的actin基因作为内参,将样品cdna浓度均一化。然后用famyb44.2基因的特异引物(上游引物:ctcattcgcaagcagccttc;下游引物:gctgagtgatgtcggtggat)进行实时荧光定量pcr(rt-qpcr)分析,用2-△△ct法(livakkj,schmittgentd.2001.analysisofrelativegeneexpressiondatausingreal-timequantitativepcrandthe2-△△ctmethod.methods.25:402-408)分析famyb44.2基因在草莓果实的表达情况,每组样品重复3次。
检测结果如图3中a右侧图所示,其中ev代表瞬时转化ph7w2gd,1空载体的对照植株,oe代表瞬时转化famyb44.2-oe载体的植株;ev-rnai代表瞬时转化rnai空载体pfgc5941的植株,rnai代表转化famyb44.2-rnai载体的植株。与wt和ev相比,oe中famyb44.2显著超表达;与wt和ev-rnai相比,rnai中famyb44.2转录水平显著降低。
3.3糖分含量测定
检测果实中糖分、有机酸的含量。果实糖分、有机酸含量的测定方法见上述。
结果如图3中b和c所示,图中ev-oe代表瞬时转化ph7w2gd空载体的对照植株,44.2-oe代表瞬时转化famyb44.2-oe载体的植株,ev-rnai代表转化pfgc5941空载体的植株,44.2-rnai代表转化famyb44.2-rnai载体的植株。
进一步分析瞬时操纵famyb44.2后果实中可溶性糖的比例,结果表明与ev-oe果实相比,44.2-oe果实的果糖和葡萄糖含量显著降低,蔗糖含量极显著降低。与ev-rnai果实相比,44.2-rnai的葡萄糖和蔗糖含量显著升高,果糖含量无显著差异(图3中b)。说明famyb44.2基因超表达后显著降低草莓果实中果糖、葡萄糖和蔗糖的含量,抑制或降低famyb44.2基因的表达,显著提高了草莓果实中葡萄糖和蔗糖含量。说明famyb44.2及其相关生物材料可用于调控草莓果实蔗糖、葡萄糖和/或果糖含量。
进一步分析瞬时操纵famyb44.2后果实中可滴定酸的比例,结果表明与ev-oe果实相比,44.2-oe果实的柠檬酸的含量显著降低,琥珀酸含量极显著升高,苹果酸含量无显著差异。与ev-rnai果实相比,44.2-rnai的柠檬酸、琥珀酸和苹果酸的含量均无显著差异,(图3中c)。famyb44.2基因超表达后显著降低草莓果实中柠檬酸、提高草莓果实琥珀酸的含量,抑制或降低famyb44.2基因的表达,对草莓果实柠檬酸、琥珀酸或苹果酸的含量均无显著影响,说明famyb44.2及其相关生物材料可用于调控草莓果实柠檬酸和琥珀酸等有机酸的含量。
然而,不同组分有机酸的含量变化不一致,表明草莓果实中famyb44.2参与的有机酸累积机制较为复杂(图3中c)。
3.4草莓果实中成熟相关基因的表达检测
我们又对famyb44.2-oe和famyb44.2-rnai载体转化草莓果实中成熟相关基因的表达结果进行了检测。实时荧光定量pcr(rt-qpcr)方法同上述3.2步骤。,每组样品重复3次。引物序列如表3所示。
表3草莓果实中成熟相关基因定量检测引物
结果如图5所示,ev-oe代表瞬时转化ph7wg2d,1空载体的对照植株,44.2-oe代表瞬时转化famyb44.2-oe载体的植株,ev-rnai代表转化pfgc5941载体的植株,44.2-rnai代表转化famyb44.2-rnai载体的植株。结果表明操纵famyb44.2可以调控许多成熟相关结构基因的表达,特别是糖酸代谢相关基因的表达(图5中a所示),包括fasus1、fasps1–3、fasut1基因。其中fasus1、fasps1–3和fasut1是草莓果实蔗糖代谢的关键基因。fasus1在蔗糖转化为单糖的过程中发挥作用,是蔗糖积累的正调控因子,其表达与蔗糖含量正相关,超表达或沉默fasut1可以增加或降低草莓果实中的蔗糖含量。
fasps3蔗糖磷酸合成酶(sucrosephosphate,sps),是不可逆的蔗糖合成催化酶,在果实后期蔗糖积累中起重要作用。为了验证fasps对草莓果实成熟过程中蔗糖积累的影响,采用瞬时遗传转化的方法,fasps3-oe对草莓果实蔗糖积累的影响如图4所示,过表达fasps3可以显著增加草莓果实蔗糖含量,。同时如图5中a所示,famyb44.2-oe果实(图5中44.2-oe所示)中fasps3的表达被显著抑制,而famyb44.2-rnai果实(图5中44.2-rnai所示)中fasps3的表达被显著诱导,这与超表达和沉默famyb44.2后果实蔗糖含量的变化保持一致。操纵famyb44.2的表达也可以调控其他与果实糖分积累相关基因的表达,如fahxk2和fatps7(图5中a)所示。
同时我们也在瞬时转化famyb44.2的果实中检测了大量与果实发育及成熟相关的调节蛋白的表达,如famrlk47、famyb1、famyb10、famads9以及激素相关基因(图5中b),结果显示调控草莓果实发育和成熟的重要转录因子如famads9、famyb10、fagamyb和famyb1均被不同程度的调控,这表明famyb44.2调控果实成熟的机制较为多样(图5中b)。在这些转录因子中,对famads9的调控最为显著,我们在famads9-oe果实中检测了famyb44.2和famyb10的表达,结果显示famyb44.2和famyb10并没有被明显调控(图5中b)。值得关注的是,尽管famyb10和famrlk47在调控果实花青素积累过程中的作用相反,但是famyb10和famrlk47在famyb44.2-oe材料中均被下调。我们也检测了mbw复合体中famyb44.2候选伴侣的基因表达。famyb44.2瞬时转化果实中fabhlh3和fattg1的表达被调控,因此fabhlh3和fattg1有可能作为famyb44.2形成mbw复合体的伴侣发挥作用(图5中b)。此外,瞬时操纵famyb44.2的表达同时影响激素相关基因的表达,包括fapyl1、fajaz1、faarf6b和fapin8(图5中b)。综上,这些结果表明famyb44.2广泛参与对草莓果实发育和成熟相关基因的转录调控,以及与激素合成和信号转导相关基因的表达调控,这暗示除了调控结构基因的表达外famyb44.2还可以调控多种生物学事件(图5中b)。
四、凝胶阻滞试验(emsa)对上述famyb44.2蛋白进行凝胶阻滞实验,检测famyb44.2和fasps3、fasus1、fahxk2、famdh1、facs1基因启动子的结合情况,筛选famyb44.2下游直接结合的结构基因。
4.1famyb44.2蛋白的获得
4.1.1构建原核表达载体并转化:
构建famyb44.2基因的原核表达蛋白载体pgex-4t-1-myb44.2,用于构建famyb44.2基因的原核表达蛋白的载体为pgex-4t-1(优宝生物,货号vt1253)。载体构建方法与上述1.2步骤中所述方法相同。
转化使用de3菌株(北京擎科新业生物技术有限公司tsv-a0)的感受态菌株(-80℃保存)。转化方法与上述1.2步骤中所述方法相同。使用转化后的de3菌株表达原核表达载体pgex-4t-1-myb44.2得到含有组蛋白标签的his-famyb44.2重组蛋白。具体步骤为:1)将原核表达载体转化de3大肠杆菌感受态菌株。2)小摇后,取500μl于50ml离心管,加入10mllb培养基摇床过夜至od值为0.6-0.8。3)取大摇菌液5ml于600ml带抗性的lb中,37℃摇床2-3h至菌液od值为0.6-0.8,加入iptg浓度到0.2mm,20℃,160rpm诱导过夜。4)8000r/s离心5min收集菌体,使用hisbuffer,重悬菌体至40ml体积;加入蛋白酶抑制剂1mmpmsf,dtt2mm,冰上超声15-30min破碎菌体值澄清。5)8000r/s,4℃离心30min收集上清,此刻蛋白在上清中。6)超声期间,将柱子垫片使用70%乙醇浸泡10min,而后加入镍柱或gst纯化柱料,使用buffer清洗3-5遍,将其吸至蛋白上清中,冰上孵育2h,使蛋白与柱料充分结合。7)将柱料与蛋白混合液倒回柱子中,收集滤出液,反复上样4-5次后,用buffer清洗4-5遍除去杂蛋白。8)使用洗脱buffer洗脱蛋白,一次500μl,洗脱15min,洗脱三次,获得的蛋白使用200μlpcr管分装保存,-80℃保存。
4.2emsa实验
步骤如下:
合成带有5’-biotin的探针,ddh2o溶解使其终浓度为10μm;探针序列如表4所示。
表4emsa实验相关探针序列
1)75℃反应30min,使正反向探针退火;
2)按照以下步骤配制反应体系,室温反应30min:
3)在0.5×tbe缓冲液体中进行非变性胶电泳1h,电压120v;
4)电泳完成后,在0.5×tbe电泳缓冲液中转膜30min,电压80v;
5)将膜置于紫外交联仪中正、反面交联各1min;
6)将膜放于10ml封闭液blockingbuffer中,室温封闭10min;
7)弃封闭液,重新加入10mlblockingbuffer,加入底物conjngate50μl,室温孵育10min;
8)用1×washbuffer清洗膜,10ml/次,共清洗4次;
9)弃清洗液,加入10mlsubstrateequilibationbuffer,孵育10min;
10)弃substrateequilibationbuffer,加入底物(1:1混合),孵育5min;
11)用保鲜膜覆膜,于暗盒内用x光片压片,显影,定影。
结果如图6所示。因为之前研究表明几个与糖酸代谢相关的重要结构基因的表达被famyb44.2显著调控(图5中a),因此我们进一步检测了famyb44.2和fasps3、fasus1、fahxk2、famdh1、facs1启动子的结合情况,瞬时操纵famyb44.2的表达可以显著调控以上这些基因的表达。由于激素和环境因素可以影响蔗糖和酸的含量,因此除了myb结合位点(mbs)外,我们也检测了响应激素和环境因素的启动子元件,包括aba、ja和温度响应相关的元件。如图6所示,famyb44.2和fasps3、famdh1、facs1启动子的mbs元件互作,与fahxk2启动子的abre和g-box元件互作,并且还和fasus1的启动子tc-rich及hse元件互作。尽管fasps3、fasus1、fahxk2、famdh1和facs1的启动子序列均包含famyb44.2结合元件,但是所结合的元件数量和类型各不相同。尽管这些基因均作为famyb44.2下游的结构基因,但它们的调控机制并不相同,每个结构基因可能与famyb44.2一起参与多种上游信号所调控的多样的信号途径。此外,如图6中a所示,famyb44.2结合fasps3启动子(pfasps3)的三个不同元件,即mbs、ja响应元件以及生长素响应元件。表明瞬时操纵famyb44.2的表达可以显著调控以上蔗糖合成相关基因的表达,影响草莓果实蔗糖的累积,从而影响草莓果实糖分含量。
五、蛋白磷酸化位点分析
1)将在-80℃保存的原核表达草莓his::mapk6(使用载体为图7的pet-30a(+))、gst::mkk4dd(使用载体为图8的pgex-6p-1)和his::myb44.2蛋白(使用载体为图7的pet-30a(+)solarbio,货号:p3120)取出,冰上融化,通过考染确定其浓度。载体构建引物见表1,载体构建方法与上述1.2步骤中所述方法相同。
2)配制10×反应缓冲液,成分为:tris-hcl(ph7.5)200mm,mgcl2100mm,dtt10mm,磷酸酶抑制剂cocktail(1:100)。
3)先将mapk6磷酸化,孵育体系(20μl),28℃1h。
4)取3)反应产物,开始孵育磷酸化底物,反应体系(20μl),28℃30min。
5)加入4μl的6×sdsloadingbuffer终止反应,95-100℃水浴10min,对样品进行sds-page胶分离,使用考马斯亮蓝染色,脱色,观察条带位置是否正确。
6)质谱检测磷酸化位点分析
(质谱实验由中科院遗传与发育研究所进行分析)
结果显示myb44.2的被磷酸化位点为第226位的丝氨酸(s226),表明famyb44.2调控糖分积累可能受到磷酸化调控,突变后能够提升草莓果实品质,为品质改良提供了策略和理论指导。
序列表
<110>中国农业大学
<120>一种草莓果实蔗糖积累相关重要转录调控因子的基因、编码蛋白及其应用
<130>gncsq201782
<160>3
<170>patentinversion3.5
<210>1
<211>326
<212>prt
<213>草莓(fragariavesca)
<400>1
metalaserserserthrlyslysalaalaalaaspargilelysgly
151015
protrpserproglugluaspglualaleuglnargleuvalglnser
202530
tyrglyproargasntrpserleuileserlysserileproglyarg
354045
serglylyssercysargleuargtrpcysasnglnleuserproglu
505560
valgluhisargprophethrproglugluaspaspthrileilearg
65707580
alahisalaargpheglyasnlystrpalathrileserargleuleu
859095
asnglyargthraspasnalailelysasnhistrpasnserthrleu
100105110
lysarglysphesersermetseraspaspmetserprogluhisgln
115120125
proleulysargseralaservalglyalaglythrthrvalsergly
130135140
leutyrleuasnproglyserproserglyseraspleuseraspser
145150155160
serleuproglyvalileprohisserglnalaalapheargproval
165170175
alametthrvalalaproprovalgluprovalalaleualavalala
180185190
valaspproprothrserleuserleuserleuproglyserasnglu
195200205
glyargthrhisglnargseralaserglyserglysersertrpile
210215220
valserprolysprolysvalvalhisglnproglnvalileglnval
225230235240
glnproglnglualaglualaalaalaalaalaalaalaalaalaala
245250255
alaalaalaargvalglylysglnasnsersergluvalglyileasp
260265270
lysglnphephethralaglupheleuaspvalmetglnglumetile
275280285
argthrgluvalargasntyrmetserglyilegluhislysglymet
290295300
metmethisthrglualaalailelysasnalavalvallysargile
305310315320
glyileserlysvalglu
325
<210>2
<211>981
<212>dna
<213>草莓(fragariavesca)
<400>2
atggcttcttcttcaaccaagaaagccgcggcggatcggataaagggtccgtggagcccg60
gaggaagacgaagcgttacagaggctggtgcagagctacggcccgaggaactggtctctg120
atcagcaaatcgatccctggtcgatccgggaaatcgtgccggctacggtggtgcaaccag180
ctctcgccggaggtggagcaccggccgttcactcctgaagaggacgacaccataatccgg240
gcccacgcccggttcgggaacaagtgggccaccatctcgcggttgcttaatggccgcacc300
gataacgccattaagaaccactggaactcgacgctcaagcgcaaattctcgtccatgtcc360
gacgacatgtcgccggagcatcagcctctcaaaagatcggccagcgtcggagccggtacc420
accgtctcgggtctgtacttgaacccgggcagcccatccggatccgacttgagcgattct480
agtctgcccggcgtaattcctcattcgcaagcagccttccggccggtggcgatgactgtt540
gctccgccggttgagccggtggctttggcggtggcggtggatccaccgacatcactcagc600
ctgtcgcttcccggatccaacgaagggcggactcatcagagatcagcatcaggatccgga660
tccagctggattgtgagccccaagcctaaagtagttcatcagcctcaagtaattcaagtt720
caacctcaagaagcagaagcggctgcggctgcggctgcggctgcggctgcggcggcgcgt780
gtggggaagcaaaacagtagtgaggtggggattgataagcagttcttcaccgcggagttt840
ttggatgtgatgcaggagatgatcagaacggaagtgaggaattatatgtctgggattgag900
cacaagggaatgatgatgcatactgaagcagccattaaaaacgcagttgtaaaacggatt960
gggattagcaaggtggagtag981
<210>3
<211>495
<212>dna
<213>人工序列(artificialsequence)
<400>3
atcacccctcttctctctcagaacaaggtgaggctccgcctctaccatcgcccctagcta60
gcttcttgtacagaaaatctccaaatttccatctagaatttatcgattagtttttatttt120
cttttatttctttatttttaaaatttttagctctagaagactatccatggcttcttcttc180
aaccaagaaagccgcggcggatcggataaagggtccgtggagcccggaggaagacgaagc240
gttacagaggctggtgcagagctacggcccgaggaactggtctctgatcagcaaatcgat300
ccctggtcgatccgggaaatcgtgccggctacggtggtgcaaccagctctcgccggaggt360
ggagcaccggccgttcactcctgaagaggacgacaccataatccgggcccacgcccggtt420
cgggaacaagtgggccaccatctcgcggttgcttaatggccgcaccgataacgccattaa480
gaaccactggaactc495
- 还没有人留言评论。精彩留言会获得点赞!
- 一种新的多肽-人调控转录因子13.09和编码这种多肽的多核苷酸的制作方法
- Ppar-调节性双芳族化合物的制作方法
- 一种新的多肽——人Pax蛋白9和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人Pax蛋白10.1和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人Pax蛋白11.3和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人Pax蛋白11.6和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人Pax蛋白18和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人Pax蛋白10.3和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人Pax蛋白9.9和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人细胞分化转录因子13.7和编码这种多肽的多核苷酸的制作方法