一种纯化质粒的方法与流程
edta和10-75mm tris(ph7.2),优选2.5-3.5m硫酸铵、8-12mm edta和25-60mm tris(ph7.2),更优选3m硫酸铵、10mm edta和50mm tris(ph7.2)。
13.洗脱缓冲液主要用于洗脱固定柱上吸附的组分,例如质粒、rna等。根据需要洗脱的成分不同,洗脱缓冲液的组成一般也不相同。在一个实施方案中,第一固定柱采用的第一洗脱缓冲液包含0.5-2m nacl、5-15mm edta和10-75mm tris(ph7.2),优选0.75-1.5m nacl、8-12mm edta和25-60mm tris(ph7.2),更优选1m nacl、10mm edta和50mm tris(ph7.2)。在一个实施方案中,第二固定柱采用的第二洗脱缓冲液包含5-15mm edta和10-75mm tris(ph7.2),优选8-12mm edta和25-60mm tris(ph7.2),更优选10mm edta和50mm tris(ph7.2)。
14.洗脱缓冲液的比例是指洗脱质粒时采用的洗脱缓冲液占的比例。例如,洗脱缓冲液的比例为x是指在洗脱质粒时,采用比例为x的洗脱缓冲液以及比例为1-x的平衡缓冲液。在一个实施方案中,第一固定柱中的洗脱缓冲液的比例为80%-100%。在一个实施方案中,第二固定柱中的洗脱缓冲液的比例为40%-60%。
15.工作流速是指采用固定柱进行层析时的平衡缓冲液和洗脱缓冲液的流速。在一个实施方案中,第一固定柱的工作流速为50ml/min。在一个实施方案中,第二固定柱的工作流速为8-50ml/min。
16.在一个实施方案中,第二固定柱的样品稀释倍数为1倍。
17.下面将参考附图并结合实例来详细说明本发明。需要说明的是,本领域的技术人员应该理解本发明的附图及其实施例仅仅是为了例举的目的,并不能对本发明构成任何限制。在不矛盾的情况下,本技术中的实施例及实施例中的特征可以相互组合。
附图说明
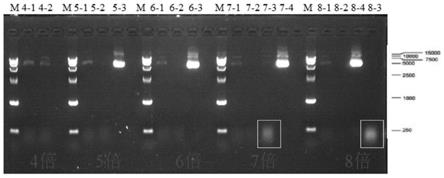
18.图1:不同电导率下用第一固定柱进行层析时的洗脱样品的凝胶电泳图。m:marker;4-1和4-2分别表示稀释4倍的样品层析过程中的裂解上清液和穿透液;5-1、5-2和5-3分别表示稀释5倍的样品层析过程中的裂解上清液、穿透液和洗脱液1;6-1、6-2和6-3分别表示稀释6倍的样品层析过程中的裂解上清液、穿透液和洗脱液1;7-1、7-2、7-3和7-4分别表示稀释7倍的样品层析过程中的裂解上清液、穿透液和洗脱液1和洗脱液2;8-1、8-2、8-3和8-4分别表示稀释8倍的样品层析过程中的裂解上清液、穿透液和洗脱液1和洗脱液2。方框示出了rna条带。
19.图2:样品不同稀释倍数下用第二固定柱进行层析时的洗脱样品的凝胶电泳图。m:marker;1-1、1-2和1-3分别表示样品稀释倍数为0.5倍的粗纯化液、穿透液和洗脱液;2-1、2-2和2-3分别表示样品稀释倍数为1.0倍的粗纯化液、穿透液和洗脱液;3-1、3-2和3-3分别表示样品稀释比例为2.0倍的粗纯化液、穿透液和洗脱液;4-1、4-2和4-3分别表示样品稀释比例为3.0倍的粗纯化液、穿透液和洗脱液。箭头示出了开环质粒条带。
具体实施方式
20.本实施例中采用的溶液组成成分如下表1所示。
21.表1
22.名称溶液组成成分
重悬缓冲液te缓冲液,ph8.0裂解缓冲液0.2m naoh+2%sds溶液中和缓冲液3m醋酸钾缓冲液,ph5.5第一平衡缓冲液te缓冲液,ph7.2第一洗脱缓冲液te缓冲液,ph7.2+1.0m nacl第二平衡缓冲液3m(nh4)2so4+te缓冲液,ph7.2第二洗脱缓冲液te缓冲液,ph7.2
23.注:te缓冲液是10mm edta+50mm tris。
24.实施例1.第一固定柱纯化条件的优化
25.用碱裂解法裂解细菌培养物:用ph8.0的重悬缓冲液将包含待纯化质粒的大肠杆菌培养物重悬均匀,然后加入等比例的裂解缓冲液,5分钟后,再加入等比例的中和缓冲液进行中和,获得裂解液。将裂解液在4200rpm下于4℃离心20min,并用1微米的过滤器过滤,获得3.7l的裂解上清液。
26.(1)优化上样电导率
27.第一固定柱的目的主要在于去除rna污染物。
28.用超纯水将100ml裂解上清液分别稀释4倍、5倍、6倍、7倍、8倍以调节电导率,然后通过第一固定柱(即,deae固定柱)进行层析,具体方法如下:首先,采用第一平衡缓冲液平衡固定柱10倍柱体积,然后采用工作流速50ml/min上样,收集此时第一固定柱流出的溶液即为穿透液;将样品完全上样结束后,采用第一平衡缓冲液平衡层析柱10倍柱体积;然后,采用第一洗脱缓冲液连续线性洗脱第一固定柱(比例从0逐渐上升到100%),并依次收集紫外吸收值>100mau的部分,即为洗脱液1、洗脱液2。最后,用第一平衡缓冲液再次平衡层析柱,直至实验完成。
29.检测穿透液、洗脱液1和洗脱液2的浓度以及所得的质粒纯度,结果如下表2所示。
30.表2.不同电导率下的纯化结果
31.稀释倍数45678电导率(ms/cm)51.6342.2336.4032.3628.59穿透液体积(ml)320400480560640穿透液浓度(ng/μl)26.324.820.015.510.3洗脱液1体积(ml)na107.52448洗脱液1浓度(ng/μl)na52.970.242.381.0洗脱液2体积(ml)nanana7.58.0洗脱液2浓度(ng/μl)nanana73.276.2纯度(%)/82.5176.9074.1174.06
32.此外,取10μl穿透液、洗脱液1和洗脱液2进行凝胶电泳,结果如图1所示。
33.从表2和图1可以看出,当电导率过高(稀释4倍)时,无法获得包含质粒的洗脱液,这表明质粒没有吸附到deae柱上;当电导率过低时(稀释7-8倍),洗脱液1中包含较高浓度的rna(参见图1的7-3和8-3),表明在该电导率下,rna也会吸附到固定柱上,而这将对质粒载量产生严重不利的影响。而当稀释倍数为5-6倍时,仅质粒会吸附到固定柱上,rna基本上被保留在穿透液里,这不仅保留了层析柱的载量也降低了层析柱的纯化压力。并且此时获
得的粗纯化液中的质粒纯度最高。
34.因此,用于第一固定柱纯化的最优电导率为35-45ms/cm,优选36-42.5ms/cm。
35.(2)优化工作流速和洗脱缓冲液的比例
36.用超纯水将200ml裂解上清液稀释5.5倍,调节电导率为40ms/cm,然后通过deae固定柱进行层析,具体方法如下:首先,采用第一平衡缓冲液平衡固定柱10倍柱体积,然后采用工作流速20ml/min或50ml/min上样,收集此时第一固定柱流出的溶液即为穿透液;将样品完全上样结束后,采用第一平衡缓冲液平衡层析柱10倍柱体积;然后,采用40%、60%、80%、100%的第一洗脱缓冲液冲洗第一固定柱,并收集紫外吸收值>100mau的部分,即为洗脱液。最后,用第一平衡缓冲液再次平衡层析柱,直至实验完成。
37.检测穿透液和洗脱液的浓度以及所得的质粒纯度,结果如下表3所示。
38.表3.洗脱缓冲液的不同流速和比例下的纯化结果
[0039][0040]
从表3可以看出,40%和60%的洗脱缓冲液比例无法洗脱目的质粒。在20ml/min的流速下,80%的洗脱缓冲液可以实现比较好的洗脱效果,在50ml/min的流速下,80%-100%的洗脱缓冲液可以实现比较好的洗脱效果。
[0041]
鉴于流速越高,纯化工艺所需的时间越短,因此用于第一固定柱纯化的最优洗脱缓冲液流速为50ml/min,洗脱缓冲液比例为80-100%。
[0042]
(3)优化条件后的纯化效果
[0043]
用超纯水将200ml裂解上清液稀释5.5倍,调节电导率为40ms/cm,然后通过deae固定柱进行层析,具体方法如下:首先,采用第一平衡缓冲液平衡固定柱10倍柱体积,然后采用工作流速50ml/min上样,收集此时第一固定柱流出的溶液即为穿透液;将样品完全上样结束后,采用第一平衡缓冲液平衡层析柱10倍柱体积;然后,采用100%的第一洗脱缓冲液冲洗第一固定柱,并收集紫外吸收值>100mau的部分,即为洗脱液。最后,用第一平衡缓冲液再次平衡层析柱,直至实验完成。重复两次实验。每次实验用时14分钟左右。
[0044]
检测穿透液和洗脱液的浓度以及所得的质粒纯度,并计算固定柱的载量,结果如下表4所示。
[0045]
表4.优化条件下的纯化效果
[0046]
样品实验1实验2上样样品浓度(ng/μl)2016.9上样体积(ml)10001000穿透液浓度(ng/μl)16.716.8
穿透液体积(ml)10001000洗脱液浓度(ng/μl)220.8216.2洗脱液体积(ml)2828载量(mg/ml)44纯度(%)93.0593.91
[0047]
从表4可以看出,在优化的电导率、洗脱缓冲液流速和洗脱缓冲液比例的情况下,固定柱的载量可以达到4mg/ml,纯化质粒的纯度可以达到93%左右,实现了纯化质粒的目的。
[0048]
实施例2.第二固定柱纯化条件的优化
[0049]
第二固定柱的主要目的在于去除开环质粒。
[0050]
根据实施例1所述的方法裂解大肠杆菌培养物,并在电导率为40ms/cm,第一洗脱缓冲液的工作流速为50ml/min,第一洗脱缓冲液的比例为100%的条件下,用deae固定柱进行纯化,获得粗纯化液60ml作为第二固定柱的上样样品。
[0051]
(1)优化样品稀释倍数
[0052]
用4m硫酸铵将50ml粗纯化液分别稀释0.5倍、1倍、2倍、3倍,然后通过第二固定柱(即,c4疏水固定柱)进行层析,具体方法如下:首先,采用第二平衡缓冲液平衡固定柱10倍柱体积,然后采用第二工作流速50ml/min上样,收集此时固定柱流出的溶液即为穿透液;将样品完全上样结束后,采用第二平衡缓冲液平衡层析柱10倍柱体积;接着,采用第二洗脱缓冲液连续线性洗脱第二固定柱(比例从0逐渐上升到100%),收集紫外吸收值>100mau的部分,即为洗脱液。最后,用第二平衡缓冲液再次平衡层析柱,直至实验完成。
[0053]
检测洗脱液的浓度以及所得的质粒纯度,结果如下表5所示。
[0054]
表5.不同样品稀释倍数下的纯化效果
[0055]
稀释倍数0.5倍1倍2倍3倍上样样品浓度(ng/μl)32.724.516.412.3上样样品体积(ml)6080120160洗脱液浓度(ng/μl)61.771.773.272.1洗脱液体积(ml)16.517.52020纯度(%)69.1977.7361.5463.69得率(%)*36.549.645.846.7
[0056]
*得率%=(洗脱样品浓度
×
洗脱样品体积
×
纯度)/(上样样品体积
×
上样样品浓度)。
[0057]
从表4可以看出,随着稀释倍数的增加,质粒的纯度和得率均出现先上升后下降的趋势。
[0058]
此外,取10μl粗纯化液、穿透液、洗脱液进行凝胶电泳,结果如图2所示。
[0059]
从图2可以看出,在稀释0.5倍和1倍的情况下,穿透液中存在部分开环质粒(如箭头所示),而在稀释2倍和3倍的样品的穿透液中则不存在开环质粒的条带。这表明,在稀释倍数较高的情况下,开环质粒不能在上样阶段穿出,这会增加开环质粒进入洗脱液中的风险,进而影响产品纯度。
[0060]
因此,用于第二固定柱纯化的最优样品稀释倍数为1倍。
[0061]
(2)优化工作流速和第二缓冲液的比例
[0062]
用4m硫酸铵将200ml粗纯化液稀释1倍,然后通过c4固定柱进行层析,具体方法如下:首先,采用第二平衡缓冲液平衡固定柱10倍柱体积,然后采用工作流速8ml/min或50ml/min上样,收集此时固定柱流出的溶液即为穿透液;将样品完全上样结束后,采用第二平衡缓冲液平衡层析柱10倍柱体积;接着,采用40%或60%的第二洗脱缓冲液冲洗层析柱,收集紫外吸收值>100mau的部分,即为洗脱液。最后,用第二平衡缓冲液再次平衡层析柱,直至实验完成。
[0063]
检测洗脱液的浓度以及所得的质粒纯度,结果如下表6所示。
[0064]
表6.洗脱缓冲液的不同流速和比例下的纯化结果
[0065][0066]
从表6可以看出,在不同的工作流速和不同的洗脱缓冲液比例下,获得的质粒纯度没有显著性差异,其对于第二固定柱的纯化效果没有显著影响。
[0067]
因此,用于第二固定柱纯化的最优工作流速为8-50ml/min,洗脱缓冲液比例为40-60%。
[0068]
(3)优化条件后的纯化效果
[0069]
用4m硫酸铵将200ml粗纯化液稀释1倍,然后通过c4固定柱进行层析,具体方法如下:首先,采用第二平衡缓冲液平衡固定柱10倍柱体积,然后采用工作流速50ml/min上样,收集此时固定柱流出的溶液即为穿透液;将样品完全上样结束后,采用第二平衡缓冲液平衡层析柱10倍柱体积;接着,采用60%的第二洗脱缓冲液冲洗层析柱,收集紫外吸收值>100mau的部分,即为洗脱液。最后,用第二平衡缓冲液再次平衡层析柱,直至实验完成。重复三次实验。每次实验用时28分钟左右。
[0070]
检测洗脱液的浓度以及所得的质粒纯度,并计算得率,结果如下表7所示。
[0071]
表7.优化条件下的纯化效果
[0072] 实验1实验2实验3上样样品浓度(ng/ul)257289.1313上样样品体积(ml)475050洗脱液浓度(ng/ul)201.4212.3234.2洗脱液体积(ml)454545纯度(%)81.8980.2486.14得率(%)66.774.371.6
[0073]
从表7可以看出,在优化的样品稀释倍数、洗脱缓冲液流速和洗脱缓冲液比例的情况下,纯化质粒的纯度可以达到80%左右,得率可以达到66%以上,实现了纯化质粒的目的。
[0074]
此外,本发明的纯化方法还大大缩短了纯化工艺所需的时间。例如,对于200ml裂
解液而言,采用传统的填料型层析柱如plasmidselect xtra需要约1.5小时才能完成整个纯化过程,而采用本发明的方法仅需要42分钟左右(第一固定柱用时约14分钟,第二固定柱用时约28分钟),时间缩短了一半。
[0075]
需要说明的是,以上仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。本领域技术人员理解的是,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1