本发明涉及医学模型技术领域,尤其涉及一种结直肠癌类器官免疫微环境重构的方法。
背景技术:
目前,提高个体化免疫治疗敏感性及疗效是肿瘤免疫领域亟待解决的问题,如何在体外模拟体内肿瘤环境,增强免疫细胞杀伤肿瘤细胞能力成为解决问题的关键。
toshirosato等人由结直肠癌患者样本体外构建人的肿瘤类器官(patient-derivedtumororganoids,pdos),该技术可在体外模拟体内3d生长环境,与传统二维培养系统相比,能够更加真实反映肠道功能及体内的信号传导及形态,并且与原发肿瘤灶基因突变类型高度一致1。科学家们借助类器官这一研究工具,用于研究结直肠癌(colorectalcancer,crc)发生发展机制及抗肿瘤药物的体外筛选2。krijn等学者将自体外周血t淋巴细胞与肠癌及肺癌类器官共培养,结果表明与自体肿瘤类器官共培养后,cd8+t细胞产生ifn-γ水平升高,且t细胞杀伤肿瘤的能力显著增强3。nicholas等人研究结果表明与乳腺导管类器官共培养后,vδ2+t细胞能够产生更多ifn-γ,增强其杀伤三阴性乳腺癌细胞的能力4。
结肠直肠癌是胃肠道中常见的恶性肿瘤,早期症状不明显,随着癌肿的增大而表现排便习惯改变、便血、腹泻、腹泻与便秘交替、局部腹痛等症状,晚期则表现贫血、体重减轻等全身症状。其发病率和病死率在消化系统恶性肿瘤中仅次于胃癌、食管癌和原发性肝癌。如果能够成功构建结直肠癌类器官的免疫微环境,将会为临床自体t细胞回输的免疫治疗提供体外实验依据,但目前未见相关内容的报道。
技术实现要素:
本发明的目的在于克服现有技术中的缺陷,提供一种结直肠癌类器官免疫微环境重构的方法。
本发明为解决上述技术问题,采用以下技术方案:
本发明提供了一种结直肠癌类器官免疫微环境重构的方法,包括如下步骤:
步骤一,用新鲜结直肠癌组织构建结直肠癌类器官;
步骤二,提供与上述结直肠癌组织同一来源的外周血,然后进行红细胞裂解并采用淋巴细胞分离液分离出淋巴细胞;
步骤三,运用cd3+t细胞磁珠分选试剂盒将淋巴细胞中的cd3+t细胞富集,并加入t细胞培养液培养4-9天;
步骤四,将步骤一构建的类器官消化为单细胞,然后与培养之后的cd3+t细胞按照1:10-30的比例进行共培养2-3周,便构建了该结直肠癌类器官免疫微环境。
进一步地,步骤一的具体步骤如下:
s1,将新鲜结直肠癌组织切成碎块,离心,弃上清;用组织消化液重悬沉淀,剧烈震荡后冰孵30-40min;
s2,冰上孵育后,将上清液过滤获得过滤液;取过滤液离心,弃上清,以基础培养基重悬细胞沉淀、计数;
s3,取所需细胞悬液,离心,弃上清后,冰上加入4℃液态温敏型matrigel基质胶,然后以预冷后枪头吹吸matrigel基质胶;
s4,将细胞与基质胶混合液加入预热孔板上,培养30-40min后,加入hisc培养基,置于培养箱中培养5-7天,并观察类器官生长状态。
进一步地,s1中新鲜结直肠癌组织需先置于含5mlpbs+1%青霉素/链霉素培养皿内清洗。
进一步地,s1中碎块的大小为2-4mm3。
进一步地,s3中液态温敏型matrigel基质胶的添加量为50μlmatrigel基质胶/20000个细胞。
进一步地,s4中培养的条件为37℃,5%co2培养箱。
进一步地,步骤二中的离心的转速为2500rpm/min,离心时间为25min,其中降速和升速均为1。
进一步地,步骤四中类器官的单细胞与cd3+t细胞按照1:20的比例进行共培养。
本发明采用以上技术方案,与现有技术相比,具有如下技术效果:
本发明提供的结直肠癌类器官免疫微环境重构的方法采用来源于同一个体的手术切除的新鲜结直肠癌组织和外周血来源的cd3+t细胞共培养获得类器官免疫微环境,从细胞形态和atp值显示免疫细胞对crc类器官有明显的杀伤能力,为临床自体t细胞回输的免疫治疗提供体外实验依据。
附图说明
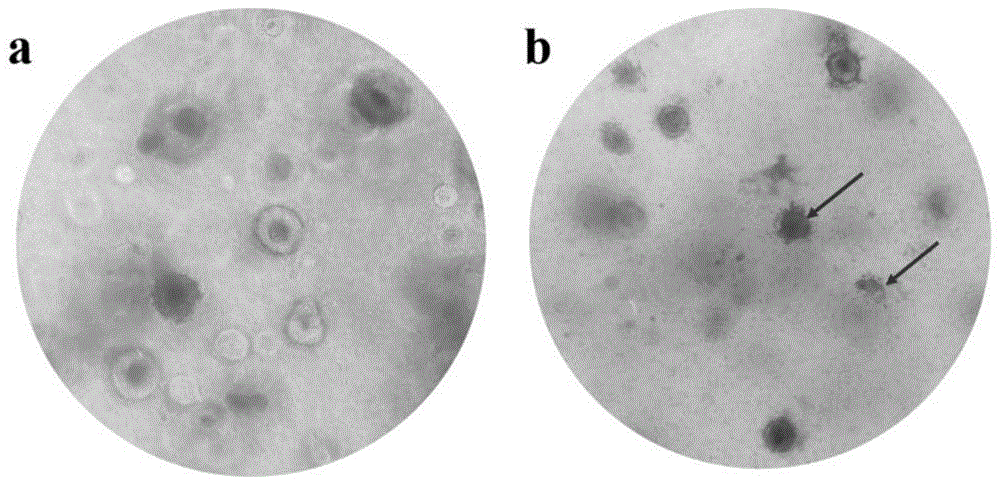
图1为本发明一实施例中结直肠癌类器官与自体外周血cd3+t细胞共培养的结果;其中,a为未加免疫细胞的对照组,b为与免疫细胞共培养2周后;
图2为显示了本发明一实施例中结直肠癌类器官与自体外周血cd3+t细胞共培养2周后细胞存活比例。
具体实施方式
本发明提供了结直肠癌类器官免疫微环境重构的方法,可为临床患者自体t细胞回输的免疫治疗提供体外实验依据。
上述结直肠癌类器官免疫微环境重构的方法,包括如下步骤:
步骤一,用新鲜结直肠癌组织构建结直肠癌类器官;
步骤二,提供与上述结直肠癌组织同一来源的外周血,然后进行红细胞裂解并采用淋巴细胞分离液并离心分离出淋巴细胞;
步骤三,运用cd3+t细胞磁珠分选试剂盒将淋巴细胞中的cd3+t细胞富集,并加入t细胞培养液培养4-9天;
步骤四,将步骤一构建的类器官消化为单细胞,然后与培养之后的cd3+t细胞按照1:10-30的比例进行共培养2-3周,便构建了该结直肠癌患者来源类器官免疫微环境。
在本发明一优选的实施例中,步骤一的具体步骤如下:
s1,将新鲜结直肠癌组织切成碎块,离心,弃上清;用组织消化液重悬沉淀,剧烈震荡后冰孵30-40min;
s2,冰上孵育后,将上清液过滤获得过滤液;取过滤液离心,弃上清,以基础培养基重悬细胞沉淀、计数;
s3,取所需细胞悬液,离心,弃上清后,冰上加入4℃液态温敏型matrigel基质胶,然后以预冷后枪头吹吸matrigel基质胶;
s4,将细胞与基质胶混合液加入预热孔板上,培养30-40min后,加入hisc培养基,置于培养箱中培养5-7天,并观察类器官生长状态。
在本发明一优选的实施例中,s1中新鲜结直肠癌组织需先置于含5mlpbs+1%青霉素/链霉素培养皿内清洗。
在本发明一优选的实施例中,s1中碎块的大小为2-4mm3。
在本发明一优选的实施例中,s3中液态温敏型matrigel基质胶的添加比例为50μlmatrigel基质胶/20000个细胞。
在本发明一优选的实施例中,s4中培养的条件为37℃,5%co2培养箱。
在本发明一优选的实施例中,步骤二中的离心的转速为2500rpm/min,离心时间为25min,其中降速和升速均为1。
在本发明一优选的实施例中,步骤四中类器官的单细胞与cd3+t细胞按照1:20的比例进行共培养。
下面通过具体实施例和附图对本发明进行详细和具体的介绍,以使更好的理解本发明,但是下述实施例并不限制本发明范围。
实施例中方法如无特殊说明的采用常规方法,使用的试剂如无特殊说明的使用常规市售试剂或按常规方法配制的试剂。
实施例1
本实施例提供一种结直肠癌类器官免疫微环境重构的方法,包括如下步骤:
(1)pdos模型的构建过程:
1.将手术切除的新鲜结直肠癌组织(离体30min内)置于含5mlpbs+1%青霉素/链霉素培养皿内清洗2遍;
2.将肿瘤组织彻底清洗后,持无菌器械将肿瘤组织切成2-4mm3大小的碎块,置于15ml离心管内(含冰pbs缓冲液10ml)中,1500rpmx3min离心,弃上清。
3.加入5ml组织消化液(stemcell,cat:07174),重悬第二步得到的肿瘤碎块组织,剧烈震荡后,置于冰上孵育30min。
4.将上清液经100μm滤网过滤至50ml离心管,获得过滤液,并富集腺体碎块。
5.取1ml第4步获得的过滤液,以190g转速离心5min,弃上清。
6.以1ml基础培养基重悬细胞后,计数。
7.取出所需细胞悬液转至ep管内,以190g转速离心5min,弃上清后,将ep管置于冰上。
8.在ep管内以预冷的枪头吸取适量4℃液态温敏型matrigel基质胶(加入比例为50μlmatrigel基质胶/20000个细胞),并以预冷后枪头吹吸matrigel基质胶十次,注意在此过程中避免产生气泡。
9.将细胞与基质胶混合液以每孔50μl滴加入预热24孔板上,凝胶在遇热后迅速转变为果冻状。
10.将滴加细胞与基质胶混合物的24孔板置于37℃,5%co2培养箱孵育30min后,每孔加入700μlhisc培养基(stemcell,cat:06011,06012)后置于37℃,5%co2培养箱培养5-7天,显微镜下观察类器官生长状态。
(2)自体外周血cd3+t细胞与pdos共培养的方法、处理时间及后续检测等:
1.取2ml外周血,经红细胞裂解液室温处理5min后,离心弃上清后以5ml含2%fbs的pbs重悬;
2.在15ml离心管内加入5ml淋巴细胞分离液(stemcell,cat:07851),缓慢将裂红后外周血重悬细胞液加于淋巴细胞分离液之上,以2500rpm/min转速室温离心25min,其中升速为1,降速为1;
3.待离心后吸取介于15ml离心管细胞分离液及细胞悬液中间的白色环状淋巴细胞,转至ep管,以3600rpm/min于4℃离心5min,弃上清;
4.运用人cd3+t细胞磁珠分选试剂盒(stemcell,cat:17851)将淋巴细胞中的cd3+t细胞富集,并加入t细胞培养液培养1周;
5.将培养好的类器官消化为单细胞,以20000个细胞每孔铺于48孔板,与t细胞以1:20的比例进行共培养2周,并于显微镜下观察细胞状态(如图1所示);
6.2周共培养之后,每孔加入80微升celltiter-glo3d细胞活力检测试剂10min后,置于orionⅱ仪器读值,与对照组对比细胞活力状态,得到的结果如图2所示。
由图1可知,结直肠癌类器官与自体外周血cd3+t细胞共培养后,肿瘤类器官生长受限,箭头所指表示类器官团出现皱缩、凋亡现象。
由图2可知,将类器官与自体免疫细胞共培养之后,atp值显著低于未处理组,提示免疫细胞对crc类器官有明显的杀伤能力,为临床自体t细胞回输的免疫治疗提供体外实验依据。
以上对本发明的具体实施例进行了详细描述,但其只作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对该实用进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
参考文献:
1.satot,stangede,ferrantem,vriesrg,vanesjh,vandenbrinks,etal.long-termexpansionofepithelialorganoidsfromhumancolon,adenoma,adenocarcinoma,andbarrett'sepithelium.gastroenterology2011,141(5):1762-1772.
2.drostj,cleversh.organoidsincancerresearch.naturereviewscancer2018,18(7):407-418.
3.dijkstrakk,cattaneocm,weeberf,chalabim,vandehaarj,fanchilf,etal.generationoftumor-reactivetcellsbyco-cultureofperipheralbloodlymphocytesandtumororganoids.cell2018,174(6):1586-1598e1512.
4.zumwaldena,haagjd,sharmad,mirrieleesja,wilkelg,gouldmn,etal.analysisofimmunecellsfromhumanmammaryductalepithelialorganoidsrevealsvdelta2+tcellsthatefficientlytargetbreastcarcinomacellsinthepresenceofbisphosphonate.cancerpreventionresearch2016,9(4):305-316.