一种空间位阻控制信号放大且简单灵敏的外泌体检测方法
1.本发明属于分析化学领域,涉及空间位阻控制信号放大的外泌体检测原理,过程,实验条件及应用。
背景技术:
2.外泌体可作为新型癌症生物标志物这一发现为癌症的早期筛查和精确诊断提供了更多可能和机会。外泌体是一种具有平均厚度5纳米的磷脂双分子层结构且尺寸在40-160纳米(平均为100纳米)的纳米级别小泡,能够被几乎所有类型的细胞分泌,在血液,尿液等各种人体体液中均有普遍分布,因此能够大大降低临床取样难度。另外,由于磷脂双分子层膜的保护作用,外泌体可以有效地避免被溶酶体或巨噬细胞损伤或清除,从而延长其循环半衰期,提高其生物活性。外泌体携带许多母细胞的信息,如与母细胞相同的膜蛋白、多糖等且外泌体内部也包含着大量与母细胞相关的核酸如mirna,dna等及其他生物分子。相比检测单一癌症标志物来判断患癌风险,检测癌细胞衍生的外泌体能够有效提高检测结果的准确性和说服力,因而具有更高的实际临床应用价值。
3.外泌体虽然是一种新兴的疾病标志物,但是目前已经有大量关于癌症外泌体检测工作的相关报道,如利用纳米颗粒跟踪分析、流式细胞法、免疫印迹法、酶联免疫吸附分析法等传统技术进行外泌体的定量分析。然而这些传统的检测方法普遍存在着成本高、操作复杂、灵敏度低等缺陷。由此,一系列新颖的检测技术开始应用于外泌体的检测,如表面增强拉曼散射技术、分子印迹、电化学技术、荧光、比色等。虽然这些新技术能够在一定程度上弥补传统方法的缺陷,但是这些方法仍然依赖于精密的仪器设备和复杂的操作流程,因此提出更简单有效的外泌体检测方法的需求依旧存在。
4.外泌体作为一种大囊泡,相比其他生物分子具有与生俱来的大体积和大质量以及由此产生的空间位阻效应常常被忽视。基于外泌体本身具有较强空间位阻的这一特性,本发明利用外泌体与链霉亲和素之间的位阻效应阻碍双链dna的互补配对过程,使得链霉亲和素修饰的dna单链能够在末端脱氧核苷酸转移酶(tdt)的作用下延伸出大量g四联体,并与硫黄素t(tht)结合产生强烈荧光,从而开发了一种基于空间位阻控制信号放大且简单灵敏的新型外泌体检测方法。该方法能够在一定浓度范围内实现外泌体的定量分析且检测限较低,同时在含有10%人血清的复杂环境中依然能够保持良好的检测效果,表明该方法在临床检测方面具有一定的潜力。
技术实现要素:
5.本发明的目的是提供一种基于空间位阻控制信号放大,能够简单灵敏检测外泌体的新方法。
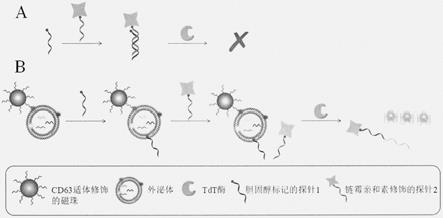
6.本发明采用以下机理:图1对实验原理进行了详细的解释。在没有外泌体的情况下,3端标记胆固醇的探针1(p1)能够与链霉亲和素修饰的探针2(sa-p2,p2的5端标记生物素)发生有效的碱基互补,形成完全配对的双链。此时的钝端双链dna因为缺少3端突出的羟
基导致tdt酶对其利用效率极低,难以催化有效的聚合反应,导致无法延伸出g四联体。当用磁珠捕获外泌体后,由于胆固醇与脂双层分子之间的疏水相互作用,p1能够自发地插入到外泌体的磷脂膜中。此时sa-p2由于外泌体与链霉亲和素之间巨大的空间位阻效应有力地阻碍了其与p1链的靠近,同时由于两条探针的设计长度较短,两条链无法成功地互补配对。因此sa-p2始终保持着单链状态,并能够作为tdt酶的良好底物延伸出大量g四联体,这些g四联体与硫黄素t相结合可以产生强烈的荧光。基于上述原理,我们设计了一种基于外泌体与链霉亲和素之间空间位阻效应的简单、灵敏的外泌体检测方法。
附图说明
7.图1:基于外泌体与链霉亲和素之间的空间位阻效应所提出的外泌体检测方法在没有(a)或有(b)外泌体存在情况下的原理示意图。
8.图2:(a)外泌体空间位阻验证示意图。(b)fam在不同反应条件下的荧光光谱。(c)tdt对不同dna的催化效率。(d)该方法在各种情况下的荧光强度。
9.图3:tdt反应时间(a)、tht与g四联体孵育时间(b)和tht浓度(c)对本发明检测性能的影响。
10.图4:(a)不同浓度外泌体产生的荧光光谱,a-h(个/μl):0,1.66
×
103,3.32
×
103,1.66
×
101,1.66
×
105,3.32
×
105,8.3
×
105,1.66
×
106;(b)外泌体浓度与500纳米荧光强度的对应曲线。(插图:荧光强度与外泌体浓度对数之间的线性关系。)
11.图5:(a)cd63适体和随机dna对hela外泌体的选择性比较。(b)本发明对不同分析物的选择性。(c)比较了pbs和10%人血清中不同浓度外泌体的检测结果(a-c:1.66
×
101,3.32
×
105,1.66
×
106个/μl)。
具体实施方式
12.一、检测方法的可行性探究:
13.外泌体与链霉亲和素之间的位阻效应能否成功地阻碍p1与sa-p2的互补配对是本实验的关键,因此我们首先在p1的5端和p2的3端分别修饰了荧光基团fam和猝灭集团bhq1来检验位阻效应,如图2a所示。我们发现当外泌体存在时,相比于只有p1和sa-p2的情况,荧光强度得到了明显的提高,这充分验证了外泌体与链霉亲和素之间存在着能够有力阻碍dna链互补配对的空间位阻效应,与预期一致。另外,我们还发现不修饰链霉亲和素的p2链也能够在外泌体存在的情况下使荧光得到低程度的恢复,表明外泌体对p1和sa-p2的结合有微小影响。值得一提的是,修饰了链霉亲和素的p2能够产生更加明显和稳定的位阻效应,因此,链霉亲和素的添加是必要的。接着,我们检验了链霉亲和素的修饰是否会影响tdt酶对sa-p2的催化效率及其与p1的互补配对。如图2c所示,p2、sa-p2都能够在tdt的催化及tht结合下产生相近的荧光强度。然而当它们与p1结合之后,所形成的双链dna均难以被tdt催化,故荧光强度大大降低。这些现象充分说明链霉亲和素的修饰不会影响tdt对sa-p2的催化以及其与p1的互补配对。在对检测方法的关键环节进行了验证之后,我们对整个方案的可行性进行了分析,结果如图2d所示。当存在外泌体时,500nm处出现了较强的荧光而外泌体不存在的情况下荧光微弱。同时,当我们用p2代替sa-p2在外泌体存在的情况下进行实验,发现有部分荧光得到保留,这一现象与我们前期验证外泌体与链霉亲和素之间位阻效
应的实验结果相一致。以上充分证明了本发明的可行性良好。
14.二、本发明相关参数的优化:
15.为了提高检测方法的性能以获得最佳的检测效果,我们对以下3个主要因素分别进行了优化:tdt作用时间、tht与g四联体孵育时间以及tht浓度。考虑到时间成本的影响,我们首先对tdt作用时间以及tht与g四联体孵育时间进行了优化。如图3a所示,当tdt反应时间达到2个小时以后,荧光强度达到最高且基本达到了稳定。当g四联体与tht孵育35分钟后能够得到最高强度的荧光信号(图3b)。为了确保所延伸的g四联体能够与足够的tht充分结合,我们对tht浓度进行了调整。随着tht浓度从5μm增加至0.5mm,荧光强度也随之增长直到进入一个平台期(图3c)。因此,我们以2个小时的tdt反应时间,35分钟的tht孵育时间以及0.5mm的tht作为最佳的反应条件,并应用于接下来的实验当中。
16.三、本发明的灵敏度探究:
17.我们对浓度从0到1.66
×
105个/μl的若干组不同浓度的外泌体样品进行了测定来检验本发明的灵敏性。由图4可知,外泌体在1.66
×
103到1.66
×
105范围内的浓度对数与荧光信号强度呈现出良好的线性关系,相应的方程对应为f=456.57logc-1105.73(f为荧光强度,c为外泌体浓度),r2=0.9792,检测限计算约为480个/μl。这样的检测效果相比早期一些外泌体检测策略,特别是在同样以荧光作为信号输出方式的检测方法中,具有一定的优势。
18.四、本发明的选择性及其在临床诊断上的应用潜力探究:
19.我们用随机的dna代替cd63适体修饰到磁珠上来测试cd63对于hela外泌体的选择性。如图5a所示,即使在1.66
×
106个/μl的高浓度下,用随机dna链修饰的磁珠无法捕获外泌体,因此产生的荧光信号与其空白组相差无几的荧光信号,而采用cd63适体修饰的磁珠在相同的对照条件下产生了相差近7倍的信号。结果说明cd63适体对于hela外泌体具有优异的选择性。接着我们以脂质体及胰酶细胞消化液处理过的hela外泌体作为分析物进一步进行了选择性探究。如图5b所示,虽然脂质体的浓度是外泌体的100倍,但是由于其表面缺少cd63蛋白故难以被磁珠识别。用胰酶细胞消化液在37℃下处理2个小时之后的外泌体也只产生少量荧光。这是因为胰酶水解了包括cd63蛋白在内的外泌体膜蛋白,因此被消化处理的外泌体无法被磁珠识别和捕获。这些验证充分体现了本发明出色的选择性。最后,为了检验本发明在复杂环境中的抗干扰能力以及其在临床检测中的应用潜力,我们用含有10%人血清的pbs进行了不同浓度外泌体的回收测试,结果显示与pbs环境下得到的结果相差不大,对此我们认为本发明能够进一步应用于临床诊断上。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1