一种慢病毒载体纯化方法与流程
1.本发明涉及病毒载体纯化技术领域,特别是涉及一种慢病毒载体纯化方法。
背景技术:
2.近年来,以嵌合抗原受体修饰t细胞(car-t)为代表的细胞治疗和以基因转运载体为 基础的基因治疗在临床上不断取得突破性进展,在治疗人类疾病方面得到了越来越多的应用。 其中,常用的病毒载体之一就是慢病毒载体。慢病毒载体是在hiv-1病毒基础上改造而成的 病毒载体系统,它能高效的将目的基因导入动物和人的原代细胞或细胞系。慢病毒载体介导 的基因表达可以用于实现连续且稳定的蛋白质生产,因为目的基因已经整合到宿主细胞的基 因组中并且在细胞分裂时被复制。另外,慢病毒载体可以有效感染非分裂细胞以及那些积极 进行细胞分裂的细胞,比其他病毒载体使用范围更广。
3.成熟的慢病毒颗粒是通过将多个质粒载体共同转染293相关细胞后在细胞内包装而成, 并分泌至细胞外培养上清中。实验室一般通过超速离心进行制备高浓度慢病毒载体,该方法 虽然简单但是无法进行工业化放大,而且制备得到的慢病毒载体可能存在较高的内毒素、 bsa、hcp或核酸等残留,无法直接用于人体。文献《large-scale production means for themanufacturing of lentiviral vectors》和《new developments in lentiviral vector design,productionand purification》里综述了现有的用于生产慢病毒载体的层析方法主要采用q膜层析、cim整 体柱或分子筛等,普遍存在着生产成本高、收率较低和步骤繁琐等缺点,难以满足工业化大 规模生产的需要。
4.因此,本领域迫切需要开发高效低成本、适合大规模生产并且满足gmp规定的慢病毒 载体纯化方法。
技术实现要素:
5.鉴于以上所述现有技术的缺点,本发明的目的在于提供一种慢病毒载体纯化方法,用于 解决现有技术中生产成本高、收率较低和步骤繁琐等缺点的问题。
6.为实现上述目的及其他相关目的,本发明提供一种慢病毒载体纯化方法,包括以下步骤:
7.1)将慢病毒收获液进行过滤和核酸酶孵育,得到慢病毒载体澄清收获液;
8.2)对所述慢病毒载体澄清收获液采用阴离子交换层析和/或复合模式层析处理,获得纯 化的慢病毒载体样品;
9.可选地,所述步骤1)中采用深层过滤膜或孔径为0.45um-1um的死端过滤膜包过滤所述 慢病毒收获液。
10.可选地,所述步骤1)中采用浓度为5u-50u/ml的核酸酶和浓度为0.8-2.0mmol/l的硫酸 镁孵育所述慢病毒收获液。
11.可选地,所述步骤2)中使用的阴离子交换层析填料的微粒孔径大于60nm。
12.可选地,所述步骤2)中,还包括以下特征中的一项或多项:
13.所述复合模式层析采用流穿模式;
14.所述复合模式层析使用capto core 700或capto core 400填料;
15.所述复合模式层析的上样量为2-10cv,优选的上样量为2-5cv。
16.如上所述,本发明的一种慢病毒载体纯化方法,具有以下有益效果:操作简单,易于放 大,工艺稳定、重复性好,制备的慢病毒载体收获率高,细胞宿主蛋白、宿主dna、残余质 粒等杂质残留低,安全性好。本发明提供的一种慢病毒载体纯化方法适合大规模生产并且满 足gmp规定要求,制备得到的慢病毒载体满足临床上细胞治疗和基因治疗的使用要求。
附图说明
17.图1显示为本发明纯化过程的紫外吸收图。
具体实施方式
18.本发明提供一种慢病毒载体纯化方法:包括以下步骤:
19.1)将慢病毒收获液进行过滤和核酸酶孵育,得到慢病毒载体澄清收获液;
20.2)对所述慢病毒载体澄清收获液采用阴离子交换层析和/或复合模式层析处理,获得纯 化的慢病毒载体样品。
21.本发明提供一种慢病毒载体纯化方法,所述步骤1)将慢病毒收获液进行过滤和核酸酶孵 育,得到慢病毒载体澄清收获液。其方法包括使用深层过滤膜或死端过滤膜包过滤所述慢病 毒收获液,使用核酸酶和硫酸镁孵育所述慢病毒收获液,孵育时间为4-20h,降低慢病毒收获 液中的宿主细胞残留dna和残留质粒等的含量,得到慢病毒载体澄清收获液,其中核酸酶 孵育可以在过滤之前,也可在过滤之后进行。
22.所述慢病毒收获液由包括如下步骤的方法制得:使用不同质粒系统和相应的培养方法包 装生产慢病毒,其中可使用三质粒或四质粒,培养基可以是无血清或有血清培养基,培养方 式可以是悬浮或贴壁培养,培养容器根据需要可采用培养瓶、细胞工厂或生物反应器。
23.上述步骤为慢病毒载体包装和培养过程,慢病毒载体的培养可参考《production of cgmp-grade lentiviral vectors》或《optimization of lentiviral vector production for scale-up infixed-bed bioreactor》等文献。
24.本发明提供一种慢病毒载体纯化方法,所述步骤2)对所述慢病毒载体澄清收获液采用阴 离子交换层析和/或复合模式层析处理,获得纯化的慢病毒载体样品。其方法包括使用阴离子 交换层析初步纯化所述慢病毒载体澄清收获液,阴离子交换层析填料包括但不限于以下种类: 苏州纳微科技有限公司生产的unigel系列(unigel-30deae、unigel-30q、unigel-80deae 和unigel-80q),和nano系列(nanoq-10l、nanoq-15l和nanoq-30l),其中孔径均为100nm; 日本东曹株式会社生产的superq-650c、deae-650c、q-600c ar、gigacap q-650m、gigacapdeae-650m、superq-650m、deae-650m、superq-650s、deae-650s和gigacap q-650s, 其中,q-600c ar孔径为75nm,其他孔径均为100nm;以及thermofisher公司生产的porosxq,孔径是110nm、poros hq50,孔径是200nm、poros pi 50,孔径是200nm和porosd 50,孔径是105nm。阴离子交换层析包括以下操作:使用3-10cv的ph值7.0-7.7、
含浓度 为50-200mmol/l nacl的缓冲液平衡层析柱;然后进行上样,上样流速为100-300cm/h,上 样完成后使用平衡液冲洗层析柱直至紫外吸收下降至接近基线,最后使用ph值为7.0-7.7、 含浓度为0.5-1mol/l nacl的洗脱液进行洗脱,洗脱流速为100-300cm/h,观察紫外吸收,收 集目标峰,并立即使用预冷至2-8℃的ph7.0-7.7、不含nacl的稀释液进行稀释,确保稀释后 的慢病毒载体样品电导在5-20ms/cm之间。
25.其方法还包括使用复合模式层析精纯所述慢病毒纯化液,选用的复合模式层析的填料为 capto core 700或capto core 400。复合模式层析采用流穿模式,首先使用3-10cv的ph值为 7.0-7.7、含浓度为50-200mmol/l nacl的缓冲液平衡层析柱,然后进行上样,上样流速为 100-400cm/h,上样完成后使用平衡液冲洗层析柱直至紫外吸收下降至接近基线。在上样和洗 涤过程中观察紫外吸收,收集目标峰。
26.进一步需要说明的是:复合模式层析精纯可以在阴离子交换层析后,也可以在阴离子交 换层析前进行。另外,根据所述慢病毒载体澄清收获液中杂质的含量差异以及不同的终产品 质量标准,整个纯化工艺中可灵活选择进行或不进行复合模式层析精纯操作。优选的是同时 使用阴离子交换层析和复合模式层析,这种层析方式对杂质的去除作用最佳,可以大程度降 低慢病毒载体样品中杂质的含量。
27.在一实施例中,所述步骤1)中采用深层过滤膜或孔径为0.45um-1um的死端过滤膜包过 滤所述慢病毒收获液。实施人员可根据需求选择死端过滤膜的孔径,选择的孔径可以是0.45 um、0.5um、0.65um、0.8um和1um。采用深层过滤膜或死端过滤膜包可以显著降低病毒液中 的宿主细胞蛋白和残留dna等。
28.在一实施例中,所述步骤1)中采用浓度为5u-50u/ml的核酸酶和浓度为0.8-2.0mmol/l 的硫酸镁育所述慢病毒收获液。实施人员,可根据需要选择核酸酶的浓度、硫酸镁的浓度和 孵育时间,核酸酶的浓度可以是5u-10u/ml、10u-15u/ml、15u-20u/ml、20u-25u/ml、 25u-30u/ml、30u-35u/ml、35u-40u/ml、40-45u/ml和45u-50u/ml。硫酸镁的浓度可以是 0.8-0.9mmol/l、0.9-1mmol/l、1-1.1mmol/l、1.1-1.2mmol/l、1.2-1.3mmol/l、1.3-1.4mmol/l、 1.4-1.5mmol/l、1.5-1.6mmol/l、1.6-1.7mmol/l、1.7-1.8mmol/l、1.8-1.9mmol/l和1.9-2.0mmol/l。 孵育条件可根据核酸酶产品推荐的条件进行,例如可以是低温长时的孵育,如实施例具体所 列举的2-8℃孵育17-18小时,也可以是生理温度下孵育合适的时间。
29.在一实施例中,所述步骤2)中所使用阴离子交换层析微粒孔径大于60nm。实施人员可 根据需求选择阴离子交换层析微粒孔径,例如可以是75nm、100nm、105nm、110nm和200nm, 微粒孔径的也可以是一个范围,例如:60nm-75nm、75nm-100nm、100nm-105nm、105nm-110 nm和110nm-200nm等。相对于传统的小孔径的微粒填料,拥有大孔径的微粒填料对于慢病 毒有更大的吸附载量和更高的洗脱回收率,更适用于慢病毒载体的制备。
30.在一实施例中,所述步骤2)中,还包括以下特征中的一项或多项:
31.所述复合模式层析采用流穿模式,所述复合模式层析使用capto core 700或capto core 400 填料。capto core 700及capto core 400填料为具有凝胶过滤层析和阴离子交换层析作用的复 合模式层析填料。其微粒具有核心辛胺配基和惰性壳层,其惰性壳层可以排阻大分子进入微 粒内部,而较小的杂质可以通过壳层上的小孔(排阻分子量为700kd或400kd)进入核心与 配基结合,因此在慢病毒载体纯化中采用流穿模式。
32.优所述复合模式层析的上样量为2-10cv,实施人员,可根据需要选择上样量,上样量可 以是2-3cv、3-4cv、4-5cv、5-6cv、6-7cv、7-8cv、8-9cv和9-10cv,优选的上样 量为2-5cv。当上样量为2cv至10cv时,慢病毒载体感染滴度收率均在85%以上;当上样 量增加时,残留宿主蛋白和宿主dna去除率逐渐降低,去除率均可达到45%以上。综合考 虑收率和杂质去除的情况,确定过程上样量可以是2-10cv,进一步的,其最优上样量为 2-5cv。
33.本发明提供一种慢病毒载体纯化方法,所述方法还包括:步骤3),对所述慢病毒载体样 品进行浓缩并将所述慢病毒载体样品中的缓冲体系置换至制剂缓冲液,获得慢病毒载体。
34.在一实施例中,采用超滤膜包或中空纤维膜柱对所述病毒载体样品进行浓缩和将所述慢 病毒载体样品中的缓冲体系置换至制剂缓冲液。慢病毒载体产品一般在-80℃冰箱中长期储 存,需要使用合适的制剂缓冲液,以最大程度保持其感染活性,降低冷冻、融化等过程感染 活性的损失。
35.在一实施例中,所述超滤膜包和所述中空纤维膜柱的孔径的100-1000kd,实施人员可根 据需求,选择所述超滤膜包和所述中空纤维膜柱的孔径,选择的孔径可以是100kd、300kd、 500kd、750kd和1000kd。优选的孔径是500kd、750kd和1000kd,它们的孔径比100kd 和300kd的孔径大,去除杂质效果更好。
36.在一实施例中,所述步骤1)至所述步骤3)采用全密闭操作的无菌生产环境或者当涉及 敞口操作时在洁净等级a级区域中进行;本发明中的a级区域需符合《药品生产质量管理规 范(2010年修订)》附录一《无菌药品》第九条无菌药品生产所需的洁净区的相关规定。
37.和/或,所述方法还包括:对所述慢病毒载体进行除菌过滤。
38.在一实施例中,所述行除菌过滤使用的是双层组合孔径的除菌过滤器,实施人员可根据 需求选择双层组合孔径,例如可以是孔径为0.45um+0.22um的组合、孔径为0.5um+0.22um、 孔径为0.65um+0.22um的组合和孔径为0.8um+0.22um的组合,双层组合孔径的除菌过滤器 比单层除菌过滤器的上样载量大,收率高。
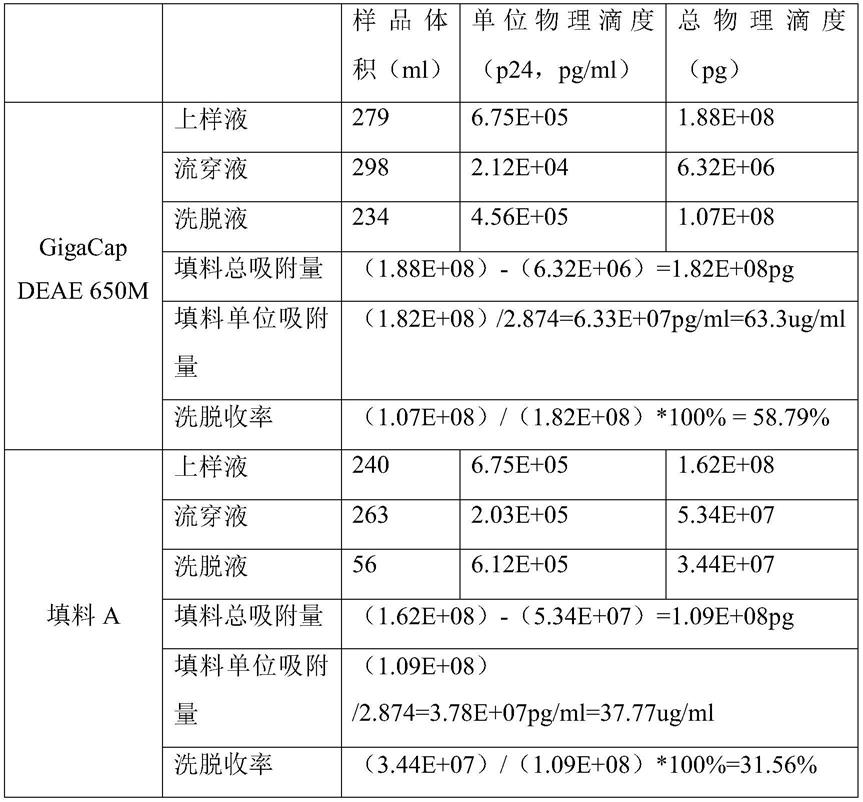
39.为了使本发明的发明目的、技术方案和有益技术效果更加清晰,以下结合实施例进一步 详细描述本发明。但是,应当理解的是,本发明的实施例仅仅是为了解释本发明,并非为了 限制本发明,且本发明的实施例并不局限于说明书中给出的实施例。实施例中未注明具体实 验条件或操作条件的按常规条件制作,或按材料供应商推荐的条件制作。
40.实施例1
41.比较大孔径阴离子交换层析填料gigacap deae 650m与填料a用于慢病毒载体纯化表 现。其中gigacap deae 650m填料为tosoh公司的一款微粒孔径为100nm的阴离子交换 层析填料;填料a为市售某品牌琼脂糖凝胶骨架的阴离子交换层析填料,微粒孔径为28nm。
42.(1)制备慢病毒收获液:使用液氮罐中冻存的293t细胞,进行复苏后依次传代扩大培 养,采用贴壁培养方式最终传代至hyper flask中。将四种质粒按一定比例与转染试剂混合后 转染细胞。转染后48h收获上清液共约560ml。
43.(2)慢病毒收获液进行过滤和核酸酶孵育:使用孔径为0.6um、膜面积为17.5cm2囊式 滤器对收获液进行过滤。过滤完成后加入merck公司benzonase至终浓度为5u/ml,硫酸镁 终浓度为1.5mmol/l,放置于2-8℃冰箱中过夜(18h)培养。过滤完成后的病毒上清液共558ml。
44.(3)对所述慢病毒载体澄清收获液采用阴离子交换层析:准备gigacap deae 650m和 填料a两种填料装填层析柱,层析柱直径0.66cm,装填高度均为8.4cm,填料体积均为2.874ml。 将核酸酶处理后的病毒上清液分成两部分,每部分各279ml,分别依次上样准备好的两根层 析柱,流速设定为210cm/h。首先使用3cv的ph值为7.2、100mmol/l nacl缓冲液平衡层 析柱;平衡完成后进行上样,上样过程中注意流穿液uv280变化,当紫外吸收开始升高时收 集流穿液。上样完成后使用平衡液冲洗层析柱至紫外吸收下降值接近基线,结束收集流穿液。 最后使用ph值为7.2、0.8mol/l nacl浓度的洗脱液进行洗脱,洗脱流速为210cm/h,观察 uv280吸收,收集目标峰,并立即使用约4倍体积预冷至2-8℃的ph值为7.2、不含nacl 的稀释液进行稀释。在上样过程中使用北京博奥龙公司慢病毒快速滴度检测卡检测流穿液发 现填料a在上样体积200ml左右出现了慢病毒载体物理颗粒流穿,所以最终填料a层析柱完 成上样240ml。
45.(5)检测:将收集的流穿液以及洗脱液送样检测单位物理滴度(p24),观察两种填料的 流穿情况并计算吸附载量。
46.(6)试验结果及分析:具体试验结果见下表:
[0047][0048]
样品总物理滴度=样品体积
ⅹ
样品单位物理滴度;
[0049]
填料总吸附量=上样液总物理滴度
–
流穿液总物理滴度;
[0050]
填料单位吸附量=填料总吸附量/填料体积;
[0051]
洗脱收率=洗脱液总物理滴度/填料总吸附量
ⅹ
100%。
[0052]
慢病毒载体滴度检测方法主要分为两种,感染滴度和物理滴度。感染滴度为有感染活性 的慢病毒载体颗粒;物理滴度为p24蛋白的含量,其中包含了有感染活性的慢病毒载体颗粒, 也包含了无感染活性的慢病毒载体碎片。在慢病毒载体收获液中,含有大量的无感染活性的 慢病毒载体碎片,在阴离子交换层析过程中也会被吸附在层析填料上。因此,为了比较两款 阴离子交换层析填料的吸附性能,选择使用物理滴度作为指标对其进行考察。
[0053]
从上表可以看出,在上样过程中,两款填料均出现了p24颗粒的流穿,但是gigacap deae650m层析柱在上样量更大的情况下流穿更少,最终结果显示慢病毒载体单位吸附量gigacapdeae 650m填料为63.3ug/ml,填料a单位吸附量为37.77ug/ml。gigacap deae 650m填料 慢病毒载体单位吸附量比填料a高了67.59%。
[0054]
而对于吸附在填料上的慢病毒载体,相同高盐洗脱条件下,可以发现gigacap deae650m填料洗脱收率为58.79%,而填料a洗脱收率只有31.56%。gigacap deae 650m填料 慢病毒载体洗脱收率比填料a高了86.28%。
[0055]
综上可以看出,对于慢病毒载体的纯化,相对于传统的小孔径阴离子交换填料,拥有大 孔径的gigacap deae 650m填料有更大的吸附载量和更高的洗脱回收率,更适用于慢病毒载 体的制备。
[0056]
实施例2
[0057]
通过设计相关试验,考察不同上样量对capto core 700层析填料纯化慢病毒载体的收率 和杂质去除能力比较。
[0058]
(1)制备慢病毒收获液:使用液氮罐中冻存的293t细胞,进行复苏后依次传代扩大培 养,采用贴壁培养方式最终传代至10层细胞培养工厂。将四种质粒按一定比例与转染试剂混 合后转染细胞。转染后48h收获上清液共959ml。
[0059]
(2)慢病毒收获液进行过滤和核酸酶孵育:使用孔径为0.8um,膜面积为17.5cm2的囊 式滤器进行澄清过滤。过滤完成后加入merck公司benzonase至终浓度20u/ml,硫酸镁终浓 度为0.8mmol/l,置于2-8℃冰箱中孵育约17h。
[0060]
(3)对所述慢病毒载体澄清收获液采用阴离子交换层析:使用苏州纳微公司的 unigel-80deae填料进行进一步纯化,unigel-80deae的孔径是100nm。使用xk16/20层析 柱,装载柱体积约20ml。首先使用5cv的ph值为7.0、200mmol/l nacl缓冲液平衡层析柱; 平衡完成后进行上样,上样流速为210cm/h,上样完成后继续使用平衡液冲洗层析柱直至紫 外吸收下降至接近基线,最后使用ph值为7.0、0.5mol/l nacl浓度的洗脱液进行洗脱,洗脱 流速为210cm/h,观察紫外吸收,收集目标峰,并立即使用2倍体积预冷至2-8℃的ph值为 7.0、不含nacl的稀释液进行稀释。洗脱完成后得到初纯慢病毒载体样品为97ml。
[0061]
(4)对步骤(3)所得到初纯慢病毒载体样品采用复合模式层析:使用capto core 700 层析填料对慢病毒载体样品进一步精纯。装载层析柱直径为0.66cm,柱高14cm,填料体积 4.79ml,层析过程流速为180cm/h。首先使用ph值为7.0、150mmol/l nacl缓冲液平衡层析 柱,共平衡10cv。平衡完成后使用步骤(3)样品进行上样,共进行3次试验,每次试验依 次上样2cv、5cv和10cv。上样完成后继续使用平衡液冲洗层析柱直至紫外吸收下降至接 近基线。在上样和冲洗过程中观察紫外吸收,收集流穿峰。每次试验之间,使用4cv 0.5mol/l
naoh溶液进行cip,然后使用ph值为7.0,1mol/l nacl溶液冲洗层析柱至流出液ph为中 性。
[0062]
(5)检测:将3次试验样品送样检测慢病毒载体感染滴度、残留宿主蛋白浓度和残留宿 主dna浓度,考察不同上样体积对capto core 700层析柱层析表现的影响。
[0063]
(6)试验结果:具体的检测结果见下表:
[0064][0065]
其中unigel-80deae洗脱样品即为capto core 700层析上样液。
[0066]
感染滴度收率=(流穿液体积
ⅹ
流穿液单位感染滴度)/(上样液体积
ⅹ
上样液单位感染 滴度)
ⅹ
100%。
[0067]
残留宿主蛋白去除率=(上样液体积
ⅹ
上样液残留宿主蛋白浓度-流穿液体积
ⅹ
流穿液 残留宿主蛋白浓度)/(上样液体积
ⅹ
上样液残留宿主蛋白浓度)
ⅹ
100%。
[0068]
残留宿主dna去除率=(上样液体积
ⅹ
上样液残留宿主dna浓度-流穿液体积
ⅹ
流穿 液残留宿主dna浓度)/(上样液体积
ⅹ
上样液残留宿主dna浓度)
ⅹ
100%。
[0069]
从上表中可以看出,对于capto core 700层析,当上样量为2cv至10cv时,慢病毒载 体感染滴度收率均在85%以上;当上样量增加时,残留宿主蛋白和宿主dna去除率逐渐降 低,但是去除率均能够达到45%以上。综合考虑收率和杂质去除的情况,确定capto core 700 层析过程上样量可以达到2-10cv,进一步的,其最优上样量为2-5cv。
[0070]
实施例3
[0071]
本实施例对1l规模慢病毒载体收获液纯化,步骤如下:
[0072]
(1)制备慢病毒收获液:使用液氮罐中冻存的293t细胞,进行复苏后依次传代扩大培 养,采用贴壁培养方式最终传代至10层细胞培养工厂。将四种质粒按一定比例与转染试剂混 合后转染细胞。转染后72h收获上清液共约965ml。
[0073]
(2)澄清过滤和核酸酶孵育所述慢病毒收获液:使用孔径为1um+0.45um、膜面积为 150cm2囊式滤器对收获液进行过滤。过滤完成后加入merck公司benzonase至终浓度50u/ml, 硫酸镁终浓度为1mmol/l,37℃水浴孵育4h。
[0074]
(3)对所述慢病毒载体澄清收获液采用阴离子交换层析:使用thermofisher公司的 poros pi50阴离子交换层析填料进行纯化,poros pi50的孔径是200nm。使用ge公司 xk16/20层析柱,装载柱体积约20ml。首先使用5cv的ph值为7.5、75mmol/l nacl缓冲 液平衡层析柱;平衡完成后进行上样,上样流速为150cm/h,上样完成后继续使用平衡液冲 洗层析柱直至紫外吸收下降值接近基线,最后使用ph值为7.6、1mol/l nacl浓度的洗脱液 进行洗脱,洗脱流速为150cm/h,观察紫外吸收,收集目标峰,并立即使用9倍体积预冷至 2-8℃的ph值为7.6、不含nacl的稀释液进行稀释。洗脱完成后慢病毒载体样品为210ml。 如图1所
示,其中peak1为上样过程中流穿峰;peak2为目标峰,含慢病毒载体样品;peak3 为层析完成后使用0.5mol/l氢氧化钠溶液对层析柱进行清洗的杂质峰。
[0075]
(4)慢病毒载体样品进行浓缩并将所述慢病毒载体样品中的缓冲体系置换至制剂缓冲 液:使用merck millipore公司孔径为500kd的超滤膜包进行超滤浓缩,浓缩至约20ml左右 后使用最终制剂缓冲液进行换液,连续换液5倍体积,完成后将超滤膜包排空,得到体积为 18ml的慢病毒载体。
[0076]
(5)除菌过滤所述慢病毒载体:在生物安全柜下,使用sartorius公司sartopore 2xlg 除菌滤器进行过滤。过滤膜孔径为0.8um+0.2um,面积为4.5cm2。过滤时设定流速为3ml/min, 并监测过滤压力,最大压力不超过1.5bar。过滤完成后使用约3ml制剂缓冲液对滤器进行冲 洗。最终得到慢病毒载体产品共16ml,1ml/管分装于冻存管中置于-80℃冰箱保存。
[0077]
(6)送样检测:将慢病毒载体中间过程样品及终产品送样检测单位感染滴度、单位物理 滴度(p24)、hcp、bsa、残余宿主dna、残余核酸酶、无菌、rcl(复制型慢病毒)等, 计算工艺总收率并考察最终产品质量。
[0078]
(7)检测结果:结果显示整个纯化工艺感染滴度总收率为44.95%,物理滴度总收率为 60.02%,具体结果见下表。
[0079][0080]
样品总感染滴度=样品体积(ml)
ⅹ
单位感染滴度(iu/ml),
[0081]
感染滴度收率=最终产品总感染滴度/收获液总感染滴度
ⅹ
100%;
[0082]
样品总物理滴度=样品体积(ml)
ⅹ
单位物理滴度(pg/ml),
[0083]
物理滴度收率=最终产品总物理滴度/收获液总物理滴度
ⅹ
100%。
[0084]
杂质项目结果显示hcp《100ng/ml,bsa《100ng/ml,残余宿主dna《40ng/ml,残余核酸 酶《0.25ng/ml,无菌检测阴性,rcl检测阴性,均符合质量标准要求,满足临床上细胞治疗 和基因治疗的使用要求。
[0085]
综上所述,本发明有效克服了现有技术中的种种缺点而具高度产业利用价值。
[0086]
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技 术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡 所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等 效修饰或改变,仍应由本发明的权利要求所涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1