一种新型抗自切甲基化胰蛋白酶及其制备方法与流程
:
[0001]
本发明涉及生物技术领域,具体涉及一种通过甲基化修饰获得的新型抗自切胰蛋白酶及其制备方法。
背景技术:
:
[0002]
胰蛋白酶广泛应用于食品、饲料、医药制造、科学研究等行业。在食品领域,胰蛋白酶可用蛋白质的水解和活性肽的制备,还可用于酒类和饮料的澄清等。在饲料领域,添加胰蛋白酶能增加动物对养分的吸收,改善动物体质。在医药领域,胰蛋白酶可用于抗炎症和消化药物的复配,还可以在创口上使用,能够加快伤口愈合速度。在科学研究领域,胰蛋白酶可用于原代细胞的制备和培养,另外还是是蛋白质组学研究中必不可少的工具酶。蛋白质组学研究,需要使用高纯度、高稳定性的胰蛋白酶,以减少杂质蛋白水解片段和自身水解片段对分析结果的干扰。国际上promega(普洛麦格)公司生产的质谱级胰蛋白酶,几乎垄断了蛋白质组学工具酶市场,产品价格极其昂贵,达到约700元/100μg。我国在蛋白质组学研究所需酶制剂上,对该公司存在很大依赖,迫切需要开发自主知识产权的新型高稳定性胰蛋白酶制剂。
[0003]
胰蛋白酶在应用过程中,不仅会水解底物蛋白,也会快速降解自身蛋白分子,引起酶活力的迅速下降,自切现象制约了胰蛋白酶的水解效率和应用水平。若能提高胰蛋白酶的抗自切能力,将会提高其水解效率,降低应用成本。近年来,化学修饰已经成功地用于增强酶在溶液中热变性和自溶失活的稳定性。目前已有研究采用了一种新型的糖基化方法,将葡萄糖共价吸附到胰蛋白酶的赖氨酸残基上,在提高了胰蛋白酶的热稳定性的同时保持其活性或特异性。也有研究指出,使用化学修饰的固定化胰蛋白酶可以在降低自切的同时保存甚至提高消化效率。因此,通过化学基团修饰提高胰蛋白酶抗自切能力具有重要意义,也为将来实现高稳定胰蛋白酶的大量生产建立了重要的基础。
技术实现要素:
:
[0004]
本发明的目的在于开发一种利用甲基化修饰获得的抗自切胰蛋白酶。
[0005]
本发明的另一目的在于提供一种利用甲基化修饰制备抗自切胰蛋白酶的方法。
[0006]
本发明的第一方面,通过甲基化修饰获得了一种新型的抗自切胰蛋白酶,其抗自切能力相比野生型胰蛋白酶显著增强。
[0007]
本发明第一方面所述的抗自切能力,通过测定甲基化酶孵育自切6小时后的酶活保留率进行评价。自切6小时后的酶活保留率越高,则说明其抗自切性能越优异。胰蛋白酶的甲基化修饰反应,除了可能提高抗自切能力之外,由于其对酶分子空间结构的影响,还会导致酶活上的一定损失,该损失通过测定相比野生型的酶活得率进行评价。所获甲基化酶,相比野生型的酶活得率越高,则说明甲基化修饰反应对胰蛋白酶活力的损伤越小。
[0008]
优选地,通过甲基化修饰所获得的抗自切胰蛋白酶,相比野生型的酶活收率不低于70%,自切6小时后的酶活保留率不小于75%。
[0009]
本发明的第二方面,提供了一种利用甲基化修饰获得抗自切胰蛋白酶的制备方法,包括以下步骤:
[0010]
1)使用含有5mm cacl2的50mm醋酸溶液配制5~15mg/ml的胰蛋白酶。
[0011]
2)混合1m二甲胺硼烷(dmab)溶液和1m甲醛溶液,按1:2体积比配置甲基化试剂。
[0012]
3)取步骤1)配制的胰蛋白酶溶液,并按1000:(15~60)的体积比,添加步骤2)配制的甲基化试剂,在4℃、避光的条件下震荡反应2~4h进行甲基化修饰反应。
附图说明
[0013]
图1甲基化型酶在甲基化过程中的活性产率和6小时保留率的变化曲线
[0014]
图2不同蛋白浓度条件下胰蛋白酶的甲基化修饰效果
[0015]
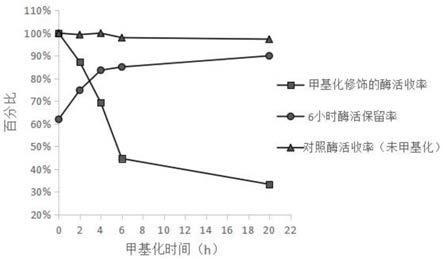
图3不同甲基化试剂添加量条件下胰蛋白酶的甲基化效果
[0016]
图4不同甲基化时间条件下胰蛋白酶甲基化自切效果的比较
具体实施方式:
[0017]
下面结合实施例对本发明的技术内容做进一步说明,但本发明不只限于这些实施例,不能以下述实施例来限定本发明的保护范围。
[0018]
实施例1:甲基化胰蛋白酶酶活收率和抗自切性能的评价方法
[0019]
(1)胰蛋白酶酶活力测定方法
[0020]
以苯甲酰l-精氨酸乙酯(英文缩写为baee)为底物,用紫外吸收法进行测定。baee在波长253nm下的紫外吸收远远弱于苯甲酰l-精氨酸。在胰蛋白酶的催化下,随着酯键的水解,苯甲酰l-精氨酸逐渐增多,反应体系的紫外吸收宜随之相应增加。
[0021]
取2个光程为1厘米的带盖石英比色杯,分别加入25℃预热过的2.8ml底物溶液。向一只比色杯中加入0.2ml 1mm hcl作为空白,使仪器在253nm处的吸光度为零。再在另一比色杯中加入0.2ml待测酶液,立即混匀并记时,每1分钟读数一次,共读3~4min。控制δda253/min在0.05~0.100左右为宜,并绘制酶促反应动力学曲线,从曲线上求出反应起始点吸光度随时间的变化率(即初速度)da253/min。
[0022]
胰蛋白酶活力单位的定义规定为:以baee为底物反应液,浓度1mm,反应条件为ph 8.0,25℃,反应体积3.0ml,光程为1厘米,测定da253下的吸光度,每分钟使da253增加0.001的酶量为一个baee单位。
[0023]
(2)甲基化胰蛋白酶的酶活收率测定方法
[0024]
分别测定胰蛋白酶甲基化修饰前后的酶活力,按照以下公式计算甲基化酶的酶活收率:
[0025]
甲基化酶酶活收率=(甲基化修饰后酶活力/甲基化修饰前酶活力)*100%
[0026]
(3)自切6小时酶活保留率的测定方法
[0027]
分别取野生型胰蛋白酶和甲基化胰蛋白酶溶液,用50mm碳酸氢铵溶液稀释到蛋白质浓度为1mg/ml,并在37℃条件下孵育自切6小时,分别在初始时刻和第6小时取样测定蛋白酶活力,通过以下公式计算自切6小时酶活保留率:
[0028]
甲基化酶自切6小时酶活保留率=(自切第6小时酶活力/初始酶活力)*100%
[0029]
实施例2:甲基化修饰过程对胰蛋白酶酶活收率和抗自切性能的影响
[0030]
对胰蛋白酶进行甲基化修饰20h,对照实验不添加甲基化试剂,替换为含5mm cacl2的50mm的醋酸溶液。在甲基化过程中分别在第0、2、4、6和20h取样测定酶活力收率和6小时酶活保留率,具体方法如下。
[0031]
(1)使用含有5mm cacl2的50mm醋酸溶液配制10mg/ml的胰蛋白酶溶液,取1ml胰蛋白酶溶液进行甲基化修饰;
[0032]
(2)加入20μl的1m dmab和40μl的1m的甲醛溶液;
[0033]
(3)在4℃、避光的条件震荡反应2h,然后取样50μl测定酶活收率和6小时酶活保留率;
[0034]
(4)重复步骤(2)(3)两次;
[0035]
(5)添加10μl的dmab,并在4℃、避光的条件下继续震荡反应14小时;最后取样50ul测定酶活力收率和6小时酶活保留率。
[0036]
酶活力收率和6小时酶活保留率测定结果如附图1所示。甲基化酶相比初始酶活力的酶活力收率,可以反映甲基化修饰反应对酶活力的损伤,而其在最适酶催化条件下的自切6小时后的酶活力保留率,能够反映甲基化酶抗自切能力的改善和稳定性能的提升。由图可知,随着甲基化程度的加深,甲基化酶的酶活力收率不断降低,反映了甲基化修饰反应对酶活力有损伤,且损伤大小与修饰程度呈正相关趋势,其中甲基化第20h时酶活力仅为对照的33%。与此同时所获的甲基化酶的6小时酶活力保留率则不断升高,由对照的平均62%提高到了90%,证明甲基化修饰确实提高了胰蛋白酶的抗自切性能,并且抗自切性能改善大小与修饰程度也呈现正相关趋势。不添加甲基化试剂的对照实验,在长达20小时的时间内,酶活力下降很小,说明含5mm cacl2的50mm醋酸溶液能够很好地保持胰蛋白酶分子的稳定性,抑制胰蛋白酶的自切影响。
[0037]
实施例3:不同甲基化条件对胰蛋白酶甲基化修饰效果的影响
[0038]
考察不同蛋白浓度、甲基化试剂添加量和反应时间对胰蛋白酶甲基化修饰效果的影响。甲基化基本过程为:将胰蛋白酶用含有5mm cacl2的50mm醋酸溶液溶解,取1ml胰蛋白酶溶液加入一定体积的1m dmab和1m甲醛溶液,4℃避光震荡反应一定时间。
[0039]
(1)比较不同胰蛋白酶浓度对其甲基化修饰效果的影响,蛋白质浓度分别为:2.5、5、10、15和20mg/ml。加入10μl 1m dmab溶液和20μl 1m甲醛溶液,4℃避光震荡2h。酶活力收率和6小时酶活保留率如附图2所示。由图可知,甲基化修饰的酶活力收率整体上呈现先升高后下降的趋势,蛋白浓度5-15mg/ml蛋白浓度在2.5-10mg/ml时,甲基化酶的6小时酶活力保留率没有明显差异,但是高于10mg/ml后略有下降。
[0040]
(2)比较甲基化试剂添加量对胰蛋白酶甲基化修饰效果的影响。1m dmab溶液的添加量分别为:15、30、60、90和150μl,1m甲醛溶液添加体积保持为1m dmab溶液的2倍。其他条件为:10mg/ml胰蛋白酶溶液,添加甲基化试剂后4℃避光震荡2h。酶活力收率和6小时酶活保留率如附图3所示。由图可知,随着甲基化试剂添加量的增加,甲基化酶的酶活收率不断下降,反映了甲基化反应对酶活力的损伤与甲基化试剂添加量呈正相关趋势,其中甲基化试剂添加90μl时,酶活力收率降为71%。而甲基化酶的6小时酶活力保留率则呈现不断上升趋势,证明了甲基化程度的升高有助于提高甲基化酶的抗自切能力,其中甲基化试剂添加90μl时,6小时酶活力保留率升高至80%。添加量高于90μl后,6小时酶活力保留率升高幅度变缓。
[0041]
(3)比较不同甲基化反应时间对胰蛋白酶甲基化修饰效果的影响。甲基化时间分别为:0、1、2、3、4h。其他条件为:10mg/ml的胰蛋白酶样品,加入10μl1m dmab溶液和20μl 1m甲醛溶液,4℃避光震荡反应。酶活力收率和6小时酶活保留率如附图4所示。由图可知,随着反应时间的延长,甲基化酶的酶活力收率不断下降,而其6小时酶活力的保留率则不断升高。其中反应3小时条件下,所获甲基化酶的酶活收率和6小时酶活保留率分别达了约78%和79%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1