重组蛋白纯化方法与流程
1.本发明涉及生物技术领域,具体地,本发明涉及一种重组蛋白纯化方法。
背景技术:
2.重组蛋白下游纯化中采用的捕获工艺,不仅是通过优化哺乳动物细胞表达系统使产生的抗体滴度增加而受到最严重影响的过程,而且也是决定整体产量、产品质量和经济成本的最重要的纯化步骤。亲和层析由于其高选择性而常规用于蛋白纯化工艺的第一捕获步骤,产生良好的总体产量和纯度。然而,对于哺乳动物细胞(cho)表达的没有亲和标签的重组蛋白不能通过亲和层析纯化,只能利用蛋白本身的电荷,疏水等特性开发纯化工艺;重组蛋白在选用离子填料纯化时,由于细胞培养上清电导过高,需要经过换液或稀释降低电导,这在大规模纯化中会增加很多场地、设备及人力成本。
3.因此,亟需开发一种简单高效、节省成本的重组蛋白纯化方法。
技术实现要素:
4.本发明旨在至少在一定程度上解决相关技术中的技术问题之一。为此,本发明的一个目的在于提供一种重组蛋白纯化方法,该方法采用混合模式层析,以阳离子复合填料作为层析柱的填料,其配基可在高电导值下直接进样,即样品在较高电导时不必换液能直接上样并保持较高的载量,采用的ph线性洗脱方式在复合模式填料上能获得更好的分辨率,一步层析就能获得95%的纯度(sec-hplc),而现有的采用盐浓度梯度洗脱单步纯化后纯度仅能达到86%。
5.为此,本发明第一方面提供一种重组蛋白纯化方法。根据本发明的实施例,所述方法包括以下步骤:
6.将含有所述重组蛋白的待纯化样品上样至层析柱,利用洗脱缓冲液对层析柱进行洗脱处理,以便获得含有所述重组蛋白的洗脱液,收集洗脱峰;
7.所述重组蛋白的等电点为5~7;
8.所述层析柱的填料为适用于混合模式层析的填料;
9.所述洗脱处理的洗脱模式为ph线性洗脱和/或ph梯度洗脱。
10.在本发明中,洗脱处理的洗脱模式用ph线性洗脱,也可以根据线性洗脱结果转换到ph梯度洗脱。
11.由于哺乳动物细胞cho细胞表达的重组蛋白没有亲和标签,无法使用亲和层析,其他层析方式对宿主细胞蛋白(hcp)的清除效果又不及亲和层析,并且细胞培养液上清成分复杂,电导高,使用离子层析需要针对上清换液,增加工艺复杂性及成本。采用本发明提供的重组蛋白纯化方法,样品在较高电导时不必换液能直接上样并保持较高的载量40mg/ml。并且,本发明提供的重组蛋白纯化方法也同样适用于具有亲和标签的重组蛋白的纯化。
12.离子层析及含有离子模式的多模式层析一般依靠盐浓度洗脱,但盐浓度洗脱分辨率不足,部分蛋白的分离效果不佳。本发明采用ph线性洗脱替代盐浓度梯度洗脱,获得了更
好的分离效果,并且采用ph线性洗脱获得的目的(重组)蛋白纯度远高于采用盐浓度梯度洗脱方式。
13.根据本发明实施例的重组蛋白纯化方法,还可以具有以下附加技术特征的至少之一:
14.根据本发明的实施例,所述待纯化样品为表达所述重组蛋白的哺乳动物细胞培养液;
15.任选地,所述哺乳动物细胞选自cho细胞、hek293细胞中的任意一种。
16.根据本发明的实施例,所述方法进一步包括在上样之前,对所述细胞培养液进行预处理,所述预处理包括酸沉淀;
17.任选地,所述酸为乙酸和/或柠檬酸。
18.细胞培养液成分复杂,一般需要经离心及过滤或深层过滤步骤去除细胞及细胞碎片等颗粒物质,操作复杂,本发明采用酸沉淀的方式对细胞培养液进行预处理,使hcp(宿主细胞蛋白)得到大幅度降低。
19.根据本发明的实施例,所述酸沉淀的ph范围为ph4.2~4.8,优选为ph4.4~4.6,进一步优选为ph4.5。
20.酸沉淀的ph过高,则导致hcp去除效果不佳;若酸沉淀的ph过低,则会导致目的蛋白不稳定,容易发生沉淀或其他的结构变化。
21.根据本发明的实施例,所述适用于混合模式层析的填料为阳离子复合填料;
22.任选地,所述阳离子复合填料选自eshmuno hcx、capto mmc和capto mmc impres中的至少之一。
23.捕获层析填料可以选用不同公司的阳离子复合填料,如ge的capto mmc。
24.根据本发明的实施例,所述洗脱缓冲液的电导值为8~15ms/cm,优选为8~12ms/cm,ph为4.5~8.5。
25.根据本发明的实施例,所述洗脱缓冲液中的缓冲剂选自磷酸盐、乙酸盐、柠檬酸盐、碳酸盐、tris中的至少之一,还包括可溶性钠盐、可溶性钾盐。
26.根据本发明的实施例,所述洗脱缓冲液的缓冲剂组成可以是napo4、naac、tris以及nacl。
27.napo4指na2hpo4和nah2po4两种试剂按一定比例混合使最终ph为特定ph(如4.5)的试剂。所述缓冲剂的浓度可根据本领域常规使用浓度,也可以进行适当的调整。
28.根据本发明的实施例,所述方法还包括在上样前利用平衡缓冲液进行柱平衡的步骤;
29.任选地,所述平衡缓冲液电导值为8~12ms/cm,ph4.2~ph4.8,优选为ph4.4~4.6;
30.任选地,所述平衡缓冲液的缓冲剂选自磷酸盐、乙酸盐、柠檬酸盐、碳酸盐、tris中的至少之一,还包括可溶性钠盐、可溶性钾盐。
31.进行柱平衡使得层析柱维持在接近样品的ph和电导值。
32.根据本发明的实施例,所述方法进一步包括在将所述待纯化样品上样至层析柱时,利用再平衡缓冲液进行再平衡的步骤;
33.任选地,所述再平衡缓冲液与所述平衡缓冲液组成相同。再平衡的步骤可冲洗掉
柱子中残留的未与柱子结合的杂质。
34.根据本发明的实施例,所述洗脱缓冲液的线性流速为100~200cm/h。
35.在本发明中,目的蛋白/重组蛋白是指利用基因重组技术,选择合适的表达系统生产的蛋白,此处指哺乳动物细胞表达的重组蛋白。
36.捕获/捕获层析是指从细胞培养液中分离出目的蛋白,去除大部分杂质,是相对于后续精纯(进一步去除微量杂质)而言。
37.梯度洗脱/线性洗脱是指洗脱时并不是以一种溶液洗脱,而是两种溶液以一定比例混合,而这个比例逐渐变化,是混合后的溶液逐渐达到合适的洗脱条件。
38.哺乳动物细胞表达系统表达的没有亲和标签的目的蛋白,无法使用亲和层析,其他层析方式对宿主细胞蛋白(hcp)的清除效果不及亲和层析,hcp的控制在工艺中成为一个难题。无法使用亲和层析,细胞培养液上清成分复杂,电导高,使用离子层析需要针对上清换液,增加工艺复杂性及成本。离子层析及含有离子模式的多模式层析一般的依靠盐浓度洗脱,但盐浓度洗脱分辨率不足,部分蛋白的分离效果不佳。
39.混合模式层析(mixed-mode chromatography,mmc)是一种新型的生物分离方法,其配基兼有疏水,静电,氢键等多种相互作用,具有吸附容量高,选择性好,洗脱条件温和等特点,可以用来替代经典亲和层析方法。
40.本发明的发明人为解决上述问题,提供一种重组蛋白纯化方法,该方法采用混合模式层析,对细胞培养液进行预处理的步骤使hcp(宿主细胞蛋白)得到大幅度降低(降低50%左右),以阳离子复合填料(capto mmc复合型填料)作为层析柱的填料,其配基可在高电导值下直接进样,即样品在较高电导时不必换液能直接上样并保持较高的载量40mg/ml,相比之下,采用阳离子填料sp hp在同样电导条件下载量低于5mg/ml;采用的ph线性洗脱方式在复合模式填料上能获得更好的分辨率,一步层析就能获得95%的纯度(sec-hplc),而盐浓度梯度洗脱单步纯化后纯度仅能达到86%。
41.本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
42.本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
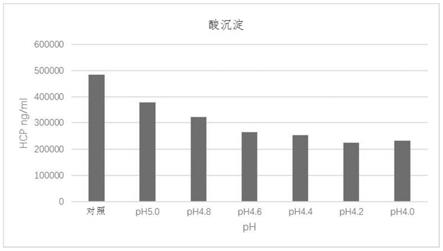
43.图1显示了不同ph值的酸对细胞培养液进行预处理,获得的上清中hcp(宿主细胞蛋白质)浓度;
44.图2显示了对比例1中capto mmc捕获层析盐浓度梯度洗脱结果;
45.图3显示了实施例2中capto mmc捕获层析ph线性洗脱结果。
具体实施方式
46.根据本发明的一些具体的实施方案,本发明提供的一种重组蛋白纯化方法包括以下步骤:
47.1)样品澄清:两步离心法去除细胞及碎片颗粒,先用1000g离心10min,移取上清于6000g离心30min,收集上清;
48.2)样品预处理:在上清中滴加5m乙酸调节ph至4.2~4.8,孵育5~30min;
49.3)捕获层析:
50.填料:capto mmc(ge)
51.柱平衡:缓冲液组成:25mm napo4(na2hpo4和nah2po4两种试剂按一定比例混合使最终ph为4.5的试剂),50mm naac,25mm tris,60mm nacl,ph4.5,平衡缓冲液电导值为8~12ms/cm;
52.上样:预处理后的样品加载到capto mmc纯化柱上,培养液的电导值不做额外调整,为9~11ms/cm;
53.再平衡:缓冲液组成:25mm napo4,50mm naac,25mm tris,60mm nacl,ph4.5;
54.洗脱缓冲液组成:25mm napo4,50mm naac,25mm tris,60mm nacl,ph 4.5~8.5,洗脱缓冲液的电导值为8~15ms/cm;
55.线性流速(流率):100~200cm/h;
56.收集洗脱峰。
57.样品预处理方法还可以使用辛酸沉淀技术。样品澄清步骤的两步离心法可以使用一次性深层过滤器(merck 20ms)替代。样品澄清步骤在中等规模生产中常使用一次性深层过滤器,但在小规模样品制备时,常常没有合适规格的滤器,两步离心将被应用。层析填料选用能够耐受高盐上样的复合模式填料,洗脱模式选用ph线性洗脱替代盐浓度梯度洗脱,能够获得更好的分离效果。下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
58.实施例1细胞培养液预处理步骤酸的ph值优化
59.细胞培养液为表达fibrolase的cho细胞培养液,fibrolase具有202个氨基酸,pi 5.32。
60.fibrolase氨基酸序列如seq id no:2所示:
61.erfapryielvivadhsvatkyndnvtailswvhqlvnniilfyrdlnvhftlsavevwsngdlinvqpeatvtlnlfgewrerdllnrrmhdnaqllnnvalddntiglaydegmcdpkysvgivkdhsainrmvaatmaheighnlgmnhdgsqcncggngcvmsavlmqqhsyqfsdcskdeyqryltnhnpqcilnqp
62.编码fibrolase的核酸序列如seq id no:1所示:
63.gaacgctttgcgccgcgctatattgaactggtgattgtggcggatcatagcgtggcgaccaaatataacgataacgtgaccgcgattctgagctgggtgcatcagctggtgaacaacattattctgttttatcgcgatctgaacgtgcattttaccctgagcgcggtggaagtgtggagcaacggcgatctgattaacgtgcagccggaagcgaccgtgaccctgaacctgtttggcgaatggcgcgaacgcgatctgctgaaccgccgcatgcatgataacgcgcagctgctgaacaacgtggcgctggatgataacaccattggcctggcgtatgatgaaggcatgtgcgatccgaaatatagcgtgggcattgtgaaagatcatagcgcgattaaccgcatggtggcggcgaccatggcgcatgaaattggccataacctgggcatgaaccatgatggcagccagtgcaactgcggcggcaacggctgcgtgatgagcgcggtgctgatgcagcagcatagctatcagtttagcgattgcagcaaagatgaatatcagcgctatctgaccaaccataacccgcagtgcattctgaaccagccg
64.cho细胞培养液:合成的fibrolase基因序列插入表达载体pcmv,构建表达质粒,
pei试剂转染质粒到cho细胞,扩大培养获取细胞培养液。
65.蛋白捕获方法步骤如下:
66.1)样品澄清:两步离心法去除细胞及碎片颗粒,先用1000g离心10min,移取上清于6000g离心30min,收集上清;
67.2)样品预处理:细胞收获时在搅拌状态下往培养液中滴加5m乙酸调节ph,孵育30min。
68.在细胞培养液预处理步骤中,利用乙酸分别将细胞培养液ph调节至4.0、4.2、4.4、4.6、4.8、5.0。通过hcp elisa检测试剂盒(购自cygnus)检测宿主细胞蛋白质,设置未进行酸沉淀的对照样品。
69.附图1中结果显示,细胞培养液用酸沉淀技术预处理后上清中hcp(宿主细胞蛋白质)能大幅降低,随着ph降低,hcp逐渐下降,但下降到ph4.6后hcp不再有明显下降,因此,酸沉淀的ph范围为ph4.2~4.8。考虑到维持目的蛋白稳定性,选用ph4.5作为酸沉淀的最终ph。
70.实施例2ph线性洗脱
71.细胞培养液为表达fibrolase的cho细胞培养液,蛋白捕获方法步骤如下:
72.1)样品澄清:两步离心法去除细胞及碎片颗粒,先用1000g离心10min,移取上清于6000g离心30min,收集上清30min;
73.2)样品预处理:往上清滴加5m乙酸调节ph至4.5,孵育30min;
74.3)捕获层析:
75.填料:capto mmc(ge);
76.柱平衡:平衡缓冲液:25mm napo4,50mm naac,25mm tris,60mm nacl,ph4.5,平衡缓冲液电导值为10ms/cm;
77.上样:预处理后的样品加载到capto mmc纯化柱上,培养液的电导值不做额外调整,为9~11ms/cm;
78.再平衡:平衡缓冲液:25mm napo4,50mm naac,25mm tris,60mm nacl,ph4.5;
79.洗脱:
80.洗脱缓冲液a:25mm napo4,50mm naac,25mm tris,60mm nacl,ph4.5;
81.洗脱缓冲液b:25mm napo4,50mm naac,25mm tris,60mm nacl,ph8.5;
82.洗脱过程中通过调节洗脱缓冲液a和洗脱缓冲液b的比例,洗脱缓冲液b的比例在0~100%之间变化,使洗脱缓冲液的ph在4.5~8.5之间呈线性变化,进行ph线性洗脱,洗脱缓冲液的电导值为10ms/cm;
83.线性流速(流率):200cm/h;
84.收集洗脱峰。
85.对比例1盐线性洗脱
86.细胞培养液为表达fibrolase的cho细胞培养液,蛋白捕获方法步骤如下:
87.1)样品澄清:两步离心法去除细胞及碎片颗粒,先用1000g离心10min,移取上清于6000g离心30min,收集上清30min;
88.2)样品预处理:往上清滴加5m乙酸调节ph至4.5,孵育30min;
89.3)捕获层析:
90.填料:capto mmc(ge);
91.柱平衡:平衡缓冲液:50mm naac,60mm nacl,ph4.5;
92.上样:预处理后的样品加载到capto mmc纯化柱上,培养液的电导值不做额外调整,为9~11ms/cm;
93.再平衡:平衡缓冲液:50mm naac,60mm nacl,ph4.5;
94.洗脱:
95.洗脱缓冲液a:50mm naac,60mm nacl,ph4.5;
96.洗脱缓冲液b:50mm naac,1m nacl,ph4.5;
97.洗脱过程中,通过调节洗脱缓冲液a、洗脱缓冲液b的比例,洗脱缓冲液b的比例在0~100%之间变化,使洗脱缓冲液的盐浓度呈线性变化,进行盐线性洗脱;
98.线性流速(流率):100~200cm/h;
99.收集洗脱峰。
100.对比例1盐线性洗脱结果如附图2所示,实施例2ph线性洗脱结果如附图3所示。另外,将上述实施例2中的填料替换为sp hp(普通阳离子填料)进行蛋白纯化。
101.选用不同填料及洗脱条件获得的重组蛋白纯度和回收率如下表1所示:
102.表1不同填料及洗脱条件对比
[0103][0104]
表1中结果表明,复合模式填料比普通离子填料有更高的载量,适合用于此类蛋白纯化。复合模式填料的洗脱模式有盐线性洗脱和ph线性洗脱,尽管两种洗脱方式重组蛋白回收率相当,但ph洗脱具有更好的分辨率,获得的蛋白纯度更高。
[0105]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
[0106]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1