具有抗炎作用的蛋白及其制备方法和用途与流程
本发明涉及生物技术领域,特别是涉及一种具有抗炎作用的蛋白及其制备方法和用途。
背景技术:
结核病是由结核分枝杆菌复合群(mycobacteriumtuberculosiscomplex,mtc)感染引起的一种慢性、消耗性传染疾病,同时也是一种可以引起动物和人类共同感染的人兽共患疾病。近年来,世界范围内艾滋病的流行及其耐药性的日益严重,结核病流行趋势又有所回升。结核病仍是一个全球性的需要高度重视的公共卫生和社会问题。
tlrs信号通路作为机体固有免疫的第一道屏障,通过诱导产生炎性因子和干扰素来清除病原体,维持机体内环境的稳定。结核分枝杆菌在进入机体后可以快速激活机体的天然免疫系统,由巨噬细胞、树突状细胞等免疫细胞以及内皮细胞系统产生大量的炎性因子(如tnf-α、il-1β、il-6、i型ifn等),一方面直接杀死和消除入侵结核分枝杆菌,一方面诱导针对结核分枝杆菌的特异性获得性免疫。
然而,tlrs的活化后产生过多的炎性因子会导致各种炎症性疾病和自身免疫病。机体过度的炎性反应导致机体自身的损伤,在此过程中,免疫细胞表面的tlrs介导的炎性反应是其致病机理的重要环节。因此,tlr信号通路的活化必须受到严格的调控,防止其过度活化,尤其是炎性因子的过度产生。目前的研究表明很多跨膜和胞内分子都能够负调节tlr信号通路,抑制炎性通路的活化和炎性因子的产生。大量研究已经表明,抑制tlr信号传导的各个环节可以有效地控制细菌感染所导致的炎症反应,预防和治疗细菌感染导致的休克、器官功能损伤等严重的后果。
综上所述,本领域迫切需要开发出一种可有效抑制分枝杆菌感染诱导过量炎性因子产生的免疫学活性物质。
技术实现要素:
鉴于以上所述现有技术的缺点,本发明的目的在于提供一种具有抗炎作用的蛋白及其制备方法和用途,用于解决现有技术中缺乏有效的降低炎性因子的问题。
为实现上述目的及其他相关目的,本发明提供一种分离的蛋白,所述蛋白的氨基酸序列包括seqidno:1所示的多肽或者其保守变异性多肽。seqidno:1所示序列具体为:
mildmfrlddkvavitgggrglgaaialafaqagadvliasrtsseldavaeqiraagrrahtvaadlahpevtaqlagqavgafgkldivvnnvggtmpntllststkdladafafnvgtahaltvaavplmlehsgggsvinisstmgrlaargfaaygtakaalahytrlaaldlcprvrvnaiapgsiltsalevvaandelrapmeqatplrrlgdpvdiaaaavylaspagsfltgktlevdggltfpnldlpipdl。
在本发明的实施例中,将本发明的蛋白,取名为rv0927c。
本发明第二方面提供了一种分离的多核苷酸,其编码如上所述蛋白。
本发明的多核苷酸可以是dna形式或rna形式。dna形式包括cdna、基因组dna或人工合成的dna。dna可以是单链的或是双链的。
进一步的,所述多核苷酸序列如seqidno:2所示,具体为:atgatcctggatatgttccgtcttgacgacaaggttgccgtcatcaccggcggcggccgcggcctgggagcagccatcgcattggctttcgcccaggccggcgcggatgtcctcatcgcttcacgaacatcatccgagcttgacgctgtcgccgaacagatccgcgctgccggccgccgcgcccacaccgttgccgccgatctggcccatcccgaggtgaccgcgcagctggctggtcaggccgtcggagctttcgggaagctcgacatcgtcgtcaacaacgttggcggcaccatgcccaacacgctgctaagcacctcgaccaaggacctcgcggacgccttcgccttcaacgtgggcaccgcccacgcgctgaccgtcgcggcggtgccgttgatgctggaacactccggcggcggcagcgtgatcaacatcagctccaccatgggccggctggcggcgcggggtttcgccgcctacggcaccgccaaggccgcactggcccactacacccggctggcggcgctggacctgtgcccacgcgtccgggtcaatgcgatcgcgccgggttccatcctgacctcggcgctggaggtggtagccgccaacgacgagctgcgtgcgccgatggagcaggcgacaccactgcgccggctcggtgaccccgtcgacattgcagctgcggcagtgtatttggcctctccggcgggcagcttcctgaccggcaagacgttggaggtcgacggcggactcaccttccccaatctcgaccttcccattccggacctgtga
本发明第三方面提供了一种表达载体,所述表达载体含有前述多核苷酸。
本领域的技术人员熟知的方法能用于构建所述表达载体。这些方法包括重组dna技术、dna合成技术等。可将编码所述蛋白的dna有效连接到表达载体中的适当启动子上,以指导mrna合成,进而表达蛋白。
较佳的,所述表达载体为原核表达载体和分枝杆菌表达载体。进一步的,所述原核表达载体可在大肠杆菌内稳定表达,如原核载体pet32a等。所述分枝杆菌表达载体可在耻垢分枝杆菌中稳定表达,如分枝杆菌载体pmv261。
本发明第四方面提供了一种宿主细胞,所述宿主细胞内含有或者整合有上述表达载体。
宿主细胞可以是原核细胞,如细菌细胞。代表性例子有:大肠杆菌、耻垢分枝杆菌等。
本发明的实施例中,采用的宿主细胞为大肠杆菌和耻垢分枝杆菌。
本发明第五方面提供了上述蛋白的制备方法,所述方法选自以下任一:
a)利用化学合成的方法合成蛋白;或
b)在适合表达所述蛋白的条件下,培养上述宿主细胞,从培养物中分离出所述蛋白。
从培养物中分离出具有抗炎作用的蛋白的方法可采用镍柱纯化法提取。
本发明第六方面提供了本发明前述分离的蛋白、前述分离的多核苷酸、前述表达载体、或前述宿主细胞在制备抗炎药物中的用途。
较佳的,所述用途中抗炎药物具体是指干扰tlr信号通路并抑制炎性细胞因子分泌的药物。
本发明第七方面,提供了一种抗炎药物组合物,所述组合物包含如上所述蛋白、前述分离的多核苷酸、前述表达载体、或前述宿主细胞。
进一步的,所述药物组合物还包括药学上可接受的载体或赋形剂。
本领域枝术人员已知的治疗惰性的无机或有机的载体或赋形剂包括(但不限于)乳糖、玉米淀粉或其衍生物、滑石、植物油、蜡、脂肪、多羟基化合物例如聚乙二醇、水、蔗糖、乙醇、甘油,诸如此类,各种防腐剂、润滑剂、分散剂、矫味剂。保湿剂、抗氧化剂、甜味剂、着色剂、稳定剂、盐、缓冲液诸如此类也可加入其中,这些物质根据需要用于帮助配方的稳定性或有助于提高活性或它的生物有效性或在口服的情况下产生可接受的口感或气味。
进一步的,所述抗炎药物组合物的抗炎活性成分含有所述蛋白。
较佳的,所述蛋白为所述抗炎药物组合物的唯一抗炎活性成分。
如上所述,本发明的具有抗炎作用的蛋白及其制备方法和用途,具有以下有益效果:
本发明的小分子蛋白(rv0927c),不会产生过度的免疫排斥反应;其次,rv0927c对tlr信号通路的干扰作用存在剂量依赖关系,通过降低作用浓度使其产生适度的抑制,但却不损害宿主的防御能力,以避免过度抑炎反应造成的副作用。rv0927c与临床所应用的抗炎症因子抗体不同的是,它们针对的不是单一一种致炎因子,而是多种因子、多条途径,利于损伤组织的修复。
附图说明
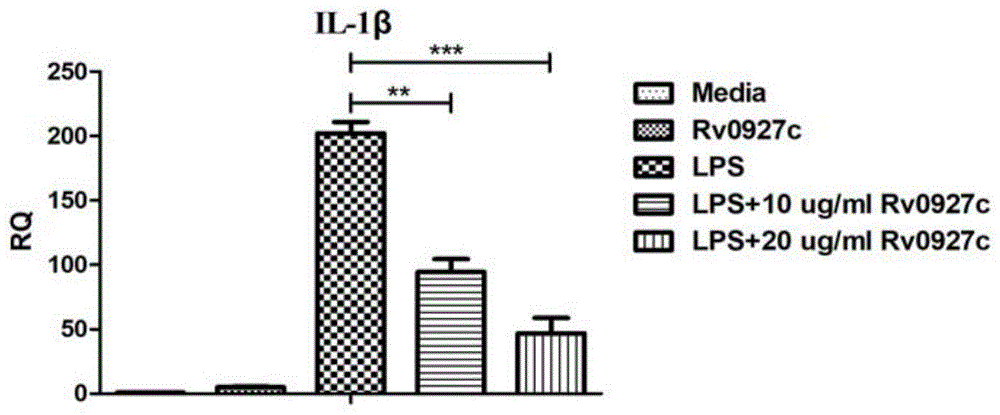
图1a显示rv0927c重组蛋白抑制lps诱导巨噬细胞炎性因子il-1β的转录水平。
图1b显示rv0927c重组蛋白抑制lps诱导巨噬细胞炎性因子il-6的转录水平。
图1c显示rv0927c重组蛋白抑制lps诱导巨噬细胞炎性因子tnf-α的转录水平。
图2a显示rv0927c过表达抑制耻垢分枝杆菌诱导巨噬细胞炎性因子il-1β的表达。
图2b显示rv0927c过表达抑制耻垢分枝杆菌诱导巨噬细胞炎性因子il-6的表达。
图2c显示rv0927c过表达抑制耻垢分枝杆菌诱导巨噬细胞炎性因子tnf-α的表达。
图3a显示rv0927c过表达下调耻垢分枝杆菌感染小鼠血清炎性因子il-6的表达。
图3b显示rv0927c过表达下调耻垢分枝杆菌感染小鼠血清炎性因子tnf-α的表达。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见sambrook等molecularcloning:alaboratorymanual,secondedition,coldspringharborlaboratorypress,1989andthirdedition,2001;ausubel等,currentprotocolsinmolecularbiology,johnwiley&sons,newyork,1987andperiodicupdates;theseriesmethodsinenzymology,academicpress,sandiego;wolffe,chromatinstructureandfunction,thirdedition,academicpress,sandiego,1998;methodsinenzymology,vol.304,chromatin(p.m.wassarmananda.p.wolffe,eds.),academicpress,sandiego,1999;和methodsinmolecularbiology,vol.119,chromatinprotocols(p.b.becker,ed.)humanapress,totowa,1999等。
实施例1重组rv0927c蛋白抑制lps诱导炎性细胞因子的表达
⑴重组rv0927c蛋白的原核表达及鉴定
首先,设计带有ecori和hindiii双酶切位点的引物:
正向引物:5'-gctgatatcggatccgaattcatgatcctggatatgttccgtctt-3'(seqidno:3)
反向引物:5'-ctcgagtgcggccgcaagctttcacaggtccggaatggga-3'(seqidno:4)
然后,从结核分枝杆菌(购自atcc)中提取基因组为模板,以seqidno:3和seqidno:4的序列为扩增引物pcr扩增rv0927c(序列如seqidno:2所示)基因后进行琼脂糖凝胶电泳回收,将rv0927c产物连接到pet32a质粒(购自novagen公司)上,随后转化dh5α(购自takar公司),并涂布抗性lb固体培养基进行筛选。挑取阳性克隆进行鉴定,测序(南京金斯瑞生物科技有限公司)正确后得到原核表达质粒pet32a-rv0927c。确认结果显示,原核表达质粒pet32a-rv0927c中,rv0927c基因表达序列如seqidno:2所示。
挑取阳性单菌落,置于4ml氨苄西林抗性的lb液体培养基中,于37℃恒温摇床中培养过夜。次日,将重组菌按1:100比例接种至氨苄西林抗性lb液体培养基中,于37℃恒温摇床中培养od值在0.4-0.6之间,并加入iptg至终浓度为0.5mmol/l,于恒温摇床中37℃150rpm诱导6h。离心收集菌体,使用无菌pbs洗涤三次。在冰水混合物中使用超声波裂解仪裂解菌体(30w,裂解3s,间隔5s)。随后10000rpm10min离心收集上清。将离心后的上清取出,沉淀用等体积的无菌pbs重悬。离心后收集的上清使用ni-agarosehis标签蛋白纯化试剂盒进行纯化。首先将柱子进行预处理,依次加入7.5ml的灭菌超纯水、12.5mlchargebuffer和7.5mlbindingbuffer冲洗带his标签的纯化柱,然后加样过柱,最后加25mlbindingbuffer、15mlwashingbuffer和15mlelutebuffer,盖上塞子室温静置20min,无菌1.5ml指形管收集纯化蛋白,并分别进行sds-page和westernblot分析。此外,进行测序确认。所表达的蛋白氨基酸序列正确。具体如seqidno:1所示。
⑵重组rv0927c蛋白抑制tlr4介导的炎性细胞因子分泌表达
将小鼠巨噬细胞j774a.1(购自atcc)铺24孔细胞板,加入不同浓度的重组rv0927c蛋白(去内毒素)进行刺激培养,同时设立未刺激对照组。培养5h后,再加入lps继续进行刺激培养,收集细胞提取rna,对il-1β、il-6、tnf-α等炎性细胞因子的转录水平进行测定。结果显示,rv0927c能够显著抑制il-1β、il-6和tnf-α的转录水平(图1)。
实施例2rv0927c蛋白过表达抑制重组耻垢分枝杆菌诱导宿主炎性因子的表达
⑴重组耻垢rms::pmv261-rv0927c的构建及鉴定
首先,设计带有bamhi和ecori双酶切位点的引物:
正向引物:5'-tcggatccatgatcctggatatgttc-3'(seqidno:5)
反向引物:3'-aagggtaaggcctggacgtagtagtggtagtagtgactcttaagat-5'(seqidno:6)
然后,从结核分枝杆菌中提取基因组为模板,以seqidno:5和seqidno:6的序列为扩增引物pcr扩增rv0927c(序列如seqidno:2所示)基因后进行琼脂糖凝胶电泳回收,将纯化回收的rv0927c扩增产物克隆入pmd20t载体(购自takar公司),并转化dh5α感受态细菌,进行蓝白斑筛选、酶切及电泳鉴定。将鉴定正确的重组质粒命名为pmd20t-rv0927c,并将阳性克隆送南京金斯瑞公司测序。将送测序正确的dh5α(pmd20t-rv0927c)进行扩大培养,挑取单菌落,分别接种相应抗生素的lb液体培养基中,置37℃恒温摇床中培养过夜。次日,提取质粒,然后进行双酶切和胶回收。将纯化回收的rv0927c扩增产物克隆入pmv261,然后转化至dh5α感受态细菌,经酶切和测序鉴定,得到重组质粒pmv261-rv0927c。随后将重组质粒电转至耻垢分枝杆菌感受态中。挑取电击转化后生长的单菌落进行pcr鉴定,鉴定成功的菌株命名为rms::pmv261-rv0927c。
⑵过表达rv0927c重组耻垢分枝杆菌抑制宿主炎性因子表达
培养小鼠raw264.7巨噬细胞(购自atcc),按照moi数10:1加入重组菌rms::pmv261-rv0927c感染细胞,以rms::pmv261空载体菌为对照组,收集细胞上清,对il-1β、il-6、tnf-α等炎性细胞因子的蛋白表达水平进行测定。结果显示,与rms::pmv261空载体菌相比,重组菌rms::pmv261-rv0927c组il-1β、il-6和tnf-α的分泌水平出现了显著下调(图2)。
实施例3rv0927c蛋白过表达下调重组耻垢分枝杆菌感染小鼠血清炎性因子的表达
分别使用rms::pmv261-rv0927c过表达菌、rms::pmv261空载体菌感染c57bl/6小鼠,并设立3天和12天感染时间组,收集小鼠血清对炎性细胞因子分泌水平进行测定。
结果显示,rv0927c基因过表达菌感染12天后,耻垢分枝杆菌诱导血清中炎性因子il-6和tnf-α的分泌水平出现了显著下调(图3)。
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法、组合物的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
序列表
<110>扬州大学
<120>具有抗炎作用的蛋白及其制备方法和用途
<160>6
<170>siposequencelisting1.0
<210>1
<211>263
<212>prt
<213>人工序列(artificialsequence)
<400>1
metileleuaspmetpheargleuaspasplysvalalavalilethr
151015
glyglyglyargglyleuglyalaalailealaleualaphealagln
202530
alaglyalaaspvalleuilealaserargthrsersergluleuasp
354045
alavalalagluglnileargalaalaglyargargalahisthrval
505560
alaalaaspleualahisprogluvalthralaglnleualaglygln
65707580
alavalglyalapheglylysleuaspilevalvalasnasnvalgly
859095
glythrmetproasnthrleuleuserthrserthrlysaspleuala
100105110
aspalaphealapheasnvalglythralahisalaleuthrvalala
115120125
alavalproleumetleugluhisserglyglyglyservalileasn
130135140
ileserserthrmetglyargleualaalaargglyphealaalatyr
145150155160
glythralalysalaalaleualahistyrthrargleualaalaleu
165170175
aspleucysproargvalargvalasnalailealaproglyserile
180185190
leuthrseralaleugluvalvalalaalaasnaspgluleuargala
195200205
prometgluglnalathrproleuargargleuglyaspprovalasp
210215220
ilealaalaalaalavaltyrleualaserproalaglyserpheleu
225230235240
thrglylysthrleugluvalaspglyglyleuthrpheproasnleu
245250255
aspleuproileproaspleu
260
<210>2
<211>792
<212>dna
<213>人工序列(artificialsequence)
<400>2
atgatcctggatatgttccgtcttgacgacaaggttgccgtcatcaccggcggcggccgc60
ggcctgggagcagccatcgcattggctttcgcccaggccggcgcggatgtcctcatcgct120
tcacgaacatcatccgagcttgacgctgtcgccgaacagatccgcgctgccggccgccgc180
gcccacaccgttgccgccgatctggcccatcccgaggtgaccgcgcagctggctggtcag240
gccgtcggagctttcgggaagctcgacatcgtcgtcaacaacgttggcggcaccatgccc300
aacacgctgctaagcacctcgaccaaggacctcgcggacgccttcgccttcaacgtgggc360
accgcccacgcgctgaccgtcgcggcggtgccgttgatgctggaacactccggcggcggc420
agcgtgatcaacatcagctccaccatgggccggctggcggcgcggggtttcgccgcctac480
ggcaccgccaaggccgcactggcccactacacccggctggcggcgctggacctgtgccca540
cgcgtccgggtcaatgcgatcgcgccgggttccatcctgacctcggcgctggaggtggta600
gccgccaacgacgagctgcgtgcgccgatggagcaggcgacaccactgcgccggctcggt660
gaccccgtcgacattgcagctgcggcagtgtatttggcctctccggcgggcagcttcctg720
accggcaagacgttggaggtcgacggcggactcaccttccccaatctcgaccttcccatt780
ccggacctgtga792
<210>3
<211>45
<212>dna
<213>人工序列(artificialsequence)
<400>3
gctgatatcggatccgaattcatgatcctggatatgttccgtctt45
<210>4
<211>40
<212>dna
<213>人工序列(artificialsequence)
<400>4
ctcgagtgcggccgcaagctttcacaggtccggaatggga40
<210>5
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>5
tcggatccatgatcctggatatgttc26
<210>6
<211>46
<212>dna
<213>人工序列(artificialsequence)
<400>6
aagggtaaggcctggacgtagtagtggtagtagtgactcttaagat46
- 还没有人留言评论。精彩留言会获得点赞!