一种新型铜双核结构金属配合物、其制备方法及用途与流程
本发明涉及药物合成技术领域,具体涉及一种新型铜双核结构金属配合物、其制备方法及用途。
背景技术:
癌症通常采用放射、手术、化疗和靶向治疗或以上多种方法进行组合治疗,进行手术和放射治疗只能保证手术区没有残留的癌细胞存在。化疗是用一些化学物质杀死癌细胞的治疗方法,化疗使用的药物一般通过高速细胞分裂来识别癌细胞,因此高速生长细胞(骨髓细胞、毛囊细胞等)也会受到化疗药物的影响,出现化疗并发症。靶向治疗是一种具有目标识别能力的治疗方法,癌细胞表面通常含有正常细胞中未被发现的特异性蛋白质,靶向药物可以利用这些蛋白质识别癌细胞,然后杀死它们,而那些没有特定蛋白质的正常细胞则无法识别,因此它们的副作用比化疗小得多。
过渡金属配合物和dna的相互结合是研究新型的高效价、低毒性抗肿瘤药物关键。铜是一种具有两种价态的重要元素,大量的生物酶都需要铜元素来激发活性,铜元素还参与人体多种酶的合成,铜离子以人体微量元素存在于生物组织中,研究证实了顺铂起抗肿瘤作用少不了铜离子转运蛋白的参与,其原因在于铜离子具有变价性,当cu(ⅱ)和cu(i)转换时产生ros,会破坏癌细胞,使其发生凋亡。但是,铂类抗癌药物存在较大的毒副作用,接受治疗的癌症患者通常出现骨髓抑制如血小板低下、恶心呕吐,肾和神经损伤等严重毒副作用。
羧酸类金属铜配合物具有良好的化学及生物活性。探讨金属铜配合物的结构与dna、人血清蛋白(hsa)作用方式及生物活性之间的关系,可以帮助人们从分子水平上认识药物分子的作用机制及药物动力学,同时对新药物的合成与设计也具有重要意义。
技术实现要素:
本发明的发明目的在于:针对上述存在的问题,提供一种新型铜双核结构金属配合物、其制备方法及用途,本发明提供的配合物具有较好的抗癌活性,且制备方法简单。
为了实现上述目的,本发明采用的技术方案如下:
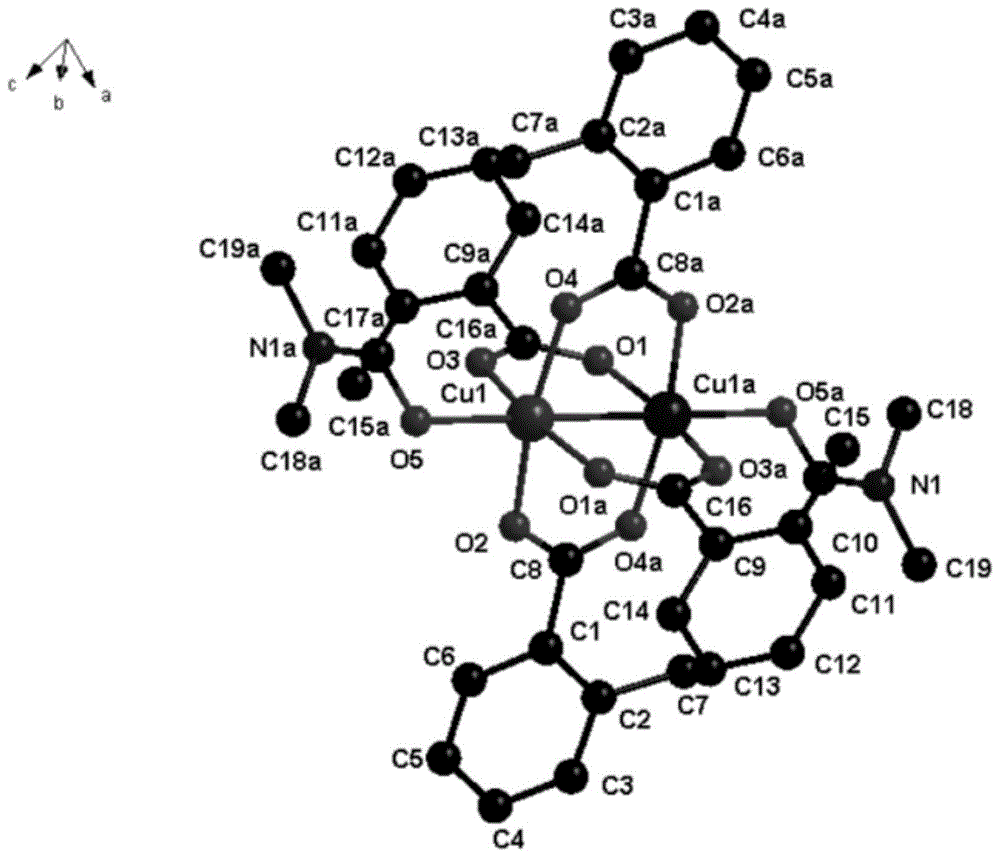
一种新型铜双核结构金属配合物,该配合物的配位结构图如下:
其中,该配合物的单元结构图如下:
本发明还提供上述新型铜双核结构金属配合物的制备方法,包括以下步骤:称取邻甲基苯甲酸溶于dmf中,完全溶解后加入少量水制得邻甲基苯甲酸溶液;往水中加入三水合硝酸铜制得硝酸铜水溶液,搅拌下将硝酸铜水溶液缓慢滴加至邻甲基苯甲酸溶液中,滴加完毕,继续搅拌一段时间,封膜置于阴凉处,7-10d后析出细小的淡青色晶体,过滤后烘干即得所述新型铜双核结构金属配合物。
在本发明中,作为优选,所述邻甲基苯甲酸与三水合硝酸铜的摩尔比为1:0.8-1.2,所述dmf过量。
在本发明中,作为优选,所述硝酸铜水溶液的滴加时间为20-40min。
在本发明中,作为优选,所述继续搅拌一段时间所指时间为20-40min。
在本发明中,作为优选,所述烘干是指在45-55℃下烘2-4h。
本发明经过试验验证所得的配合物具有较好的抗癌活性,因此,本发明还提供上述新型铜双核结构金属配合物在制备癌症治疗药物中的应用。更具体地,是在制备宫颈癌、肺癌和肝癌治疗药物中的应用。
综上所述,由于采用了上述技术方案,本发明的有益效果是:
1、本发明提供一种具有抗癌活性的新型铜双核结构金属配合物,并进行了药理学分析,证明该新型铜双核结构金属配合物具有较好的抗癌活性,与宫颈癌细胞hela、肺癌细胞a549及肝癌细胞hepg2作用48h后细胞的ic50值分别为156.2μm、187.8μm、62.93μm;且其制备方法简单,对设备要求低,适合在抗癌领域中推广应用。
2、本发明通过紫外吸收光谱、荧光光谱、粘度证实所合成的新型铜双核结构金属配合物与ct-dna的结合方式为插入式;通过紫外吸收光谱、荧光光谱证实所合成的新型铜双核结构金属配合物与hsa的结合方式为插入式,与hsa有较强的结合,结合常数ka=1.97×104l·mol-1,结合位点数为1。
附图说明
图1为本发明合成的新型铜双核结构金属配合物的配位结构图。
图2为本发明合成的新型铜双核结构金属配合物的单元结构图。
图3为本发明合成的新型铜双核结构金属配合物与小牛胸腺dna(ct-dna)相互作用的紫外吸收光谱图。
图4为本发明合成的新型铜双核结构金属配合物与小牛胸腺dna(ct-dna)相互作用的荧光光谱图。
图5为本发明合成的新型铜双核结构金属配合物与小牛胸腺dna(ct-dna)作用后,ct-dna粘度的变化情况图。
图6为本发明合成的新型铜双核结构金属配合物与人血清蛋白(hsa)相互作用的紫外吸收光谱图。
图7为本发明合成的新型铜双核结构金属配合物与人血清蛋白(hsa)相互作用的荧光光谱图。
图8为本发明合成的新型铜双核结构金属配合物对宫颈癌细胞hela、肺癌细胞a549及肝癌细胞hepg2的细胞毒性测试结果。
具体实施方式
为了更清楚地表达本发明,以下通过具体实施例对本发明作进一步说明。
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
为了获得更多抗癌活性较高的配合物,本发明经过研究和验证提供以下新型铜双核结构金属配合物。本发明的一种典型的实施方式中,提供一种新型铜双核结构金属配合物,该配合物的配位结构图见图1所示,该配合物的单元结构图见图2所示。
本实施方式以邻甲基苯甲酸和dmf配体,并与三水硝酸铜反应生成以铜离子为中心的双核五配位配合物,该结构提高了配合物的抗癌活性。
该具有抗癌活性的新型铜双核结构金属配合物属于三斜晶系,p-1空间群,晶胞参数为a=10.370(5)nm,b=10.536(4)nm,c=11.059(5)nm;α=62.737(6)°,β=73.355(7)°,γ=63.231(7)°;z=1,dc=1.416mg/m3,f(000)=422。
本发明还提供上述新型铜双核结构金属配合物的制备方法,包括以下步骤:称取邻甲基苯甲酸溶于dmf中,完全溶解后加入少量水制得邻甲基苯甲酸溶液;往水中加入三水合硝酸铜制得硝酸铜水溶液,搅拌下将硝酸铜水溶液缓慢滴加至邻甲基苯甲酸溶液中,滴加完毕,继续搅拌一段时间,封膜置于阴凉处,7-10d后析出细小的淡青色晶体,过滤后烘干即得所述新型铜双核结构金属配合物。
为了使配体原料充分反应且获得目标配合物,在本发明的一些实施例中,所述邻甲基苯甲酸与三水合硝酸铜的摩尔比为1:0.8-1.2,所述dmf过量。
为了更好地反应,在本发明的一些实施例中,所述硝酸铜水溶液的滴加时间为20-40min。
为了更好地反应,在本发明的一些实施例中,所述继续搅拌一段时间所指时间为20-40min。
在本发明的一些实施例中,所述烘干是指在45-55℃下烘2-4h。
为了使本领域技术人员能够更清楚地了解本申请的技术方案,以下将结合具体的实施例对本申请的技术方案作详细地说明。
一、制备实施例
实施例1
称取1mmol邻甲基苯甲酸溶于4mldmf中,完全溶解后加入2ml水制得邻甲基苯甲酸溶液;往4ml水中加入0.8mmol三水合硝酸铜制得硝酸铜水溶液,搅拌下将硝酸铜水溶液在20min内缓慢滴加至邻甲基苯甲酸溶液中,滴加完毕,继续搅拌一段时间,封膜置于阴凉处,7d后析出细小的淡青色晶体,过滤后烘干即得所述新型铜双核结构金属配合物。
实施例2
称取1mmol邻甲基苯甲酸溶于4mldmf中,完全溶解后加入2ml水制得邻甲基苯甲酸溶液;往4ml水中加入1mmol三水合硝酸铜制得硝酸铜水溶液,搅拌下将硝酸铜水溶液在30min内缓慢滴加至邻甲基苯甲酸溶液中,滴加完毕,继续搅拌一段时间,封膜置于阴凉处,9d后析出细小的淡青色晶体,过滤后烘干即得所述新型铜双核结构金属配合物。
实施例3
称取1mmol邻甲基苯甲酸溶于4mldmf中,完全溶解后加入2ml水制得邻甲基苯甲酸溶液;往4ml水中加入1.2mmol三水合硝酸铜制得硝酸铜水溶液,搅拌下将硝酸铜水溶液在40min内缓慢滴加至邻甲基苯甲酸溶液中,滴加完毕,继续搅拌一段时间,封膜置于阴凉处,10d后析出细小的淡青色晶体,过滤后烘干即得所述新型铜双核结构金属配合物。
二、配合物的确认
将实施例1-3制备得到的蓝色块状晶体结构经单晶-xrd衍射确证,该配合物的晶体学、主要键长与键角、主要扭转角等数据分别列于表1、表2、表3。
表1配合物的晶体学数据
表2配合物的主要键长和键角
用于产生等效原子的对称变换:
#1-x,-y+1,-z+1
表3本发明合成的新型铜金属配合物的主要扭转角
用于产生等效原子的对称变换:
#1x-1,y,z#2x+1,y,z#3-x,-y,-z
三、本发明合成的新型铜双核结构金属配合物与ct-dna作用的紫外吸收光谱
用ph=7.2的tris-hcl/nacl缓冲溶液扫描基线,扣除空白背景。在200~400nm范围内测定50μmol·l-1配合物的紫外吸收光谱。用移液枪分别滴加80ul的2mmo/lct-dna溶液于参比池和样品池中。共15次,每次滴加完后,使其反应5min,再对溶液扫描。
图3为本发明合成的新型铜双核结构金属配合物与小牛胸腺dna(ct-dna)相互作用的紫外吸收光谱图。可以看出,随着ct-dna的浓度增大,配合物在228nm处具有减色效应,吸收峰位置发生紫移,由此推测配合物对ct-dna具有插入作用。计算得到配合物与dna的结合常数kb=939.61l·mol-1。
四、本发明合成的新型铜双核结构金属配合物与ct-dna作用的荧光光谱
将8μmol·l-1溴化乙啶(eb)与10μmol·l-1ct-dna溶液同等体积混匀,反应12h。将3ml的eb-ct-dna混合溶液加入样品池中,于激发波长为565nm、扫描速度为240nm·s-1下,测定540~700nm波长范围内的发射光谱。向eb-ct-dna体系中滴加40μl浓度为1mmol·l-1的配合物溶液,共滴加14次,每次待其反应5min后,再测定其发射光谱。
图4为本发明合成的新型铜双核结构金属配合物与小牛胸腺dna(ct-dna)相互作用的荧光光谱图。可以看出,eb-ct-dna的最大发射波长一直在596nm处,随着配合物的浓度增大,荧光强度逐渐减小。在不同的r=[complex]/[dna]值下,初始荧光强度从96.43%降到68.11%。配合物与ct-dna作用模式与eb相似,为经典的插入模式。得猝灭速率常数kq=2.996×1011l·mol-1·s-1。配合物对eb-dna的荧光猝灭是静态猝灭。结合速率常数ka=5.38×103l·mol-1,结合位点n=1。
五、本发明合成的新型铜双核结构金属配合物对ct-dna粘度的影响:
用恒温水槽将反应温度控制在29.0±0.1℃,往乌氏粘度计中加入ct-dna溶液,逐渐增大配合物溶液浓度,使配合物与ct-dna的浓度比值[complex]/[dna]=0、0.05、0.1、0.15、0.20、0.25、0.30,并依次记录下ct-dna溶液流经在毛细管有效刻度的时间(s),每组实验重复3次,取平均值。
图5为本发明合成的新型铜双核结构金属配合物与小牛胸腺dna(ct-dna)作用后,ct-dna粘度的变化情况图。可以看出,随着配合物浓度的增大,dna的粘度增大,表明配合物以插入的方式与dna结合。
六、本发明合成的新型铜双核结构金属配合物与hsa作用的紫外吸收光谱
往样品池中加入3ml的100μmol·l-1的hsa溶液,参比池内加入一样量的tris-hcl/nacl缓冲溶液,测定其在190~400nm波长下的紫外光谱。分别往两池中加入10μl的配合物溶液(1mmol·l-1),共15次,每次加完后,吹打混匀,在室温下放置5min后,在同样波长范围内扫描测定。
图6为本发明合成的新型铜双核结构金属配合物与人血清蛋白(hsa)相互作用的紫外吸收光谱图。可以看出,随着配合物浓度增大,210nm处的吸收峰发生减色效应,吸收峰位置有轻微红移现象,表明配合物与hsa发生了相互作用。
七、本发明合成的新型铜双核结构金属配合物与hsa作用的荧光光谱
样品池中加入3ml的hsa溶液(25μmol·l-1),在激发态为280nm下,测其在300~500nm波长内的荧光光谱。往样品池中加入10μl的配合物溶液(1mmol·l-1),共14次,每次加完后,吹打混匀,在室温下放置5min后,在同样条件下扫描。
图7为本发明合成的新型铜双核结构金属配合物与人血清蛋白(hsa)相互作用的荧光光谱图。可以看出,hsa在强吸收峰312nm处,随着配合物浓度的增大,吸收强度降低,但峰位和峰型基本不变。在不同的r=[complex]/[hsa]值下,初始荧光强度从96.39%降到62.72%。猝灭速率常数值kq=1.26×1012l·mol-1·s-1,配合物对hsa的荧光猝灭是静态猝灭。结合常数ka=1.97×104l·mol-1,结合位点数n=1。
八、本发明合成的新型铜双核结构金属配合物对肿瘤细胞的细胞毒性
用酶标仪测定配合物对宫颈癌细胞hela、肺癌细胞a549细胞及肝癌细胞hepg2的细胞毒性。图8为本发明合成的新型铜双核结构金属配合物对肺癌细胞a549、宫颈癌细胞hela及肝癌细胞hepg2作用后的细胞毒性图。计算得到新型铜双核结构金属配合物与肺癌细胞a549、宫颈癌细胞hela及肝癌细胞hepg2作用48h后细胞的ic50值分别为156.2μm、187.8μm、62.93μm。说明本发明合成的新型铜双核结构金属配合物对肿瘤细胞的具有较好的抗癌活性,因此可以将其应用在制备癌症治疗药物中,特别是在宫颈癌、肺癌和肝癌治疗药物中的应用。
上述说明是针对本发明较佳可行实施例的详细说明,但实施例并非用以限定本发明的专利申请范围,凡本发明所提示的技术精神下所完成的同等变化或修饰变更,均应属于本发明所涵盖专利范围。
- 还没有人留言评论。精彩留言会获得点赞!