稀有鮈鲫载脂蛋白ApoE基因、重组蛋白、多克隆抗体及制备方法和应用与流程
本发明是从分子水平研究生物大分子的结构和功能,属于基因工程领域、蛋白质-核酸体系,涉及稀有鮈鲫(gobiocyprisrarus)载脂蛋白apoe基因的核苷酸序列、经过密码子优化后的核苷酸序列、以及所编码的氨基酸序列,尤其涉及一种稀有鮈鲫apoe重组蛋白的表达制备方法和蛋白抗兔多克隆抗体的制备。
背景技术:
apoe是一种多态性蛋白,参与脂蛋白的转化与代谢过程,其基因可以调节许多生物学功能,apoe主要存在于cm、vldl、idl和部分hdl中,apoe存在于所有研究过的不同种属动物中。在动物和人体中进行的关量营养和生化研究表明,apoe在肝脏和肝外组织的脂蛋白分解代谢中起着重要的作用。apoe除了可引起脂质代谢异常,还参与致血管内皮细胞功能失调过程,有促炎和促发动脉粥样硬化的作用;apoe能引起血管内皮细胞和单核细胞活化,启动相关信号通路而导致细胞粘附率增加稀有鮈鲫,属鲤科,鮈鲫属,本属仅有1种,为我国特有种,野生数量不多,仅见于长江上游的大渡河支流和四川成都附近的平原及其西部边缘地区的小河流中。稀有鮈鲫具有体型小、繁殖周期短、性成熟快、产卵批次多、胚胎发育可人为控制、对化学物质敏感等优良特点,再加上它具有单型种、温度适应范围广、饲养管理方便、卵膜透明等一系列作为实验鱼的优点,是我国迄今发现的最适合作为实验动物的鱼类。鱼类是理想的心血管疾病研究模型,对apoe的研究,有助于了解机体内胆固醇的转运过程。动物摄取高胆固醇膳食后,血浆apoe的浓度显著增加,血中出现富含胆固醇的两种脂蛋白,即β-vldl和hdlc,两者均含较多的apoe。但是目前关于apoe的抗体主要集中于哺乳动物上,没有针对鱼类上可供应用的抗体。通过原核表达方法获得的重组蛋白,大多是以包涵体形式存在的,不具有生物学活性。
技术实现要素:
为解决上述技术问题,本发明提供了稀有鮈鲫载脂蛋白apoe基因、重组蛋白、多克隆抗体及制备方法和应用,以解决缺少鱼类apoe检测抗体而无法进行apoe蛋白测定等问题。
本发明的技术方案如下:
一种稀有鮈鲫载脂蛋白apoe基因,所述apoe基因命名为grapoe,其核苷酸序列如sedidno:1所示。
一种密码子优化后的稀有鮈鲫载脂蛋白apoe基因,其核苷酸序列如sedidno:2所示。
一种稀有鮈鲫载脂蛋白apoe重组蛋白,其氨基酸序列如sedidno:3所示。
上述稀有鮈鲫载脂蛋白apoe重组蛋白的制备方法,包括:
构建重组质粒:将稀有鮈鲫apoe密码子优化基因序列sedidno:2连入pet30a表达载体得到pet30a-grapoe重组质粒;
重组蛋白的诱导表达:将pet30a-grapoe重组质粒转化入大肠杆菌中,培养,诱导,裂解,纯化,得到稀有鮈鲫apoe重组蛋白。
在一些实施例中,重组蛋白的诱导表达包括:将经过密码子优化的sedidno:2序列与pet30a表达载体直接合成并连入进去,再与大肠杆菌感受态细胞bl21进行转化,随即培养并涂布至固体培养基上,挑选单克隆进行菌落pcr后摇菌,然后加入iptg进行诱导培养,得到粗产物,收集菌体进行sds-page(聚丙烯酰胺凝胶电泳)蛋白检测,用超声破碎仪将细菌裂解,最后进行重组蛋白的纯化,检测纯化后的纯度。进一步的,破碎条件为:破碎开4s,间隔关3s,共超声破碎30min。
具体包括:向大肠杆菌感受态细胞e.colibl21中加入pet30a-grapoe重组质粒,搅匀,在冰浴中静置30min,后置于42℃~45℃水浴中热激90s,转移至冰浴中放置2-5min;向每个样品中加入900μl的无菌lb培养液,混匀后36-38℃(37℃左右)振荡培养50-70min左右,使菌体复苏,然后吸取100μl已复苏的菌液涂布在抗性平板上为含卡纳青霉素的lb固体培养基,倒置36-38℃37℃过夜培养至出现菌落;挑选含有重组质粒的大肠杆菌,加入液体培养基,37℃震荡培养直至菌液od600为0.4~0.6,加入终浓度为1mm的异丙基-β-d-硫代半乳糖苷,在16℃下进行4h的诱导培养后,收集菌体;
将收集到的菌体用灭菌水重悬,放入-80℃冻存,并反复冻融1-2次;取诱导培养后反复冻融的重悬菌体在冰浴条件下进行超声波破碎,裂解菌体,离心收集破碎后的上清液,加入上样缓冲液、煮沸、离心、冷却、取上清,得到grapoe-his重组蛋白粗产物;
纯化包括:取一定量诱导培养后的菌体,进行固液分离,收集菌体,再将经超声破碎后裂解的菌体,得上清及沉淀,再将上清样品使用硫酸铵盐后进行ni2+离子亲和层析柱纯化,流速为10倍柱体积/小时,收集流穿液;用15倍柱体积的结合缓冲液洗涤ni离子亲和柱,洗脱杂蛋白;使用5ml洗脱液再进行洗涤柱子,出现目的蛋白峰时,收集含有目的蛋白的洗脱液。
一种多克隆抗体,是以所述的稀有鮈鲫apoe重组蛋白为抗原,免疫动物制备所得。
上述的多克隆抗体的制备方法,以所述的稀有鮈鲫apoe重组蛋白为抗原,采用常规多克隆抗体的制备方法制备抗血清,将抗血清分离纯化得到多克隆抗体。
在一些实施例中,一种稀有鮈鲫apoe蛋白抗兔多克隆抗体的制备方法,包括:将所述的稀有鮈鲫apoe重组蛋白作为抗原注入兔子体内,四次免疫后,采集兔血,分离血清,纯化后得到稀有鮈鲫apoe蛋白抗兔多克隆抗体。
进一步的,一种稀有鮈鲫载脂蛋白apoe抗兔多克隆抗体的制备方法,包括以下步骤:
采用5只新西兰白兔,用生理盐水稀释免疫原,调整浓度为1mg/ml,作为抗原注射,然后与相应的佐剂进行1:1混合,完全混合后形成稳定的乳剂,在兔子双肩周围皮肤下和后大腿进行皮下肌肉注射,每个区域用量为1/4的免疫原,约为每点0.2ml。首兔免疫采用完全佐剂,之后都用不完全佐剂。首兔可采用背部多点注射法,间隔2周后再于二兔上述部位不同点注射(不要选择临近点,否则溃疡愈合不好)。到三兔间隔时间为7天,即免疫一周后可以耳动脉取血检测抗体效价,因起初几次免疫产生的抗体效价较低,头两次取血够检测即可。在三次免疫之后,可取血量增加,但不要太多。检测合格7天后加兔,加兔完一周后可采用颈动脉放血。用elisa(间接法)检测兔血清中抗体效价,再经pcr扩增出的apoe基因片段与理论值大小比较。然后使用简介还原胺化制备亲和层析柱proteing,优化反应条件。运用高氯酸沉淀、离子交换及亲和层析从人血清中纯化抗原。进一步再经过sds-page以及western-blotting验证纯化后的蛋白质分子质量与质谱分析数据相比。
进一步的,grapoe-his多克隆抗体的检测方法为:
首先提取稀有鮈鲫的血清总蛋白,进行sds-page电泳,在湿转法的条件下对血清总蛋白进行pvdf(聚偏二氟乙烯膜)转膜1h,然后将pvdf膜放在5%bsa或者脱脂奶粉封闭液中处理2h以封闭pvdf膜上的疏水结合位点,并将纯化后的抗体按照1:1500进行稀释,放在摇床上进行一抗孵育过夜,用tbst进行洗膜三至四次,每次5min,洗膜结束后,加入用羊抗兔hrp标记的igg二抗与pvdf膜放在摇床上室温孵育2h,孵育结束后,再用tbst洗膜六至七次,最后用增强型的dab显色试剂盒进行显色,放入凝胶成像仪中进行检测并观察。
所述的稀有鮈鲫(gobiocyprisrarus)载脂蛋白apoe基因是cdna序列:长度792bp,类型是双链、线性、核酸,所述grapoe的序列是通过pcr扩增,并进行测序获得。具体序列如下所示,seqidno.1:
cgtagcctgtttcaggcagatgcacctcagcctcgttgggaagaaatggttgaacgtttttgggagagcgttagcgaactgaatacccatgcagatggtgttgttcaaaatattaaaggtagccaactgagccgtgaactggataccctgattaccgataccattagtgaactgggtagttatagcgataatctgcaaacgcagctgaccccgtatgcaagtgacgcagccggccagctgagcaaagatctgcagctgctggcaggtaaactgcagaccgacatgaccgatgcaaaagaacgtagcacccagtacctgcaagaactgaaaaccatggttgaacaaaatgcagacgatgttaaaaatcgcgtcaatacctatacacgcaaactgaaaaagcgcctgaataaagataccgaagaaattcgcaataccgtagcaacctacctgggcgaactgcaaagccgtgcaagccagaacgccgatgcagtgaaagatcgcctggaaccgtacctgacccaagcccaagatggcgcaaatcagaaactgggagcaattagcgaactgatgaaaagccaagcacaagaaatgagcgaacagctggaagtacaggcaggtgctctgaaagaaaaactggaacagaccgcagaagatctgcgtacaagcctggaaggccgtgtggatgaactgaccagcctgctgaccccgtacagcgaaaaaattcgtgaacagctgaaaattgttatggataaaattaaagaagcaagcgcagcactgccgacccaggcataa。
对grapoe的核苷酸序列进行密码子优化,选用大肠杆菌表达系统,对grapoe序列的密码子优化后的序列,标记seqidno.2:
cgtagcctgtttcaggcagatgcacctcagcctcgttgggaagaaatggttgaacgtttttgggagagcgttagcgaactgaatacccatgcagatggtgttgttcaaaatattaaaggtagccaactgagccgtgaactggataccctgattaccgataccattagtgaactgggtagttatagcgataatctgcaaacgcagctgaccccgtatgcaagtgacgcagccggccagctgagcaaagatctgcagctgctggcaggtaaactgcagaccgacatgaccgatgcaaaagaacgtagcacccagtacctgcaagaactgaaaaccatggttgaacaaaatgcagacgatgttaaaaatcgcgtcaatacctatacacgcaaactgaaaaagcgcctgaataaagataccgaagaaattcgcaataccgtagcaacctacctgggcgaactgcaaagccgtgcaagccagaacgccgatgcagtgaaagatcgcctggaaccgtacctgacccaagcccaagatggcgcaaatcagaaactgggagcaattagcgaactgatgaaaagccaagcacaagaaatgagcgaacagctggaagtacaggcaggtgctctgaaagaaaaactggaacagaccgcagaagatctgcgtacaagcctggaaggccgtgtggatgaactgaccagcctgctgaccccgtacagcgaaaaaattcgtgaacagctgaaaattgttatggataaaattaaagaagcaagcgcagcactgccgacccaggcataa。
所述的grapoe分子类型为蛋白质,序列特征:长度263aa,类型为氨基酸,序列信息如下,标记为seqidno.3:
rslfqadapqprweemverfwesvselnthadgvvqnikgsqlsreldtlitdtiselgsysdnlqtqltpyasdaagqlskdlqllagklqtdmtdakerstqylqelktmveqnaddvknrvntytrklkkrlnkdteeirntvatylgelqsrasqnadavkdrlepyltqaqdganqklgaiselmksqaqemseqlevqagalkekleqtaedlrtslegrvdeltslltpysekireqlkivmdkikeasaalptqa*。
本发明所述稀有鮈鲫(gobiocyprisrarus)载脂蛋白apoe重组蛋白和抗兔多克隆抗体的制备方法,包括以下步骤:
稀有鮈鲫(gobiocyprisrarus)载脂蛋白apoe密码子优化基因的合成;
稀有鮈鲫(gobiocyprisrarus)载脂蛋白apoe重组表达步骤;
稀有鮈鲫(gobiocyprisrarus)载脂蛋白apoe抗兔多克隆抗体的制备方法。
本发明还提供了所述的稀有鮈鲫apoe重组蛋白/所述多克隆抗体在apoe检测中的应用。
有益效果:
通过本发明不仅将具有活性的apoe蛋白重组表达了,更加进一步地研究了为该蛋白功能提供基础,而且生产的多克隆抗体,也为检测鱼体内apoe的含量提供了条件,同时生产的抗体也可为进一步科学研究提供条件。而本发明能够获得以可溶性方式存在的apoe重组蛋白,该蛋白直接具有生物学活性,不需要再通过复性等方法使其获得活性,生产工艺更加简便。而获得的抗兔apoe多克隆抗体,为以后在鱼类研究载脂蛋白的功能,提供了抗体支持。
本发明将grapoe密码子优化后的序列seqidno.2直接合成并连入pet30a载体,通过转化到大肠杆菌感受态细胞bl21中,挑选单克隆进行摇菌,iptg诱导培养,收集菌体进行sds-page蛋白检测,超声破碎裂解细菌,用ni2+亲和层析柱纯化目的蛋白。然后以纯化后的grapoe重组蛋白作为抗原,采用5只新西兰白兔,进行免疫,收集血清,用elisa(间接法)检测兔血清中抗体效价。然后使用亲和层析柱proteing,纯化抗体,并应用于后续的westernblot等实验。通过重组表达grapoe蛋白可以进一步在体外分析该蛋白的结构和功能,另外多克隆抗体的制备能够为进一步检测鱼体内apoe的含量奠定基础。通过传统的原核表达方法,重组蛋白多是以包涵体形式存在的,不具有生物学活性,在本技术方法中,通过低浓度iptg诱导、30℃和100rpm低转速诱导条件下,实现了重组表达grapoe蛋白的可溶性表达,重组蛋白在菌体裂解液的上清中,直接具有生物学活性,不需要再经过复性,减少了生产工艺。本发明制备的多克隆抗体能够特异性的识别结合apoe蛋白,表示该抗体的特异性较好,通过蛋白浓度测定,抗体的浓度达4.8mg/ml。
附图说明
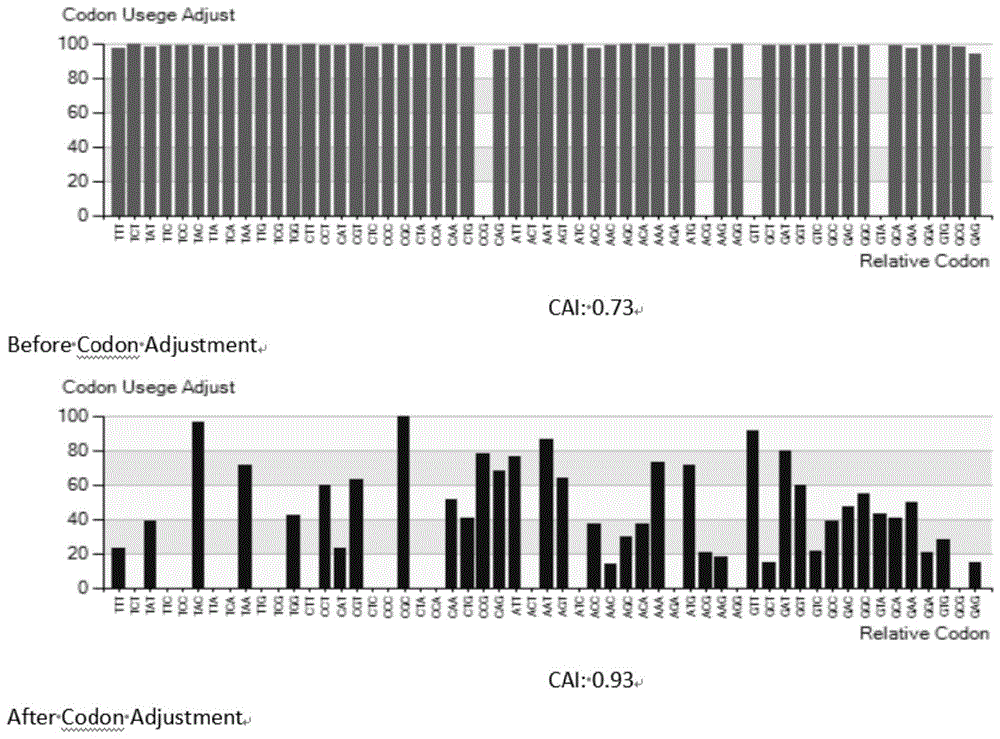
图1,grapoe密码子优化后的密码子偏好性分析。seqidno.1的cai是0.73,经密码子优化后seqidno.2的cai是0.93。cai数值越接近1,表示密码子优化的效果越好。经密码子优化后,seqidno.2序列更适用于大肠杆菌表达系统。
图2,grapoe重组蛋白的sds-page电泳检测。m表示蛋白marker,1表示未iptg诱导的菌体蛋白,2表示iptg诱导后的菌体蛋白,3表示ni2+纯化后的mrthyβ4重组蛋白。
图3,grapoe抗兔多克隆抗体的westernblot检测。
具体实施方式
实施例1
1.grapoe-his重组蛋白的诱导表达:
向大肠杆菌感受态细胞e.colibl21中连接上pet30a-grapoe重组质粒,轻轻混匀,不要吹打,在已准备好的冰浴中静置30min,后置于42℃~45℃水浴中热激90s,迅速转移至冰浴中放置2-5min,整个过程不要摇动样品离心管。向每个样品中加入900μl的无菌lb培养基,轻轻混匀后斜放置于摇床上,37℃振荡培养60min,使菌体复苏,如若调到38℃或者增加转速可减少振荡培养时间。然后吸取100μl复苏的菌液涂布在抗性平板上为含卡纳青霉素的lb固体培养基上,待液体被吸收后,看不见水分流动即倒置,37℃过夜培养,培养至出现菌落,结束后可放于4℃数小时,使蓝白斑充分显色。挑选含有重组质粒的大肠杆菌,加入液体培养基,摇床37℃震荡培养直至菌液od600为0.4~0.6,加入终浓度为1mm的异丙基-β-d-硫代半乳糖苷,在19~25℃下进行4h的诱导表达后,收集菌体,并用灭菌水重悬,再放入-80℃冻存,并反复冻融1-2次;取诱导培养后反复冻融的重悬菌体在冰浴条件下进行超声波破碎,裂解菌体,离心收集破碎后的上清液,加入上样缓冲液、煮沸、离心、冷却、取上清,并进行sds-page电泳检测。
2.grapoe-his重组蛋白的纯化:
对grapoe-his重组蛋白进行分离纯化:取一定量诱导培养后的菌体,进行固液分离,收集菌体,将超声破碎后的上清样品使用硫酸铵盐后进行ni2+离子亲和层析柱纯化,流速为10倍柱体积/小时,收集流穿液。用15倍柱体积的bindingbuffer(20mmtris-hclph7.9,5mm咪唑,0.5mnacl)洗涤ni离子亲和柱,洗脱杂蛋白。使用5mlelutionbuffer(20mmtris-hclph7.9,500mm咪唑,0.5mnacl)再进行洗涤柱子,出现目的蛋白峰时,收集含有目的蛋白的洗脱液。如图2中,条带1表示未诱导蛋白,条带2表示诱导后表达蛋白,条带3表示纯化后的重组蛋白。可以看出诱导表达后,目的蛋白大量表达,且经过纯化后,条带单一,纯度也较高。
3.抗兔grapoe-his多克隆抗体的制备:
采用5只新西兰白兔,用生理盐水稀释免疫原,调整重组grapoe蛋白浓度为1mg/ml,作为抗原注射,然后与相应的佐剂进行1:1混合,完全混合后形成稳定的乳剂,在兔子双肩周围皮肤下和后大腿进行皮下肌肉注射,每个区域用量为1/4的免疫原,约为每点0.2ml。首兔免疫采用完全佐剂,之后都用不完全佐剂。首兔可采用背部多点注射法,间隔2周后再于二兔上述部位不同点注射(不要选择临近点,否则溃疡愈合不好)。到三兔间隔时间为7天,即免疫一周后可以耳动脉取血检测抗体效价,因起初几次免疫产生的抗体效价较低,头两次取血够检测即可。在三次免疫之后,可取血量增加,但不要太多。检测合格7天后加兔,加兔完一周后可采用颈动脉放血。用elisa(间接法)检测兔血清中抗体效价,再经pcr扩增出的apoe基因片段与理论值大小比较。然后使用简介还原胺化制备亲和层析柱proteing,优化反应条件。运用高氯酸沉淀、离子交换及亲和层析从人血清中纯化抗原。进一步再经过sds-page以及western-blotting验证纯化后的蛋白质分子质量与质谱分析数据相比。
4.grapoe-his多克隆抗体的westernblot检测:
首先提取稀有鮈鲫的血清总蛋白,进行sds-page电泳,在湿转法的条件下对血清总蛋白进行pvdf(聚偏二氟乙烯膜)转膜1h,然后将pvdf膜放在5%bsa或者脱脂奶粉封闭液中处理2h以封闭pvdf膜上的疏水结合位点,并将纯化后的抗体按照1:1500进行稀释,放在摇床上进行一抗孵育过夜,用tbst进行洗膜三至四次,每次5min,洗膜结束后,加入用羊抗兔hrp标记的igg二抗与pvdf膜放在摇床上室温孵育2h,孵育结束后,再用tbst洗膜六至七次,最后用增强型的dab显色试剂盒进行显色,放入凝胶成像仪中进行检测并观察。
如图3,可以看出用制备的grapoe-his多克隆抗体进行westernblot实验,该抗体能够特异性的识别结合apoe蛋白,表示该抗体的特异性较好,另外通过蛋白浓度测定,抗体的浓度达4.8mg/ml。
序列表
<110>扬州大学
<120>稀有鮈鲫载脂蛋白apoe基因、重组蛋白、多克隆抗体及制备方法和应用
<160>3
<170>siposequencelisting1.0
<210>1
<211>792
<212>dna
<213>人工序列(artificialsequence)
<400>1
cgtagcctgtttcaggcagatgcacctcagcctcgttgggaagaaatggttgaacgtttt60
tgggagagcgttagcgaactgaatacccatgcagatggtgttgttcaaaatattaaaggt120
agccaactgagccgtgaactggataccctgattaccgataccattagtgaactgggtagt180
tatagcgataatctgcaaacgcagctgaccccgtatgcaagtgacgcagccggccagctg240
agcaaagatctgcagctgctggcaggtaaactgcagaccgacatgaccgatgcaaaagaa300
cgtagcacccagtacctgcaagaactgaaaaccatggttgaacaaaatgcagacgatgtt360
aaaaatcgcgtcaatacctatacacgcaaactgaaaaagcgcctgaataaagataccgaa420
gaaattcgcaataccgtagcaacctacctgggcgaactgcaaagccgtgcaagccagaac480
gccgatgcagtgaaagatcgcctggaaccgtacctgacccaagcccaagatggcgcaaat540
cagaaactgggagcaattagcgaactgatgaaaagccaagcacaagaaatgagcgaacag600
ctggaagtacaggcaggtgctctgaaagaaaaactggaacagaccgcagaagatctgcgt660
acaagcctggaaggccgtgtggatgaactgaccagcctgctgaccccgtacagcgaaaaa720
attcgtgaacagctgaaaattgttatggataaaattaaagaagcaagcgcagcactgccg780
acccaggcataa792
<210>2
<211>792
<212>dna
<213>人工序列(artificialsequence)
<400>2
cgtagcctgtttcaggcagatgcacctcagcctcgttgggaagaaatggttgaacgtttt60
tgggagagcgttagcgaactgaatacccatgcagatggtgttgttcaaaatattaaaggt120
agccaactgagccgtgaactggataccctgattaccgataccattagtgaactgggtagt180
tatagcgataatctgcaaacgcagctgaccccgtatgcaagtgacgcagccggccagctg240
agcaaagatctgcagctgctggcaggtaaactgcagaccgacatgaccgatgcaaaagaa300
cgtagcacccagtacctgcaagaactgaaaaccatggttgaacaaaatgcagacgatgtt360
aaaaatcgcgtcaatacctatacacgcaaactgaaaaagcgcctgaataaagataccgaa420
gaaattcgcaataccgtagcaacctacctgggcgaactgcaaagccgtgcaagccagaac480
gccgatgcagtgaaagatcgcctggaaccgtacctgacccaagcccaagatggcgcaaat540
cagaaactgggagcaattagcgaactgatgaaaagccaagcacaagaaatgagcgaacag600
ctggaagtacaggcaggtgctctgaaagaaaaactggaacagaccgcagaagatctgcgt660
acaagcctggaaggccgtgtggatgaactgaccagcctgctgaccccgtacagcgaaaaa720
attcgtgaacagctgaaaattgttatggataaaattaaagaagcaagcgcagcactgccg780
acccaggcataa792
<210>3
<211>263
<212>prt
<213>人工序列(artificialsequence)
<400>3
argserleupheglnalaaspalaproglnproargtrpgluglumet
151015
valgluargphetrpgluservalsergluleuasnthrhisalaasp
202530
glyvalvalglnasnilelysglyserglnleuserarggluleuasp
354045
thrleuilethraspthrilesergluleuglysertyrseraspasn
505560
leuglnthrglnleuthrprotyralaseraspalaalaglyglnleu
65707580
serlysaspleuglnleuleualaglylysleuglnthraspmetthr
859095
aspalalysgluargserthrglntyrleuglngluleulysthrmet
100105110
valgluglnasnalaaspaspvallysasnargvalasnthrtyrthr
115120125
arglysleulyslysargleuasnlysaspthrglugluileargasn
130135140
thrvalalathrtyrleuglygluleuglnserargalaserglnasn
145150155160
alaaspalavallysaspargleugluprotyrleuthrglnalagln
165170175
aspglyalaasnglnlysleuglyalailesergluleumetlysser
180185190
glnalaglnglumetsergluglnleugluvalglnalaglyalaleu
195200205
lysglulysleugluglnthralagluaspleuargthrserleuglu
210215220
glyargvalaspgluleuthrserleuleuthrprotyrserglulys
225230235240
ilearggluglnleulysilevalmetasplysilelysglualaser
245250255
alaalaleuprothrglnala
260
- 还没有人留言评论。精彩留言会获得点赞!