一种用于检测基因甲基化的组合物、试剂盒、用途及其方法与流程
文档序号:29437494发布日期:2022-03-30 09:16阅读:691来源:国知局
导航: X技术> 最新专利>有机化合物处理,合成应用技术
1.本发明属于分子生物学检测领域,具体地,属于基因甲基化检测领域,更具体地,属于甲基化特异性pcr。
背景技术:
2.dna甲基化(dna methylation)是指在dna甲基化转移酶的作用下,基因组的cpg二核苷酸的胞嘧啶5'碳位会以共价键结合一个甲基基团(-ch3),dna甲基化是dna化学修饰的一种形式,能够在不改变dna序列的前提下,改变遗传表现。大量研究表明,dna甲基化能引起染色质结构、dna构象、dna稳定性及dna与蛋白质相互作用方式的改变,从而控制基因表达。cpg双核苷酸在人类基因组中的分布很不均一,在基因组的某些区段,cpg比例高于正常,称之为cpg岛,cpg岛主要位于基因的启动子(promoter)和外显子区域,长度为300-3000bp。
3.研究表明,dna甲基化在肿瘤发生发展过程中发挥着重要作用。肿瘤抑制基因启动子区cpg岛往往呈高甲基化;而癌基因启动子区则呈现出低甲基化。因此,异常的dna甲基化通常被作为肿瘤诊断、分类和治疗的重要分子标记。
4.2017年,oncotarget上发表的一篇基于浆液新卵巢癌(hgsc)的研究,研究对比hgsc肿瘤组织、无肿瘤细胞的癌旁组织及配对血液的甲基化改编,发现肿瘤组织与癌旁组织的一致性高达84.9%,表明癌旁组织也发生了甲基化改变,提示甲基化改变可能发生于细胞癌变之前(giannopou lou,et al.2017)。leon等人发现,肿瘤患者的血浆游离dna水平要明显高于健康人群。之后研究者在肿瘤患者的血浆和血清中检测到了癌基因突变,并且与原发肿瘤相一致。因此,能够将血浆游离dna与癌症诊断联系起来。
5.随着二代测序技术及ivd行业的不断发展,基于ctdna的肿瘤早筛早诊研究及产品不断涌现。如广州康立明生物技术有限公司基于粪便核酸样本检测的肠癌辅助诊断产品“sdc2基因甲基化检测试剂盒”临床灵敏度及特异性分别达到82%和97%;博尔诚公司的基于外周血游离dna样本的胃癌辅助诊断产品“rnf180/septin9基因甲基化检测试剂盒”临床灵敏度及特异性分别为61.8%和85%;江苏为真生物、北京博尔诚的基于外周血游离dna样本检测的“septin9基因甲基化检测产品”临床灵敏度均为75%左右。以上通过nmpa注册认证的肿瘤辅助诊断产品相较于传统的筛查方式,如大便隐血等,在临床性能上有了极大的提升,但仍然有很大的不足。原因在于上述产品所采用的检测技术为传统的亚硫酸盐转化法以及荧光定量pcr技术,亚硫酸盐转化会严重破坏核酸的完整程度,同时在纯化回收的过程中会造成核酸的大量损失,而外周血中循环肿瘤dna(ctdna)的占比仅为1%-3%,因此本就含量极低的ctdna经亚硫酸盐转化后就更加难以检测了,从而影响临床检测性能。
6.为了克服上述缺陷,引入了甲基化敏感型限制性内切酶,其能够特异性识别酶切位点并进行酶切,但是当酶切位点的胞嘧啶呈甲基化时则不能进行酶切,因此能够将甲基化dna同非甲基化dna进行区分,将非甲基化的靶标序列进行充分碎片化,而甲基化序列则保持完整状态。通过甲基化敏感型限制性内切酶,避免了使用亚硫酸盐转化,不会破坏核酸
的完整程度,但是仍然面临着需要纯化回收酶切产物从而损失核酸的问题。除此之外,先酶切后pcr的过程也具有耗时长,易污染等缺陷。
7.目前,为了克服回收酶切产物所带来的核酸损失及耗时长等缺陷。已研究了一些酶切和pcr同时进行的方法,例如中国专利cn108277281a,其公开了一种可以同时进行酶切和pcr的方法,其中所用的酶是针对特定的碱基位点进行酶切的,利用的是野生型与突变型的碱基不同的特点,只能将含有特定位点的序列酶切为两段,该专利的方法无法适用于需要将整个检测区域进行碎片化的甲基化检测区域,因此,本领域需要一种能够同时进行酶切和pcr,能够保证甲基化特异性pcr的准确率和灵敏度,并且耗时短,不易污染的产品。
技术实现要素:
8.第一方面,本发明提供了一种用于检测基因甲基化的组合物,所述组合物包括:
9.非离子表面活性剂、甘油、bsa、明胶、单链结合蛋白,以及缓冲液。
10.在一些具体的实施方案中,非离子表面活性剂可以是市售的任意非离子表面活性剂。例如,选自由brij-58、chaps、np-40、sds、x-15、x-35、x-45、x-100、x-102、x-114、x-165、x-305、x-405、x-705、20,以及组成的组中的一种或多种。
11.在一个优选的实施方案中,非离子表面活性剂可以是x-100。
12.在一个更优选地实施方案中,非离子表面活性剂可以是x-100和20。
13.在一些具体的实施方案中,单链结合蛋白是本领域技术人员知晓的可用于pcr的任意种类的单链结合蛋白。例如,rec a蛋白、t4噬菌体32基因表达蛋白、大肠杆菌单链结合蛋白。
14.在一个具体的实施方案中,单链结合蛋白是t4噬菌体32基因表达蛋白。
15.在一些具体的实施方案中,缓冲液可以是本领域技术人员知晓的常用的缓冲体系,其离子强度为50mm。例如50mm乙酸钾、ph为7.6的tris-hcl、tris-磷酸盐缓冲液等,
16.在一个具体的实施方案中,缓冲液是tris-hcl。
17.使用本发明的组合物,能够在一管中同时进行酶切和pcr,无需先进行酶切再进行pcr。还能够保证酶切的效率,以及甲基化特异性pcr的准确性和灵敏度,并且耗时短,不易污染。
18.在一个优选的实施方案中,本发明的组合物进一步包括:dmso、钾离子、硫酸铵、四甲基氯化铵、二硫苏糖醇中的一种或多种。
19.使用本发明优选的组合物,能够使得甲基化检测灵敏度大大提升。以肝癌甲基化检测标志物clec11a为例,采用本发明提供的酶切及pcr扩增一管法检测体系对肝癌患者血浆核酸样本进行检测,其检测灵敏度达到86.7%,而传统的亚硫酸盐转化法检测灵敏度仅为66.7%,二者差异巨大;酶切法同样具有很好的检测特异性,对肝硬化、乙肝、丙肝、健康人血浆样本的整体检测特异性达到了98.1%,而转化法的检测特异性为99.1%,二者基本一致。
20.在本发明中,非离子表面活性剂在最终反应液中具有0.1%-1%体积比(v/v),优选0.1%-0.8%、更优选0.5%-0.8%的终浓度。例如,0.5%、0.6%、0.7%、0.8%。例如,20在最终反应液中最优选为0.5%以及x-100在最终反应液中最优选为0.8%,当多个非离子表面活性剂存在时,上述浓度是指每一个非离子表面活性剂存在于最终反应液中的浓度。
21.在本发明中,甘油在最终反应液中具有1%-10%体积比(v/v)、优选5%-10%。例如,5%、6%、7%、8%、9%。更优选为8%的终浓度。
22.在本发明中,bsa在最终反应液中具有1-20μg/ml、优选5-10μg/ml的终浓度。例如,5μg/ml、6μg/ml、7μg/ml、8μg/ml、9μg/ml。更优选为8μg/ml的终浓度。
23.在本发明中,明胶在最终反应液中具有0.1%-3%体积比(v/v)、优选0.5%-3%。例如,0.5%、1%、1.5%、2%、3%。更优选为1.5%的终浓度。
24.在本发明中,单链结合蛋白在最终反应液中具有50-150μg/ml、优选80-120μg/ml的终浓度。例如,80μg/ml、90μg/ml、100μg/ml、110μg/ml、120μg/ml。更优选为90μg/ml的终浓度。
25.在本发明中,缓冲液在最终反应液中具有50-150mm,优选80-120mm的终浓度。例如,80mm、90mm、100mm、110mm。更优选为100mm的终浓度。
26.在本发明中,dmso在最终反应液中具有0.1%-3%体积比(v/v)、优选0.5%-2%。例如,0.5%、1%、1.5%、2%。更优选为1%的终浓度。
27.在本发明中,钾离子在最终反应液中具有50-100mm,优选50-80mm的终浓度。例如,50mm、60mm、70mm、80mm。更优选为60mm的终浓度。
28.在本发明中,硫酸铵在最终反应液中具有60-150mm,优选60-120mm的终浓度。例如,60mm、70mm、80mm、90mm、100mm。更优选为70mm的终浓度。
29.在本发明中,四甲基氯化铵在最终反应液中具有10-100mm,优选10-20mm的终浓度。例如,10mm、20mm、30mm、40mm。更优选为20mm的终浓度。
30.在本发明中,二硫苏糖醇在最终反应液中具有0.1-2mm,优选0.1-1mm的终浓度。例如,0.2mm、0.4mm、0.6mm、0.8mm。更优选为0.6mm的终浓度。
31.在本发明中,最终反应液的ph为7.5-8.5,更优选为7.8-8.2,最优选为7.8。
32.在本发明中,“最终反应液”是指能够直接用于对待测基因同时进行酶切和pcr的反应液。其可以是完全由本发明的组合物和必备溶剂所配置的体系,也可以包括其余所需的成分。
33.进一步地,上述组合物还包括一步法提取核酸的试剂。
34.进一步地,上述组合物还包括甲基化敏感型限制性内切酶。所述甲基化敏感型限制性内切酶包括但不限于hhai、hpaii、hinpii酶。
35.进一步地,上述组合物还包括pcr所需试剂,例如包括dntp、dna聚合酶、镁离子。
36.更进一步地,所述组合物还包括核酸引物和探针。
37.所述核酸引物和探针是本领域技术人员根据常规的引物和探针设计就能得到的。
38.在一个具体的实施方案中,上述组合物在同一包装中以混合的形式存在。
39.在一个具体的实施方案中,上述组合物中除核酸引物和探针以外的组分在同一包装中以混合的形式存在。
40.第二方面,本发明提供了上述组合物在制备用于检测基因甲基化试剂盒中的用途。
41.本发明提供了上述组合物在改善甲基化敏感型限制性内切酶酶切性能中的用途。
42.本发明提供了上述组合物在制备用于一步法检测基因甲基化试剂盒中的用途。
43.在本发明中,“一步法”是指,将待测核酸样本直接加入本发明的组合物中,并同时进行酶切和pcr。
44.第三方面,本发明提供了一种用于检测基因甲基化的试剂盒,所述试剂盒包括上述组合物。
45.进一步地,所述试剂盒还包括本领域技术人员知晓的常规的用于pcr和酶切的成分。例如,dntp、dna聚合酶、镁离子、甲基化敏感型限制性内切酶。
46.更进一步地,所述试剂盒还包括核酸引物和探针。
47.所述核酸引物和探针是本领域技术人员根据常规的引物和探针设计就能得到的。
48.所述核酸引物和探针的靶点是待测基因被甲基化敏感型限制性内切酶处理之后的片段。在一个具体的实施方案中,所述待测基因是clec11a(nc_000019.10);在一个具体的实施方案中,所述待测基因是pak1(nc_000011.9)。
49.进一步地,当所述待测基因为clec11a(nc_000019.10),其靶标区域如下seq id no:16所示:
50.cccggccccgcccacaggctgcctgaaggggctgcgcctgggccacaagtgcttcctgctctcgcgcgacttcgaagctcaggcggcggcgcaggcgcggtgcacggcgcggggcgggagcctggcgcagccggcagaccgccagcagatggaggcgctcactcggtacctgcgcgcggcgctcgctccctacaactggcccgtgtggctgggcgtgcacgatcggcgcgc。
51.当所述待测基因为pak1(nc_000011.9),其靶标区域如下seq id no:17所示:
52.aaaatctactggaccccgtgtcaccactctccgaaagccggcggagatcccccagaacccggcccagctaggggagccccaggcagggccggcattacctggtggggaaggctagccccggcatctctggcgattgtttccgtcgcagagccgcacctctccctgcccaaccgggtacccacaaggcccctgctccaccggctccgctcgattcagctgggctgggctcctggcagctcagccgccagctcccgaggtgcagcacgctcgcgctctcgcagggcggcagcgaaggcgccgcgtcggggttggcgaaacagaaggggcgggggaagaaaggagggaaggaggcgggaggaagccgcgcgcttctccttttctgcaaagcagagctgagggcggggagacagctatcttcccaccctctcag。
53.在一个具体的实施方案中,所述引物和探针的具体序列分别为seq id no:1-3或seq id no:4-6:
[0054][0055]
在另一个具体的实施方案中,所述引物和探针的具体序列分别为:seq id no:7-9或seq id no:10-12:
[0056][0057]
所述核酸引物和探针的靶点也可以是内标。在一个具体的实施方案中,所述内标基因为人管家基因actb。更具体地,当内标基因为人管家基因actb时,其靶标区域如下seq id no:18所示:
[0058]
aatagtcattccaaatatgagatgcgttgttacaggaagtcccttgccatcctaaaagccaccccacttctctctaaggagaatggcccagtcctctcccaagtccacacaggggaggtgatagcattgctttcgtgtaaattatgtaatgcaaaa。
[0059]
在一个具体的实施方案中,所述引物和探针的具体序列分别为seq id no:13-15:
[0060][0061]
在一些具体的实施方案中,所述甲基化敏感型限制性内切酶是hhai、hpaii、hinpii。
[0062]
在本发明中,dntp在最终反应液中具有150-250mm,优选180-220mm的终浓度。例如,180mm、190mm、200mm、210mm。更优选为200mm的终浓度。
[0063]
在本发明中,镁离子在最终反应液中具有50-100mm,优选50-80mm的终浓度。例如,50mm、60mm、70mm、80mm。更优选为60mm的终浓度。
[0064]
在本发明中,dna聚合酶为严格的热启动酶,例如,taq dna聚合酶。dna聚合酶在最终反应液中的用量为5-30u/反应。
[0065]
在本发明中,甲基化敏感型限制性内切酶在最终反应液的用量为5-25u/反应,更优选为10u/反应。
[0066]
第四方面,本发明提供一种用于配置检测基因甲基化反应液的方法,所述方法包括将样本与上述组合物或试剂盒混合的步骤。
[0067]
在本发明中,“样本”为选自个体的生物样本。具体地,例如,选自细胞系、组织学切片、组织活检/石蜡包埋的组织、体液、粪便、结肠流出物、尿、血浆、血清、全血、分离的血细胞、从血液中分离的细胞,或其组合。
[0068]
优选地,本发明的“样本”为血浆,即血浆中的游离dna(即外周血中循环肿瘤dna)。
[0069]
血浆中的游离dna能用作检测肿瘤,具有对病人伤害小,特异性好等特点。但是由于其在血浆中的含量极低,因此,存在灵敏度较低的问题。使用本发明的检测试剂,能够使用血浆中的游离dna作为样本进行检测,具有较高的灵敏度和准确性。
[0070]
进一步地,所述方法还包括酶切和pcr同时进行的步骤。
附图说明
[0071]
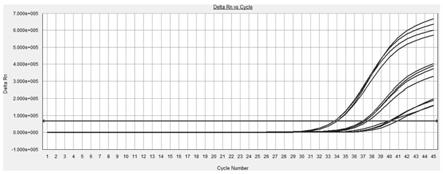
图1为本发明组合物1检测不同浓度样本(clec11a基因)的扩增曲线;
[0072]
图2为本发明组合物1检测非甲基化dna(clec11a基因)的扩增曲线;
[0073]
图3为标准甲基化dna(clec11a基因)采用亚硫酸盐转化后进行检测的扩增曲线;
[0074]
图4为本发明组合物2检测不同浓度样本(clec11a基因)的扩增曲线;
[0075]
图5为本发明组合物2检测非甲基化dna(clec11a基因)的扩增曲线;
[0076]
图6为本发明组合物1检测不同浓度样本(pak1基因)的扩增曲线;
[0077]
图7为本发明组合物1检测非甲基化dna(pak1基因)的扩增曲线;
[0078]
图8为不含甘油的本发明组合物1检测不同浓度样本的扩增曲线;
[0079]
图9为不含bsa的本发明组合物1检测非甲基化dna的扩增曲线;
[0080]
图10为不含单链结合蛋白的本发明组合物1检测非甲基化dna的扩增曲线;
[0081]
图11为不含单链结合蛋白的本发明组合物1检测不同浓度样本的扩增曲线。
具体实施方式
[0082]
下文将结合具体实施方式和实施例,具体阐述本发明,本发明的优点和各种效果将由此更加清楚地呈现。本领域技术人员应理解,这些具体实施方式和实施例是用于说明本发明,而非限制本发明。
[0083]
实施例1、人基因组(靶向clec11a基因)参考品检测
[0084]
阳性参考品:采用人标准甲基化dna配置不同浓度的参考品,具体浓度为0.2ng/μl,0.02ng/μl,0.002ng/μl。
[0085]
阴性参考品:经测序验证无目标基因甲基化的人基因组dna,4ng/μl;
[0086]
pcr体系配置:按照下表1的试剂配方配制pcr反应液
[0087]
将样本按照5μl/反应加入到pcr反应管,然后依次加入25μl pcr反应液,盖上pcr管盖,瞬时离心5s。
[0088]
荧光pcr反应与结果分析
[0089]
1)将pcr反应管放入扩增仪样品槽,按对应顺序设置待测样本名称;
[0090]
2)荧光检测通道选择:选择fam通道(reportere:fam,quencher:none)检测clec11a;选择cy5通道(reportere:cy5,quencher:none)检测内标actb;
[0091]
3)荧光定量pcr反应条件为:
[0092][0093]
4)结果分析
[0094]
反应结束后,仪器自动保存结果,可以利用仪器自带的软件进行自动分析(也可以手动调节基线的开始值、结束值以及阈值线值进行分析),扩增曲线与阈值线的交点,称为ct(即cycle threshold,指pcr反应管内的荧光信号达到设定的阈值时所经历的循环数值);
[0095]
当本发明组合物(组合物1)为:100mm的tris-hcl,60mm镁离子,1%dmso,200mm dntp,60mm乙酸钾,70mm硫酸铵,20mm四甲基氯化铵(tmac),tween 20,0.8%triton x-100,0.6mm二硫苏糖醇,8%甘油,1.5%明胶,8μg/ml bsa,90ng/μl t4 gene 32protein(t4噬菌体32基因表达蛋白),ph为7.8。
[0096]
表1
[0097]
试剂组分用量本发明组合物15μlme-cle-f1(10μm)1μlme-cle-r1(10μm)1μlme-cle-hp1(10μm)0.8μlme-act-f1(10μm)1μlme-act-r1(10μm)1μlme-act-cp1(10μm)0.8μl镁离子0.2μlhhai、hpaii、hinpii酶mix(10u)3μldntp(200mm)1μl热启动酶(5u/μl)2μlddh2o至25μl
[0098]
扩增曲线分别如图1、图2所示,本发明所提供的两套clec11a甲基化检测引物探针组合,其试剂检测灵敏度均能达到0.01ng/反应(图1,扩增曲线分别为1ng/反应、0.1ng/反应和0.01ng/反应),同时在20ng/反应的非甲基化dna中无非特异扩增(图2)。
[0099]
相应的,1ng/反应的标准甲基化dna采用亚硫酸盐转化后进行检测,其扩增曲线如图3所示,由图3可知同样为1ng/反应的样本检测,亚硫酸盐转化法检测ct值要比酶切法靠后3个ct左右(与图1中1ng/反应参考品扩增曲线进行比较),由此可知联合酶切法的检测效率要远高于亚硫酸盐转化法。其主要原因在于,亚硫酸盐转化会破坏核酸的完整性,同时亚硫酸盐转化后的纯化回收会造成核酸的大量损失,从而导致检测效率的降低。
[0100]
当本发明组合物(组合物2)为:100mm的tris-hcl,60mm mg离子,200mm dntp,60mm乙酸钾,0.8%triton x-100,8%甘油,1.5%明胶,8μg/ml bsa,90ng/μl t4 gene 32protein(t4噬菌体32基因表达蛋白),ph为7.8。
[0101]
按照前述组合物的方式检测参考品,其检测灵敏度能达到0.01ng/反应,但扩增效率略低(其荧光强度较低,ct值相比组合物1也较为靠后),同时检测20ng/反应的非甲基化dna亦无非特异扩增,即能够充分酶切。具体检测结果如下图4-5所示。
[0102]
实施例2、人基因组(靶向)参考品检测
[0103]
采用实施例1的最佳检测组合物,针对pak1甲基化检测区域设计引物探针进行甲基化检测,检测体系如下表2所示,结果显示检测特异性及检测灵敏度均非常理想,因此可认为本发明所提供的组合物及联合酶切一步法扩增的方法能够很好的用于不同基因的甲基化检测。检测结果如下图6-7所示。
[0104]
表2
[0105]
试剂组分用量本发明组合物15μlme-pa-f1(10μm)1μlme-pa-r1(10μm)1μlme-pa-hp1(10μm)0.8μl
me-act-f1(10μm)1μlme-act-r1(10μm)1μlme-act-cp1(10μm)0.8μlmg离子0.2μlhhai、hpaii、hinpii酶mix(10u/3ul)3μldntps(200mm)1μl热启动酶(5u/μl)2μlddh2o至25μl
[0106]
实施例3、临床样本检测
[0107]
收集临床血浆样本若干,其中初诊肝癌患者30例,乙肝(hbv)患者30例,丙肝(hcv)患者20例,肝硬化患者40例,健康人血浆样本20例;同时收集到30位肝癌患者各自对应的癌组织样本。
[0108]
采用凯杰的人血浆游离dna样本提取试剂盒对血浆样本进行核酸提取,采用凯杰的ffpe样本核酸提取试剂盒进行组织样本的核酸提取。
[0109]
所提取的核酸按照5ng/反应进行检测,分别采用亚硫酸盐转化法及本发明实施例1提及的方法(使用组合物1)进行检测,其中亚硫酸盐转化法采用zymo公司的转化试剂盒(d5042)进行,检测结果如表3所示:
[0110]
表3
[0111][0112]
组织样本检测灵敏度(%)=阳性检出数/阳性病例总数*100%
[0113]
血浆样本检测灵敏度(%)=阳性检出数/阳性病例总数数*100%
[0114]
血浆样本检测特异性(%)=阴性检出总数/阴性样本总数*100%
[0115]
其中阴性样本为所有非肝癌患者样本综合。
[0116]
由表3可知,当以肝癌肿瘤组织样本为检测对象时,采用亚硫酸盐转化法及本发明所提供的多酶切-pcr一管法均获得了很高的灵敏度,分别为96.7%和100%;而采用肝癌患
者血浆cfdna为检测样本时,两种方法的差异性即显现出来,酶切法检测灵敏度达到了86.7%,而转化法检测灵敏度仅为66.7%,这是因为血浆cfdna样本中来源于肝脏肿瘤细胞凋零所释放的ctdna极其有限,在经过亚硫酸盐转化及纯化回收的进一步损失后,已经不足以通过q-pcr技术进行检测,而采用本发明的方法则避免了纯化回收所带来的核酸损失,因此能够对投入的dna进行充分的检测,从而实现了对肝癌阳性样本的高检出率;同时对不同类型的阴性血浆样本检测结果显示,酶切法同样具有很好的检测特异性,对肝硬化、乙肝、丙肝、健康人血浆样本的整体检测特异性达到了98.1%,而转化法的检测特异性为99.1%,二者基本一致。
[0117]
实施例4、本发明对比例组合物的检测结果
[0118]
本发明通过实验测试,确定bsa、甘油、单链结合蛋白为组合物中的关键元素,在最佳组合物中分别剔除甘油、bsa、单链结合蛋白进行参考品检测,发现当剔除甘油时,同时进行酶切和pcr之后,酶切不充分,扩增灵敏度下降,0.01ng/反应的甲基化标准品无法百分百检出;当不含bsa时,同时进行酶切和pcr之后,酶切不充分,检测20ng/反应的非甲基化dna时存在阳性扩增曲线;当不含单链结合蛋白时,同时进行酶切和pcr之后,扩增效率急剧下降,0.01ng/反应的甲基化dna完全无法检出,同时酶切亦不充分,20ng/反应非甲基化dna存在较强的扩增信号。具体检测结果如图8-11所示。
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:吴康 何翔 缪为民 邓中平 戴立忠
- 技术所有人:圣湘生物科技股份有限公司
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、薛老师:1.CRISPR-Cas系统 2.基因编辑 3.基因修复 4.天然产物合成 5.单分子技术开发与应用
- 2、张老师:1.探索新型氧化还原酶结构-功能关系,电催化反应机制 2.酶电催化导向的酶分子改造 3.纳米材料、生物功能多肽对酶-电极体系的影响4. 生物电化学传感和生物电合成体系的设计与应用。
- 3、豆老师:1.环境纳米材料及挥发性有机化合物(VOCs) 2.CO污染物的催化氧化 3.低温等离子体 4.吸脱附等控制技术
- 4、赵老师:1.高分子材料改性及加工技术 2.微孔及过滤材料 3.环境友好高分子材料
- 5、邬老师:1.高分子材料的共混与复合 2.涉及材料功能化及结构与性能的研究; 高分子热稳定剂的研发
- 如您是高校老师,可以点此联系我们加入专家库。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
精彩留言,会给你点赞!
专利分类正在加载中....