一种(R)-选择性转氨酶及其应用的制作方法
b3ap的光学纯度为62.5
±
0.5%,转化率为39.0
±
5%。这种手性拆分外消旋胺的方法转化率不到50%,手性产物的光学纯度也不高,并不适用于工业化应用。
10.cn2014106524072报道了来源于土曲霉(aspergillus terreus)的转氨酶ate-ata(该专利序列3)可以催化n-boc-3-氨基呲咯烷酮转化为(r)-1-boc-3-氨基吡咯烷,ee值可达99%,但是转化率只有11%。
11.因而市场上仍然存在对具有高度立体选择性r构型催化活性的ω-转氨酶的需求,以满足制备手性胺化合物的需要,尤其是适用于制备度格列汀(dutogliptin)中间体(r)-1-boc-3-氨基吡咯烷的r构型ω-转氨酶。
技术实现要素:
12.本发明所要解决的技术问题是针对现有技术中缺乏有效的能够制备度格列汀(dutogliptin)中间体的酶不足,提供(r)-选择性转氨酶及其催化制备度格列汀(dutogliptin)中间体(r)-1-boc-3-氨基吡咯烷的方法。
13.本发明主要通过以下技术手段解决上述技术问题。
14.本发明的第一方面提供一种(r)-选择性转氨酶,所述(r)-选择性转氨酶含有如seq id no.1所示的氨基酸序列或者其衍生序列;
15.所述衍生序列与seq id no.1具有98%以上序列同一性并且至少保留如seq id no.1所示氨基酸序列的功能。
16.较佳地,所述的衍生序列包含如seq id no.3所示的氨基酸序列。
17.本发明的第二方面提供一种分离的核酸,其编码如本发明第一方面所述的(r)-选择性转氨酶。较佳地,所述核酸的核苷酸序列如序列表中seq id no.2或者4所示。
18.本发明的第三方面提供一种包含第二方面所述的核酸的重组表达载体;较佳地,所述重组表达载体的骨架为质粒pet系列、pqe系列或者pbad系列,例如质粒pet21a。
19.本发明的第四方面提供一种包含如第二方面所述的核酸或如第三方面所述的重组表达载体的转化体;较佳地,所述转化体的宿主为大肠杆菌,优选大肠杆菌bl21(de3)。
20.本发明的第五方面提供一种(r)-1-boc-3-氨基吡咯烷的制备方法,所述的制备方法包括:在辅因子以及氨基供体的存在下,使用如第一方面所述的(r)-选择性转氨酶催化1-叔丁氧羰基-3-吡咯烷酮生成(r)-1-boc-3-氨基吡咯烷;
21.所述(r)-选择性转氨酶的氨基酸序列如序列表中seq id no.1或者3所示。
22.其中,所述的辅因子可为本领域常规的辅因子,例如磷酸吡哆醛。
23.所述的氨基供体也可为本领域常规,优选苯乙胺、异丙胺或者丙氨酸,或其盐;较佳地,所述的氨基供体为异丙胺盐酸盐。
24.在所述的催化反应当中,所述1-叔丁氧羰基-3-吡咯烷酮的浓度较佳地为0.01~100g/l,更佳地为9~100g/l,例如,9.0g/l、9.3g/l、29.4g/l、80.0g/l或者83.3g/l;
25.所述氨基供体与所述1-叔丁氧羰基-3-吡咯烷酮摩尔比较佳地为1:1~6:1,例如3:1~6:1;
26.所述辅因子与所述1-叔丁氧羰基-3-吡咯烷酮的质量比较佳地为(0.0005~0.01):1;
27.所述(r)-选择性转氨酶与所述1-叔丁氧羰基-3-吡咯烷酮的质量比较佳地为1:10
~1:4。
28.本发明中所述的催化按本领域常规在反应溶剂中进行,例如水,或者有机溶剂和水的混合溶剂;所述反应溶剂优选甲醇和水的混合溶剂、乙醇和水的混合溶剂,或水。
29.本发明中,所述催化较佳地在ph 7.0~8.5下进行,例如为7.5;所述催化较佳地在30~40℃下进行。
30.在本发明一较佳实施方案中,底物1-叔丁氧羰基-3-吡咯烷酮通过流加方式添加到反应体系中。在所述流加过程中,底物1-叔丁氧羰基-3-吡咯烷酮可以溶于乙醇后再进行流加过程。
31.本发明的第六方面提供本发明第一方面所述的(r)-选择性转氨酶在制备手性胺中的应用。
32.较佳地,所述的手性胺为(r)-1-boc-3-氨基吡咯烷。
33.在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
34.本发明所用试剂和原料均市售可得。
35.本发明的积极进步效果在于:
36.本发明筛选获得氨基酸序列如seq id no.1或者3所示的(r)-选择性转氨酶,使用该酶催化以获得(r)-1-boc-3-氨基吡咯烷,转化率至少高达62%,同时ee值保持在99.8%以上,可有效满足手性胺化合物的需要。
附图说明
37.图1底物对照品图谱。
38.图2产物对照品图谱。
39.图3转氨酶(enz.2)反应转化率检测图谱。
40.图4产物rs消旋体对照品手性图谱。
41.图5产物r构型对照品手性图谱。
42.图6转氨酶(enz.2)催化所获产物ee值检测图谱。
具体实施方式
43.下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
44.本发明中的实验方法如无特别说明均为常规方法,基因克隆操作具体可参考j.萨姆布鲁克等编的《分子克隆实验指南》。
45.pet21a和蛋白抽提试剂(bugbuster protein extraction reagent)购买自novagen公司;ndei酶、hindiii酶购买自thermo fisher公司;e.coli bl21(de3)感受态细胞购买自北京鼎国昌盛生物技术有限责任公司。
46.底物1-叔丁氧羰基-3-吡咯烷酮来源麦克林试剂网。
47.产物rs消旋体和r构型对照品来源上海腾准科技有限公司。
48.hplc转化率分析方法:
49.色谱柱:agilent eclipse plus c18(3.5μm,150
×
4.6mm);流动相a:0.1%tfa水溶液,流动相b:0.1%tfa乙腈溶液,梯度洗脱:90%a+10%b(0min),100%b(10min),100%b(11min),90%a+10%b(11.5min),90%a+10%b(16min);检测波长:210nm;流速:1ml/min;进样体积:10μl;柱温:30℃。
50.底物对照品保留时间6.902min(图1),产物对照品保留时间4.537min(图2)。
51.产物的手性分析通过柱前衍生化高效液相色谱(high performance liquid chromatography,hplc)进行,具体的分析方法为:
52.(1)色谱条件:inertsil ods-3(5μm,150
×
4.6mm);流动相a:缓冲液︰甲醇=90︰10;流动相b:缓冲液︰甲醇=10︰90;0.1%tea+h2o,梯度洗脱:50%a+50%b(0min),30%a+70%b(10min),30%a+70%b(30min),50%a+50%b(31min),50%a+50%b(40min);检测波长:340nm;流速:0.8ml/min;进样体积:10μl;柱温:35℃。
53.(2)衍生化试剂:marfey试剂。准确称取50mg的n-α-(2,4-二硝基-5-氟苯基)-l-丙氨酰胺,配成25ml乙腈溶液,备用。
54.(3)衍生反应:移取1ml样品溶液,加入1ml marfey衍生液,加入100μl1m碳酸氢钠溶液,避光,60℃衍生1h。衍生后,加入100μl盐酸溶液(6ml浓盐酸加水稀释至50ml),摇匀后稀释5倍,过膜待测。
55.产物rs消旋体对照品手性hplc保留时间20.344min和21.918min(图4),产物r构型对照品手性hplc保留时间20.388min(图5)。
56.实施例1转氨酶的制备
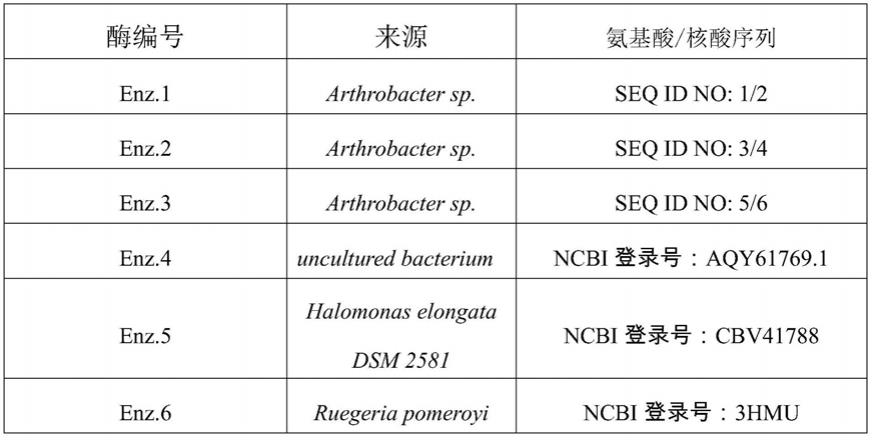
57.根据如seq id no:1、seq id no:3、seq id no:5所示的转氨酶的酶基因序列seq id no:2、seq id no:4、seq id no:6,以及ncbi登录号为aqy61769.1、cbv41788、3hmu的酶基因全基因合成转氨酶基因,在ndei、hindiii位点连入pet21a,经过测序验证基因成功连接到相应的载体上。合成公司为苏州金唯智生物科技有限公司(江苏省南京市江北新区研创园浦滨路211号)。
58.将含有转氨酶基因的载体转化宿主大肠杆菌bl21(de3)感受态细胞,得到分别含有各转氨酶的工程菌株。将分别含有转氨酶基因的工程菌在经平皿划线活化后,挑单菌落接种至含100μg/ml氨苄抗生素的5ml lb液体培养基中,37℃震荡培养12h。按2%接种量转接至150ml同样含100μg/ml氨苄抗生素的新鲜lb液体培养基中,37℃震荡至od
600
达到0.8左右时,加入异丙基-β-d-硫代吡喃半乳糖苷(iptg)至其终浓度为0.5mm,25℃诱导培养16h。培养结束后,将培养液10000rpm离心10min,弃上清液,收集菌体,置于-20℃超低温冰箱中保存,待用。
59.表1
[0060][0061]
实施例2转氨酶催化活性及手性验证
[0062][0063]
将实施例1中培养结束后收集到的菌体5g,用50mm ph 8.0磷酸缓冲液洗涤菌体两次,之后将菌体重悬于50ml ph8.0的磷酸缓冲液中,超声破碎,破碎液离心去除沉淀,得到的上清液为含转氨酶的粗酶液。
[0064]
在反应瓶中加入0.323g底物(1-叔丁氧羰基-3-吡咯烷酮),5.25ml甲醇,1.4ml 50mm plp,8.75ml 200mm ph7.0 pbs,1.75ml 4m异丙胺盐酸盐,17.85ml水,配制底物终浓度为50mm(9g/l)的反应液。在反应体系中,加入400μl反应液,100μl粗酶液,反应温度控制在37℃,反应18h,取样hplc检查反应转化率、ee值,结果如下表:
[0065]
表2
[0066][0067]
[0068]“/”表示未检测
[0069]
结果显示enz.1和enz.2都有较好的催化效果。
[0070]
将enz.1或enz.2与缓冲液1:12(菌体质量:缓冲液体积)均质后,离心去除沉淀,得到的上清液用bradford试剂盒(采购自上海捷瑞生物工程有限公司)测定蛋白浓度,结果如下表:
[0071]
表3
[0072][0073]
实施例3转氨酶(enz.2)催化生成(r)-1-boc-3-氨基吡咯烷
[0074]
enz.2酶菌体和缓冲液按1:4(质量体积比)均质后使用。以下实施例中均使用此方法获得的酶液参与反应。
[0075]
在反应体系中,加入4ml酶液(相当于1g菌体,酶质量为229.5mg蛋白),10ml 0.1m ph 7.0磷酸盐缓冲液(即:pbs),再加入10mg plp,4ml(3eq)异丙胺盐酸盐溶液,再加80ml水,用饱和碳酸钠溶液调ph 7.5最后加入底物乙醇溶液(1g底物(1-叔丁氧羰基-3-吡咯烷酮)溶于10ml乙醇,底物终浓度为9.3g/l)于30℃下反应18h后hplc测转化率和ee值,转化率76%,ee值99.8%。盐酸调ph 2,过滤除酶,二氯甲烷萃取除杂,氢氧化钠调ph至9~10,二氯甲烷萃取后浓缩,得到0.85g产品粗品。
[0076]
实施例4转氨酶(enz.2)催化生成(r)-1-boc-3-氨基吡咯烷
[0077]
在反应体系中,加入4ml酶液(相当于1g菌体,酶质量为229.5mg蛋白),10ml 0.1m ph 7.0磷酸盐缓冲液,再加入10mg plp,4ml(3eq)异丙胺盐酸盐溶液,再加80ml水,用饱和碳酸钠溶液调ph 8.0最后加入底物乙醇溶液(1g底物(1-叔丁氧羰基-3-吡咯烷酮)溶于10ml乙醇,底物终浓度为9.3g/l)于30℃下反应18h后hplc测转化率和ee值,转化率62%,ee值99.8%。盐酸调ph 2,过滤除酶,二氯甲烷萃取除杂,氢氧化钠调ph至9~10,二氯甲烷萃取后浓缩,得到0.73g产品粗品。
[0078]
实施例5转氨酶(enz.2)催化生成(r)-1-boc-3-氨基吡咯烷
[0079]
在反应体系中,加入40ml酶液(相当于10g菌体,酶质量为2295mg蛋白),50ml 0.1m ph 7.0磷酸盐缓冲液,再加入10mg plp,40ml(3eq)异丙胺盐酸盐溶液,再加200ml水,用饱和碳酸钠溶液调ph 7.5,最后流加底物乙醇溶液(10g底物(1-叔丁氧羰基-3-吡咯烷酮)溶于10ml乙醇,底物终浓度为29.4g/l),6h左右流加完底物,于40℃下反应18h后hplc测转化率和ee值,转化率81%,ee值99.8%。盐酸调ph 2,过滤除酶,二氯甲烷萃取除杂,氢氧化钠调ph至9~10,二氯甲烷萃取后浓缩,得到8.7g产品粗品。
[0080]
实施例6转氨酶(enz.2)催化生成(r)-1-boc-3-氨基吡咯烷
[0081]
在反应体系中,加入40ml酶液(相当于10g菌体,酶质量为2295mg蛋白),50ml 0.1m ph 7.0磷酸盐缓冲液,再加入10mg plp,40ml(3eq)异丙胺盐酸盐溶液,再加100ml水,用饱
和碳酸钠溶液调ph 7.5,最后流加底物乙醇溶液(20g底物(1-叔丁氧羰基-3-吡咯烷酮)溶于10ml乙醇,底物终浓度为83.3g/l),6h左右流加完底物,于40℃下反应18h后hplc测转化率和ee值,转化率85%(图3),ee值99.8%(图6)。盐酸调ph 2,过滤除酶,二氯甲烷萃取除杂,氢氧化钠调ph至9~10,二氯甲烷萃取后浓缩,得到18.4g产品粗品。
[0082]
实施例7转氨酶(enz.1)催化生成(r)-1-boc-3-氨基吡咯烷
[0083]
在反应体系中,加入40ml酶液(相当于10g菌体,酶质量为2307mg),50ml 0.1m ph 7.0磷酸盐缓冲液,再加入10mg plp,40ml(3eq)异丙胺盐酸盐溶液,再加100ml水,用饱和碳酸钠溶液调ph 7.5,最后流加底物乙醇溶液(20g底物(1-叔丁氧羰基-3-吡咯烷酮)溶于20ml乙醇,底物终浓度为80.0g/l),6h左右流加完底物,于40℃下反应18h后hplc测转化率和ee值,转化率82%,ee值99.8%。盐酸调ph 2,过滤除酶,二氯甲烷萃取除杂,氢氧化钠调ph至9~10,二氯甲烷萃取后浓缩,得到18.2g产品粗品。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1