一种人生长激素重组表达载体、表达人生长激素的工程菌、其构建方法及其应用与流程
1.本发明涉及基因工程技术领域。具体涉及一种人生长激素重组表达载体、表达人生长激素的工程菌及其应用。
背景技术:
2.人生长激素(human growth hormone,hgh)含有191个氨基酸分子,分子量为22kda,等电点为4.9,在第53位与165位的半胱氨酸之间以及第182位与189位半胱氨酸之间存在两个二硫键,人体内另有5%~10%生长激素以176个氨基酸组成的分子量为20kda的形式存在。生长激素最主要的生理作用是通过刺激蛋白质和胶原的合成以及组织对循环系统中氨基酸的摄取和利用,促进骨、软骨和组织的生长。
3.人生长激素在临床上主要用于儿童生长激素缺乏症。目前在中国,儿童生长发育迟缓发生率高达9.9%,居全球第二。根据中华医学会统计,目前全国4~15岁矮小患儿总数约有700万人,按其中的1/3为生长激素缺乏症推算,国内需要用生长激素治疗的儿童大概有200万。
4.hgh结构中不含糖链,因此可以用原核表达系统生产而不会由于无翻译后修饰对产品的功能造成影响。而大肠杆菌细胞具有良好的可操作性,成本相对较低。因此国内的公司大多采用大肠杆菌分泌表达技术生产生长激素,但现有技术往往蛋白表达量不高,仅在15%左右(李晶,何政红,李湘.重组人生长激素生产过程中间工序的质控研究[j].药物生物技术,2000,7(1):11
–
13.)。因此需要开发一种生长激素产量高的工程菌株。
[0005]
中国专利cn201310699346.0提供了一种高效表达人生长激素的重组工程菌及构建方法和应用。该发明提供一种表达重组hgh的大肠杆菌操纵子、含有该操纵子序列的表达质粒以及用含有该操纵子的表达质粒转化得到的分泌表达重组hgh的工程菌qjsw-sz01(cgmcc no:7258)。其发明点在于通过改造大肠杆菌耐热肠毒素信号肽的编码序列,突变掉其中的大肠杆菌稀有密码子并尽可能避免形成二级结构,同时在其末端改变一个氨基酸使其更利于引导人hgh分泌表达,并以此信号肽与大肠杆菌碱性磷酸酶启动子(phoa启动子)和大肠杆菌t7终止子组合作为表达调控元件使重组hgh在大肠杆菌中得以可溶形式高效分泌表达。
[0006]
中国专利cn201210580558.2提供了一种高效分泌表达重组人生长激素的操纵子、载体和工程菌及载体和工程菌的制备方法,属于医药生物工程技术领域。此发明的操纵子,包括大肠杆菌色氨酸启动子、经过优化改造的大肠杆菌碱性磷酸酶信号肽的编码序列和重组人生长激素的编码序列。本发明的表达载体是:将序列表中操纵子和重组人生长激素的编码序列依次通过ecori和xbai、xbai和bamhi克隆至pbr322中得到的表达质粒,命名为ptps-hgh。本发明提供的工程菌是:用含有该发明操纵子的表达质粒转化w3110大肠杆菌菌株得到的工程菌,命名为tps-hgh。此发明的有益效果是能够使重组人生长激素在大肠杆菌中实现高效的分泌表达,可获得较高的重组人生长激素产量,利于工业规模的生产和加工。
[0007]
虽然上述专利能够可获得较高的重组人生长激素产量,但是存在如下技术问题:大肠杆菌细胞壁肽聚糖层是蛋白分泌过程的天然物理屏障。上述专利未对大肠杆菌细胞壁糖蛋白进行敲除处理,会直接影响蛋白分泌效率。
[0008]
本发明已经解决了上述技术问题,构建了一种菌株表达方式为胞内可溶表达,且表达量在20%以上的生长激素工程菌株。
技术实现要素:
[0009]
本发明的目的是解决现有技术存在的技术问题,提供一种人生长激素重组表达载体、表达人生长激素的工程菌、其构建方法及其应用。
[0010]
本发明的技术方案如下:
[0011]
本发明的第一个发明目的是提供一种人生长激素重组表达载体,所述的表达载体是将核苷酸序列如seq id no.2所示的带融合标签和肠激酶酶切位点的人生长激素dna导入表达质粒构建而成。
[0012]
优选地,
[0013]
所述的表达质粒为pet24、pet11、pet21或pet31。
[0014]
本发明的第二个发明目的是提供一种高效表达人生长激素的工程菌,所述的重组工程菌株是由上述表达载体转化宿主菌制得。
[0015]
优选地,
[0016]
所述的宿主菌为e.coli bl21(de3)、e.coli dh5α或e.coli rosetta。
[0017]
本发明的第三个发明目的是提供一种高效表达人生长激素的工程菌的构建方法,包括如下步骤:
[0018]
1)通过pcr扩增的方式获得带有肠激酶酶切位点的人生长激素dna;
[0019]
2)将步骤1)获得的人生长激素dna与pet32a质粒连接,获得含有人生长激素基因的pet32a重组质粒;
[0020]
3)通过pcr扩增步骤2)获得的pet32a重组质粒,获得带有融合标签和肠激酶酶切位点的人生长激素dna,核苷酸序列如seq id no.2所示;
[0021]
4)将步骤3)获得的dna和表达质粒分别双酶切后连接,即得到编码人生长激素的质粒;
[0022]
5)制备宿主菌感受态细胞,取步骤4)的质粒转化宿主菌,筛选阳性克隆,得到高效表达人生长激素的重组工程菌。
[0023]
优选地,
[0024]
所述的步骤4)中,表达质粒为pet24、pet11、pet21或pet31。
[0025]
所述的步骤5)中,宿主菌为e.coli bl21(de3)、e.coli dh5α、或e.coli rosetta。
[0026]
优选地,
[0027]
所述高效表达人生长激素的工程菌的构建方法,包括如下步骤:
[0028]
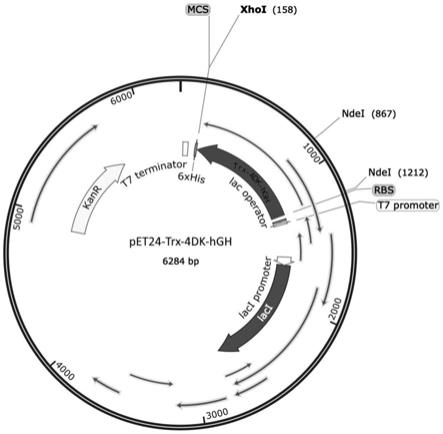
1)分别设计上下游引物f1和r1,以核苷酸序列为seq id no.1的人生长激素dna为模板,进行pcr扩增,获得带有肠激酶酶切位点的人生长激素dna扩增产物,扩增产物命名为4dk-hgh;
[0029]
2)将4dk-hgh与pet32a质粒分别使用限制性内切酶kpn i和xho i进行双酶切后连
接,得到含有带有肠激酶酶切位点的人生长激素dna的pet32a重组质粒,连接产物命名为pet32-4dk-hgh;
[0030]
3)分别设计上下游引物f2和r2,以连接产物pet32-4dk-hgh为模板,进行pcr扩增,获得带有融合标签和肠激酶酶切位点的人生长激素dna扩增产物,扩增产物命名为trx-4dk-hgh;带有融合标签和肠激酶酶切位点的人生长激素dna的核苷酸序列如seq id no.2所示;
[0031]
4)将步骤3)的pcr扩增产物trx-4dk-hgh与pet24a质粒分别使用限制性内切酶nde i和xho i进行双酶切后连接,得到编码人生长激素dna的重组质粒,连接产物命名为pet24-trx-4dk-hgh;
[0032]
5)使用步骤4)的连接产物pet24-trx-4dk-hgh转化大肠杆菌bl21(de3)感受态细胞,得到能够高效表达人生长激素的重组工程菌株,重组工程菌株命名为bl21(de3)/pet24a;
[0033]
所述的步骤1)和3)中,涉及的引物序列如下表所示:
[0034][0035]
本发明的第四个发明目的是提供上述高效表达人生长激素的工程菌在制备人生长激素中的应用。
[0036]
本发明具有如下技术效果:
[0037]
1)带融合标签和肠激酶酶切位点的人生长激素dna中的硫氧还原蛋白trxa融合标签能够保证人生长激素的蛋白内二硫键正确形成,保证蛋白质的正确结构。促进人生长激素在大肠杆菌胞内充分折叠,提高人生长激素蛋白在破菌后上清的溶解度,还可自行剪切,最终得到不含融合标签的人生长激素,避免不必要的人体免疫原性。
[0038]
2)带融合标签和肠激酶酶切位点的人生长激素dna中除了带有硫氧还原蛋白trxa融合标签,还带有his亲和标签,可通过亲和层析较简单的得到纯度95%以上的的目的蛋白。
[0039]
3)从本发明的实施例可以看出,将获得的含有带融合标签和肠激酶酶切位点的人生长激素dna的工程菌进行发酵培养,破菌离心后将上清通过离子交换、亲和等纯化方式获得重组人生长激素蛋白。对蛋白进行sds-page、质谱和n末端序列检测,发现电泳纯度达95%以上,且分子量和n末端序列正确。连续三批发酵后用sds-page电泳检测破菌后上清,
三批上清中目标蛋白表达量均在20%以上。
附图说明
[0040]
图1是重组人生长激素原液质谱分子量检测结果。
[0041]
图2是最后一步亲和纯化后sds-page检测结果;其中,5:原液;6:亲和500mm咪唑洗脱;7:蛋白标准品。
[0042]
图3是重组人生长激素原液n末端氨基酸序列检测结果。
[0043]
图4是连续三批发酵破菌后上清电泳检测结果。其中,2、3、4泳道分别是三批次破菌后上清液。
[0044]
图5为表达载体构建示意图。
具体实施方式
[0045]
实施例1构建含有本发明基因的表达菌株
[0046]
(1)引物的设计和基因的pcr扩增
[0047]
根据growth hormone 1[homo sapiens(human)]序列(gene id:2688,seq id no.1)合成人生长激素dna序列。
[0048]
分别设计上下游引物f1和r1,以合成的序列为模板,使用twistamp试剂盒(twistdx)进行pcr扩增,得到扩增产物命名为4dk-hgh。
[0049]
将4dk-hgh与pet32a质粒(novagen)分别进行双酶切处理。取2个无菌的微量离心管,分别命名为a管和b管,在两管中加入2μl 10
×
buffer、限制性内切酶kpn i和xho i各1μl。在a管中加入扩增产物1μl、无核酸酶的超纯水16μl,在b管中加入质粒1μl、无核酸酶的超纯水16μl。将离心管置于37℃恒温水浴下15min,进行双酶切消化。之后用genejet pcr纯化试剂盒(thermo fisher)分别从2个离心管中回收酶切片断。
[0050]
将酶切片段用t4 dna连接酶连接。建立如下酶切体系:1μl质粒酶切片段,10μl基因酶切片段,5μl t4 dna ligase master mix(invitrogen),用无核酸酶的水补足体积至20μl,25℃连接15min,得到连接产物命名为pet32-4dk-hgh。
[0051]
分别设计上下游引物f2和r2,以连接产物pet32-4dk-hgh为模板,使用twistamp试剂盒(twistdx)进行pcr扩增,得到扩增产物命名为trx-4dk-hgh。
[0052][0053]
(2)表达载体的构建
[0054]
将步骤1中得到的pcr扩增产物trx-4dk-hgh,与pet24a质粒(novagen)分别进行双酶切处理。取2个无菌的微量离心管,分别命名为a管和b管,在两管中加入2μl 10
×
buffer、限制性内切酶nde i和xho i各1μl。在a管中加入扩增产物1μl、无核酸酶的超纯水16μl,在b管中加入质粒1μl、无核酸酶的超纯水16μl。将离心管置于37℃恒温水浴下15min,进行双酶切消化。之后用genejet pcr纯化试剂盒(thermo fisher)分别从2个离心管中回收酶切片断。
[0055]
将酶切片段用t4 dna连接酶连接。建立如下酶切体系:1μl质粒酶切片段,10μl基因酶切片段,5μl t4 dna ligase master mix(invitrogen),用无核酸酶的水补足体积至20μl,25℃连接15min,得到连接产物pet24-trx-4dk-hgh。
[0056]
表达载体的构建示意图如图5所示。
[0057]
使用连接产物pet24-trx-4dk-hgh转化大肠杆菌bl21(de3)感受态细胞,得到原始菌株。
[0058]
将得到的原始菌株加至带卡那霉素抗性的琼脂平板上,涂布接种,37℃恒温培养过夜后,冷藏保存,即为筛选平板。从筛选平板上挑选单菌落提取质粒后测序验证序列是否正确,序列正确的菌落即为含有本发明基因的工程菌株bl21(de3)/pet24a。
[0059]
实施例2含本发明基因的工程菌的表达与蛋白纯化
[0060]
将实施例1中获得的含本发明基因的工程菌株bl21(de3)/pet24a接种于含有硫酸卡那霉素的200ml lb液体培养基中,放置在37℃、250rpm条件下培养至od
600
为0.6左右;加入终浓度为0.5mm的iptg进行诱导,并在37℃、250rpm条件下继续培养3小时后收集发酵液。4℃、5000rpm离心发酵液,收集菌体并称重。按1g湿菌体加10ml破菌缓冲液的比例在菌体中加入4℃预冷的破菌缓冲液350w,用玻璃棒搅拌,使菌体充分悬浮。冰浴条件下超声45min破碎菌体,在8000rpm,4℃的条件下离心30min,收集上清液。
[0061]
将上清经deae sepharose fast flow层析填料(cytiva)纯化,洗脱液为150mm的氯化钠溶液,收集洗脱峰,为deae纯化产品。将deae纯化产品经ni-chelating sepharose fast flow层析填料(cytiva)纯化,洗脱液为200mm的咪唑溶液,收集洗脱峰,得到酶切前样
品。将酶切前样品在4℃的条件下按质量比1:500加入牛肠激酶,酶切17小时,得到酶切后样品。将酶切后样品经ni-chelating sepharose fast flow层析填料纯化,收集流穿,得到重组人生长激素原液。
[0062]
将原液用超滤适当浓缩并更换缓冲体系后,分别检测sds-page电泳、质谱分子量和n末端氨基酸序列。结果见图1-3。
[0063]
从图1可以看出,使用本发明构建的菌株生产的重组人生长激素质谱分子量在22.1kda左右,与理论一致。
[0064]
从图2可以看出,使用本发明构建的菌株生产的重组人生长激素经纯化至原液后,电泳纯度可达95%以上。
[0065]
从图3可以看出,使用本发明构建的菌株生产的重组人生长激素n末端前五位氨基酸残基为fptip,与理论一致。
[0066]
结论:原液中目标蛋白纯度可达95%以上,且分子量和n末端序列正确,符合预期。
[0067]
连续三批发酵后用sds-page电泳检测破菌后上清,结果见图4,
[0068]
从图4可以看出,连续三批破菌上清液中,目标蛋白条带占比均在20%以上。。
[0069]
结论:三批上清中目标蛋白表达量均在20%以上。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1